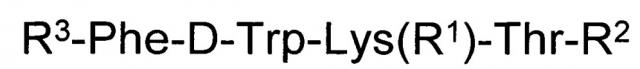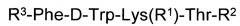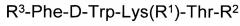Короткие пептиды с противоопухолевой активностью
Иллюстрации
Показать всеИзобретение относится к медицине и касается короткого пептида с цитотоксической активностью общей формулы R3-Phe-D-Trp-Lys(R1)-Thr-R2, где R1 представляет собой Н, трет-бутилоксикарбонил; R2 представляет собой гидрокси, метокси, амино, гидроксиамино, аминобензильную, 1-аминонафтильную группу; R3 - трет-бутилоксикарбонил-Cys(R4) или 3-R5-тиазолидин-4-карбонил, где R4 - Н или трет-бутилоксикарбонил, ацетамидометил; R5 - Н или трет-бутилоксикарбонил. Изобретение обеспечивает высокую цитотоксическую активность и устойчивость к ферментативному разложению, что дает возможность орального введения в организм, дополнительно к парентеральному, осуществляемому подкожно, внутривенно, внутримышечно и внутрибрюшинно. 2 табл., 19 пр.
Реферат
Изобретение относится к фармацевтической химии и непосредственно касается новых коротких пептидов, обладающих цитотоксической активностью, которые могут быть применены для лечения онкологических заболеваний.
Как известно, к коротким пептидам относят пептидный белок-Соматостатин (SRIF) - пептидный гормон, обнаруженный в 1973 г. (Brazeau P. et al. Science. 1973, Vol. 179, No 4068, P. 77-79). SRIF представляет собой циклический тетрадекапептидный гормон, содержащий дисульфидный мостик между положением 3 и положением 14 (Heiman, et al., Neuroendocrinology, 1987, Vol. 45, P. 429-436). Выявлено, что Соматостатин вырабатывается дельта-клетками поджелудочной железы, желудка и кишечника и также является одним из гормонов гипоталамуса. Он обладает способностью ингибировать высвобождение гормона роста (ГР, GH) и тиреотропного гормона (ТТГ, TSH), ингибировать высвобождение амилина, инсулина и глюкагона, снижать секрецию желудочного сока и высвобождение нейротрансмиттеров. SRIF действует также в качестве нейромодулятора в центральной нервной системе.
Наряду с этим соматостатин обладает широким спектром биологического действия - угнетает выделение пролактина, инсулина, глюкагона, гормонов поджелудочной железы и желудочно-кишечного тракта, стимулирующих пролиферативные процессы в клетке (Buscail L., Vernejoul F., Faure P., Torrisani J., Susini C. Ann Endocrinol. - 2002. - Vol.63. - P. 2S13-8).
Соматостатин оказывает свое биологическое влияние через взаимодействие с рецепторами, расположенными на мембранах клеток. В настоящее время различают 5 типов рецепторов к соматостатину: SST1, SST2, SST3, SST4 и SST5, которые имеются как в тканях различных областей ЦНС, так и в периферических тканях (Adams R.L., Adams I.P., Lindow S.W. et al. Br. J. Cancer. - 2005. - 92. - P. 1493-1498; Kilian M., Gregor J. I., Heukamp I. et al. Clin. Exp.Metastasis. - 2009. - 26. - P. 719-727).
Несмотря на полученные положительные результаты, применение соматостатина сильно ограничено из-за его короткого периода жизни в плазме (1-3 мин) (Chapman I. М., Helfgott A., Willoughby J. О. J. Endocrinol. - 1991. - 128. - P. 369-374). Метаболизм соматостатина аминопептидазами и карбоксипептидазами сокращает период его действия. В связи с коротким сроком жизни нативного соматостатина разрабатываются различные аналоги Соматостатина, например, для лечения акромегалии (Raynor, et al. Molecular Pharmacol. 43:838 (1993)).
Оказалось, что для сохранения активности критически важным является наличие в циклической части молекулы последовательности Phe7-Trp8-Lys9-Thr10. Остаток Trp8-Lys9 образует часть β-изгиба, который обычно стабилизируется заменой L-Trp на D-Trp, циклизацией скелета, дисульфидным мостиком или всеми ограничениями (Veber, D. F. Freidinger, R. М., Schwenk-Perlow, D. et al. Nature (Lond.). 1981. - 292. - P. 55-58). Аминокислотные фрагменты Trp и Lys обязательны, a Phe и Thr могут быть заменены, например на Tyr и Ser или Val соответственно.
Пептидные аналоги соматостатина имеют ряд ограничений в клиническом применении, таких как низкая оральная биодоступность, относительно короткий период полураспада и иммуногенность. Практическое применение синтетических пептидных аналогов также лимитируется наличием тахифилаксии (быстрое снижение лечебного эффекта при повторном применении) и значительных антисекреторных эффектов. Поэтому поиск новых метаболически стабильных синтетических агонистов соматостатина является актуальной задачей в целях улучшения клинического профиля.
Одним из путей поиска эффективных аналогов соматостатина является синтез пептидов линейной структуры.
Исследованы N-замещенные нипекотиновые и изонипекотиновые амиды дипептида beta-methylTrp-Lys-OBu-t, среди которых найдены новые селективные агонисты рецептора соматостатина 2 типа (Zhou С.et al. Bioorg. Med. Chem. Lett. 2001, Vol. 11, P. 415-417). Конъюгаты замещенной мочевины и дипептидов D-Trp-Lys-OH и D-Trp-Lys-NH2 также показали высокую активность и селективность к рецептору соматостатина 2 типа (Yang L., Guo L., Pasternak A. et al. Journal of Medicinal Chemistry, 1998, Vol. 41, No. 13, P. 2175-2179).
С целью уменьшения размеров пептида и сохранения антипролиферативной активности на основе биологически значимой аминокислотной последовательности Tyr-D-Trp-Lys пептида ТТ-232 были синтезированы короткие пептиды и пептидомиметики линейной структуры с двумя или тремя аминокислотами и Boc-защищенной аминогруппой, где Boc обозначает трет-бутилоксикарбонильную группу (Kuriyama I. et al. Biorg. Med. Chem. 2013, Vol. 21, №2, P. 403-411). Наиболее активным признано соединение - Boc-Tyr-Ile-1-naphthylamide, которое ингибирует ДНК полимеразу-β млекопитающих, значительно подавляет рост раковых клеток карциномы толстой кишки человека (НСТ116). Необходимо отметить, что при удалении Вос-группы в данных пептидах их активность значительно снижается.
Наиболее сходными по своей структуре к предлагаемым коротким пептидам являются известные аналоги соматостатина линейной структуры, основанные на фрагменте октреотида: Phe7-D-Trp8-Lys9-Thr10, входящие в качестве активного компонента в средство, обладающее противоопухолевым действием (RU 2254139, А61К 38/08, 2005). Данное известное средство имеет общую формулу R-Cys(R1)-Phe-D-Trp-Lys(R2)-Thr-R3, где - R-третбутилоксикарбонил или Н, R1 - тетрагидроксипиранил или Н, R2 - N-бензилкарбонил или Н, R3 - О -метил или S-тетрагидропиранилцистеин метиловый эфир и предназначено для парентерального введения. К конкретным известным синтезированным соединениям, подпадающим под вышеуказанную структурную формулу, относятся следующие 4 пептида:
Boc-Cys(Thp)-Phe-D-Trp-Lys(Z)-Thr-OMe;
H-Cys(Thp)-Phe-D-Trp-Lys(Z)-Thr-OMe;
H-Cys-Phe-D-Trp-Lys-Thr-OMe;
Boc-Cys(Thp)-Phe-D-Trp-Lys(Z)-Thr-Cys(Thp)-OMe.
Эти пептиды частично сохраняют специфические гормональные свойства соматостатина, что проявляется подавлением секреции гормона роста (СТГ), пролактина и инсулина соответствующими эндокринными железами, наряду со значительным противоопухолевым эффектом in vitro и in vivo (Кубасова И.Ю., Борисова Л.М., Киселева М.П. и др., Российский биотерапевтический журнал, 2006, Т. 5, №3, С. 128-133).
Выявлено, что наиболее активным является пентапептид Boc-Cys(Thp)-Phe-D-Trp-Lys(Z)-Thr-OMe, который проявляет более высокую цитотоксическую активность, чем нативный соматостатин (Михаевич Е.И., Красильников М.А. Бюллетень экспериментальной биологии и медицины, 2012, Т. 154, №11, С. 629-632). В данной работе показано, что индуцированный пептидом апоптоз развивается по р53-независимому механизму и сопровождается ранним подавлением активности NF-kB. Благодаря защите всех реакционно-способных групп этот пептид частично сохраняется в кислой среде желудка, что дает возможность орального применения. Данное свойство в сочетании с небольшим размером молекулы и высокой цитотоксической активностью делает этот класс соединений потенциально перспективным для терапии опухолей.
Также описан синтез пептидных аналогов соматостатина и проведено исследование их цитотоксической активности in vitro и противоопухолевой активности на моделях перевиваемых опухолей мышей (Балаев А.Н., Осипов В.Н., Фёдоров В.Е, и др., Российский биотерапевтический журнал, 2012, Т. 11, №4, С. 47-53; Балаев А.Н., Осипов В.Н., Фёдоров В.Е. и др., Российский биотерапевтический журнал, 2013, Т. 12, №3, С. 57-60).
В этой работе рассмотрены следующие синтетические пептидные аналоги соматостатина:
H-Cys-Phe-D-Trp-Lys-Thr-OMe
H-Cys(Acm)-Phe-D-Trp-Lys-Thr-OMe диацетат
H-Cys-Phe-D-Trp-Lys-ThrOMe (1→1')-дисульфид тетраацетат
Получение пептидов, рассматриваемых как аналоги заявляемым, описано ранее в публикациях, приведенных выше.
Одним из ключевых полупродуктов для синтеза заявляемой группы соединений является пептид Н-Phe-D-Trp-Lys(Вос)-Thr-ОМе, синтез которого описан ранее (Балаев А.Н., Охманович К.А., Осипов В.Н., и др., Получение H-Phe-D-Trp-Lys(ε-Boc)-Thr-OMe-тетрапептпдного фрагмента синтеза аналогов соматостатина // Российский биотерапевтический журнал, 2011, Т. 10, №4, С. 43-47; Балаев А.Н., Осипов В.Н., Охманович К.А., Фёдоров В.Е., Использование F-комплекса при получении Z-Phe-D-Trp-Lys(ε-Boc)OH в полупромышленном масштабе, Химико-фармацевтический журнал, 2014, Т. 48, №5, С. 40-42). Синтез, согласно данным работам, проводится по оригинальной схеме с использованием F-комплекса до получения активированного пентафторфенилового эфира дипептида H-Phe-D-Trp-OPfp и с последующим присоединением к нему гамма-Boc-лизина и метилового эфира треонина по С-концу. Дальнейшее удаление бензилоксикарбонильной группы гидрированием на палладиевом катализаторе приводит к целевому соединению.
Синтез другого структурного аналога - пептида - Boc-Cys(Acm)-Phe-D-Trp-Lys(Boc)-Thr-OMe описан ранее в статье (Балаев А.Н., Осипов В.Н., Фёдоров В.Е. и др., Синтез и изучение цитотоксической активности аналогов гипоталамического гормона соматостатина, Российский биотерапевтический журнал, 2012, Т. 11, №4, С. 47-53). Синтез в данном случае проводится по карбодиимидному методу и осуществляется взаимодействием Boc-Cys(Acm)-ОН с тетрапептидом Н-Phe-D-Trp-Lys(Вос)-Thr-ОМе. Другим ближайшим аналогом и полупродуктом для синтеза заявляемых соединений является пептид Вос-Cys(Thp)-Phe-D-Trp-Lys(Z)-Thr-OMe, который получают последовательным наращиванием пептидной цепи с N-конца методом смешанных ангидридов, начиная с метилового эфира треонина (Шпрах З.С., Ярцева И.В., Игнатьева Е.В. и др. Синтез и химико-фармацевтические характеристики аналога соматостатина, обладающего противоопухолевой активностью, Химико-фармацевтический журнал, 2014, Т. 48, №3, С. 19-22).
Целью настоящего изобретения является получение новых производных коротких пептидов, обладающих цитотоксической активностью, с низкой токсичностью,
с возможностью орального применения и с расширенным спектром противоопухолевого действия.
В качестве таких соединений предлагается короткий пептид с цитотоксической активностью общей формулы:
,
где R1 представляет собой Н, трет-бутилоксикарбонил;
R2 представляет собой гидрокси, метокси, амино, гидроксиамино, аминобензильную, 1-аминонафтильную группу;
R3 - трет-бутилоксикарбонил-Cys(R4) или 3-R5-тиазолидин-4-карбонил, где R4 - Н или трет-бутилоксикарбонил, ацетамидометил;
R5 - Н или трет-бутилоксикарбонил.
Все синтезированные соединения, имеющие заявленную общую структурную формулу, содержат общую аминокислотную последовательность из четырех аминокислот Phe-D-Trp-Lys-Thr, которая важна для сохранения активности их как аналогов соматостатина. Также полученные соединения содержат цистеин или циклическое производное цистеина -тиазолидин-4-карбоновую кислоту (тиопролин), которое получают в результате взаимодействия цистеина и формальдегида. Пептиды отличаются различными заместителями по аминогруппам цистеина, тиазолидин-4-карбоновой кислоты и гамма-аминогруппе лизина, а также различными функциональными группами на С-конце пептидов (кислотной, сложноэфирной, гидроксамовой, амидной и замещенной амидной).
Синтезированы следующие короткие пептиды, обладающие общей заявленной формулой, а именно:
1. Boc-Cys(Acm)-Phe-D-Trp-Lys(Boc)-Thr-OH
2. Boc-Cys(Acm)-Phe-D-Trp-Lys(Boc)-Thr-NHOH
3. Boc-Cys(Acm)-Phe-D-Trp-Lys(Boc)-Thr-NH2
4. Boc-Thz-Phe-D-Trp-Lys(Boc)-Thr-OMe
5. Boc-Thz-Phe-D-Trp-Lys(Boc)-Thr-OH
6. Boc-Thz-Phe-D-Trp-Lys(Boc)-Thr-NH2
7. Thz-Phe-D-Trp-Lys-Thr-NH2
8. Boc-Thz-Phe-D-Trp-Lys(Boc)-Thr-NHOH
9. Thz-Phe-D-Trp-Lys-Thr-NHOH
10. Boc-Cys(Boc)-Phe-D-Trp-Lys(Boc)-Thr-OMe
11. Boc-Cys(Boc)-Phe-D-Trp-Lys(Boc)-Thr-OH
12. Boc-Cys(Boc)-Phe-D-Trp-Lys(Boc)-Thr-NH2
13. Boc-Cys(Boc)-Phe-D-Trp-Lys(Boc)-Thr-NH-CH2Ph
14. Вос-Cys(Acm)-Phe-D-Trp-Lys(Вос)-Thr-1-нафтиламид
15. Вос-Cys(Вос)-Phe-D-Trp-Lys(Вос)-Thr-1-нафтиламид
16. Boc-Thz-Phe-D-Trp-Lys(Boc)-Thr-1-нафтиламид
В представленных формулах и в дальнейшем описании:
Boc обозначает трет-бутилкарбоксильную группу,
Z обозначает бензилоксикарбонильную группу,
Acm обозначает ацетамидометильную группу ,
Thz обозначает остаток тиазолидин-4-карбоновой кислоты: ,
CH2Ph обозначает бензильную группу ,
1-нафтиламид обозначает ,
Синтезированные соединения имеют общую структурную формулу, под которую с учетом конкретных описанных заместителей не подпадают известные структурные аналоги, а именно ранее синтезированные короткие пептиды:
Boc-Cys(Thp)-Phe-D-Trp-Lys(Z)-Thr-OMe;
H-Cys(Thp)-Phe-D-Trp-Lys(Z)-Thr-OMe;
H-Cys-Phe-D-Trp-Lys-Thr-OMe;
Boc-Cys(Thp)-Phe-D-Trp-Lys(Z)-Thr-Cys(Thp)-OMe
H-Cys(Acm)-Phe-D-Trp-Lys-Thr-OMe диацетат
H-Cys-Phe-D-Trp-Lys-ThrOMe (1→1')-дисульфид тетраацетат.
Особым преимуществом новых соединений является их высокая устойчивость к ферментативному разложению и возможность орального применения, наряду с парентеральными методами применения (подкожным, внутривенным, внутримышечным и внутрибрюшинным).
Соединения могут быть введены по отдельности или в виде фармацевтических композиций.
Новые соединения получают известными методами синтеза, применимыми в пептидной химии. Пептиды синтезируют последовательным соединением аминокислот или путем связывания подходящих небольших пептидных фрагментов. При последовательном соединении, начиная с С-конца, пептидная цепь удлиняется постепенно, каждый раз на одну аминокислоту. При взаимодействии олигопептидов соединяют вместе фрагменты различной длины, а последние в свою очередь могут быть получены путем последовательного наращивания пептидной цепочки из аминокислот или из более коротких пептидов через образование амидных связей.
Химические способы для синтеза новых пептидов подробно описаны в «Synthesis of Peptides and Peptidomimetics in Houben-Weyl Methods in Organic Chemis-try Vol. E-22a / Eds. Goodman M., Felix A., Moroder L., and Toniolo C, Thieme Verlag, Stuttgart, Germany. - 2002».
Одними из ключевых полупродуктов для синтеза новых соединений являются: пептид H-Phe-D-Trp-Lys(Boc)-Thr-OMe и пептид Boc-Cys(Acm)-Phe-D-Trp-Lys(Boc)-ThrOMe, синтез которых рассмотрен выше. Новые пептиды синтезируют путем жидкофазного синтеза с использованием стандартной методики с Z- и Вос-защитными группами.
Ниже приводятся примеры осуществления изобретения:
Пример 1
Получение Z-Phe-D-Trp-Lys(Boc)-Thr-1-нафтиламид
В 15 мл диметилформамида при перемешивании последовательно растворяют 2.65 г (3.7 ммоль) Z-Phe-D-Trp-Lys(Boc)-OH, 0.62 г (4 ммоль) моногидрата N-гидроксибензотриазола, 1.34 г (3.9 ммоль) гидрохлорида 1-нафтиламида треонина и 0.43 г (4.2 ммоль) N-метилморфолина. Охлаждают до 0°С и при этой температуре добавляют по каплям раствор 0.81 г (3.9 ммоль) дициклогексилкарбодиимида в 3 мл диметилформамида. Реакционную массу перемешивают при этой температуре 2 ч и еще 12 ч при комнатной температуре. Фильтруют выпавшие кристаллы, промывают 5 мл диметилформамида, объединенные жидкие фазы разбавляют водой (1 объем фильтрата - 2 объема воды) оставляют на 10 ч, декантируют жидкую фазу с выпавшего масла и растворяют его в 25 мл хлороформа. Хлороформный слой промывают 1 раз 25 мл насыщенного раствора бикарбоната натрия и затем 2 раза по 25 мл воды. Сушат над сульфатом натрия, отгоняют растворитель на роторном испарителе в вакууме (40°С, 15 мм рт. ст.). Полученный остаток растирают и сушат на воздухе до постоянного веса. Получают 3.3 г (94.2%) белого мелкокристаллического порошка. ТСХ: CHCl3/МеОН/АсОН 10/1/0.1 (алюминиевая пластинка, проявление УФ и нингидрином). Rf=0.46. Содержание основного вещества >95% (определено методом ВЭЖХ).
Пример 2
Получение H-Phe-D-Trp-Lys(Boc)-Thr-1-нафтиламид
Растворяют 3.0 г (3.2 ммоль) Z-Phe-D-Trp-Lys(Boc)-Thr-1-нафтиламида в смеси 25 мл метилового спирта и 3 мл уксусной кислоты. К полученному раствору добавляют 30 мг 20% водной пасты гидроксида палладия. При интенсивном перемешивании и при комнатной температуре пропускают не очень сильный ток водорода. За протеканием реакции следят по ТСХ. После окончания реакции (около 8 ч) добавляют 10 мл воды и перемешивают 1.5 часа. Катализатор отфильтровывают, промывают его 3 мл воды. Объединенные жидкие фазы упаривают на роторном испарителе до окончания отгонки спирта (40°С, 10-15 мм рт. ст.), снова фильтруют раствор от остатков катализатора. К фильтрату добавляют 15 мл этилацетата и при перемешивании обрабатывают гидрокарбонатом натрия до слабощелочной среды (рН 8). Этилацетатный слой отделяют, а водный - двукратно экстрагируют 15 мл этилацетата. Объединенную органическую фазу промывают 5 мл воды и добавляют 25 мл диэтилового эфира. Отфильтровывают выпавший осадок и сушат на воздухе при комнатной температуре до постоянного веса. Получают 2.2 г (85.3%) продукта в виде светло-бежевого твердого вещества. Содержание основного вещества 76.9% (ВЭЖХ). ТСХ: CHCl3/МеОН/АсОН 5/1/0.1 (алюминиевая пластинка, проявление УФ и нингидрином). Rf=0.28.
Пример 3
Получение Boc-Cys(Acm)-Phe-D-Trp-Lys(Boc)-Thr-OH
Растворяют 500 мг Boc-Cys(Acm)-Phe-D-Trp-Lys(Boc)-Thr-OMe в 7 мл метанола. При 0°С прибавляют раствор 20 мг гидроксида лития в 3 мл воды. Перемешивают реакционную массу 30 мин при комнатной температуре, добавляют 10 мл 5%-ного раствора лимонной кислоты. Отфильтровывают выпавший осадок, промывают на фильтре 5 мл воды и 5 мл гексана, сушат на воздухе. Получают 390 мг белого твердого вещества.
Пример 4
Получение Boc-Cys(Acm)-Phe-D-Trp-Lys(Boc)-Thr-NHOH
Растворяют 500 мг Boc-Cys(Acm)-Phe-D-Trp-Lys(Boc)-Thr-OMe в 7 мл метанола. При 0°С прибавляют 10 мл раствора гидроксиламина (полученного перемешиванием в течение 30 мин суспензии 140 мг измельченного гидрохлорида гидроксиламина в растворе 75 мг гидроксида натрия в 10 мл метанола и последующей фильтрацией осадка). Перемешивают смесь 3 дня при комнатной температуре. Отгоняют растворитель. Получают 450 мг белого твердого вещества.
Пример 5
Получение Вос-Cys(Acm)-Phe-D-Trp-Lys(Вос)-Thr-NH2
Растворяют 500 мг Вос-Cys(Acm)-Phe-D-Trp-Lys(Вос)-Thr-ОМе в 15 мл метанола. Насыщают раствор аммиаком при 5°С, оставляют в закрытой колбе при комнатной температуре на 5 дней. Отгоняют растворитель досуха. Получают 410 мг белого твердого вещества.
Пример 6
Получение Вос-Thz-Phe-D-Trp-Lys(Вос)-Thr-ОМе
В 30 мл диметилформамида последовательно растворяют 2.1 г (3 ммоль) H-Phe-D-Trp-Lys(Boc)-Thr-OMe, 0.76 г (3.1 ммоль) Boc-Thz-OH и 0.51 г (3.1 ммоль) моногидрата N-гидроксибензотриазола. Охлаждают до 0°С и при этой температуре прибавляют по каплям раствор 0.62 г (3.0 ммоль) дициклогексилкарбодиимида в 5 мл диметилформамида. Реакционную массу перемешивают при этой температуре 2 ч, затем 12 ч при комнатной температуре. Отфильтровывают выпавшие кристаллы, промывают 5 мл диметилформамида, к фильтрату добавляют 50 мл 1%-ной лимонной кислоты. Экстрагируют 2 раза по 15 мл этилацетата, органический слой промывают 10 мл воды, 10 мл 5%-ного бикарбоната натрия, 2 раза по 10 мл насыщенного раствора хлористого натрия. Органическую фазу сушат над сульфатом натрия и отгоняют растворитель в вакууме (40°С, 15 мм рт. ст.), остаток растирают и сушат на воздухе до постоянного веса. Получают 2.4 г белого твердого вещества.
Пример 7
Получение Вос-Thz-Phe-D-Trp-Lys(Вос)-Thr-ОН
Растворяют 500 мг Вос-Cys(Acm)-Phe-D-Trp-Lys(Вос)-Thr-ОМе в 7 мл метанола. При 0°С прибавляют раствор 20 мг гидроксида лития в 3 мл воды. Перемешивают реакционную массу 30 мин при комнатной температуре, добавляют 10 мл 5%-ного раствора лимонной кислоты. Отфильтровывают выпавший осадок, промывают на фильтре 2 раза по 5 мл воды и 5 мл гексана, сушат на воздухе. Получают 420 мг белого твердого вещества.
Пример 8
Получение Boc-Thz-Phe-D-Trp-Lys(Boc)-Thr-NHOH
Растворяют 500 мг Вос-Thz-Phe-D-Trp-Lys(Вос)-Thr-ОМе в 7 мл метанола. При 0°С прибавляют 10 мл раствора гидроксиламина (полученного перемешиванием в течение 30 мин суспензии 140 мг измельченного гидрохлорида гидроксиламина в растворе 75 мг гидроксида натрия в 10 мл метанола и последующей фильтрацией осадка). Перемешивают смесь 3 дня при комнатной температуре. Отгоняют растворитель. Получают 445 мг белого твердого вещества.
Пример 9
Получение Boc-Thz-Phe-D-Trp-Lys(Boc)-Thr-NH2
Растворяют 500 мг Boc-Thz-Phe-D-Trp-Lys(Boc)-Thr-OMe в 15 мл метанола. Насыщают раствор аммиаком при 5°С, оставляют в закрытой колбе при комнатной температуре на 5 дней. Отгоняют растворитель досуха. Получают 455 мг белого твердого вещества.
Пример 10
Получение Thz-Phe-D-Trp-Lys-Thr-NH2
К 16 мл смеси трифторуксусной кислоты и хлористого метилена (1:1, объемные соотношения) прибавляют 0.05 мл β-меркаптоэтанола, 0.05 мл анизола и затем при 0°С 300 мг пептида Boc-Thz-Phe-D-Trp-Lys(Boc)-Thr-NH2. Смесь выдерживают 45 мин при комнатной температуре и выливают в 20 мл охлажденного до 5°С диэтилового эфира. Выпавший осадок отфильтровывают, промывают на фильтре 10 мл серного эфира, сушат на воздухе. Получают 280 мг белого кристаллического вещества.
Пример 11
Получение Thz-Phe-D-Trp-Lys-Thr-NHOH
К 16 мл смеси трифторуксусной кислоты и хлористого метилена (1:1, объемные соотношения) прибавляют 0.05 мл β-меркаптоэтанола, 0.05 мл анизола и затем при 0°С 300 мг пептида Вос-Thz-Phe-D-Trp-Lys(Вос)-Thr-NHOH. Смесь выдерживают 45 мин при комнатной температуре и выливают в 20 мл охлажденного до 5°С диэтилового эфира. Выпавший осадок отфильтровывают, промывают на фильтре 10 мл серного эфира, сушат на воздухе. Получают 276 мг белого кристаллического вещества.
Пример 12
Получение Вос-Cys(Вос)-Phe-D-Trp-Lys(Вос)-Thr-ОМе
В 150 мл диметилформамида при перемешивании последовательно растворяют 20.80 г (30 ммоль) Н-Phe-D-Trp-Lys(Вос)-Thr-ОМе, 4.59 г (30 ммоль) моногидрата N-гидроксибензотриазола, 10.59 г (33 ммоль) Boc-Cys(Boc)-OH. Охлаждают до 0°С и при этой температуре добавляют по каплям раствор 6.78 г (33 ммоль) дициклогексилкарбодиимида в 25 мл диметилформамида. Реакционную массу перемешивают при этой температуре 2 ч и еще 12 ч при комнатной температуре. Фильтруют выпавшие кристаллы, промывают 20 мл этилацетата, фильтрат разбавляют водой (1 объем фильтрата - 2 объема воды). Экстрагируют 2 раза по 100 мл этилацетата, органический слой промывают 25 мл 5%-ной лимонной кислотой, 25 мл воды, 25 мл насыщенного раствора бикарбоната натрия, затем 2 раза по 25 мл насыщенного раствора хлористого натрия. Органическую фазу сушат над сульфатом натрия и отгоняют растворитель в вакууме (40°С, 15 мм рт. ст.), остаток растирают и сушат на воздухе до постоянного веса. Получают 27.54 г (92.1%) белого мелкокристаллического вещества.
Пример 13
Получение H-Phe-D-Trp-Lys(Boc)-Thr-NH2
Растворяют 500 мг H-Phe-D-Trp-Lys(Boc)-Thr-OMe в 15 мл метанола. Насыщают раствор аммиаком при 5°С, оставляют в закрытой колбе при комнатной температуре на 5 дней. Отфильтровывают выпавший осадок, сушат на воздухе. Получают 460 мг белого кристаллического вещества.
Пример 14
Получение Вос-Cys(Вос)-Phe-D-Trp-Lys(Вос)-Thr-NH2
В 10 мл диметилформамида при перемешивании последовательно растворяют 680 мг (1 ммоль) H-Phe-D-Trp-Lys(Boc)-Thr-NH2, 153 мг (1 ммоль) моногидрата N-гидроксибензотриазола, 363 мг (1.1 ммоль) Boc-Cys(Boc)-OH. Охлаждают до 0°С и при этой температуре добавляют медленно раствор 227 мг (1.1 ммоль) дициклогексилкарбодиимида в 3 мл диметилформамида. Реакционную массу перемешивают при этой температуре 2 ч, после чего перемешивают 12 ч при комнатной температуре. Фильтруют выпавшие кристаллы, промывают 50 мл этилацетата, фильтрат разбавляют водой (1 объем фильтрата - 2 объема воды). Экстрагируют 2 раза по 15 мл этилацетата, органический слой промывают 10 мл 5%-ной лимонной кислотой, 10 мл воды, 10 мл насыщенного раствора бикарбоната натрия, затем 10 мл насыщенного раствора хлористого натрия. Органическую фазу сушат над сульфатом натрия и отгоняют растворитель в вакууме (40°С, 15 мм рт. ст.), остаток растирают и сушат на воздухе до постоянного веса. Получают 917 мг (93.3%) белого мелкокристаллического вещества.
Пример 15
Получение Boc-Cys(Boc)-Phe-D-Trp-Lys(Boc)-Thr-OH
Растворяют 10.00 г Вос-Cys(Acm)-Phe-D-Trp-Lys(Вос)-Thr-ОМе в 150 мл метанола.
При 0°С прибавляют раствор 400 мг гидроксида лития в 50 мл воды. Перемешивают реакционную массу 30 мин при комнатной температуре, добавляют 200 мл 5%-ного раствора лимонной кислоты. Отфильтровывают выпавший осадок, промывают на фильтре 2 раза по 50 мл воды и 50 мл гексана, сушат на воздухе. Получают 8.94 г белого твердого вещества.
Пример 16
Получение Вос-Cys(Вос)-Phe-D-Trp-Lys(Вос)-Thr-NH-CH2Ph
К раствору 984 мг (1 ммоль) Boc-Cys(Boc)-Phe-D-Trp-Lys(Boc)-Thr-OH, 160 мг (1.5 ммоль) бензиламина, 170 мг (1.1 ммоль) моногидрата N-гидроксибензотриазола в 10 мл диметилформамида при 0°С медленно прибавляют раствор 227 мг (1.1 ммоль) дициклогексилкарбодиимида в 5 мл диметилформамида. Реакционную массу перемешивают 12 ч при комнатной температуре. Фильтруют выпавшие кристаллы, промывают 5 мл этилацетата, фильтрат разбавляют водой (1 объем фильтрата - 2 объема воды). Двукратно экстрагируют по 15 мл этилацетата, органический слой промывают 10 мл 5%-ной лимонной кислотой, 10 мл воды, 10 мл насыщенного раствора бикарбоната натрия, затем 2 раза по 10 мл насыщенного раствора хлористого натрия. Органическую фазу сушат над сульфатом натрия и отгоняют растворитель в вакууме (40°С, 15 мм рт. ст.), остаток растирают и сушат на воздухе до постоянного веса. Получают 922 мг (86.1%) белого твердого вещества
Пример 17
Получение Вос-Cys(Acm)-Phe-D-Trp-Lys(Вос)-Thr-1-нафтиламид
В 10 мл диметилформамида при перемешивании последовательно растворяют 806 мг (1 ммоль) Н-Phe-D-Trp-Lys(Вос)-Thr-1-naphthylamide, 153 мг (1 ммоль) моногидрата N-гидроксибензотриазола, 321 мг (1.1 ммоль) Boc-Cys(Acm)-OH. Охлаждают до 0°С и при этой температуре прикапывают раствор 227 мг (1.1 ммоль) дициклогексилкарбодиимида в 5 мл диметилформамида. Реакционную массу перемешивают при этой температуре 2 ч и еще 12 ч при комнатной температуре. Фильтруют выпавшие кристаллы, промывают 5 мл этилацетата, фильтрат разбавляют водой (1 объем фильтрата - 2 объема воды). Экстрагируют 2 раза по 15 мл этилацетата, органический слой промывают 10 мл 5%-ной лимонной кислотой, 10 мл воды, 10 мл насыщенного раствора бикарбоната натрия, затем 2 раза по 10 мл насыщенного раствора хлористого натрия. Органическую фазу сушат над сульфатом натрия и отгоняют растворитель в вакууме (40°С, 15 мм рт. ст.), остаток растирают и сушат на воздухе до постоянного веса. Получают 960 мг (91.0%) белого мелкокристаллического вещества.
Пример 18
Получение Вос-Cys(Вос)-Phe-D-Trp-Lys(Вос)-Thr-1-нафтиламид
В 10 мл диметилформамида при перемешивании последовательно растворяют 806 мг (1 ммоль) Н-Phe-D-Trp-Lys(Вос)-Thr-1-naphthylamide, 153 мг (1 ммоль) моногидрата N-гидроксибензотриазола, 385 мг (1.2 ммоль) Boc-Cys(Boc)-OH. Охлаждают до 0°С и при этой температуре прикапывают раствор 227 мг (1.1 ммоль) дициклогексилкарбодиимида в 5 мл диметилформамида. Реакционную массу перемешивают при этой температуре 2 ч, после чего перемешивают 12 ч при комнатной температуре. Фильтруют выпавшие кристаллы, промывают 5 мл этилацетата, фильтрат разбавляют водой (1 объем фильтрата - 2 объема воды). Экстрагируют двукратно по 15 мл этилацетата, органический слой промывают 10 мл 5%-ной лимонной кислотой, 10 мл воды, 10 мл насыщенного раствора бикарбоната натрия, затем 2 раза по 10 мл насыщенного раствора хлористого натрия. Органическую фазу сушат над сульфатом натрия и отгоняют растворитель в вакууме (40°С, 15 мм рт. ст.), остаток растирают и сушат на воздухе до постоянного веса. Получают 1.01 г (91.7%) белого мелкокристаллического вещества.
Пример 19
Получение Вос-Thz-Phe-D-Trp-Lys(Вос)-Thr-1-нафтиламид
В 10 мл диметилформамида при перемешивании последовательно растворяют 806 мг (1 ммоль) Н-Phe-D-Trp-Lys(Вос)-Thr-1-naphthylamide, 153 мг (1 ммоль) моногидрата N-гидроксибензотриазола, 256 мг (1.1 ммоль) Boc-Thz-OH. Охлаждают до 0°С и при этой температуре прибавляют по каплям раствор 227 мг (1.1 ммоль) дициклогексилкарбодиимида в 25 мл диметилформамида. Реакционную массу перемешивают при этой температуре 2 ч, после чего перемешивают 12 ч при комнатной температуре. Фильтруют выпавшие кристаллы, промывают 5 мл этилацетата, фильтрат разбавляют водой (1 объем фильтрата - 2 объема воды). Экстрагируют 2 раза по 15 мл этилацетата, органический слой промывают 10 мл 5%-ной лимонной кислотой, 10 мл воды, 10 мл насыщенного раствора бикарбоната натрия, затем 2 раза по 10 мл насыщенного раствора хлористого натрия. Органическую фазу сушат над сульфатом натрия и отгоняют растворитель в вакууме (40°С, 15 мм рт. ст.), остаток растирают и сушат на воздухе до постоянного веса. Получают 837 мг (81.3%) белого мелкокристаллического вещества.
Синтезированные пептиды были очищены и проанализированы (См. Таблица 1)
Препаративная ВЭЖХ
Очистку проводили с помощью препаративной обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ). Для очистки тетрапептидов использовалась хроматографическая система, состоящая из 2 насосов GILSON 306 производительностью до 25 мл в минуту, манометрического модуля GILSON 805 и спектрофотометрического детектора UVV-105 (производство фирмы JET chrom). Разделение производилось на колонке ReproSil-PurAQ С18 5 мкм, размером 250*10 мм с предколонкой ReproSil-PurAQ С18 10 мкм, размером 30*8 мм. Элюент: 60% водный ацетатно-аммонийный буфер (рН 5)/40% ацетонитрил.
Все соединения были очищены до содержания основного вещества выше 98%.
ВЭЖХ-МС:
Чистоту полученных соединений определяли при помощи аналитической высокоэффективной жидкостной хроматографии на хроматографической системе Agilent LC/MS 1200 (колонка - ReproSil-Pur Basic C18 5 мкм размером 250×4,6 мм с предколонкой SecurityGuard Cartridges Widepore С18 4×2 мм; подвижная фаза: градиент с 95% вода +5% ацетонитрил до 100% ацетонитрил с буферизацией 0,01% трифторуксусной кислотой за 20 минут). Детектирование на УФ-детекторе с длиной волны 220 нм.
Содержание основного вещества в образце определяли по относительной величине площади пика на хроматограмме.
Спектры ESI-MS регистрировались на MS детекторе Agilent Ion Trap 6310. Ионизация пробы с помощью электроспрея, регистрация в режиме положительных ионов, в некоторых случаях в режиме отрицательных ионов.
Настройки масс-детектора:
- давление на нибулайзере 40 psi;
- напряжение на нибулайзере 3500 вольт;
- поток шторного газа 7 л в минуту;
- температура газа носителя 360°С;
- детекция масс в диапазоне от 70 до 1500 атомных единиц массы.
Параметром, характеризующим анализируемое вещество, является молекулярный вес иона, определенный МС детектором.
Структурные и физико-химические характеристики полученных соединений приведены в Таблице 1.
Синтезированные соединения были испытаны на цитотоксическую активность.
Цитотоксическую активность заявляемых соединений определяли с помощью МТТ-теста. Концентрацию полумаксимального ингибирования (IC50) для синтезированных веществ определяли на клетках рака молочной железы линии MCF-7, клетках аденокарциномы простаты линии РС-3, клетках колоректального рака линии НСТ-116 и ФЭЧ (фибробласты эмбриональные человека). Клетки MCF-7 и ФЭЧ культивировали в среде DMEM, клетки PC-3 и НСТ-116 - в среде RPMI 1640 (ПанЭко, Россия) с добавлением 10% эмбриональной бычьей сыворотки (GE Healthcare LifeSciences) и гентамицина в концентрации 40 мг/мл.
Клетки MCF-7, РС-3 и НСТ-116 рассевали в 96-луночные планшеты по 5×103 клеток в лунку в 90 мкл культуральной среды.
Исследуемые вещества растворяли в ДМСО до получения концентрации 1×10-2 М, для последующего разведения веществ использовалась бессывороточная культуральная среда.
Через сутки в лунки с клетками добавляли растворы испытуемых веществ в объеме 10 мкл на лунку в различных концентрациях. Использовалась линейка из 10 концентраций, от 1×10-4М до 2×10-7М, каждая концентрация добавлялась в 3-4 повторах. В контрольные лунки добавляли 10 мкл бессывороточной среды. Клетки культивировали в СО2-инкубаторе в атмосфере 5% СО2, при 100% влажности и температуре 37°С в течение 72 часов. Затем в лунки добавляли реагент МТТ в концентрации 5 мг/мл в объеме 20 мкл на лунку. После 1,5-2-часовой инкубации в атмосфере 5% СО2, при 100% влажности и температуре 37°С планшеты центрифугировали при 1500 об/мин в течение 5 минут, удаляли супернатант и в каждую лунку добавили по 60 мкл ДМСО для растворения осадка кристаллов фармазана. Через 30 минут инкубации при комнатной температуре, после полного растворения кристаллов формазана, уровень оптической плотности определяли с помощью спектрофотометра Multiskan FC (Thermo Scientific), при длине волны 594 нм.
Далее в компьютерной программе строился график зависимости уровня оптической плотности (проценты от контроля) от концентрации исследуемого вещества и рассчитывалась концентрация IC50.
Результаты испытаний приведены в Таблице 2.
Наиболее активным является пептид Boc-Cys(Boc)-Phe-D-Trp-Lys(Boc)-Thr-1-нафтиламид, который показал активность против различных линий клеток в микромолярном диапазоне.
Как показали исследования, особым преимуществом новых соединений перед известными аналогами является их высокая цитотоксическая активность и устойчивость к ферментативному разложению, что дает возможность их орального введения в организм, дополнительно к парентеральному, осуществляемому подкожно, внутривенно, внутримышечно и внутрибрюшинно.
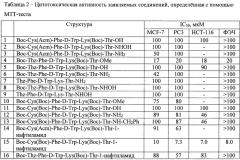
Короткий пептид с цитотоксической активностью общей формулы:
,
где R1 представляет собой Н, трет-бутилоксикарбонил;
R2 представляет собой гидрокси, метокси, амино, гидроксиамино, аминобензильную, 1-аминонафтильную группу;
R3 - трет-бутилоксикарбонил-Cys(R4) или 3-R5-тиазолидин-4-карбонил, где R4 - Н или трет-бутилоксикарбонил, ацетамидометил;
R5 - Н или трет-бутилоксикарбонил.