Способ защиты вегетирующих растений подсолнечника от повреждающего действия 2,4-д
Иллюстрации
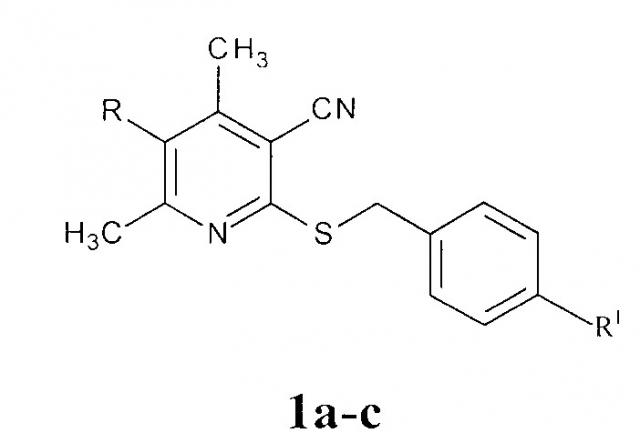
Показать всеИзобретение относится к сельскому хозяйству. Для защиты вегетирующих растений подсолнечника от повреждающего действия 2,4-Д их обрабатывают 2-(4-R1-бензилсульфанил)-4,6-диметил-5-R-никотинонитрилом формулы:
,
где 1a R=СН3, R1=CI; 1b R=Н, R1=CI; 1c R=CI, R1=Н; в количестве 30 г/га через 1 сутки после использования гербицида. Изобретение позволяет повысить урожайность подсолнечника. 1 табл., 5 пр.
Реферат
Изобретение относится к технологии защиты культурных растений от повреждающего действия гербицидов.
Известен способ защиты вегетирующих культурных растений от повреждающего действия гербицидов, предусматривающий их обработку антидотом после использования гербицида [Питина М.Р. и др., Современный уровень и перспективные направления защиты сельскохозяйственных культур от нежелательных последствий применения гербицидов // Агрохимия, 1986, №4, с. 107-136].
Задачей изобретения является расширение арсенала антидотов подсолнечника от повреждающего действия 2,4-Д.
Техническим результатом изобретения является защита вегетирующих растений подсолнечника от повреждающего действия 2,4-Д, выражающаяся в повышении урожайности по сравнению с обработанным гербицидом KOHтролем.
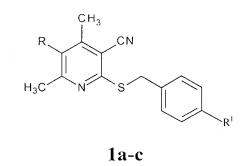
Этот результат достигается тем, что в способе защиты вегетирующих растений от повреждающего действия 2,4-Д, предусматривающем их обработку антидотом после использования гербицида, согласно изобретению в качестве антидота используют 2-бензилсульфанил-4,6-диметилникотино-нитрилы формулы 1а-с:
где 1a R=CH3, R1=CI; 1b R=H, R1=CI; 1c R=CI, R1=H;
в количестве 30 г/га через 1 сутки после использования гербицида.
Наиболее близким аналогом по структуре и свойствам заявляемому соединению является 2-(4-бромбензилсульфанил)-4,6-диметилникотинонитрил (соединение 2) [Пат. РФ №2383135. Антидот 2,4-дихлорфенилуксусной кислоты на подсолнечнике. Стрелков В.Д., Дядюченко Л.В., Исакова Л.И., Морозовский В.В. Заявл. 11.02.2008. Опубл. 10.03.2010. Бюл. №7]:
Соединение 2 проявляет свойства антидота против 2,4-Д на подсолнечнике и при применении в дозе 200 г/га обеспечивает антидотный эффект на уровне 27%.
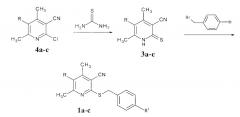
Синтез антидотов осуществлен авторами по схеме:
Заявляемые соединения получали алкилированием 4,6-диметил-3-циано-2(1Н)-пиридинтионов 3а-с бензилбромидами в растворе ДМФА [Вейганд-Хильгетаг. Методы экспиримента в органической химии. - М.: Химия. 1969, с. 328].
В свою очередь 4,6-диметил-3-циано-2(1Н)-пиридинтионы синтезировали известным методом - взаимодействием 4,6-диметил-2-хлорникотинонитрилов 4а-с с тиомочевиной [Pat. №2555450 Franse. Composition anti-acneique contenant en tant que compose actif un derive diisothia-zolo[5,4-b]pyridine one-3. Заявл. 34.11.83; опубл. 31.05.85, РЖ Хим. - 1986. -120 - 150].
Изобретение иллюстрируется следующими примерами.
Пример 1. 2-(4-хлорбензилсульфанил)-4,5,6-триметилникотино-нитрил (соединение 1а).
К суспензии из 1,2 г (6,7 ммоль) 4,5,6-триметил-3-циано-2(1Н)-пиридинтиона в 20 мл ДМФА прибавляют раствор 0,38 г (6,7 ммоль) KOH в минимальном количестве воды и перемешивают до полного растворения осадка. Затем в реакционную смесь вносят раствор 1,38 г (6,7 ммоль) 4-хлорбензилбромида в 10 мл ДМФА и перемешивают при комнатной температуре 1 ч, разбавляют реакционную массу водой вдвое и выделившийся осадок отфильтровывают, сушат. После перекристаллизации из смеси циклогексан : этил ацетат = 1:1 получают 2,0 г (74%) целевого продукта 1а в виде кристаллов с т.пл. 147-148°С.
Найдено, %: С 64,71; Н 4,84; N 9,16. C16H15CIN2S;
Вычислено, %: С 64,46; Н 4,99; N 9,25.
Спектр ЯМР 1Н, δ, м.д. (группа): 2,26 (с, 3Н, 6-СН3 Ру); 2,30 (с, 3Н, 5-СН3 Ру); 2,47 (с, 3Н, 4-СН3 Ру); 4,36 (с, 2Н, SCH2); 7,30 и 7,49 (два д., 4Н, Ar).
Пример 2. 2-(4-хлорбензилсульфанил)-4,6-диметилникотинонитрил (соединение 1b).
К суспензии из 1,2 г (7,3 ммоль) 4,6-диметил-3-циано-2(1Н)-пиридинтиона в 20 мл ДМФА прибавляют раствор 0,41 г (7,3 ммоль) KОН в минимальном количестве воды и перемешивают до полного растворения осадка. Затем в реакционную смесь вносят раствор 1,50 г (7,3 ммоль) 4-хлорбензилбромида в 10 мл ДМФА и перемешивают при комнатной температуре 1 ч, разбавляют реакционную массу водой вдвое и выделившийся осадок отфильтровывают, сушат. После перекристаллизации из смеси циклогексан : этил ацетат = 1:1 получают 1,65 г (78%) целевого продукта 1b в виде кристаллов с т.пл. 129-130°С.
Найдено, %: С 62,54; Н 4,36; N 9,60. C15H13CIN2S;
Вычислено, %: С 62,38; Н 4,54; N 9,70.
Спектр ЯМР 1Н, δ, м.д. (группа): 2,31 (с, 3Н, 6-СН3 Ру); 2,42 (с, 3Н, 4-СН3 Ру); 4,35 (с, 2Н, SCH2); 7,13 (с, 1Н, 5-Н Ру); 7,29 и 7,47 (два д., 4Н, Ar).
Пример 3. 2-(бензилсульфанил)-4,6-диметил-5-хлорникотинонитрил (соединение 1с).
К суспензии из 1,99 г (10 ммоль) 4,6-диметил-3-циано-2(1Н)-пиридинтиона в 20 мл ДМФА прибавляют раствор 0,56 г (10 ммоль) KOH в минимальном количестве воды и перемешивают до полного растворения осадка. Затем в реакционную смесь вносят раствор 1,71 г (10 ммоль) 4-хлорбензилбромида в 10 мл ДМФА и перемешивают при комнатной температуре 1 ч, разбавляют реакционную массу водой вдвое и выделившийся осадок отфильтровывают, сушат. После перекристаллизации из смеси циклогексан : этилацетат = 1:1 получают 2,3 г (81%) целевого продукта 1 с в виде кристаллов с т.пл. 77°С.
Найдено, %: С 62,21; Н 4,40; N 9,88. C15H13CIN2S;
Вычислено, %: С 62,38; Н 4,54; N 9,70.
Спектр ЯМР 1Н, δ, м.д. (группа): 2,28 (с, 3Н, 6-СН3 Ру); 2,52 (с, 3Н, 4-СН3 Ру); 4,40 (с, 2Н, SCH2); 7,42…7,70 (м, 5Н, Ar).
Пример 4. 2-(4-бромбензилсульфанил)-4,6-диметилникотинонитрил (соединение 2, прототип).
К суспензии из 1,2 г (7,3 ммоль) 4,6-диметил-3-циано-2(1Н)-пиридинтиона в 20 мл ДМФА прибавляют раствор 0,41 г (7,3 ммоль) KOH в минимальном количестве воды и перемешивают до полного растворения осадка. Затем в реакционную смесь вносят раствор 1,82 г (7,3 ммоль) 4-бромбензилбромида в 10 мл ДМФА и перемешивают при комнатной температуре 1 ч, разбавляют реакционную массу водой вдвое и выделившийся осадок отфильтровывают, сушат. После перекристаллизации из смеси циклогексан : этилацетат = 1:1 получают 1,8 г (88%) целевого продукта 1 в виде кристаллов с т.пл. 152-153°С.
Найдено, %: С 53,80; Н 3,81; N 8,56. C15H13BrN2S;
Вычислено, %: С 54,06; H 3,93; N 8,41.
Спектр ЯМР 1Н, δ, м.д. (группа): 2,38 (с, 3Н, 6-СН3 Ру); 2,55 (с, 3Н, 4-СН3 Ру); 4,47 (с, 2Н, SCH2); 7,12 (с, 1Н, 5-НРу); 7,35…7,54 (м, 4Н, Ar).
Пример 5. Оценка соединений 1a-с и прототипа на антидотную активность на растениях подсолнечника в условиях полевого опыта
Оценку антидотной активности заявляемых соединений на растениях подсолнечника проводили на экспериментальном поле ВНИИ биологической защиты растений. В качестве прототипа использовали соединение 2.
В полевых условиях растения подсолнечника сорта Флагман в фазу 10-16 листьев обрабатывали бутиловым эфиром 2,4-дихлорфеноксиуксусной кислоты в дозе 18 г/га в расчете на 40-60% поражение культуры и через 1 сутки наносили раствор антидота в дозе 30 г/га с нормой расхода рабочей жидкости 300 л/га.
В опыте предусмотрены следующие варианты:
- контроль - необработанные растения;
- «гербицид» (эталон) – растения, обработанные гербицидом;
- «гербицид + антидот» - растения, обработанные гербицидом и антидотом.
Опыты проводили на делянках площадью 2,8 м2, повторность четырехкратная. Уборку урожая подсолнечника проводили в момент полного созревания семян.
Антидотный эффект определяли по абсолютной величине прибавки урожая к гербицидному эталону и в процентах по формуле:
Ах - антидотный эффект, %;
А - урожай в варианте антидот + гербицид;
Э - урожай в варианте эталон (гербицид).
Полученные данные статистически обработаны с использованием t-критерия Стьюдента.
Результаты испытаний представлены в таблице.
* Различия между вариантами достоверны при Р=0,90
Таким образом, предлагаемое изобретение позволяет обеспечить антидотный эффект на уровне 32-44% против 19% у прототипа, что увеличивает урожайность подсолнечника на 4,7-6,6 ц/га.
Способ защиты вегетирующих растений подсолнечника от повреждающего действия 2,4-Д, предусматривающий их обработку антидотом после использования гербицида, отличающийся тем, что в качестве антидота используют 2-(4-R1-бензилсульфанил)-4,6-диметил-5-R-никотинонитрилы формулы 1а-с:
где 1a R=СН3, R1=CI; 1b R=Н, R1=CI; 1c R=CI, R1=Н;
в количестве 30 г/га через 1 сутки после использования гербицида.