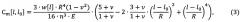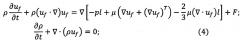Демпфирующий элемент микрофлюидного чипа и микрофлюидный чип
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии, а именно к микрофлюидным устройствам с замкнутой микроциркуляцией питательной среды, предназначенным для культивирования и исследования клеток или клеточных моделей. Демпфирующий элемент, интегрированный в замкнутый микрожидкостный контур микрофлюидного чипа, включает демпфирующую камеру, закрытую сверху мембраной, подводящий и отводящий каналы, связанные с демпфирующей камерой. При этом мембрана выполнена сообщающейся сверху с открытым воздухом; демпфирующая камера в проекции на плоскость мембраны выполнена в форме круга, а подводящий и отводящий каналы выполнены формой, обеспечивающей ламинарное движение среды через демпфирующий элемент. Также раскрыт микрофлюидный чип для культивирования клеток или клеточной модели, включающий замкнутый микрофлюидный контур, соединяющий перистальтический микронасос, по меньшей мере один демпфирующий элемент и ячейку для культивирования. Группа изобретений обеспечивает оптимальные условия жизнедеятельности культивируемых клеток за счет сглаживания пульсаций скорости и давления питательной среды при подводе ее к клеткам на частотах, соответствующих физиологическим условиям, что позволяет проводить исследования на клетках, минимизируя пагубное влияние перистальтического насоса. 2 н. и 9 з.п. ф-лы, 11 ил., 2 табл., 1 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области биохимии, а именно к микрофлюидным устройствам с замкнутой микроциркуляцией питательной среды, предназначенным для культивирования и/или исследования клеток и/или клеточных моделей тканей и органов млекопитающих, и может быть использовано для сглаживания скачков давления и скорости течения питательной среды с целью обеспечения оптимальных условий жизнедеятельности культивируемых клеток и/или клеточных моделей in vitro, максимально приближенных к in vivo. Изобретение может применяться, в частности, при проведении испытаний лекарственных препаратов, исследовании влияния различных химических веществ на клетки млекопитающих и т.п.
Уровень техники
При культивировании клеток и/или клеточных моделей тканей и органов млекопитающих в микрофлюидных устройствах, как правило, для приведения в движение среды культивирования используют насосы, в т.ч. перистальтического действия. Однако перистальтические насосы вытесняющего типа создают резкие пульсации тока жидкости с частотой, равной частоте работы клапанов, которые оказывают пагубное воздействие на культивируемые клетки. Известно, что в гидравлических и пневматических системах в качестве гасителей пульсаций потока, гидроударов и стабилизации тока рабочей среды используют демпферы. Демпферы позволяют уменьшить амплитуду этих пульсаций и сгладить их воздействие по времени. В качестве демпфирующего элемента широко используют гидроаккумулятор. При этом в микрофлюидных устройствах можно реализовать поршневой, баллонный, пружинный или мембранный гидроаккумулятор. Следует отметить, что поршневой и баллонный гидроаккумуляторы обладают низкой стоимостью и обеспечивают постоянство давления, однако их конструкции очень громоздкие и они требуют заполнения полости газом под давлением, что сильно затрудняет работу с микрофлюидным устройством. В поршневом гидроаккумуляторе возможно возникновение течей. Пружинный гидроаккумулятор обладает низкой стоимостью, но давление в системе будет сильно зависеть от характеристики пружины. Мембранный гидроаккумулятор легко изготовить в виде встраиваемого в микрофлюидное устройство элемента, он обладает малыми габаритами, минимальной инерционностью, простой и надежной конструкцией. Однако имеет малый рабочий объем и требует заполнения полости газом под давлением.
Из уровня техники известен биореактор для создания 3D модели печени (Perfused Multiwell Plate for 3D Liver Tissue Engineering. Karel Domanskya, Walker Inmana, James Serdyb, Ajit Dasha, Matthew H. M. Lime, and Linda G. Griffith. Lab Chip.2010 January 7; 10(1): 51-58), который имеет в качестве основы стандартную многоячеечную плашку. Через каждую ячейку проходит замкнутый контур с питательной средой. Среду нагнетает трехклапанный мембранный насос с пневматическим приводом. В ячейку помещают стаканчик с пористой мембраной, на которой высеивают клетки. А под клетками находится демпфирующий элемент, который также состоит из эластичной мембраны и сглаживает пульсации от насоса.
Особенностью конструкции данной системы является открытая ячейка для культивирования клеток, что в ряде случаев становится существенным недостатком в связи с высоким риском контаминации, так как ячейка сверху сообщается с воздухом. Кроме того, такая система имеет очень большое отношение объема питательной среды к объему клеток, что не соответствует физиологическим параметрам. Демпфер расположен под ячейкой, вследствие чего постоянно растянут массой жидкости, находящейся на нем. Таким образом, не весь ресурс мембраны используется для сглаживания импульсов.
Из уровня техники также известны различные средства, которые позволяют управлять или манипулировать потоком текучей среды через микроканалы микрофлюидальных систем (например, патенты РФ №2588905, №2381382). Однако данные решения не обеспечивают сглаживание пульсации текучей среды и создание условий циркуляции, не травмирующих культивируемые клеточные модели.
Наиболее близкими к предлагаемому изобретению являются демпфер и микрофлюидное устройство, известные из патента US 7258774. Микрофлюидное устройство содержит проточный канал, сформированный из эластомерного материала, насос для перемещения потока жидкости в указанном канале и демпфер для уменьшения амплитуды колебаний жидкости. Демпфер содержит полость, отделенную от канала эластичной мембраной. В ответ на колебания давления в проточном канале эластичная мембрана отклоняется в полость, тем самым уменьшая амплитуду колебаний давления в канале.
За счет выполнения демпфера прямоугольной формы во всех проекциях возможно возникновение вихрей и отрывных течений в угловых областях, что резко снижает эффективность работы насоса по формированию потока жидкости во всем микрофлюидном контуре. Один из важнейших недостатков известного решения заключается в том, что проточный режим не позволяет сохранить продукты метаболизма в среде в процессе культивирования клеток, а следовательно, не дает возможность, с одной стороны, обеспечить условия in vitro, максимально приближенные к in vivo, а с другой стороны, осуществить полноценный анализ продуктов метаболизма. Наконец, известное техническое решение рассчитано на работу при частотах пульсаций более 10 Гц. Это обусловлено спецификой реализации известного технического решения, но совершенно не соответствует физиологическим условиям. Применение же известного решения при более низких частотах пульсаций среды в контуре не позволит достичь требуемого уровня ослабления скачков давления и скорости среды в контуре. Следует также заметить, что формирование пульсирующего потока в замкнутом контуре сопряжено с возможностью возникновения резонансных явлений: в зависимости от частоты работы насоса амплитуда пульсаций потока жидкости может возрастать. Кроме того, в замкнутом контуре существенную роль играют обратные течения, также сопровождающиеся скачкообразным изменением давления и расхода питательной среды.
Вследствие перечисленных выше особенностей к демпфирующему элементу, расположенному в замкнутом контуре, должны быть предъявлены особые требования: необходимо создание демпфера, характеризующегося повышенным показателем рассеиваемой энергии пульсаций потока жидкости, а также рассчитанного на работу при значительно меньших частотах пульсации среды по сравнению с ближайшим аналогом.
Раскрытие изобретения
Задача настоящего изобретения заключалась в разработке демпфирующего элемента, интегрированного в замкнутый микрофлюидный контур для циркуляции питательной среды в составе микрофлюидного устройства с перистальтическими насосами объемного принципа действия, который позволял бы видоизменять поток питательной среды, приближая его к естественным процессам, протекающим в организме человека.
Техническим результатом является обеспечение оптимальных условий жизнедеятельности культивируемых клеток за счет сглаживания пульсаций скорости и давления питательной среды при подводе ее к клеткам на частотах, соответствующих физиологическим условиям, что позволяет проводить исследования на клетках и/или клеточных моделях при различных условиях, минимизируя пагубное влияние перистальтического насоса.
Указанный технический результат может быть достигнут за счет реализации конструкции демпфирующего элемента, интегрированного в замкнутый микрожидкостный контур микрофлюидного чипа, включающего демпфирующую камеру, закрытую сверху мембраной, подводящий и отводящий каналы, связанные с демпфирующей камерой, и в котором мембрана выполнена сообщающейся сверху с открытым воздухом, демпфирующая камера в проекции на плоскость мембраны выполнена в форме круга, а подводящий и отводящий каналы выполнены формой, обеспечивающей ламинарное движение среды через демпфирующий элемент.
В предпочтительном варианте осуществления изобретения демпфирующая камера, мембрана, подводящий и отводящий каналы выполнены в слое эластомера, например полидиметилсилокеана, толщиной от 1 до 2 мм. При этом подводящий и отводящий каналы расположены симметрично относительно геометрического центра демпфирующей камеры, выполнены прямоугольного сечения с высотой, равной высоте демпфирующей камеры, и имеют округлое расширение в месте соединения с демпфирующей камерой в проекции на плоскость мембраны с радиусом кривизны от 0,5 до 1 мм, при этом кривизна стенок демпфирующей камеры и стенок отводящего или подводящего канала в проекции на плоскость мембраны выполнена с различным знаком. Сама демпфирующая камера выполнена в форме цилиндра диаметром от 3,5 до 4,5 мм и высотой от 0,1 до 1 мм, а мембрана выполнена толщиной от 0,2 до 0,4 мм.
Технический результат может быть также достигнут за счет реализации конструкции микрофлюидного чипа, включающего замкнутый микрофлюидный контур, соединяющий перистальтический микронасос, по меньшей мере один демпферный элемент, описанный выше, и клеточную ячейку и в котором демпферный элемент расположен между перистальтическим микронасосом и клеточной ячейкой на расстоянии не менее 5 мм от перистальтического насоса.
Количество демпферных элементов может быть выбрано равным двум, при этом их располагают на входе и выходе микронасоса.
Наличие демпфирующей камеры позволяет увеличить площадь мембраны, что, с одной стороны, приводит к повышенному рассеянию энергии пульсации среды, а с другой стороны, обеспечивает эффективное демпфирование пульсаций среды на частотах, соответствующих физиологическим условиям жизнедеятельности клеток. При этом сообщение мембраны с атмосферой дает возможность больше прогибаться мембране и лучше гасить колебания, а выполнение каналов с расширениями позволяет избежать возникновения вихрей и турбулентности в потоке циркулирующей среды, тем самым обеспечивая высокий уровень эффективности работы насоса. Выполнение демпфера интегрированным в конструкцию чипа исключает риски контаминации. Кроме того, возможность изготовления мембраны различной толщины позволяет подобрать емкость мембраны под конкретную задачу поддержания необходимых условий культивирования клеток. Объем демпферной камеры полностью заполняется питательной средой, без воздуха, тем самым исключая переотражение пульсаций от границы раздела. Демпфер, изготовленный из полидиметилсилоксана в составе микрофлюидного устройства, обладает высокой надежностью и низкой стоимостью.
Краткое описание чертежей
Изобретение поясняется чертежами и графиками, где на фиг. 1 и фиг. 2 представлен вариант выполнения микрофлюидного чипа с четырьмя замкнутыми контурами и демпфирующим элементом, интегрированным в каждый контур - общий вид и вид снизу, соответственно; на фиг. 3 представлен вид сбоку на чип, где на местном разрезе представлен фрагмент, показывающий демпфирующий элемент и сквозное отверстие в верхней пластине чипа над демпфером; на фиг. 4 представлен увеличенный фрагмент фиг. 3; на фиг. 5 представлена демпфирующая камера в виде уширения микроканала, вид снизу; на фиг. 6 представлена временная диаграмма работы насоса (такты работы микронасоса), на фиг. 7 и фиг. 8 представлены графики изменения давления и расхода жидкости в течение одного цикла работы насоса, соответственно; на фиг. 9 представлен результат моделирования смещения мембраны демпфера и поля скоростей в канале; на фиг. 10 представлены графики зависимостей мгновенного расхода жидкости через микроканал от времени с использованием демпфера и без демпфера, полученных в результате математического моделирования; на фиг. 11 представлены графики экспериментально полученных зависимостей мгновенного расхода жидкости через микрофлюидный чип с демпфером и без демпфера.
Позициями на чертежах обозначены: 1 - демпфирующий элемент, 2 - замкнутый микрожидкостный контур, 3 - клеточная ячейка для культивирования клеток или клеточных моделей тканей и органов млекопитающих, 4 - микронасос, 5 - демпфирующая камера, 6 - микрофлюидный канал, 7 - эластичная мембрана демпфера, 8 - подводящий микроканал на входе в демпфирующую камеру, 9 - отводящий микроканал на выходе из демпфирующей камеры, 10 - округлое расширение подводящего и отводящего микроканалов, 11 - верхняя пластина чипа, 12 - слой из оптически прозрачного эластичного полимера, 13 - нижний слой чипа (стандартное предметное стекло), 14 - сквозное отверстие, выполненное в верхней пластине чипа над демпфером, 15 - фитинг для подключения пневматических трубок, 16 - пробка с уплотнительным кольцом, герметизирующая клеточную ячейку, 17 - технологическое отверстие для доступа к питательной среде, 18 - заглушка с уплотнительным кольцом.
Осуществление изобретения
Демпфирующий элемент 1 (демпфер) является элементом, интегрированным в конструкцию микрофлюидного устройства (чипа), содержащего, по меньшей мере, один замкнутый микрожидкостный контур 2 для циркуляции питательной среды, включающий объединенные системой микрофлюидных (микрожидкостных) каналов клеточную ячейку 3 для культивирования клеток или клеточных моделей тканей и органов млекопитающих и микронасос 4, обеспечивающий непрерывную перфузию питательной среды (фиг. 1-3). При этом демпфирующий элемент представляет собой демпфирующую камеру 5 (фиг. 4), выполненную в форме цилиндра высотой от 0,1 до 1 мм мм и диаметром от 1 до 10 мм и закрытую сверху эластичной мембраной 7 толщиной от 0,2 до 0,4 мм, сообщающейся с атмосферой. Микрофлюидный канал на входе в демпфирующую камеру является подводящим каналом 8, а на выходе из нее - отводящим каналом 9. Подводящий 8 и отводящий 9 каналы выполнены с округлым расширением 10 с радиусом скругления от 0,5 до 1 мм в месте соединения с демпфирующей камерой, что обеспечивает ламинарное движение среды через демпфирующий элемент.
Микрофлюидный чип, содержащий заявляемый демпфирующий элемент, может представлять собой слоистую структуру. В частности, верхний слой чипа может быть образован пластиной 11, выполненной из поликарбоната толщиной от 5 до 10 мм, на нижней стороне которой размещен (отлит) слой 12 из оптически прозрачного эластичного полимера, например полидиметилсилоксана (ПДМС), толщиной от 1 до 2 мм, содержащего, по меньшей мере, один замкнутый микрожидкостный контур 2 для циркуляции питательной среды, а нижний слой 13 может быть образован стандартным предметным стеклом толщиной от 0,16 до 1 мм, формирующим нижнюю стенку контура. Таким образом, с одной стороны, слой ПДМС покрыт предметным стеклом, а с другой - пластиной из поликарбоната, которая является механическим каркасом микрофлюидного устройства, обеспечивая прочность его конструкции.
Демпфирующий элемент 1 интегрирован в замкнутый контур чипа между перистальтическим микронасосом 4 и клеточной ячейкой 3 таким образом, чтобы поток питательной среды перед попаданием к клеточным моделям проходил через демпфер. При этом демпфирующий элемент расположен на расстоянии не менее 5 мм от перистальтического насоса для обеспечения оптимального размещения элементов микрофлюидного чипа, объединенных замкнутым контуром, и поддержания эффективного режима работы демпфирующего элемента. Возможен вариант выполнения, при котором микрофлюидный чип содержит дополнительный демпфирующий элемент, расположенный перед микронасосом по направлению циркуляции среды в замкнутом контуре, что обеспечивает гашение обратных пульсаций скорости и давления жидкости в замкнутом контуре, вызванных работой перистальтического насоса.
Мембрана 7 демпфирующего элемента 1, закрывающая рабочую камеру 5, может быть выполнена из ПДМС как часть истонченного эластичного слоя 12 чипа. При этом верхняя стенка мембраны демпфера может быть сформирована в процессе литья специальной оснасткой соответствующего диаметра, зафиксированной в поликарбонатной пластине посадкой в натяг. Кроме того, мембрана может быть выполнена в виде отдельного элемента, установленного в чипе с обеспечением герметичности, например, выполненного в виде составленной из двух частей пробки (поликарбонат, капролон), между которыми зажата эластичная мембрана (ПДМС, полиэтилентерефталат). Данная пробка может быть выполнена с резьбовым креплением к чипу и снабжена уплотнительным кольцом.
Сверху мембрана 7 демпфера сообщается с атмосферой через сквозное отверстие 14, выполненное в верхней пластине 11 чипа над демпфером и формирующее над мембраной воздушную полость, необходимую для подвижности демпфера. При этом отверстие имеет цилиндрическую форму и выполнено диаметром 5-10 мм, не меньшим диаметра мембраны. Под мембраной 7 расположена демпфирующая камера 5 с подводящим и отводящим каналами, через которые осуществляется циркуляция питательной среды (фиг. 5). Таким образом, снизу мембрана 7 демпфера сообщается с потоком питательной среды и гасит резкие скачки скорости.
В наилучшем варианте выполнения изобретения микроканалы, соединяющие элементы каждого контура, выполнены прямоугольного сечения, с высотой 0,1 мм и шириной 0,4 мм, а мембрана демпфера выполнена диаметром 4 мм. При выполнении мембраны большего диаметра мембрана, благодаря вязко-эластичным свойствам ПДМС и учитывая высоту канала, в 0,1 мм, начинает прогибаться и приклеиваться к предметному стеклу в процессе изготовления чипа. Толщина мембраны демпфера может варьироваться от 0,2 до 0,4 мм. При этом, если толщина мембраны будет меньше указанного диапазона, мембрана будет рваться при изготовлении, а если больше - мембрана перестанет сглаживать поток. Под мембраной 7 расположена демпфирующая камера 5, выполненная в виде цилиндрической полости в слое ПДМС диаметром 4 мм, высотой, равной высоте микроканалов, с нижней стенкой, образованной предметным стеклом. Микроканалы в месте соединения с демпфирующей камерой образуют подводящий и отводящий каналы демпфирующего элемента и выполнены с округлым уширением в проекции на предметное стекло с радиусом кривизны от 0,5 до 1 мм. При этом кривизна боковых стенок подводящего или отводящего канала и кривизна боковых стенок демпфирующей камеры выполнены с различным знаком. Подводящий и отводящий каналы выполнены симметричными относительно центра демпфирующей камеры с высотой, равной высоте демпфирующей камеры, и расположенными на одной оси, проходящей через центр демпфирующей камеры. Нижние стенки подводящего и отводящего каналов образованы предметным стеком и расположены в одной плоскости с нижней стенкой демпфирующей камеры.
В верхней пластине 11 чипа выполнены сквозные резьбовые отверстия, обеспечивающие подключение управляющих пневматических выходов к микронасосу 4 с помощью фитингов 15, а также доступ к клеточной ячейке 3 и герметизацию ее пробкой 16 с уплотнительным кольцом.
Микрофлюидный чип может содержать технологическое отверстие 17 для заполнения контура и вывода из него воздуха и излишков культуральной среды, снабженное заглушкой 18 с уплотнительным кольцом.
В одном из вариантов, клеточная ячейка 3, расположенная в замкнутом контуре, может быть выполнена цилиндрической формы, при этом боковые стенки ячейки образованы слоем ПДМС, а дно ячейки образовано предметным стеклом, герметизирующим микроканалы. Микрофлюидные каналы в местах соединения с клеточной ячейкой образуют уширения, при этом проекции границ каналов в месте уширения на плоскость предметного стекла имеют форму расходящихся кривых с радиусом кривизны, например, 2,1 мм (с целью устранения неоднородностей и обеспечения более равномерного распределения поля скоростей по площади ячейки), а проекция клеточной ячейки представляет собой окружность, например, с диаметром 4,2 мм, при этом продольная ось каналов проходит через центр окружности. Высота ячейки выбрана из условия обеспечения величин касательных напряжений на клеточной модели ткани или органа в пределах физиологических значений и может составлять 2 мм.
Микронасос 4, входящий в конструкцию чипа, является перистальтическим и состоит из двух микроклапанов и рабочей камеры. Такой насос относится к мембранным насосам объемного принципа действия, он обеспечивает циркуляцию питательной среды по замкнутому контуру чипа, подводя к клеткам питательные вещества и отводя продукты метаболизма. Рабочая камера и микроклапаны насоса выполнены в виде уширений микроканала в форме цилиндра, закрытого сверху эластичной мембраной, а каждый клапан снабжен размещенной на мембране перемычкой, выполненной с возможностью перекрытия канала. При этом мембраны рабочей камеры и клапанов выполнены из полидиметилсилоксана толщиной от 0,1 до 0,6 мм и диаметром от 1 до 10 мм, предпочтительно 0,53 мм и 3 мм соответственно. Перемычки могут быть выполнены, например, шириной 0,4 мм и высотой 0,1 мм.
При подаче на клапан воздуха под давлением ниже атмосферного мембрана с перемычкой поднимается и клапан открывается, при подаче воздуха под давлением выше атмосферного клапан герметично закрывается. Микроклапаны и рабочая камера насоса посредством воздушных трубок и фитингов, устанавливаемых в резьбовые отверстия пластины, подключаются к блоку управления микробиореактора БАВР.422522.001, который регулирует подаваемое насосом давление. Переключение повышенного и пониженного давления на клапанах и мембране рабочей камеры микронасоса в определенной последовательности обеспечивает циркуляцию жидкости (питательной среды) по микроканалам в определенном направлении и с определенной скоростью.
Так как насос встроен в конструкцию микрофлюидного чипа и функционирует в замкнутом объеме, необходимым условием его работы является наличие упругих стенок в контуре, которые могут аккумулировать излишки жидкости при закрытии клапанов и возвращать жидкость в контур при открытии клапанов. Поэтому для обеспечения подвижности стенок и работы клапанов насоса чип изготавливают методом «мягкой литографии» (A flexible method for rapid-prototyping of PDMS microfluidic chips using direct-writing for generation of polymer-master-structures L. Gutzweiler, F. Stumpf, L. Riegger, P. Koltay, R. Zengerle and L. Tanguy) посредством литья эластичного материала, например, полидиметилсилоксана в формы. Шаблон для литья может быть изготовлен фотолитографически или механической обработкой. Для формирования закрытых структур поверхность эластичного материала активируют с помощью низкотемпературной плазмы и прижимают к чистой стеклянной поверхности.
Переключение положений клапанов и рабочей камеры микронасоса производится циклически по шеститактному принципу (фиг. 6). Каждый такт соответствует срабатыванию одного из клапанов. При изменении положения клапана микронасоса появляется волна давления, проходящая по контуру чипа, и скачок скорости питательной среды. Таким образом микронасос создает течение пульсирующего характера. А так как канал замкнут и клапаны имеют объем того же порядка, что и рабочая камера, в процессе работы насоса возникают обратные течения, сопровождающиеся таким же скачкообразным изменением давления и расхода питательной среды (фиг. 7, 8).
Заявляемый демпфирующий элемент оказывает значительно меньшее сопротивление изгибу по сравнению со стенками канала. При прохождении волны давления жидкости через демпфер мембрана демпфера отклоняется вверх относительно положения равновесия и принимает в себя излишки жидкости. Когда давление в контуре опускается, излишки жидкости из демпфера возвращаются в канал благодаря упругости мембраны. Таким образом, скачок давления и пульсация скорости потока питательной среды понижаются по амплитуде и сглаживаются по времени. При этом существенную роль играет форма подводящего и отводящего каналов: криволинейная форма их расширяющихся стенок позволяет избежать возникновение завихрений и турбулентности, уменьшающих эффективность циркуляции питательной среды в контуре.
Диаметр демпфера должен быть больше диаметра клапана в 1-1.5 раза, а отношение проходного сечения демпфера к микроканалу не более 12, что обусловлено необходимостью соразмерности объемов клапанов и демпфера для оптимального гашения пульсаций давления и скорости движения среды в микрофлюидном контуре.
В процессе культивирования в клеточной ячейке чипа, например, клеточной модели печени человека (КМПЧ) в виде сфероидов HepaRG, на сфероид действует целый ряд факторов, обусловленных взаимодействием с потоком жидкости. В допустимом приближении сфероид является пористым телом. Для него скорость фильтрации среды определена соотношением
где k - коэффициент проницаемости пористой среды,
μ - вязкость жидкости,
Δp - перепад давлений на сфероиде,
d - диаметр сфероида.
В данном случае скорость фильтрации приблизительно равна 4.5 мкм/с, тогда как физиологическое значение около 2 мкм/с.
Относительное сжатие сфероида может быть определено с использованием закона Гука [Wells RG. Tissue mechanics and fibrosis. Biochim Biophys Acta 2013 Jul; 1832(7): 884-90]
Резкие скачки потока могут провоцировать относительное сжатие до 0.4%. При этом для "мягких тканей", таких как головной мозг и печень, предел линейного вязко-эластического напряжения составляет порядка 0.1-0.2% [Kerdok ЕА. Characterizing the Nonlinear Mechanical Response of Liver to Surgical Manipulation. PhD Thesis, Harvard University, 2006].
Из формул (1) и (2) следует, что пагубное влияние потока на клетки можно понизить, сгладив скачки давления жидкости за микронасосом. Способность упругих стенок сглаживать пульсации определяется емкостью канала. Емкость прямоугольного канала может быть определена по формуле: , где α1=0.121 и α2=0.48 - коэффициенты для ПДМС [Brian S Hardy, Kawika Uechi, Janet Zhen, and H Pirouz Kavehpour. The deformation of flexible PDMS microchannels under a pressure driven flow. Lab Chip, 9(7): 935-938, 2009]. Для канала МФУ эта величина составляет 8⋅10-6. Для тонкостенной мембраны диаметром 4 мм и толщиной 0.2 мм гидравлическая емкость может быть вычислена с использованием формулы [J.N. Reddy. Theory and Analysis of Elastic Plates and Shells. CRC Press, 2nd edition, 2006]
где ν - коэффициент Пуассона, n - толщина мембраны.
В центре мембраны емкость составит 0.03, что на порядки выше емкости канала.
Для определения количественных параметров сглаживания потока питательной среды демпфирующим элементом было проведено математическое моделирование. Для демпфирующей мембраны были выбраны значения диаметра - 4 мм и толщины - 0.2 мм. При этом ширина микроканала была выбрана 0.4 мм, а высота 0.1 мм. Решалась система уравнений
где ρ - плотность жидкости, p - давление, μ - динамическая вязкость, F - внешняя сила, σ - тензор напряжений, Fν - объемная сила.
Материал предполагался гиперэластичным с коэффициентами: λ=678.6⋅103; μ=30⋅106. На вход в канал подавался скачок давления, описываемый функцией Гаусса, а на выходе нормальные напряжения приравнивались к нулю.
В результате решения системы методами конечных элементов было получено поле скоростей в микроканале и смещение мембраны демпфера (фиг. 9). Для сравнения были построены кривые мгновенного расхода на выходе из рассматриваемого элемента для случая подвижной мембраны и неподвижной (фиг. 10). Из графиков следует, что скачок расхода среды сглажен по времени и уменьшен по амплитуде, при этом общее количество жидкости, прошедшее через рассматриваемые элементы, сохраняется. Таким образом, проведенное численное моделирование доказывает эффективность заявляемого демпфирующего элемента.
Пример конкретного выполнения
Был изготовлен макет микрофлюидного чипа, представляющего собой слой полидиметилсилоксана толщиной 2 мм и размерами 2×75 мм, отлитый на слое поликарбоната марки Makrolon 2099 фирмы Bayer толщиной 10 мм с образованием четырех замкнутых контуров с микрофлюидными элементами (клеточной ячейкой, микронасосом, демпфером и технологическим отверстием), соединенными микрожидкостными каналами, и герметизированных предметным стеклом толщиной 1 мм. Микрофлюидные каналы имели высоту 0,1 мм и ширину 0,4 мм. Клеточные ячейки были выбраны высотой 2 мм и диаметром 4,4 мм. Рабочая камера микронасоса была выполнена высотой 0,1 мм и закрыта сверху мембраной из ПДМС толщиной 0,44 мм и диаметром 3 мм. Клапаны микронасоса, выполненные в виде уширения микроканала, также были закрыты сверху эластичной мембраной из ПДМС толщиной 0,53 мм и диаметром 3 мм с перемычкой шириной 0,4 мм и высотой 0,1 мм. Демпфирующий элемент представлял собой рабочую камеру, выполненную в форме цилиндра высотой 0,1 мм и диаметром 4 мм, закрытую мембраной диаметром 4 мм и толщиной 0,35 мм. Подводящий и отводящий каналы имели округлое расширение с радиусом скругления 0.5 мм. Демпфирующий элемент располагался на расстоянии 5 мм от перистальтического насоса.
В качестве мастер-шаблона при изготовлении чипа использовали алюминиевую пластину, в которой фрезерованием получали выступающие относительно плоскости пластины каналы будущего чипа и контуры демпфера. Сборка чипа осуществлялась заполнением заливочной формы полидиметилсилоксаном с центрифугированием. Предварительно собранные формы для заливки заготовки МФУ помещались на ротор центрифуги. Далее экспериментальным способом были подобранны параметры центрифугирования, а именно температура центрифугирования и количество оборотов вращения ротора центрифуги в минуту. Подбором количества оборотов вращения ротора - 200 об/мин, удалось добиться наиболее качественного и полного заполнения заливочной формы, избежать возникновения пузырей в толще полидиметилсилоксана. Для усиления адгезии слоя ПДМС на поверхности поликарбоната использовали праймер-грунт Primer PR-1200 фирмы Dow Corning.
Для исследования влияния демпфирующего элемента на пульсацию потока среды в микрофлюидном контуре был проведен эксперимент, в котором контур чипа блокировали каплей ПДМС между клеточной ячейкой и технологическим отверстием. В место посадки пробки в клеточную ячейку и в технологическое отверстие устанавливали два датчика давления Honeywell 40РС001B через специальный переходник, позволяющий подавать в полученный проточный канал жидкость и отводить ее из канала. В микроканал подавали воду с известным расходом с помощью шприцевого насоса. Датчиками давления фиксировали перепад давления на контуре чипа (таблица 1). Вычисляли гидравлическое сопротивление микроканала чипа как отношение расхода жидкости через канал к перепаду давления, полученному датчиками. Среднее значение сопротивления, полученное по результатам, составило 3.37⋅10-4 мкл/(Па⋅с).
Далее датчики давления устанавливали в целый замкнутый микроконтур чипа, не блокированный каплей ПДМС. Включали перистальтический насос на режиме работы ±50 кПа, 1 Гц. Из измеренного перепада давления (таблица 2) умножением на коэффициент гидравлического сопротивления получали расход жидкости внутри замкнутого контура чипа. В результате получили скачок расхода жидкости в канале, сглаженный демпфером. В следующем эксперименте отверстие в поликарбонатной плате над демпфером закрывали герметично заглушкой, приводя тем самым демпфер в неподвижное состояние, и производили аналогичные измерения расхода воды в микроканале чипа. В результате провели сравнение мгновенных расходов жидкости, полученных на чипе с демпфером и на чипе без демпфера (фиг. 11).
Величина пагубного воздействия потока среды на клетки пропорциональна перепаду давления. При этом максимальный перепад давления для чипа с демпфером составил 2616 Па, а для чипа без демпфера - 6271 Па. Сдвига мембраны в вертикальной плоскости при давлении 3000 достаточно для аккумуляции некоторого объема жидкости и падения скорости с 0.042 мм/с до 0.013 мм/с в сечении демпфера. Это приводит к уменьшению давления, воздействующего на клетки в ячейке. Также давление нарастает более плавно. Таким образом, установкой в конструкцию чипа заявляемого демпфирующего элемента было достигнуто уменьшение механических воздействий на клетки в 2.4 раза. Следует отметить, что конструкция ближайшего аналога, обусловленная, в частности, формой и размерами мембраны, не предполагает его использование в выбранных диапазонах амплитуд и частот работы микронасоса. Таким образом, использование ближайшего аналога в данных условиях не эффективно и не позволяет достигнуть сравнимых результатов по сглаживанию пульсаций давления и скорости среды.
Таким образом, использование предлагаемого демпфирующего элемента позволило обеспечить уменьшение амплитуды пульсаций давления и скорости питательной среды в замкнутом микрофлюидном контуре при сохранении среднего расхода жидкости. Таким образом удалось реализовать режим движения жидкости по микроканалам микрофлюидного чипа, наиболее приближенный к физиологическим условиям и не допускающий пагубных механических воздействий на культивируемые клетки и клеточные модели.
1. Демпфирующий элемент, интегрированный в замкнутый микрожидкостный контур микрофлюидного чипа, включающий демпфирующую камеру, закрытую сверху мембраной, подводящий и отводящий каналы, связанные с демпфирующей камерой, при этом мембрана выполнена сообщающейся сверху с открытым воздухом; демпфирующая камера в проекции на плоскость мембраны выполнена в форме круга, а подводящий и отводящий каналы выполнены формой, обеспечивающей ламинарное движение среды через демпфирующий элемент, и имеют округлое расширение в месте соединения с демпфирующей камерой в проекции на плоскость мембраны, при этом кривизна стенок демпфирующей камеры и стенок отводящего или подводящего канала в проекции на плоскость мембраны выполнена с различным знаком.
2. Демпфирующий элемент по п. 1, характеризующийся тем, что подводящий и отводящий каналы выполнены прямоугольного сечения.
3. Демпфирующий элемент по п. 2, характеризующийся тем, что подводящий и отводящий каналы в месте соединения с демпфирующей камерой имеют округлое расширение с радиусом кривизны от 0,5 до 1 мм.
4. Демпфирующий элемент по п. 1, характеризующийся тем, что подводящий и отводящий каналы расположены симметрично относительно геометрического центра демпфирующей камеры.
5. Демпфирующий элемент по п. 1, характеризующийся тем, что демпфирующая камера выполнена в форме цилиндра.
6. Демпфирующий элемент по п. 1, характеризующийся тем, что демпфирующая камера, мембрана, подводящий и отводящий каналы выполнены в слое эластомера, например полидиметилсилоксана, толщиной от 1 до 2 мм.
7. Демпфирующий элемент по п. 1, характеризующийся тем, что диаметр демпфирующей камеры в проекции на плоскость мембраны выбран равным от 3 до 4,5 мм.
8. Демпфирующий элемент по п. 1, характеризующийся тем, что мембрана выполнена толщиной от 0,2 до 0,4 мм.
9. Демпфирующий элемент по п. 1, характеризующийся тем, что подводящий, отводящий каналы и демпфирующая камера выполнены высотой от 0,1 до 1 мм.
10. Микрофлюидный чип для культивирования клеток или клеточной модели, включающий замкнутый микрофлюидный контур, соединяющий перистальтический микронасос, по меньшей мере один демпфирующий элемент, выполненный по п. 1, и ячейку для культивирования, при этом демпфирующий элемент расположен между перистальтическим микронасосом и ячейкой для культивирования на расстоянии не менее 5 мм от перистальтического микронасоса.
11. Микрофлюидный чип по п. 10, характеризующийся тем, что количество демпфирующих элементов выбрано равным двум, при этом они расположены на входе и выходе перистальтического микронасоса.