Способ экспресс-диагностики оспы овец и коз
Иллюстрации
Показать всеИзобретение относится к области ветеринарной вирусологии, в частности к способу диагностики оспы овец и коз. Способ экспресс-диагностики вируса оспы коз и овец включает отбор проб патологического материала из очага инфекционного заболевания, экстракцию ДНК бактерий инфекционного заболевания из полученных проб, идентификацию видовой принадлежности возбудителя болезни методом полимеразной цепной реакции с флуоресцентным учетом результатов в режиме реального времени с применением термоциклера типа RotorGene на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией. В качестве патологического материала используют пробы из очага инфекционного заболевания оспы, при этом отбор проб патологического материала осуществляют от всех животных, находящихся в очаге инфекционного заболевания, и проводят экспресс-диагностику полученного патологического материала в течение суток для выявления животных-носителей вируса оспы на начальной стадии инфицирования. Учет результатов полимеразной цепной реакции проводят по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, если наблюдают рост специфического сигнала, то образец считают положительным - вирус оспы овец и коз присутствует, при этом значения контрольных образцов находятся в пределах нормы, если не наблюдают рост специфического сигнала, то образец считают отрицательным - вирус оспы овец и коз отсутствует и значения контрольных образцов также находятся в пределах нормы. Способ позволяет расширить функциональные возможности способа диагностики оспы овец и коз. 3 табл., 1 ил.
Реферат
Изобретение относится к области ветеринарной вирусологии, в частности к способу диагностики вируса оспы коз и овец.
Известен способ обнаружения специфических антител к вирусам оспы овец и коз методом ингибирования твердофазного иммуноферментного анализа, предусматривающий взаимодействие исследуемой сыворотки крови с антигеном вируса оспы овец и последующую детекцию иммобилизированного на твердой фазе комплекса антитело - специфический антиген поликлональным пероксидазным конъюгатом, где на первом этапе реакции происходит взаимодействие исследуемой сыворотки с культуральным антигеном вируса оспы овец, на втором этапе не вступивший в реакцию антиген взаимодействует с иммобилизированными на твердой фазе моноклональными антителами клона 08.3, обладающими специфичностью к антигенной детерминанте полипептида молекулярной массы 36-40 кД вируса оспы овец штамма "НИСХИ", а образовавшийся комплекс моноклональное антитело - антиген выявляют специфическим пероксидазным конъюгатом поликлональных антител, выделенных из гипериммунной сыворотки животных-реконвалесцентов (патент РФ №2202112, кл. А61К 39/275, G12Q 1/68).
Известен метод диагностики оспы коз и овец (Орлова Е.С. Совершенствование методов диагностики оспы овец и оспы коз: автореф. дис. канд. биол. наук / Е.С. Орлова. - Владимир, 2007 г. - 25 с.), включающий проведение ПЦР в реакционной смеси следующего состава: 2,5 мкл 10× буфера для Taq-полимеразы, 3 мМ Mg2+ 0,2 мМ dNTPs, 1,0 ед. Taq-полимеразы, по 10 пмоль праймеров, 3 мкл раствора вирусной ДНК и вода до конечного объема 25 мкл на ДНК-амплификаторе РТС-100 (MJ Research, США) при следующем температурном режиме: 2 мин предварительной денатурации при 94°C, 35 циклов амплификации (30 с денатурации при 94°C, 30 с отжига праймеров при 55°C, 30 с элонгации при 72°C) и 2 мин заключительной элонгации, с возможным (при необходимости) проведением второго этапа амплификации с внутренними праймерами в смеси аналогичного состава в течение 20-25 циклов, далее продукты реакции анализировали с помощью электорофореза в 2,0% агарозном геле, содержащем 0,001% бромистого этидия, при силе тока 50 мА.
Недостаток данного способа - он дает только качественный результат.
Известно техническое решение (Касьян Ж.А. и др. «Разработка тест-системы для дифференциации видов бруцелл методом ПЦР с учетом результатов в режиме реального времени. Проблемы особо опасных инфекций. 2016, вып. 3, с. 47-51. http://journal.microbe.ru/jour - прототип) отбор проб патологического материала из очага инфекционного заболевания, экстракцию ДНК бактерий инфекционного заболевания из полученных проб, идентификацию видовой принадлежности возбудителя болезни методом полимеразной цепной реакции с флуоресцентным учетом результатов в режиме реального времени с применением термоциклера типа RotorGene на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией.
Недостатком данного метода является ограниченная применимость только к возбудителю бруцеллеза и отсутствие возможности диагностирования раннего развития заболевания с целью предотвращения массового распространения заболевания и перехода его в тяжелую запущенную форму.
Техническим результатом является расширение функциональных возможностей способа, предотвращение массового распространения заболевания и перехода его в тяжелую запущенную форму.
Технический результат достигается тем, что в способе экспресс-диагностики вируса оспы коз и овец, включающем отбор проб патологического материала из очага инфекционного заболевания, экстракцию ДНК бактерий инфекционного заболевания из полученных проб, идентификацию видовой принадлежности возбудителя болезни методом полимеразной цепной реакции с флуоресцентным учетом результатов в режиме реального времени с применением термоциклера типа RotorGene на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией, согласно изобретению в качестве патологического материала используют пробы из очага инфекционного заболевания оспы, при этом отбор проб патологического материала осуществляют от всех животных, находящихся в очаге инфекционного заболевания, и проводят экспресс-диагностику полученного патологического материала в течение суток для выявления животных-носителей вируса оспы на начальной стадии инфицирования, при этом учет результатов полимеразной цепной реакции проводят по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, если наблюдают рост специфического сигнала, то образец считают положительным - вирус оспы овец и коз присутствует, при этом значения контрольных образцов находятся в пределах нормы, если не наблюдают рост специфического сигнала, то образец считают отрицательным - вирус оспы овец и коз отсутствует и значения контрольных образцов также находятся в пределах нормы.
Новизна заявляемого способа экспресс-диагностики вируса оспы коз и овец состоит в идентификации вируса оспы в пробах патологического материала с помощью полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени, что в свою очередь позволяет выявить животных-носителей вируса оспы на начальной стадии инфицирования животных.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ экспресс-диагностики вируса оспы коз и овец рекомендовано использовать в специализированных ветеринарных, санитарно-эпидемиологических, животноводческих, сельскохозяйственных предприятиях, что соответствует критерию «промышленная применимость».
Способ экспресс-диагностики вируса оспы коз и овец осуществляют следующим образом.
В стаде овец или коз осуществляют отбор проб патологического материала от каждого животного из очага инфекционного заболевания оспы.
При отборе проб и их подготовке для исследования соблюдают меры, предупреждающие обсеменение объектов внешней среды. Материал от каждого животного отбирают отдельными инструментами.
Для исследования используют содержимое везикул, пустул, после предварительной очистки их поверхности спиртом; папулы, соскобленные скальпелем, и оспенные корки, собранные пинцетом; фрагменты измененных органов (лимфатические узлы, селезенка, легкие); для получения сыворотки собирают кровь в пробирку без антикоагулянта.
Взятие клинического материала производят в пробирку с транспортной средой.
Перед проведением анализа исследуемый материал подготавливают:
- исследуемые пробы тканей, органов гомогенизируют с использованием стерильных фарфоровых ступок и пестиков, затем готовят 10% суспензию на стерильном физиологическом растворе. Суспензию переносят а пробирку объемом 1,5 мл и отстаивают в течение 5-7 минут. Аликвоту надосадочной жидкости используют для экстракции ДНК;
- для получения сыворотки пробирки с кровью отстаивают при комнатной температуре в течение 30 мин до полного образования сгустка. Затем центрифугируют при 800-1000 g в течение 10 минут при комнатной температуре. Сыворотку переносят одноразовыми наконечниками с фильтром в одноразовые пробирки объемом 1,5 мл.
После подготовки исследуемого материала приступают к проведению анализа, состоящего из 3 этапов:
- экстракция ДНК;
- проведение полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени;
- учет результатов анализа.
ПЦР с флуоресцентной детекцией в режиме реального времени имеет ряд значительных преимуществ:
- объединение этапов амплификации и детекции результатов. Появляется возможность оценить кинетику процесса, которая зависит от начального количества исследуемого материала;
- существенное снижение риска контаминации и ошибок при анализе результатов;
- высокая специфичность реакции за счет использования высокоспецифичных флуоресцентных зондов;
- высокая производительность;
- упрощение требований к организации ПЦР-лаборатории;
- возможность количественной оценки исходной ДНК матрицы;
- регистрация и учет данных в электронном формате.
ПЦР в реальном времени характеризуется возможностью проведения качественного и количественного анализа. Регистрируемое в процессе амплификации нарастание сигнала от отделенного флуорофора прямо пропорционально увеличению концентрации синтезированных специфических продуктов и отражает концентрацию ДНК в исходной матрице.
Экстракция ДНК.
Перед выделением ДНК осуществляют подготовку исследуемых проб с помощью набора реагентов «ПЦР-ОСПА-ФАКТОР», состоящего из 2 комплектов (таблица 1 и 2).
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию 10 мкл ПЦР СМЕСЬ РОХ, 5 мкл смеси ПЦР БУФЕР РОХ, 0,5 мкл TAQ POLYMERASE. Перемешивают смесь на вортексе и сбрасываю капли кратковременным центрифугированием. Затем отбирают необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб, вносят по 15 мкл приготовленной реакционной смеси. Используя наконечники с фильтром в подготовленные пробирки добавляют:
1) отрицательный контроль ПЦР (К-) - вносят в пробирку по 10 мкл ОКО;
2) по 10 мкл ДНК из исследуемых образцов в соответствующие пробирки;
3) положительный контроль ПЦР (К+) - вносят в пробирку 10 мкл ПКО.
При этом не наносят маркировку на крышку пробирок, т.к. это затрудняет процесс считывания амплификатором.
Проведение полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени.
Устанавливают пробирки в реакционный модуль прибора «Rotor-Gene 3000/6000» (Q), в котором осуществляют полимеразную цепную реакцию с флуоресцентным детектором в режиме реального времени. В соответствии с протоколом анализа прибор программируют, устанавливают параметры температурно-временного режима амплификации, детекцию флуоресцентного сигнала назначают после стации отжига праймеров, после чего начинают процесс амплификации с флуоресцентной детекцией в режиме реального времени. В его основе лежит принцип флуоресцентной детекции продуктов полимеразной цепной реакции непосредственно в ходе амплификации. Детекция продуктов амплификации проводится прямо в реакционной среде через стенки или крышку закрытой пробирки.
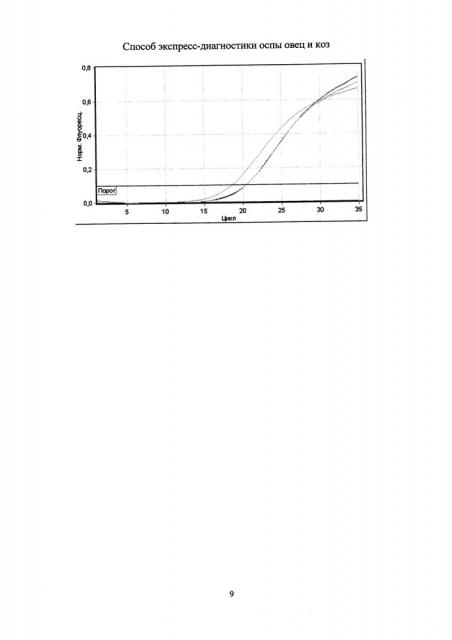
Учет результатов полимеразной цепной реакции проводят по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (см. чертеж). Образец считают положительным (вирус оспы овец и коз присутствует), если наблюдают рост специфического сигнала, при этом значения контрольных образцов находятся в пределах нормы (таблица 3). Образец считают отрицательным (вирус оспы овец и коз отсутствует), если не наблюдают рост специфического сигнала, при этом значения контрольных образцов находятся в пределах нормы.
Способ экспресс-диагностики вируса оспы коз и овец, включающий отбор проб патологического материала из очага инфекционного заболевания, экстракцию ДНК бактерий инфекционного заболевания из полученных проб, идентификацию видовой принадлежности возбудителя болезни методом полимеразной цепной реакции с флуоресцентным учетом результатов в режиме реального времени с применением термоциклера типа RotorGene на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией, отличающийся тем, что в качестве патологического материала используют пробы из очага инфекционного заболевания оспы, при этом отбор проб патологического материала осуществляют от всех животных, находящихся в очаге инфекционного заболевания, и проводят экспресс-диагностику полученного патологического материала в течение суток для выявления животных-носителей вируса оспы на начальной стадии инфицирования, при этом учет результатов полимеразной цепной реакции проводят по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, если наблюдают рост специфического сигнала, то образец считают положительным - вирус оспы овец и коз присутствует, при этом значения контрольных образцов находятся в пределах нормы, если не наблюдают рост специфического сигнала, то образец считают отрицательным - вирус оспы овец и коз отсутствует и значения контрольных образцов также находятся в пределах нормы.