Модифицированные нуклеозиды, нуклеотиды и нуклеиновые кислоты и их применение
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описана группа изобретений, включающая фармацевтическую композицию для экспрессии полипептида в клетке млекопитающего и применение композиции для получения лекарственного средства для повышения уровня интересующего полипептида у млекопитающего. Указанный полинуклеотид содержит: (a) открытую рамку считывания, кодирующую указанный полипептид, состоящий из нуклеозидов, включая 1-метилпсевдоуридин, цитидин или 5-метилцитидин, аденозин и гуанозин, (b) 5'-UTR, (c) 3'-UTR, и (d) структуру 5'-кэпа. Изобретение расширяет арсенал средств для экспрессии полинуклеотидов. 2 н. и 4 з.п. ф-лы, 10 ил., 50 табл., 90 пр.
Реферат
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка подана вместе со списком последовательностей в электронном формате. Файл списка последовательностей под названием M009SQLST.txt был создан 3 октября 2012 года и имеет размер 9859 байт. Информация списка последовательностей в электронном формате включена в настоящее описание в качестве ссылки в полном объеме.
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет временной патентной заявки США №61/542533, поданной 3 октября 2011 года, под названием ''Modified Nucleosides, Nucleotides and Nucleic Acids, and Uses Thereof'', содержание которой включено в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям и способам, в которых используются модифицированные нуклеиновые кислоты для модулирования функции клеток. Модифицированные нуклеиновые кислоты по изобретению могут кодировать пептиды, полипептиды или множество белков. Кодируемые молекулы можно использовать в качестве терапевтических средств и/или диагностических средств.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Встречающиеся в природе РНК синтезируются из четырех основных рибонуклеотидов: ATP, CTP, UTP и GTP, однако они могут содержать посттранскрипционно модифицированные нуклеотиды. Кроме того, в РНК идентифицировано приблизительно сто различных модификаций нуклеозидов (Rozenski, J, Crain, P, and McCloskey, J. (1999). The RNA Modification Database: 1999 update. Nucl Acids Res 27: 196-197). Однако роль модификаций нуклеозидов в иммуностимулирующем потенциале и в эффективности трансляции РНК неизвестна.
Предшествующие методологии обеспечения экспрессии белков имеют множество проблем. Например, гетерологичная ДНК, введенная в клетку, может наследоваться дочерними клетками (независимо от того, встроилась ли гетерологичная ДНК в хромосому) или потомками. Введенная ДНК может встраиваться в геномную ДНК клетки-хозяина с некоторой частотой, что приводит к изменениям и/или повреждению геномной ДНК клетки-хозяина. Кроме того, до получения белка необходимо осуществить множество стадий. После проникновения в клетку ДНК должна транспортироваться в ядро, где она транскрибируется в РНК. Затем РНК, транскрибированная с ДНК, должна проникнуть в цитоплазму, где она транслируется в белок. Эта необходимость множества стадий процессинга обеспечивает латентный период перед тем, как будет получен представляющий интерес белок. Кроме того, трудно достигнуть экспрессии ДНК в клетках; часто ДНК проникает в клетки, но не экспрессируется или экспрессируется на недостаточных уровнях или в недостаточных концентрациях. Особенно это может быть проблемой, когда ДНК вводят в клетки, такие как первичные клетки или модифицированные клеточные линии.
В данной области существует потребность в биологических средствах для осуществления модулирования внутриклеточной трансляции нуклеиновых кислот.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем описании представлены, среди прочих, модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, которые могут демонстрировать сниженный врожденный иммунный ответ при введении в популяцию клеток, как in vivo, так и ex vivo.
Настоящее изобретение относится к полинуклеотидам, которые могут быть выделенными или очищенными. Эти полинуклеотиды могут кодировать один или несколько представляющих интерес полипептидов и содержат последовательность ряда связанных нуклеозидов или нуклеотидов, содержащих по меньшей мере один модифицированный нуклеозид или нуклеотид по сравнению с химической структурой нуклеозида или нуклеотида A, G, U или C. Полинуклеотиды также могут содержать 5'-UTR, содержащую по меньшей мере одну последовательность Козака, 3'-UTR и по меньшей мере одну структуру 5'-кэпа. Кроме того, выделенные полинуклеотиды могут содержать концевую часть поли-A и могут быть очищенными.
Выделенные полинуклеотиды по изобретению также содержат по меньшей мере одну структуру 5'-кэпа, выбранную из группы, состоящей из кэпа 0, кэпа 1, ARCA, инозина, N1-метилгуанозина, 2'фторгуанозина, 7-деазагуанозина, 8-оксогуанозина, 2-аминогуанозина, LNA-гуанозина и 2-азидогуанозина.
Модификации полинуклеотидов по изобретению могут быть осуществлены на нуклеозидном основании и/или сахарной части нуклеозидов, которые содержатся в полинуклеотиде.
В некоторых вариантах осуществления модификацию осуществляют на основании нуклеиновой кислоты и она выбрана из группы, состоящей из псевдоуридина или N1-метилпсевдоуридина.
В некоторых вариантах осуществления модифицированный нуклеозид не является псевдоуридином (ψ) или 5-метилцитидином (m5C).
В некоторых вариантах осуществления множество модификаций включены в модифицированную нуклеиновую кислоту или в один или несколько индивидуальных нуклеозидов или нуклеотидов. Например, модификации нуклеозида могут включать одну или несколько модификаций оснований нуклеиновой кислоты и сахара.
В некоторых вариантах осуществления предусматриваются новые структурные элементы, например нуклеозиды и нуклеотиды, для получения модифицированных полинуклеотидов и способ их синтеза и производства.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим модифицированные полинуклеотиды, описанные в настоящем описании. Также они могут дополнительно включать один или несколько фармацевтически приемлемых эксципиентов, выбранных из растворителя, водного растворителя, неводного растворителя, диспергирующей среды, разбавителя, дисперсии, суспендирующей добавки, поверхностно-активного вещества, изотонического агента, загустителя или эмульгатора, консерванта, липида, липидоидов, липосомы, липидной наночастицы, наночастиц типа сердцевина-оболочка, полимера, липоплексного пептида, белка, клетки, гиалуронидазы и их смесей.
Также предусматриваются способы, в которых используются полинуклеотиды и модифицированные нуклеиновые кислоты по изобретению. В этом случае полинуклеотиды можно составлять любыми способами, известными в данной области, или можно вводить любым из нескольких путей, включающих инъекцию внутрикожным, подкожным или внутримышечным способом.
Введение модифицированных нуклеиновых кислот по изобретению может быть осуществлено посредством двух или более равных или неравных разделенных доз. В некоторых вариантах осуществления уровень полипептида, продуцируемого у индивидуума при введении разделенных доз полинуклеотида, превышает уровни, продуцируемые путем введения той же общей суточной дозы полинуклеотида в качестве однократного введения.
Обнаружение модифицированных нуклеиновых кислот или кодируемых полипептидов можно проводить в жидкости организма индивидуума или пациента, где жидкость организма выбрана из группы, состоящей из периферической крови, сыворотки, плазмы, асцитной жидкости, мочи, цереброспинальной жидкости (CSF), мокроты, слюны, костного мозга, синовиальной жидкости, внутриглазной жидкости, амниотической жидкости, ушной серы, грудного молока, жидкости бронхоальвеолярного лаважа, семенной жидкости, жидкости предстательной железы, куперовой жидкости или предэякулята, пота, фекальных масс, волос, слез, жидкости кисты, плевральной и перитонеальной жидкости, перикардиальной жидкости, лимфы, химуса, хилуса, желчи, интерстициальной жидкости, менструальных жидкостей, гноя, кожного сала, рвотной массы, вагинальных секретов, секретов слизистых оболочек, жидкости стула, сока поджелудочной железы, жидкостей лаважа из полостей пазух, бронхолегочной аспирированной жидкости, жидкости полости бластоцеля и пуповинной крови.
В некоторых вариантах осуществления введение проводят в соответствии с режимом дозирования, который выполняют в течение периода нескольких часов, суток, недель, месяцев или лет, и оно может быть осуществлено с использованием одного или нескольких устройств, выбранных из многоигольных инъекционных систем, катетера или люминальных систем, и ультразвуковых, электрических или излучающих систем.
Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение. В настоящем описании описаны способы и материалы для применения в рамках настоящего изобретения; также можно использовать другие пригодные способы и материалы, известные в данной области. Материалы, способы и примеры являются только иллюстративными и не являются ограничивающими. Все публикации, патентные заявки, патенты, последовательности, регистрационные записи баз данных и другие ссылки, упомянутые в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме. В случае противоречий настоящее описание, включая определения, будет решающим.
Другие признаки и преимущества настоящего изобретения будут очевидны из представленного ниже подробного описания и фигур, и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Представленные выше и другие задачи, признаки и преимущества будут очевидны из представленного ниже описания конкретных вариантов осуществления изобретения, как проиллюстрировано на прилагаемых чертежах, в которых на различных изображениях условные обозначения относятся к одинаковым частям. Чертежи не обязательно представлены в масштабе, вместо этого внимание обращено на иллюстрацию принципов различных вариантов осуществления изобретения.
На фиг. 1 представлен спектр и графики аналитических результатов для N4-Me-CTP (NTP соединения 1). На фиг. 1A представлен спектр ядерного магнитного резонанса (ЯМР) в DMSO и на фиг. 1B представлен спектр ЯМР в D2O, на фиг. 1C представлены результаты масс-спектрометрии (MS), и на фиг. 1D представлены результаты высокоэффективной жидкостной хроматографии (ВЭЖХ) для N4-метилцитидина (N4-Me-цитидин, соединение 1).
На фиг. 2 представлены результаты ВЭЖХ для N4-Me-CTP (NTP соединения 1).
На фиг. 3 представлены аналитические результаты для 2'-OMe-N, N-ди-Me-CTP (NTP соединения 2). На фиг. 3A представлен спектр ЯМР. На фиг. 3B представлены результаты MS. На фиг. 3C представлены результаты ВЭЖХ для 2'-O-метил-N4,N4-диметилцитидина (2'-OMe-N,N-ди-Me-цитидин, соединение 2).
На фиг. 4 представлены результаты ВЭЖХ для 2'-OMe-N, N-ди-Me-CTP (NTP соединения 2).
На фиг. 5 представлены результаты ВЭЖХ для 5-метоксикарбонилметокси-UTP (NTP соединения 3).
На фиг. 6 представлены аналитические результаты для 3-метилпсевдоуридина (соединение 4). На фиг. 6A представлен спектр ЯМР для 3-метилпсевдоуридина (соединение 4) и на фиг. 6B представлены результаты ВЭЖХ для 3-метилпсевдоуридина (соединение 4).
На фиг. 7 представлены аналитические результаты для 5-TBDMS-OCH2-цитидина (соединение 6). На фиг. 7A представлен спектр ЯМР, на фиг. 7B представлены результаты MS, и на фиг. 7C представлены результаты ВЭЖХ для 5-TBDMS-OCH2-цитидина (соединение 6).
На фиг. 8 представлены аналитические результаты для 5-трифторметилуридина (соединение 8). На фиг. 8A представлен спектр ЯМР, на фиг. 8B представлены результаты MS, и на фиг. 8C представлены результаты ВЭЖХ для 5-трифторметилуридина (соединение 8).
На фиг. 9 представлены результаты спектра ЯМР для 5-(метоксикарбонил)метилуридина (соединение 9).
На фиг. 10 представлен график, на котором показана вариабельность экспрессии белков (GCSF; дорожка B) и цитокинов (интерферон-альфа (IFNa); дорожка A, и фактор некроза опухоли-альфа (TNFa); дорожка C) в зависимости от процентной модификации.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится, среди прочего, к модифицированным нуклеозидам, модифицированным нуклеотидам и модифицированным нуклеиновым кислотам, которые проявляют улучшенные терапевтические свойства, включая, но не ограничиваясь ими, сниженный врожденный иммунный ответ при введении в популяцию клеток.
Поскольку в данной области остается потребность в терапевтических средствах, направленных на множество препятствий эффективному модулированию внутриклеточной трансляции и процессинга нуклеиновых кислот, кодирующих полипептиды или их фрагменты, авторы изобретения показали, что определенные модифицированные последовательности мРНК обладают потенциалом в качестве терапевтических средств с преимуществами, выходящими за пределы только ускользания от, избегания или уменьшения иммунного ответа.
Настоящее изобретение удовлетворяет эту потребность путем предоставления соединений на основе нуклеиновой кислоты или полинуклеотидов, которые кодируют представляющий интерес полипептид (например, модифицированную мРНК) и которые обладают структурными и/или химическими признаками, которые устраняют одну или несколько проблем уровня техники, например, признаками, которые пригодны для оптимизации терапевтических средств на основе нуклеиновых кислот при одновременном сохранении структурной и функциональной целостности, преодолении порога экспрессии, повышении уровней экспрессии, времени полужизни и/или концентраций белка, оптимизации локализации белка и избегании вредоносных биологических ответов, таких как иммунный ответ и/или пути деградации.
В рамках настоящего изобретения предусматриваются, частично, полинуклеотиды, кодирующие представляющие интерес полипептиды, которые химически модифицированы для повышения одного или нескольких из стабильности и/или клиренса в тканях, рецепторного захвата и/или кинетики, доступа композиций к клеткам, вовлечения аппарата транскрипции, времени полужизни мРНК, эффективности трансляции, ускользания от иммунной системы, способности к продуцированию белка, эффективности секреции (когда это применимо), доступности для кровообращения, времени полужизни белка и/или модулирования статуса, функции и/или активности клеток.
Модифицированные нуклеозиды, нуклеотиды и нуклеиновые кислоты по изобретению, включающие комбинацию модификаций, описанных в настоящем описании, имеют улучшенные свойства, что делает их более пригодными в качестве терапевтических средств.
Было определено, что модель уровня техники ''все или ничего'' является совершенно недостаточной для описания биологических явлений, ассоциированных с терапевтической применимостью модифицированной мРНК. Авторы настоящего изобретения определили, что для повышения продукции белка можно учитывать природу модификации или комбинации модификаций, процентную модификацию и исследовать более одного цитокина или показателя для определения эффективности и профиля риска конкретной модифицированной мРНК.
В одном аспекте изобретения способы определения эффективности модифицированной по сравнению с немодифицированной мРНК вовлекают измерение и анализ одного или нескольких цитокинов, экспрессия которых запускается путем введения экзогенной нуклеиновой кислоты по изобретению. Эти величины сравнивают с введением немодифицированной нуклеиновой кислоты или со стандартным показателем, таким как ответ цитокинов, поли-IC, R-848, или другим стандартом, известным в данной области.
Одним примером стандартного показателя, разработанного в рамках настоящего изобретения, является показатель соотношения уровня или количества кодируемого полипептида (белка), продуцируемого в клетке, ткани или организме, и уровня или количества одного или нескольких (или панели) цитокинов, экспрессия которых запускается в клетке, ткани или организме в результате введения или контакта с модифицированной нуклеиновой кислотой. Такие соотношения обозначают в настоящем описании как соотношение белок:цитокин или соотношение ''PC''. Чем более высоким является соотношение PC, тем более эффективной является модифицированная нуклеиновая кислота (полинуклеотид, кодирующий измеренный белок). Предпочтительные соотношения PC, на цитокин, по настоящему изобретению могут составлять более 1, более 10, более 100, более 1000, более 10000 или более. Модифицированные нуклеиновые кислоты, имеющие более высокие соотношения PC, чем модифицированная нуклеиновая кислота с отличающейся или немодифицированной конструкцией, являются предпочтительными.
Далее, соотношение PC можно определять по процентной модификации полинуклеотида. Например, можно определять нормализованную к 100% модифицированной нуклеиновой кислоте продукцию белка в качестве функции уровня цитокина (или риска) или профиля цитокинов.
В одном варианте осуществления настоящее изобретение относится к способу определения, посредством химических соединений, цитокинов или процентной модификации, относительной эффективности любого конкретного модифицированного полинуклеотида путем сравнения соотношения PC для модифицированной нуклеиновой кислоты (полинуклеотида).
В другом варианте осуществления химически модифицированная мРНК является по существу нетоксичной и немутагенной.
В одном варианте осуществления модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты могут быть химически модифицированными на поверхности большой бороздки, тем самым нарушая взаимодействия с основными партнерами по связыванию большой бороздки, которые могут вызвать врожденные иммунные ответы. Кроме того, эти модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты можно использовать для доставки груза, например, поддающегося обнаружению или терапевтического средства, к биологической мишени. Например, нуклеиновые кислоты можно ковалентно связывать с грузом, например, поддающимся обнаружению или терапевтическим средством, через линкер, присоединенный к нуклеиновому основанию или сахарной части. Композиции и способы, описанные в настоящем описании, можно использовать, in vivo и in vitro, как внеклеточно, так и внутриклеточно, а также в анализах, таких как бесклеточные анализы.
В некоторых вариантах осуществления настоящее изобретение относится к соединениям, содержащим нуклеотид, который нарушает связывание взаимодействующего, например, связывающегося, с большой бороздкой партнера с нуклеиновой кислотой, где нуклеотид обладает сниженной аффинностью связывания с взаимодействующими с большой бороздкой партнерами.
В другом аспекте настоящее изобретение относится к нуклеотидам, которые содержат химические модификации, где нуклеотид обладает измененным связыванием с взаимодействующими с большой бороздкой партнерами.
В некоторых вариантах осуществления химические модификации расположены на обращенной к большой бороздке поверхности основания нуклеиновой кислоты, и где химические модификации могут включать замену или замещение атома пиримидина нуклеинового основания амином, SH, алкилом (например, метилом или этилом) или галогеном (например, хлором или фтором).
В другом аспекте настоящее изобретение относится к химическим модификациям, расположенным на сахарной части нуклеотида.
В другом аспекте настоящее изобретение относится к химическим модификациям, расположенным на фосфатном остове нуклеиновой кислоты.
В некоторых вариантах осуществления химические модификации изменяют электрохимию поверхности большой бороздки нуклеиновой кислоты.
В другом аспекте настоящее изобретение относится к нуклеотидам, которые содержат химические модификации, где нуклеотид снижает врожденный клеточный иммунный ответ по сравнению с врожденным клеточным иммунным ответом, индуцируемым соответствующей немодифицированной нуклеиновой кислотой.
В другом аспекте настоящее изобретение относится к последовательностям нуклеиновой кислоты, содержащим по меньшей мере два нуклеотида, причем последовательность нуклеиновой кислоты содержит нуклеотид, который нарушает связывание взаимодействующего с большой бороздкой партнера с последовательностью нуклеиновой кислоты, где нуклеотид обладает сниженной аффинностью связывания со связывающимся с большой бороздкой партнером.
В другом аспекте настоящее изобретение относится к композициям, содержащим соединение, как описано в настоящем описании. В некоторых вариантах осуществления композиция представляет собой реакционную смесь. В некоторых вариантах осуществления композиция представляет собой фармацевтическую композицию. В некоторых вариантах осуществления композиция представляет собой клеточную культуру. В некоторых вариантах осуществления композиция дополнительно содержит РНК-полимеразу и кДНК-матрицу. В некоторых вариантах осуществления композиция дополнительно содержит нуклеотид, выбранный из группы, состоящей из аденозина, цитозина, гуанозина и урацила.
В следующем аспекте настоящее изобретение относится к способам получения фармацевтического состава, содержащего физиологически активный секретируемый белок, включающим трансфекцию первой популяции клеток человека фармацевтической нуклеиновой кислотой, полученной способами, описанными в настоящем описании, где секретируемый белок является активным в отношении второй популяции клеток человека.
В некоторых вариантах осуществления секретируемый белок способен взаимодействовать с рецептором на поверхности по меньшей мере одной клетки, присутствующей во второй популяции.
В некоторых вариантах осуществления секретируемый белок представляет собой гранулоцитарный колониестимулирующий фактор (G-CSF).
В некоторых вариантах осуществления вторая популяция содержит миелобластные клетки, которые экспрессируют рецептор G-CSF.
В определенных вариантах осуществления в рамках настоящего изобретения предусматриваются комбинированные терапевтические средства, содержащие одну или несколько модифицированных нуклеиновых кислот, содержащих транслируемые области, которые кодируют белок или белки, которые усиливают иммунитет млекопитающего, вместе с белком, который индуцирует антителозависимую клеточную токсичность. Например, в рамках настоящего изобретения предусматриваются терапевтические средства, содержащие одну или несколько нуклеиновых кислот, которые кодируют трастузумаб и гранулоцитарный колониестимулирующий фактор (G-CSF). В частности, такие комбинированные лекарственные средства пригодны у пациентов с раком молочной железы Her2+, у которых развилась индуцированная устойчивость к трастузумабу (см., например, Albrecht, Immunotherapy. 2(6):795-8 (2010)).
В одном варианте осуществления подразумевается, что соединения по настоящему изобретению являются стабильными. Кроме того, понятно, что определенные признаки настоящего изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, также могут быть предоставлены в комбинации в одном варианте осуществления. Напротив, различные признаки настоящего изобретения, которые, для краткости, описаны в контексте одного варианта осуществления, также могут быть предоставлены по отдельности или в любой подходящей подкомбинации.
Модифицированные нуклеотиды, нуклеозиды и полинуклеотиды по изобретению
В настоящем описании в нуклеотиде, нуклеозиде или полинуклеотиде (таком как нуклеиновые кислоты по изобретению, например, молекула мРНК) термины ''модификация'' или, в соответствующих случаях, ''модифицированный'' относятся к модификации в отношении рибонуклеотидов A, G, U или C. Главным образом, в настоящем описании не подразумевают, что эти термины относятся к модификациям рибонуклеотидов во встречающихся в природе 5'-концевых частях кэпа мРНК. В полипептиде термин ''модификация'' относится к модификации части по сравнению с каноническим набором из 20 аминокислот.
Модификации могут представлять собой различные отличающиеся модификации. В некоторых вариантах осуществления, где нуклеиновая кислота представляет собой мРНК, кодирующая область, фланкирующие области и/или концевые области могут содержать одну, две или более (необязательно отличающихся) нуклеозидных или нуклеотидных модификаций. В некоторых вариантах осуществления модифицированный полинуклеотид, введенный в клетку, может проявлять сниженную деградацию в клетке по сравнению с немодифицированным полинуклеотидом.
Полинуклеотиды могут включать любую полезную модификацию, такую как модификация сахара, основания нуклеиновой кислоты или межнуклеозидной связи (например, связывающего фосфата/фосфодиэфирной связи/фосфодиэфирного остова). Например, большая бороздка полинуклеотида или обращенная к большой бороздке поверхность основания нуклеиновой кислоты могут содержать одну или несколько модификаций. Один или несколько атомов пиримидинового основания нуклеиновой кислоты (например, на поверхности большой бороздки) могут быть заменены или замещены необязательно замещенным амино, необязательно замещенным тиолом, необязательно замещенным алкилом (например, метилом или этилом) или галогеном (например, хлором или фтором). В определенных вариантах осуществления модификации (например, одна или несколько модификаций) присутствуют в каждом из сахара и межнуклеозидной связи. Модификации в соответствии с настоящим изобретением могут представлять собой модификации рибонуклеиновых кислот (РНК), дезоксирибонуклеиновых кислот (ДНК), например, замена 2'-OH рибофуранизильного кольца на 2'-H, нуклеиновые кислоты с треозой (TNA), нуклеиновые кислоты с гликолем (GNA), пептидные нуклеиновые кислоты (PNA), замкнутые нуклеиновые кислоты (LNA) или их гибриды). Дополнительные модификации описаны в настоящем описании.
Как описано в настоящем описании, полинуклеотиды по изобретению по существу не индуцируют врожденный иммунный ответ в клетке, в которую введен полинуклеотид (например, мРНК). Признаки индуцированного врожденного иммунного ответа включают 1) увеличенную экспрессию провоспалительных цитокинов, 2) активацию внутриклеточных PRR (RIG-I, MDA5 и т.д.), и/или 3) терминацию или снижение трансляции белка.
В определенных вариантах осуществления может быть желательным, чтобы модифицированная молекула нуклеиновой кислоты, введенная в клетку, деградировалась внутриклеточно. Например, деградация модифицированной молекулы нуклеиновой кислоты может быть предпочтительной, если является желательным точный период времени продуцирования белка. Таким образом, в некоторых вариантах осуществления изобретение относится к модифицированной молекуле нуклеиновой кислоты, содержащей домен деградации, который способен действовать направленным образом в клетке. В другом аспекте настоящее изобретение относится к полинуклеотидам, содержащим нуклеозид или нуклеотид, которые могут нарушать связывание взаимодействующего, например, связывающегося, с большой бороздкой партнера с полинуклеотидом (например, где модифицированный нуклеотид обладает сниженной аффинностью связывания с взаимодействующим с большой бороздкой партнером по сравнению с немодифицированным нуклеотидом).
Полинуклеотиды необязательно могут включать другие агенты (например, индуцирующие РНК-i агенты, агенты РНК-i, миРНК (siRNA), кшРНК (shRNA), микроРНК (miRNA), антисмысловые РНК, рибозимы, каталитические ДНК, тРНК, РНК, которые индуцируют образование тройной спирали, аптамеры, векторы и т.д.). В некоторых вариантах осуществления полинуклеотиды могут включать одну или несколько матричных РНК (мРНК), имеющих один или несколько модифицированных нуклеозидов или нуклеотидов (т.е. модифицированные молекулы мРНК). Подробно описание этих полинуклеотидов следуют далее.
Полинуклеотиды
Полинуклеотиды по изобретению включают первую область связанных нуклеозидов, кодирующую представляющий интерес полипептид, первую фланкирующую область, расположенную на 5'-конце первой области, и вторую фланкирующую область, расположенную на 3'-конце первой области.
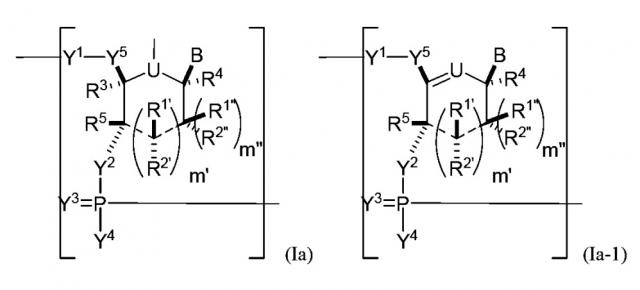
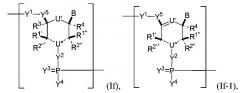
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Ia) или формулу (Ia-1):
,
или формулу их фармацевтически приемлемых солей или их стереоизомеров, где U представляет собой O, S, N(RU)nu или C(RU)nu, где nu представляет собой целое число от 0 до 2, и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил;
представляет собой одинарную связь или отсутствует;
каждый из R1', R2', R1'', R2'', R1, R2, R3, R4 и R5, если присутствует, независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил, или отсутствует; где комбинация R3 с одним или несколькими из R1', R1'', R2', R2'' или R5 (например, комбинация R1' и R3, комбинация R1'' и R3, комбинация R2' и R3, комбинация R2'' и R3 или комбинация R5 и R3), связанных вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен и, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклил (например, бициклический, трициклический или трициклический гетероциклил); где комбинация R5 с одним или несколькими из R1', R1'', R2' или R2'' (например, комбинация R1' и R5, комбинация R1'' и R5, комбинация R2' и R5 или комбинация R2'' и R5), связанных вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен и, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклил (например, бициклический, трициклический или тетрациклический гетероциклил); и где комбинация R4 с одним или несколькими из R1', R1'', R2', R2'', R3 или R5, связанных вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен и, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклил (например, бициклический, трициклический или тетрациклический гетероциклил);
каждый из m' и m'' независимо представляет собой целое число от 0 до 3 (например, от 0 до 2, от 0 до 1, от 1 до 3 или от 1 до 2);
каждый из Y1, Y2 и Y3 независимо представляет собой O, S, Se, -NRN1-, необязательно замещенный алкилен или необязательно замещенный гетероалкилен, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил или отсутствует;
каждый Y4 независимо представляет собой H, гидрокси, тиол, боранил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный тиоалкокси, необязательно замещенный алкоксиалкокси или необязательно замещенный амино;
каждый Y5 независимо представляет собой O, S, Se, необязательно замещенный алкилен (например метилен) или необязательно замещенный гетероалкилен;
n представляет собой целое число от 1 до 100000; и
B представляет собой основание нуклеиновой кислоты (например, пурин, пиримидин или их производные), где комбинация B и R1', комбинация B и R2', комбинация B и R1'' или комбинация B и R2'', взятые вместе с атомами углерода, к которым они присоединены, необязательно могут образовывать бициклическую группу (например, бициклический гетероциклил) или где комбинация B, R1'' и R3 или комбинация B, R2'' и R3 необязательно могут образовывать трициклическую или тетрациклическую группу (например, трициклический или тетрациклический гетероциклил, такой как в формуле (IIo)-(IIp) настоящего описания).
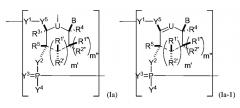
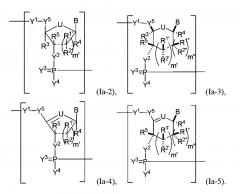
В некоторых вариантах осуществления полинуклеотид включает модифицированную рибозу. В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Ia-2)-(Ia-5) или формулу их фармацевтически приемлемой соли или их стереоизомера.
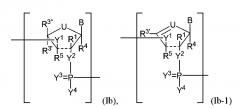
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Ib) или формулу (Ib-1):
,
или формулу их фармацевтически приемлемой соли или их стереоизомера, где
U представляет собой O, S, N(RU)nu или C(RU)nu, где nu представляет собой целое число от 0 до 2 и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил;
представляет собой одинарную связь или отсутствует;
каждый из R1, R3', R3'' и R4 независимо представляет собой H, галоген, гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил или отсутствует; и где комбинация R1 и R3' или комбинация R1 и R3'', взятые вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен (например, образуя замкнутую нуклеиновую кислоту);
каждый R5 независимо представляет собой H, галоген, гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси или отсутствует;
каждый из Y1, Y2 и Y3 независимо представляет собой O, S, Se, NRN1-, необязательно замещенный алкилен или необязательно замещенный гетероалкилен, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил;
каждый Y4 независимо представляет собой H, гидрокси, тиол, боранил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный алкоксиалкокси или необязательно замещенный амино;
n представляет собой целое число от 1 до 100000; и
B представляет собой основание нуклеиновой кислоты.
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Ic):
или формулу их фармацевтически приемлемой соли или их стереоизомера, где
U представляет собой O, S, N(RU)nu или C(RU)nu, где nu представляет собой целое число от 0 до 2 и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил;
представляет собой одинарную связь или отсутствует;
каждый из B1, B2 и B3 независимо представляет собой основание нуклеиновой кислоты (например, пурин, пиримидин или их производные, как описано в настоящем описании), H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязател