Способ получения монозамещенных производных урацила
Иллюстрации
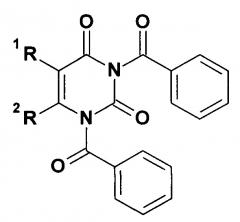
Показать всеИзобретение относится к новому способу получения N1-замещенных производных урацила, которые обладают широким спектром биологической активности, и могут, например, найти применение в качестве противоопухолевого средства. Способ получения N1-монозамещенных производных урацила или хиназолин-2,4-диона заключается в алкилировании 1,3-дибензоилпроизводного урацила или хиназолин-2,4-диона общей формулы
где: R1=Н, СН3, F или Br; R2=Н или СН3; R1+R2=СН=СН-СН=СН, галоидным алкилом или толуолсульфонатом спирта в среде полярного апротонного растворителя в безводной среде в присутствии основания, с последующим добавлением к полученному продукту алкилирования концентрированного водного раствора основания. Способ позволяет достичь высокой региоселективности алкилирования и повышения выхода целевых продуктов до 59-89%. 15 пр.
Реферат
Изобретение относится к области органической химии, к новым способам получения N1-монозамещенных производных урацила или хиназолин-2,4-диона, которые могут быть использованы в качестве биологически активных веществ.
N1-замещенные производные урацила обладают широким спектром биологической активности. В частности, среди этих соединений найдены эффективные противоопухолевые агенты [Engel D., Nudelman A., Tarasenko N., Levovich I., Makarovsky I., Sochotnikov S., Tarasenko I., Rephaeli A. J. Med. Chem. - 2008. - Vol. 51. - P. 314-323], ингибиторы вирусной репликации [Tanaka H., Takashima H., Ubasawa M., Sekiya K., Inouye N., Baba M., Shigeta S., Walker R.T., De Clercq E., Miyasaka T. J. Med. Chem. - 1995. - Vol. 38. - P. 2860-2865], антибактериальные агенты [ G., Loch J.T., Green O.M., Kawatkar S.P., Olivier N.B., Boriack-Sjodin P.A., Keating T.A. Bioorg. Med. Chem. Lett. - 2013. - Vol. 23. - P. 169-173] и блокаторы жизненного цикла простейших [Gasse С., Douguet D., Huteau V., Marchal G., Munier-Lehmann H., Pochet S. Bioorg. Med. Chem. - 2008. - Vol. 16. - P. 6075-6085].
Для введения различных заместителей в положение N1 урацила и его производных часто применяют силильный вариант реакции Гилберта-Джонсона - конденсацию соответствующих триметилсилилпроизводных с высокореакционноспособными алкилирующими агентами (α-галогенэфирами и защищенными галогенсахарами) в среде апротонных растворителей в мягких условиях. Этот метод используют для получения аналогов нуклеозидов [Griengl Н., Wanek Е., Schwarz W., Streicher W., Rosenwirth В., De Clercq E. J. Med. Chem. - 1987. - Vol. 30. - P. 1199-1204] и ациклонуклеозидов [Ogilvie K.K., Hamilton R.G., Gillen M.F., Radatus B.K., Smith K.O., Galloway K.S. Can. J. Chem. - 1984. - Vol. 62. - P. 16-21] пиримидинового ряда. Алкилгалогениды аллильного и бензильного типа также могут быть использованы в качестве алкилирующих агентов, но при более высокой температуре - в среде кипящего 1,2-дихлорэтана [Latxague L., Thibon J., Deleris G. Tetrahedron Lett. - 1998. - Vol. 39. - P. 4025-4028]. Метод также может быть распространен и на алкилирующие агенты с более низкой реакционной способностью, например на 2-арилоксиэтилбромиды, однако в этих случаях необходимы более жесткие условия синтеза - длительное нагревание субстрата и алкилирующего агента без растворителя при температурах до 180°С [Novikov M.S., Ivanova O.N., Ivanov A.V., Ozerov A.A., Valuev-Elliston V.T., Temburnikar K., Gurskaya G.V., Kochetkov S.N., Pannecouque C., Balzarini J., Seley-Radtke K.L. Bioorg. Med. Chem. - 2011. - Vol. 19. - P. 5794-5802]. Толуолсульфонаты алифатических спиртов в качестве алкилирующих агентов в условиях реакции Гилберта-Джонсона непосредственно не используются. Наличие заместителя в положении 6 пиримидинового кольца может привести к изменению региоселективности алкилирования 6-замещенного урацила [Wu F., Buhendwa M.G., Weaver D.F. J. Org. Chem. - 2004. - Vol. 69. - P. 9307-9309] или получению смеси N1-, N3-моно- и N1,N3-дизамещенных урацилов, соотношение которых зависит от условий проведения реакции [Salikhov I.S., Reznik V.S., Shvetsov Y.S., Petrova V.V., Shagidullin R.R. Bull. Acad. Sci. USSR Div. Chem. Sci. - 1986. - Vol. 35. - P. 1064-1068].
Другим способом получения N1-замещенных производных урацила является его взаимодействие с алкилирующими агентами, обладающими средней или низкой реакционной способностью. Реакция протекает в среде полярного апротонного растворителя (диметилформамида или диметилсульфоксида) в присутствии оснований - гидридов или карбонатов щелочных металлов [Kundu N.G., Sikdar S., Hertzberg R.P., Schmitz S.A., Khatri S.G. J. Chem. Soc. Perkin Trans. 1. - 1985. - P. 1295-1300], или диазобициклоундецена [Boncel S., Gondela A., M., M., Grec P., Hefczyc В., Walczak K. Synthesis. - 2011. - Vol. 2011. - P. 603-610], что всегда приводит к смеси N1-моно- и N1,N3-дизамещенных производных, разделение которых часто требует хроматографических методов. Алкилирующие агенты с высокой реакционной способностью редко используются в этих условиях вследствие их нестабильности в высокополярной среде в присутствии оснований.
Альтернативой является использование в качестве субстратов N3-бензоилпроизводных урацила, тимина [Zhou J., Shevlin Р.В. Synth. Commun. - 1997. - Vol. 27. - P. 3591-3597] или 5-фторурацила [Kametani Т., Kigasawa K., Hiiragi M., Wakisaka K., Haga S., Nagamatsu Y., Sugi H., Fukawa K., Irino O., Yamamoto Т., Nishimura N., Taguchi A., Okada Т., Nakayama M. J. Med. Chem. - 1980. - Vol. 23. - P. 1324-1329], легко образующихся при селективном N1-дебензоилировании соответствующих N1,N3-дибензоилпроизводных при комнатной температуре под действием водно-спиртового раствора гидроксида аммония [Cruickshank K.А., Jiricny J., Reese C.B. Tetrahedron Lett. - 1984. - Vol. 25. - P. 681-684], карбоната калия в среде водного диоксана [Paryzek Z., Tabaczka В. Org. Prep. Proced. Int. - 2001. - Vol. 33. - P. 400-405] либо при добавлении воды к реакционной массе в конце реакции дибензоилирования [Caram L., Doeleman М., Roberts W.J., Prankerd R.J., Perrin J.H., Underberg W.J., Sloan K.B. J. Heterocycl. Chem. - 1999. - Vol. 36. - P. 397-401]. Однако в случае N1,N3-дибензоилпроизводного 6-метилурацила селективного образования N3-бензоил-6-метилурацила при таком гидролизе не происходит, и образуется полностью деблокированный 6-метилурацил [Zhang Z.L., Han P., Ma X.Y., Liu J., Wang X.W., Liu J.Y. Chinese Chem. Lett. - 2005. - Vol. 16. - P. 287-289]. Использование в качестве субстратов в реакции алкилирования непосредственно N1,N3-дибензоилпроизводных урацила без их предварительного N1-дебензоилирования до настоящего времени не было известно.
Целью настоящего изобретения является разработка нового высокоселективного метода N1-алкопирования урацила и его 5- и 6-замещенных производных.
Сущность изобретения заключается в использовании в качестве субстратов при проведении реакции алкилирования в полярной апротонной среде в присутствии оснований N1,N3-дибензоилпроизводных урацила общей формулы
где: R1 = Н, СН3, F или Br; R2 = Н или СН3; R1+R2 = СН=СН-СН=СН.
Взаимодействие N1,N3-дибензоилпроизводных урацила, в том числе содержащих различные заместители в положениях 5 и 6 пиримидиновой системы, с алкилгалогенидами аллильного и бензильного типа, галогенметилкетонами, первичными алкилбромидами и толуолсульфонатами первичных спиртов эффективно протекает в среде диметилформамида или диметилсульфоксида при комнатной или повышенной температуре в присутствии карбонатов щелочных металлов (натрия, калия или цезия) и приводит с выходом 52-89% после кристаллизации из водно-спиртового раствора гидроксида аммония к N1-замещенным производным урацила, не содержащим примесей N1,N3-дизамещенных продуктов.
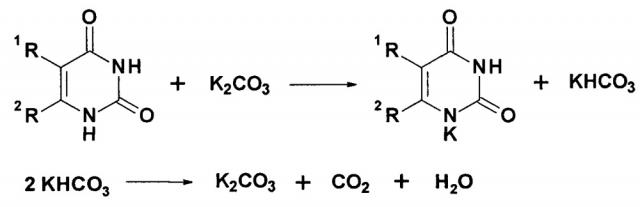
Существенным преимуществом нового способа по сравнению с известным способом алкилирования незамещенных производных урацила в среде безводного диметилформамида в присутствии карбонатов щелочных металлов является полное исключение образования воды в ходе реакции за счет диспропорционирования гидрокарбонатов, образующихся в результате ионного обмена между производными урацила и карбонатами в соответствии со схемой:
Образующаяся вода, особенно при проведении реакции при повышенной температуре, может существенно снижать выход целевых продуктов за счет гидролиза используемых алкилирующих агентов.
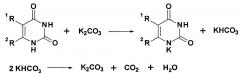
В противоположность этому, при использовании в качестве субстратов непосредственно N1,N3-дибензоилпроизводных урацила, первичным продуктом их реакции с основаниями, например карбонатом калия, являются образующиеся in situ калиевые соли N3-монобензоилпроизводных урацила, при этом бензоильный заместитель в положении N1 отщепляется в виде калия бензоата:
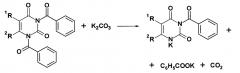
Прямыми доказательствами реализации данной схемы реакции являются: выделение двуокиси углерода при проведении реакции; образование бензойной кислоты после фильтрования реакционной массы и подкисления осадка; образование 3-бензоилпроизводных урацила с выходом до 85% при проведении реакции в отсутствии алкилирующего агента.
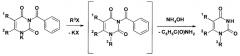
Образовавшиеся таким образом соли 3-бензоилпроизводных урацила вступают во взаимодействие с алкилирующими агентами по механизму нуклеофильного замещения, что приводит к соответствующим 1-замещенным 3-бензоилурацилам, которые без выделения и очистки деблокируют при нагревании с водно-спиртовым раствором гидроксида аммония:
Сохранение бензоильного заместителя в промежуточных продуктах обеспечивает эффективное блокирование положения N3 пиримидиновой системы и высокую селективность реакции алкилирования.
Наиболее выраженно преимущества нового метода по сравнению с известным алкилированием незамещенных производных урацила в среде полярного апротонного растворителя в присутствии основания проявляются при наличии заместителя в положении 6 пиримидинового цикла, например, в случае 6-метилурацила или хиназолин-2,4(1H,3H)-диона. В этих случаях выход целевых продуктов N1-моноалкилирования повышается более чем в 3 раза.
Дополнительным преимуществом нового метода является возможность проведения реакции алкилирования в мягких условиях, что позволяет использовать алкилирующие агенты сложного строения, в том числе при синтезе известных биологически активных веществ [Петров В.И., Озеров А.А., Луганченко А.И. Пиримидиновые производные бензофенона, обладающие анти-ВИЧ-1 активностью // Пат. России №2489427 (2013). - Опубл. 10.08.2013, Бюл. №22].
Следующие примеры иллюстрируют сущность изобретения.
Пример 1 согласно изобретению. Получение 1-[2-(2-нафтилокси)этил]-6-метилурацила. Смесь 2,0 г (5,98 ммоль) 1,3-дибензоил-6-метилурацила, 2,0 г (5,84 ммоль) n-толуолсульфоната 2-(2-нафтилокси)этанола и 2,0 г (7,24 ммоль) тонко измельченного безводного калия карбоната перемешивают в 40 мл безводного диметилформамида в течение 24 ч при комнатной температуре. Фильтруют, осадок на фильтре промывают 2 раза по 5 мл диметилформамида, фильтрат упаривают в вакууме при температуре бани 80-90°С, остаток распределяют между 100 мл хлороформа и 50 мл воды, органическую фазу отделяют, сушат сульфатом натрия, фильтруют и упаривают в вакууме. Остаток растворяют при нагревании в 25 мл 95% этилового спирта, добавляют 2,5 мл концентрированного водного раствора аммония гидроксида, кипятят 5 мин, охлаждают, выдерживают при температуре 0-5°С в течение суток, образовавшийся осадок отфильтровывают, промывают на фильтре 5 мл холодного 95% этилового спирта, 5 мл диэтилового эфира, 10 мл гексана, сушат на воздухе, повторно кристаллизуют из 95% этилового спирта и получают 1,30 г (73%) светло-желтого кристаллического вещества, Т. пл. 216,5-218,5°С. Спектр ЯМР 1Н, δ, м.д.: 2,35 с (3Н, СН3); 4,17 т (2Н, 5 Гц, СН2); 4,29 т (2Н, 5 Гц, СН2); 5,52 с (1Н, Н5); 7,11-7,46 м (4Н, арил); 7,75-7,83 м (3Н, арил); 11,27 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 23,11; 46,45; 68,68; 104,51; 110,20; 121,75; 127,13; 129,85; 130,10; 130,90; 131,98; 132,81; 137,56; 155,01; 158,11; 159,25; 165,88.
Из водной фазы после подкисления, фильтрования и кристаллизации из этилацетата получают 0,19 г (14%) промежуточного 3-бензоил-6-метилурацила. Т. пл. 218-220°С. Спектр ЯМР 1Н, δ, м.д.: 2,13 с (3Н, СН3); 5,62 с (1Н, Н5); 7,55-7,62 м (2Н, арил); 7,72-7,79 м (1Н, арил); 7,91-7,97 м (2Н, арил); 11,59 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 18,82; 98,83; 129,77; 130,49; 131,81; 135,63; 150,30; 154,71; 162,88; 170,50.
Пример 2 для сравнения. Получение 1-[2-(2-нафтилокси)этил]-6-метилурацила согласно известному методу. 5,0 г (0,040 моль) 6-метилурацила и 2,5 г (0,042 моль) 95% калия гидроксида растворяют в 20 мл воды, раствор упаривают досуха в вакууме при температуре бани 80-85°С, дважды упаривают в вакууме с 20 мл толуола, остаток растворителя удаляют при температуре 80-90°С и остаточном давлении 4-5 мм рт.ст. в течение 2 ч и получают 6,7 г (100%) безводной калиевой соли 6-метилурацила. Суспензию 2,5 г (0,015 моль) этой соли перемешивают в 100 мл безводного диметилсульфоксида при температуре 80-90°С в течение 30 мин, добавляют в один прием 6,2 г (0,015 моль) n-толуолсульфоната 2-(2-нафтилокси)этанола и перемешивают 1 ч при той же температуре, при этом происходит полное растворение осадка. Раствор упаривают в вакууме на кипящей водяной бане, остаток охлаждают, добавляют 100 мл воды, перемешивают, охлаждают в течение суток при температуре 0-5°С, фильтруют, осадок на фильтре промывают 20 мл воды, сушат на воздухе и получают 5,2 г смеси продуктов алкилирования. Полученное вещество распределяют между 200 мл хлороформа и 200 мл 5% раствора калия гидроксида, органическую фазу дополнительно экстрагируют 2 раза по 100 мл 5% раствора калия гидроксида. Объединенную водную фазу подкисляют концентрированной соляной кислотой до рН 1-2, выдерживают при температуре 0-5°С в течение 24 ч, образовавшийся осадок отфильтровывают, промывают на фильтре 25 мл воды, сушат на воздухе, дважды кристаллизуют из 50 мл 95% этилового спирта и получают 0,85 г (19%) 1-[2-(2-нафтилокси)этил]-6-метилурацила в виде светло-желтого кристаллического вещества. Т. пл. 217-220°С. Спектр ЯМР 1Н, δ, м.д.: 2,35 с (3Н, СН3); 4,17 т (2Н, 6 Гц, СН2); 4,29 т (2Н, 6 Гц, СН2); 5,52 с (1Н, Н5); 7,12-7,47 м (4Н, арил); 7,76-7,83 м (3Н, арил), 11,28 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 23,11; 46,46; 68,68; 104,52; 110,19; 121,75; 127,13; 129,85; 130,10; 130,89; 131,98; 132,81; 137,56; 155,01; 158,11; 159,25; 165,88.
Органическую фазу сушат сульфатом натрия, фильтруют, фильтрат упаривают в вакууме при температуре 80-90°С, остаток дважды кристаллизуют из 200 мл 95% этилового спирта и получают 1,90 г (54%) 1,3-ди[2-(2-нафтилокси)этил]-6-метилурацила в виде светло-желтого кристаллического вещества. Т. пл. 154,5-157,5°С. Спектр ЯМР 1Н, δ, м.д.: 2,39 т (3Н, СН3); 4,21-4,28 м (6Н, СН2); 4,34 т (2Н, 6 Гц, СН2); 5,70 с (1Н, Н5); 7,00-7,48 м (8Н, арил); 7,68-7,83 м (6Н, арил). Спектр ЯМР 13С, δ, м.д.: 23,08; 47,62; 67,40; 68,67; 103,77; 110,17; 121,76; 121,86; 126,99; 127,13; 129,73; 129,86; 130,03; 130,11; 130,81; 130,89; 131,85; 131,98; 132,61; 132,81; 137,54; 137,56; 155,13; 156,96; 159,25; 159,36; 164,71.
Пример 3. 1-[2-(2-Нафтилокси)этил]урацил. Получают аналогично примеру 1 из 1,3-дибензоилурацила и n-толуолсульфоната 2-(2-нафтилокси)этанола в среде безводного диметилсульфоксида в присутствии карбоната натрия при комнатной температуре. Выход 89%. Т. пл. 211-213°С. Спектр ЯМР 1Н, δ, м.д.: 4,13 т (2Н, 5 Гц, СН2); 4,29 т (2Н, 5 Гц, СН2); 5,59 д (1Н, 8 Гц, Н5); 7,11-7,47 м (4Н, арил); 7,72 д (1Н, 8 Гц, Н6); 7,78-7,83 м (3Н, арил), 11,36 с (1H, NH). Спектр ЯМР 13С, δ, м.д.: 50,30; 68,65; 104,05; 110,34; 121,84; 127,13; 129,84; 130,10; 130,89; 131,99; 132,79; 137,55; 149,73; 154,39; 159,23; 167,14.
Пример 4. 1-[2-(2-Нафтилокси)этил]тимин. Получают аналогично примеру 1 из 1,3-дибензоилтимина и n-толуолсульфоната 2-(2-нафтилокси)этанола в среде безводного диметилформамида в присутствии карбоната цезия при комнатной температуре. Выход 84%. Т. пл. 212-215°С. Спектр ЯМР 1Н, δ, м.д.: 1,76 с (3Н, СН3); 4,08 т (2Н, 5 Гц, СН2); 4,28 т (2Н, 5 Гц, СН2); 7,12-7,47 м (4Н, арил); 7,60 с (1Н, Н6); 7,76-7,83 м (3Н, арил), 11,33 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 15,32; 50,02; 68,69; 110,35; 111,61; 121,88; 127,12; 129,83; 130,09; 130,89; 131,98; 132,78; 137,55; 145,40; 154,35; 159,26; 167,68.
Пример 5. 1-[2-(2-Нафтилокси)этил]-5,6-диметилурацил. Получают аналогично примеру 1 из 1,3-дибензоил-5,6-диметилурацила и n-толуолсульфоната 2-(2-нафтилокси)этанола в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 61%. Т. пл. 202-204°С. Спектр ЯМР 1Н, δ, м.д.: 1,83 с (3Н, СН3); 2,36 с (3Н, СН3); 4,23 т (2Н, 5 Гц, СН2); 4,28 т (2Н, 6 Гц, СН2); 7,11-7,48 м (4Н, арил); 7,76-7,84 м (3Н, арил), 11,33 с (1H, NH). Спектр ЯМР 13С, δ, м.д.: 11,29; 16,78; 43,57; 65,79; 106,58; 107,11; 118,76; 124,06; 126,79; 127,04; 127,84; 128,90; 129,72; 134,51; 149,82; 151,30; 156,21; 163,53.
Пример 6. 1-[2-(2-Бензоилфенокси)этил]-5-фторурацил. Получают аналогично примеру 1 из 1,3-дибензоил-5-фторурацила и 1-бром-2-(2-бензоилфенокси)этана в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 73%. Т. пл. 184-186°С. Спектр ЯМР 1Н, δ, м.д.: 3,78 т (2Н, 5 Гц, CH2-N); 4,19 т (2Н, 5 Гц, СН2-O); 7,08-7,68 м (10Н, арил, Н6); 11,65 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 47,29; 65,33; 112,85; 121,22; 128,51; 128,95; 129,07; 129,88; 130,21; 132,06; 133,43; 136,78; 137,89; 140,17; 149,35; 155,29; 157,17; 157,42; 195,43.
Пример 7. 1-(4-Бензоилбензил)-5-бромурацил. Получают аналогично примеру 1 из 1,3-дибензоил-5-бромурацила и 4-бензоилбензилбромида в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 69%. Т. пл. 197,5-199°С. Спектр ЯМР 1Н, δ, м.д.: 4,99 с (2Н, СН2); 7,46-7,77 м (9Н, арил); 8,41 с (1Н, Н6); 11,85 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 54,00; 98,73; 130,83; 131,95; 132,97; 133.37; 136,09; 139,76; 140,35; 144,61; 148,60; 153,79; 163,01; 198,71.
Пример 8. 1-Бензилхиназолин-2,4(1H,3H)-дион. Получают аналогично примеру 1 из 1,3-дибензоилхиназолин-2,4(1H,3H)-диона и бензилхлорида в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 62%. Т. пл. 217-220°С. Спектр ЯМР 1Н, δ, м.д.: 5,30 с (2Н, СН2); 7,18-7,34 м (7 Н, арил, Н6, Н8); 7,60 т (1H, 8 Гц, Н7); 8,01 д (1Н, 8 Гц, Н5); 11,76 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 48,50; 118,48; 119,27; 126,03; 129,80; 130,57; 130,96; 132,96; 138,53; 139,75; 144,21; 154,09; 165,19.
Пример 9. 1-Аллил-6-метилурацил. Получают аналогично примеру 1 из 1,3-дибензоил-6-метилурацила и аллилбромида в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 52%. Т. пл. 171,5-173°С. Спектр ЯМР 1Н, δ, м.д.: 2,18 с (3Н, СН3); 4,38-4,41 м (2Н, СН2); 4,98-5,17 м (2Н, =СН2); 5,51 с (1Н, Н5); 5,83-5,94 м (1Н, =СН); 11,22 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 19,17; 45,34; 101,36; 115,98; 133,57; 151,70; 154,61; 162,83.
Пример 10. 1-Бензил-6-метилурацил. Получают аналогично примеру 1 из 1,3-дибензоил-6-метилурацила и бензилхлорида в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 84%. Т. пл. 236-238°С. Спектр ЯМР 1Н, δ, м.д.: 2,11 с (3Н, СН3); 5,04 с (2Н, СН2); 5,56 с (1Н, Н5); 7,15-7,38 м (5Н, арил); 11,36 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 19,55; 46,28; 101,75; 126,25; 127,58; 129,12; 137,38; 152,34; 154,65; 162,82.
Пример 11. 1-(2-Фенилэтил)-6-метилурацил. Получают аналогично примеру 1 из 1,3-дибензоил-6-метилурацила и n-толуолсульфоната 2-фенилэтанола в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 59%. Т. пл. 205-208°С. Спектр ЯМР 1Н, δ, м.д.: 2,09 с (3Н, СН3); 2,86 т (2Н, 8 Гц, СН2); 3,89 т (2Н, 8 Гц, СН2); 5,43 с (1Н, Н5); 7,20-7,34 м (5Н, арил); 11,23 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 19,39; 34,31; 45,35; 101,21; 126,89; 128,86; 129,17; 138,56; 151,76; 154,56; 162,81.
Пример 12. 1-(2-Феноксиэтил)-6-метилурацил. Получают аналогично примеру 1 из 1,3-дибензоил-6-метилурацила и 1-бром-2-феноксиэтана в среде безводного диметилформамида в присутствии карбоната калия при температуре 80-85°С в течение 2 ч. Выход 69%. Т. пл. 186-189°С. Спектр ЯМР 1Н, δ, м.д.: 2,32 с (3Н, СН3); 4,10 т (2Н, 5 Гц, СН2); 4,16 т (2Н, 5 Гц, СН2); 5,51 с (1Н, Н5); 6,91-6,96 м (3Н, арил); 7,24-7,30 м (2Н, арил); 11,26 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 20,02; 43,43; 65,34; 101,41; 114,61; 121,27; 129,91; 151,91; 155,07; 158,31; 162,84.
Пример 13. 1-(2-Фенил-2-оксоэтил)-6-метилурацил. Получают аналогично примеру 1 из 1,3-дибензоил-6-метилурацила и фенацилбромида в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 54%. Т. пл. 252-255°С. Спектр ЯМР 1Н, δ, м.д.: 2,09 с (3Н, СН3); 5,42 с (2Н, СН2); 5,59 с (1Н, Н5); 7,56-7,62 м (2Н, арил); 7,70-7,75 м (1Н, арил); 8,04-8,08 м (2Н, арил); 11,35 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 19,61; 50,43; 101,27; 128,46; 129,29; 134,44; 134,58; 151,99; 154,76; 162,90; 194,01.
Пример 14. 1-(2-Бензилоксиэтил)-6-метилурацил. Получают аналогично примеру 1 из 1,3-дибензоил-6-метилурацила и n-толуолсульфоната 2-бензилоксиэтанола в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 67%. Т. пл. 145-147°С. Спектр ЯМР 1Н, δ, м.д.: 2,26 с (3Н, СН3); 3,60 т (2Н, 5 Гц, СН2); 3,93 т (2Н, 5 Гц, СН2); 4,47 с (2Н, СН2); 5,49 с (1Н, Н5); 7,22-7,34 м (5Н, арил); 11,20 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 20,07; 43,85; 67,63; 72,38; 101,19; 127,48; 127,78; 128,59; 138,49; 151,80; 155,23; 162,89.
Пример 15. 1-[2-(2-Бензоилфенокси)этил]-6-метилурацил. Получают аналогично примеру 1 из 1,3-дибензоил-6-метилурацила и 1-бром-2-(2-бензоилфенокси)этана в среде безводного диметилформамида в присутствии карбоната калия при комнатной температуре. Выход 66%. Т. пл. 226,5-228,5°С. Спектр ЯМР 1Н, δ, м.д.: 1,80 с (3Н, СН3); 3,83 т (2Н, 5 Гц, СН2); 4,16 т (2Н, 5 Гц, СН2); 5,10 с (1Н, Н5); 7,06-7,68 м (9Н, арил); 10,89 с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 22,77; 46,36; 69,15; 104,44; 116,09; 124,53; 131,85; 132,01; 132,62; 135,16; 136,99; 139,83; 154,73; 157,41; 158,62; 165,65; 198,97.
Таким образом, нами разработан новый простой, удобный, высокоэффективный и селективный способ N1-алкилирования урацила и его 5- и 6-замещенных производных, позволяющий с высоким выходом получать известные и новые соединения пиримидинового ряда.
Способ получения N1-монозамещенных производных урацила или хиназолин-2,4-диона алкилированием бензоилзамещенного пиримидинового субстрата в среде полярного апротонного растворителя в безводной среде в присутствии основания, отличающийся тем, что в качестве пиримидинового субстрата используют 1,3-дибензоилпроизводное урацила или хиназолин-2,4-диона общей формулы
где: R1=Н, СН3, F или Br; R2=Н или СН3; R1+R2=СН=СН-СН=СН,
и алкилирование проводят галоидным алкилом или толуолсульфонатом спирта, с последующим добавлением к полученному продукту алкилирования концентрированного водного раствора основания.