Способ получения некоторых 2-(пиридин-3-ил)тиазолов
Иллюстрации
Показать всеИзобретение относится к способу получения 2-(пиридин-3-ил)тиазолов, представленных формулой (III). Способ включает (i) циклизацию соединения (I) с соединением (II) для получения соединения (III), в которой (А) каждый R1 представляет собой Н или (C1-C6)алкил; (В) R2 представляет собой незамещенный (C1-C6)алкил и (С) R3 представляет собой Н, где стадию (а) проводят в полярном протонном растворителе. Способ дополнительно включает галогенирование указанного R3 до F, Cl, Br или I, в котором указанное галогенирование проводят в полярном растворителе и указанное галогенирование проводят при температуре от 0°С до температуры окружающей среды. Технический результат - способ получения 2-(пиридин-3-ил)тиазолов как промежуточных продуктов для синтеза пестицидных тиазоловых амидов. 7 з.п. ф-лы, 5 пр.
Реферат
Перекрестные ссылки на родственные заявки
Настоящая заявка испрашивает приоритет и преимущества предварительной заявки США 61/655076, поданной 4 июня 2012 года. Полное содержание этой предварительной заявки включено посредством ссылки в настоящую заявку.
Область техники, к которой относится изобретение
Изобретение, раскрытое в данном документе, относится к области способов получения некоторых 2-(пиридин-3-ил)тиазолов как промежуточных продуктов для синтеза пестицидных тиазоловых амидов.
Уровень техники
Регулирование популяций вредителей является важным для современного сельского хозяйства, хранения продовольствия и гигиены. Существует более десяти тысяч видов сельскохозяйственных вредителей, которые вызывают потери в сельском хозяйстве. Мировые сельскохозяйственные потери составляют биллионы долларов США каждый год. Также известно, что вредители, такие как термиты, вызывают повреждение всех видов частных и общественных структур, приводя каждый год к потерям в миллиардах долларов США. Вредители также поедают и портят продовольствие/корм при хранении, приводя каждый год к потерям в миллиардах долларов США, а также к потерям продовольствия, необходимого для людей.
Некоторые пестициды имеют или развивают устойчивость к пестицидам при современном применении. Сотни видов вредителей являются устойчивыми к одному или нескольким пестицидам. В соответствии с этим существует постоянная потребность в новых пестицидах и в способах получения таких пестицидов.
Заявка WO 2019/129497 (полное раскрытие которой включено в настоящую заявку) раскрывает некоторые пестициды. Однако способы получения таких пестицидов могут быть либо дорогими, либо неэффективными. В соответствии с этим, существует потребность в способах, эффективно образующих такие пестициды.
Определения
Примеры, данные в определениях, обычно не являются исчерпывающими и не должны рассматриваться в качестве ограничения изобретения, раскрытого в данном документе. Понятно, что заместитель должен подчиняться правилам химического связывания и ограничениям стерической совместимости по отношению к определенной молекуле, к которой он прикреплен.
Термин “алкенил” означает ациклический, ненасыщенный (по меньшей мере одна углерод-углеродная двойная связь), разветвленный или неразветвленный, заместитель, состоящий из углерода и водорода, например, винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил.
Термин “алкенилокси” означает алкенил, дополнительно содержащий ординарную связь углерод-кислород, например, аллилокси, бутенилокси, пентенилокси, гексенилокси, гептенилокси, октенилокси, ноненилокси и деценилокси.
Термин “алкокси” означает алкил, дополнительно содержащий ординарную связь углерод-кислород, например, метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изобутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси и декокси.
Термин “алкил” означает ациклический, насыщенный, разветвленный или неразветвленный, заместитель, состоящий из углерода и водорода, например, метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, октил, нонил и децил.
Термин “алкинил” означает ациклический, ненасыщенный (по меньшей мере одна углерод-углеродная тройная связь и любые двойные связи), разветвленный или неразветвленный, заместитель, состоящий из углерода и водорода, например, этинил, пропаргил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил.
Термин “алкинилокси” означает алкинил, дополнительно содержащий ординарную связь углерод-кислород, например, пентинилокси, гексинилокси, гептинилокси, октинилокси, нонинилокси и децинилокси.
Термин “арил” означает циклический, ароматический заместитель, состоящий из углерода и водорода, например, фенил, нафтил и бифенил.
Термин “циклоалкенил” означает моноциклический или полициклический, ненасыщенный (по меньшей мере одна углерод-углеродная двойная связь), заместитель, состоящий из углерода и водорода, например, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, циклодеценил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
Термин “циклоалкенилокси” означает циклоалкенил, дополнительно содержащий ординарную связь углерод-кислород, например, циклобутенилокси, циклопентенилокси, циклогексенилокси, циклогептенилокси, циклооктенилокси, циклодеценилокси, норборненилокси и бицикло[2.2.2]октенилокси.
Термин “циклоалкил” означает моноциклический или полициклический, насыщенный заместитель, состоящий из углерода и водорода, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
Термин “циклоалкокси” означает циклоалкил, дополнительно содержащий ординарную связь углерод-кислород, например, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси, циклооктилокси, циклодецилокси, норборнилокси и бицикло[2.2.2]октилокси.
Термин “циклогалогеналкил” означает моноциклический или полициклический, насыщенный заместитель, состоящий из углерода, галогена и водорода, например, 1-хлорциклопропил, 1-хлорциклобутил и 1-хлорциклопентил.
Термин “галоген” означает фтор, хлор, бром и иод.
Термин “галогеналкил” означает алкил, дополнительно содержащий от одного до максимально возможного числа, одинаковых или разных, галогенов, например, фторметил, дифторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
Термин “гетероциклил” означает циклически заместитель, который может быть полностью замещенным, частично замещенным или полностью ненасыщенным, где циклическая структура содержит по меньшей мере один углерод и по меньшей мере один гетероатом, где указанный гетероатом представляет собой азот, серу или кислород, например, бензофуранил, бензоизотиазолил, бензоизооксазолил, бензоксазолил, бензотиенил, бензотиазолил, циннолинил, фуранил, индазолил, индолил, имидазолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, 1,3,4-оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, 1,2,3,4-тетразолил, тиазолинил, тиазолил, тиенил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил и 1,2,4-триазолил.
Подробное описание раскрытия
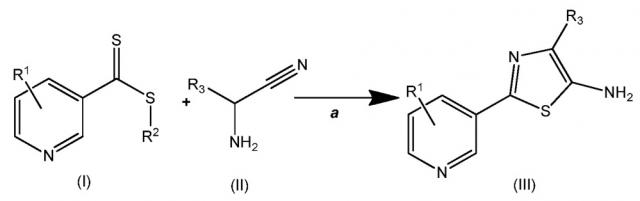
Вариант осуществления данного изобретения показан на схеме один
Схема один
,
в которой
(А) каждый R1 независимо выбран из Н, F, Cl, Br, I, CN, NO2 и замещенного или незамещенного (C1-C6)алкила, где каждый замещенный R1 имеет один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, (C1-C6)алкила и (C1-C6)галогеналкила;
(В) R2 выбран из замещенного или незамещенного (C1-C6)алкила, замещенного или незамещенного (C2-C6)алкенила, замещенного или незамещенного (C1-C6)алкокси, замещенного или незамещенного (C2-C6)алкенилокси, замещенного или незамещенного (C3-C10)циклоалкила, замещенного или незамещенного (C3-C10)циклоалкенила, замещенного или незамещенного (C6-C20)арила, замещенного или незамещенного (C1-C6)алкил(С6-С20)арила и замещенного или незамещенного (C1-C20)гетероциклила, где каждый замещенный R2 имеет один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, (C1-C6)алкила, (C2-C6)алкенила, (C1-C6)галогеналкила, (C2-C6)галогеналкенила, (C1-C6)галогеналкокси, (C2-C6)галогеналкенилокси, (C3-C10)циклоалкила, (C3-C10)циклоалкенила, (C3-10)галогенциклоалкила, (C3-C10)галогенциклоалкенила, (C6-C20)арила и (C1-C20)гетероциклила; и
(С) R3 выбран из Н, замещенного или незамещенного (C1-C6)алкила, замещенного или незамещенного (C3-C10)циклоалкила, замещенного или незамещенного (С1-С6)алкил(C3-C10)циклоалкила, замещенного или незамещенного (C6-C20)арила и замещенного или незамещенного (C1-C6)алкил(С6-С20)арила, где каждый замещенный R3 имеет один или несколько заместителей, независимо выбранных из F, Cl, Br и I.
В другом варианте осуществления данного изобретения каждый R1 независимо выбран из Н, F и Cl.
В другом варианте осуществления данного изобретения R1 представляет собой Н.
В другом варианте осуществления данного изобретения R3 выбран из Н, (C1-C6)алкила, (C1-C6)галогеналкила и (C6-C20)арила.
В другом варианте осуществления данного изобретения R3 выбран из Н, СF3, CH2F, CHF2, CH3, CH2CH3, CH(CH3)2 и фенила.
В другом варианте осуществления данного изобретения R3 выбран из Н и СН3.
Обычно S-R2 представляет собой удаляемую группу, в которой R2 является частью удаляемой группы, которая не оказывает существенного и негативного влияния на требуемую реакцию. Предпочтительно, что R2 представляет собой группу, которая положительно влияет на летучесть тио-промежуточного продукта реакции.
На стадии а соединения (I) и (II) подвергают циклизации для получения соединения (III). Данную стадию проводят в присутствии основания, когда соединение (II) представляет собой форму соли. Подходящие основания включают, но без ограничения только ими, бикарбонат натрия, бикарбонат калия, карбонат натрия, карбонат цезия, карбонат калия, гидроксид натрия, гидроксид калия, бисульфат натрия, ацетат натрия, ацетат калия, гидроксид аммония, метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, триэтиламин и пиридин. Реакцию можно проводить при температуре и давлении окружающей среды, но, если желательно, можно использовать более высокие или более низкие температуры и давления. Реакцию проводят в полярном протонном растворителе. Примеры таких растворителей включают, но без ограничения только ими, н-бутанол, изопропанол, н-пропанол, этанол, метанол и воду или их смесь. Повсеместно предпочитают метанол.
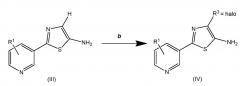
Одно преимущество стадии а в пределах данного способа состоит в том, что соединение (III) обычно получают в основном в виде чистого твердого вещества, которому не требуются дополнительные процедуры очистки. Другое преимущество данных процессов состоит в том, что соединение (III) - если R3 представляет собой Н, можно галогенировать. Следовательно, с этой точки зрения, R3 дополнительно в данной работе включает F, Cl, Br и I (см. схему два). Как дополнительное преимущество соединение (IV) может быть в форме соли.
Схема два
На стадии b можно использовать любой агент для галогенирования, например, 1-хлорпирролидин-2,5-дион, N-бромсукцинимид и 1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октан бис(тетрафторборат). Можно использовать полярные растворители, такие как дихлорметан, тетрагидрофуран, этилацетат, ацетон, диметилформамид, ацетонитрил и диметилсульфоксид. В настоящее время предпочитают дихлорметан. Реакцию можно проводить при температуре и давлении окружающей среды, но, если желательно, можно использовать более высокие или более низкие температуры и давления. Повсеместно предпочитают температуры от приблизительно 0° до приблизительно температуры окружающей среды.
В другом варианте осуществления данного изобретения R3 предпочтительно означает Cl.
Соединение (III) или соединение (IV) можно дополнительно подвергать взаимодействию для образования некоторых пестицидов, раскрытых в заявке WO 2010/129497 (полное раскрытие которой включено здесь ссылкой).
Примеры
Примеры даются для иллюстративных целей и не должны рассматриваться в качестве ограничения изобретения, раскрытого в данном документе, только до вариантов осуществления, раскрытых в данных примерах.
Исходные материалы, реагенты и растворители, которые получены из коммерческих источников, использованы без дополнительной очистки. Безводные растворители приобретены в виде Sure/Seal™ от фирмы Aldrich и использованы в виде полученных образцов. Температуры плавления определены на капиллярном приборе для измерения температуры плавления Thomas Hoover Unimelt или на автоматизированной системе для измерения температуры плавления OptiMelt Automated Melting Point System от Stanford Research Systems и не корректированы. Молекулы даны по их известным названиям, обозначены по номенклатурным программам в пределах ISIS Draw, ChemDraw или ACD Name Pro. Если такие программы не способны обозначить молекулу, молекула названа при применении обычных номенклатурных правил. Все ЯМР даются в м.д. (δ) и зарегистрированы при 300, 400 или 600 МГц, если не указано особо.
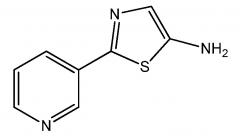
Пример 1: Получение 2-(пиридин-3-ил)-1,3-тиазол-5-амина:
В сухую 500 мл круглодонную колбу, снабженную магнитной мешалкой, термометром, скруббером и капельной воронкой, загружали 27,6 г (179 ммоль) бисульфата аминоацетонитрила и 200 мл безводного метанола. Раствор охлаждали до ~0°С и 24,15 г (239 ммоль) триэтиламина добавляли по каплям со скоростью, которая устанавливала температуру ниже 10°С. Спустя 10 минут добавляли по каплям 20,2 г (119 ммоль) метил-пиридин-3-карбодитиоата в 50 мл безводного метанола. Реакционную смесь перемешивали при температуре окружающей среды в течение 20 часов, после чего растворитель удаляли в вакууме на роторном испарителе. Остаток выливали в 500 мл воды и экстрагировали метиленхлоридом (4×100 мл). Объединенные метиленхлоридные экстракты промывали 100 мл воды, 100 мл насыщенного водного раствора хлорида натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме на роторном испарителе. Сырой продукт суспендировали в 100 мл этилового простого эфира, и полученное желтое твердое вещество собирали фильтрованием в вакууме с получением 14,1 г (66%) бледно-желтого твердого вещества:
1Н ЯМР (400 МГц, ДМСО-d6) δ 8,97(д, J=2,2 Гц, 1Н), 8,53(дд, J=4,8, 1,6 Гц, 1H), 8,12-8,03(м, 1Н), 7,45(дд, J=7,9, 4,8 Гц, 1Н), 6,99(с, 1H), 6,28(ушир.с, 2H); 13Н ЯМР (101 МГц, CDCl3) δ 151,72, 148,55, 146,06, 145,40, 131,57, 130,18, 129,93, 122,20.
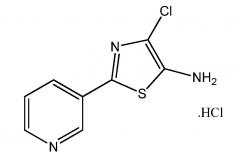
Пример 2: Получение гидрохлорида 4-хлор-2-(пиридин-3-ил)-1,3-тиазол-5-амина:
В сухую 250 мл круглодонную колбу, снабженную магнитной мешалкой, загружали 6,3 г (35,5 ммоль) 2-(пиридин-3-ил)-1,3-тиазол-5-амина и 100 мл безводного 1,4-диоксана. Раствор охлаждали до ~0°С и добавляли порциями 4,75 г (35,5 ммоль) N-хлорсукцинимида со скоростью, которая обеспечивала поддержание температуры ниже 10°С. Реакционную смесь перемешивали при 5-10°С в течение 20 минут, и затем фильтровали через небольшой слой диатомовой земли. Фильтрат разбавляли с помощью 50 мл диэтилового простого эфира и подкисляли с помощью 10 мл 4,0 М HCl в 1,4-диоксане. Полученное твердое вещество собирали фильтрованием в вакууме, промывали этиловым простым эфиром (100 мл) и метиленхлоридом (500 мл), и затем сушили в вакууме при 40°С с получением 7,5 г (85%) оранжевого твердого вещества:
1Н ЯМР (400 МГц, ДМСО-d6) δ 9,08(д, J=2,1 Гц, 1Н), 8,76(дт, J=9,5, 4,7 Гц, 1H), 8,66(ддд, J=8,3, 2,0, 1,3 Гц, 1Н), 7,97(дт, J=15,6, 7,8 Гц, 1Н).
Пример 3: Получение N-(4-хлор-2-(пиридин-3-ил)тиазол-5-ил)-2-метил-3-(метилтио)пропанамида:
В сухую 500 мл круглодонную колбу, снабженную магнитной мешалкой, термометром, капельной воронкой и впуском для азота, загружали 7,5 г (30,2 ммоль) гидрохлорида 4-хлор-2-(пиридин-3-ил)-1,3-тиазол-5-амина и 200 мл безводного метиленхлорида. Полученную суспензию охлаждали до 15°С и добавляли 5,98 г (76 ммоль) пиридина со скоростью, которая обеспечивала поддержание температуры ниже 20°С. 1,85 г (15,11 ммоль) N,N-диметилпиридин-4-амина добавляли одной порцией и полученный раствор желтого цвета перемешивали при 5°С в течение 10 минут. Раствор 2-метил-3-(метилтио)пропаноилхлорида (5,54 г, 36,3 ммоль) в 25 мл метиленхлорида добавляли по каплям со скоростью, которая обеспечивала поддержание температуры ниже 15°С. Реакционную смесь перемешивали при температуре окружающей среды в течение 12 часов, затем выливали в 200 мл воды. Целевое вещество экстрагировали метиленхлоридом (3×100 мл) и объединенные метиленхлоридные экстракты промывали 0,5 H водной хлористоводородной кислотой (100 мл), водой (100 мл) и насыщенным водным раствором хлорида натрия (100 мл). Органический экстракт сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме на роторном испарителе. Сырой продукт очищали флэш-хроматографией на силикагеле, элюирование с градиентом из 100% гексана до 100% этилацетата в течение 30 минут давало масло желтого цвета (5,4 г, 55%):
1Н ЯМР (400 МГц, CDCl3) δ 9,12(дд J=2,3, 0,8 Гц, 1Н), 9,00(c, 1Н), 8,64(дд, J=4,8, 1,6 Гц, 1H), 8,17(ддд, J=8,0, 2,3, 1,6 Гц, 1Н), 7,37(ддд, J=8,0, 4,9, 0,8 Гц, 1Н), 3,00-2,57(м, 3H), 2,17(c, 3H), 1,38(д, J=6,7 Гц, 3H); 13Н ЯМР (101 МГц, CDCl3) δ 171,68, 155,24, 150,55, 146,75, 132,81, 129,26, 127,62, 124,99, 123,80, 40,85, 37,98, 17,46, 16,45.
Пример 4: Получение N-(4-хлор-2-(пиридин-3-ил)тиазол-5-ил)-N,2-диметил-3-(метилтио)пропанамида:
В сухую 50 мл круглодонную колбу, снабженную магнитной мешалкой, капельной воронкой и впуском для азота, загружали 1,0 г (3,05 ммоль) N-(4-хлор-2-(пиридин-3-ил)-1,3-тиазол-5-ил)-2-метил-3-(метилтио)пропанамида и 10 мл безводного N,N-диметилформамида. К полученному раствору затем добавляли в виде одной порции 1,1 г (3,36 ммоль) порошка карбоната цезия, с последующим добавлением по каплям 0,476 г (3,36 ммоль) иодметана в 5 мл безводного N,N-диметилформамида. Гетерогенную смесь перемешивали при температуре окружающей среды в течение 12 часов, и затем выливали в 200 мл воды и экстрагировали метиленхлоридом (3×100 мл). Объединенные метиленхлоридные экстракты промывали водой (100 мл), насыщенным водным раствором хлорида натрия (100 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме на роторном испарителе. Сырой продукт очищали флэш-хроматографией на силикагеле, элюирование с градиентом из 100% гексана до 100% этилацетата в течение 20 минут давало масло желтого цвета (0,93 г, 89%):
1Н ЯМР (400 МГц, CDCl3) δ 9,12(д J=1,4 Гц, 1Н), 8,73(д, J=3,8 Гц, 1Н), 8,34-8,09(м, 1H), 7,43(дд, J=7,9, 4,9 Гц, 1H), 3,30(c, 3H), 3,06-2,70(м, 2H), 2,49(д, J=7,4 Гц, 1Н), 2,04(с, 3H), 1,21(д, J=6,4 Гц, 3H); 13Н ЯМР (101 МГц, ДМСО-d6) δ 175,22, 162,37, 151,91, 146,53, 136,46, 134,64, 133,35, 127,98, 124,27, 37,47, 36,71, 36,47, 17,56, 15,44.
Пример 5: Получение N-(4-хлор-2-(пиридин-3-ил)тиазол-5-ил)-N-этил-2-метил-3-(метилтио)пропанамида:
В сухую 50 мл круглодонную колбу, снабженную магнитной мешалкой, капельной воронкой и впуском для азота, загружали 1,0 г (3,05 ммоль) N-(4-хлор-2-(пиридин-3-ил)-1,3-тиазол-5-ил)-2-метил-3-(метилтио)пропанамида и 10 мл безводного N,N-диметилформамида. К полученному раствору затем добавляли в виде одной порции 1,1 г (3,36 ммоль) порошка карбоната цезия, с последующим добавлением по каплям 0,523 г (3,36 ммоль) иодэтана в 5 мл безводного N,N-диметилформамида. Гетерогенную смесь перемешивали при температуре окружающей среды в течение 12 часов. Анализ аликвоты указал на неполную реакцию. Добавляли дополнительные 100 мкл иодэтана и реакционную смесь нагревали при 60°С в течение 3 часов, затем выливали в 200 мл воды и экстрагировали метиленхлоридом (3×100 мл). Объединенные метиленхлоридные экстракты промывали водой (100 мл), насыщенным водным раствором хлорида натрия (100 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме на роторном испарителе. Сырой продукт очищали флэш-хроматографией на силикагеле, элюирование с градиентом из 100% гексана до 100% этилацетата в течение 20 минут давало масло желтого цвета, которое кристаллизовалось при стоянии (0,38 г, 35%): т. пл. 80-81°С;
1Н ЯМР (400 МГц, CDCl3) δ 9,12(д, J=1,9 Гц, 1Н), 8,72(дд J=4,8, 1,4 Гц, 1Н), 8,22(ддд, J=8,0, 2,2, 1,8 Гц, 1Н), 7,43(ддд, J=8,0, 4,8, 0,6 Гц, 1H), 4,03-3,80(м, 1H), 3,80-3,59(м, 1Н), 2,97-2,68(м, 2H), 2,60-2,39(м, 1H), 2,03(c, 3H), 1,30-1,16(м, 6H); 13Н ЯМР (101 МГц, ДМСО-d6) δ 175,66, 162,63, 151,89, 147,14, 138,19, 133,49, 133,23, 128,58, 123,90, 44,81, 38,94, 37,93, 18,16, 16,83 12,90.
1. Способ, включающий:
(i) циклизацию соединения (I) с соединением (II) для получения соединения (III);
в которой
(А) каждый R1 представляет собой Н или (C1-C6)алкил;
(В) R2 представляет собой незамещенный (C1-C6)алкил и
(С) R3 представляет собой Н,
где стадию а проводят в полярном протонном растворителе.
2. Способ по п.1, в котором указанный полярный протонный растворитель стадии а выбран из группы, состоящей из н-бутанола, изопропанола, н-пропанола, этанола, метанола, уксусной кислоты, воды или их смеси.
3. Способ по п.2, в котором указанный полярный протонный растворитель представляет собой метанол.
4. Способ по п.1, 2 или 3, причем указанный способ дополнительно включает галогенирование указанного R3 до F, Cl, Br или I,
в котором указанное галогенирование проводят в полярном растворителе и указанное галогенирование проводят при температуре от 0°С до температуры окружающей среды.
5. Способ по п.4, в котором указанное галогенирование проводят в полярном растворителе, выбранном из группы, состоящей из дихлорметана, тетрагидрофурана, этилацетата, ацетона, диметилформамида, ацетонитрила и диметилсульфоксида.
6. Способ по п.5, в котором указанный растворитель представляет собой дихлорметан.
7. Способ по п.6, где R3 представляет собой Cl.
8. Способ по п.1, где R2 представляет собой метил.