Средство для профилактики и лечения язвенного колита
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности, медицине, ветеринарии, фармакологии и представляет собой средство, обладающее противовоспалительной и антибактериальной активностями с пробиотическим эффектом, предотвращающее развитие язвенного поражения слизистой нисходящего отдела толстой кишки, системного действия на основе комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином с количественным содержанием ионов цинка 8,8-9,2%, воска коры лиственницы сибирской и Гмелина, вазелинового масла и диметилсульфоксида. Изобретение позволяет создать фармацевтическую композицию в виде мягкой лекарственной формы для наружного применения системного действия, представляющую собой гидрофобную ректальную мазь для профилактики и лечения язвенного колита, причем использование комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином с количественным содержанием ионов цинка 8,8-9,2% позволяет достичь высокой антиоксидантной и противомикробной активности. 2 н. и 1 з.п. ф-лы, 8 ил., 3 табл., 5 пр.
Реферат
Изобретение относится к химико-фармацевтической промышленности, медицине, ветеринарии, фармакологии и касается средства для профилактики и лечения язвенного колита, в котором для закрытия язвенного дефекта слизистой толстого кишечника используется фармацевтическая композиция в виде мягкой лекарственной формы для наружного применения системного действия, представляющая собой гидрофобную ректальную мазь, обладающую противовоспалительной и протекторной активностями с пробиотическим эффектом.
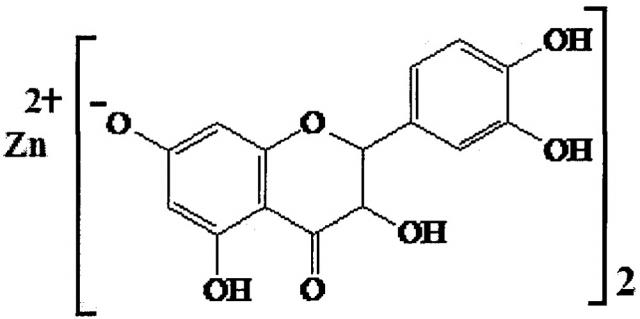
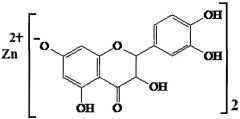
Основными действующими компонентами фармацевтической композиции являются продукты комплексной переработки биомассы лиственницы: лиственничный воск коры (ТУ ОП 9154-004-03533719-2001), а также цинксодержащее производное флавоноида дигидрокверцетина, представляющее собой комплексное соединение цинка с транс-(+)-2R3R дигидрокверцетином, с количественным содержанием ионов цинка 8,8-9,2% (Трофимова Н.Н., Бабкин В.А., Столповская Е.В. // Патент РФ №2553428, МПК А61K 31/352, А61K 33/06, А61K 33/20, А61K 33/34 от 10.06.2015; Трофимова Н.Н., Бабкин В.А., Вакульская Т.И., Чупарина Е.В. Синтез и установление строения комплексов и солей дигидрокверцетина с цинком, медью (II) и кальцием в водных растворах // Химия растительного сырья. - 2012. - №2. - С. 51-62), формулой:
Язвенный колит - это заболевание, характеризующееся диффузным воспалением в слизистой толстой кишки, часто с изменением периодов обострения и ремиссии (Ruxi L.V., Weiguang Qiao, Zhiyong Wu, Yinjun Wang, Shixue Dai, Qiang Liu, Xuebao Zheng Tumor Necrosis Factor Alpha Blocking Agents as Treatment for Ulcerative Colitis Intolerant or Refractory to Conventional Medical Therapy: A Meta-Analysis. // PLOS ONE. January 2014, Volume 9, Issue 1). Как известно, это заболевание более характерно для западных стран. Однако за последние 20 лет отмечается устойчивая тенденция к увеличению заболеваемости язвенным колитом не только среди европейской, но и тихо-азиатской части населения (Ouyang Q., Tandon R., Goh K.L., Pan G.Z., Fock K.M., Fiocchi C., Lam S.K., Xiao S.D. Management consensus of inflammatory bowel disease for the Asia-Pacific region. // J Gastroenterol Hepatol 2006, 21 (12): 1772-1782.; Ooi C.J., Fock K.M., Makharia G.K., Goh K.L., Ling K.L., Hilmi I., Lim W.C., Kelvin Т., Gibson P.R., Gearry R.B., et al: The Asia-Pacific consensus on ulcerative colitis. // J Gastroenterol Hepatol 2010, 25 (3): 453-468).
Распространенность язвенного колита среди населения составляет около 80 больных на 100000 жителей с устойчивой тенденцией к увеличению показателя на 5-20 случаев в год, что связано не только с истинным приростом, но и улучшением выявления данного заболевания (Molodecky N.A., Soon I.S., Rabi D.M., Ghali W.A., Ferris M., Chernoff G., Benchimol E.I., Panaccione R., Ghosh S., Barkema H.W., et al: Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. // Gastroenterology 2012, 142 (1): 46-54). Более 50% больных имеют возраст 20-40 лет, средний возраст в момент возникновения болезни составляет 29 лет. Наивысшие показатели смертности отмечаются в течение первого года болезни, вследствие случаев крайне тяжелого молниеносного течения заболевания и через 10 лет после его начала из-за развития колоректального рака. Заболевание чаще всего в равной степени поражает как мужчин, так и женщин трудоспособного возраста (Asakura K., Nishiwaki Y., Inoue N., Hibi Т., Watanabe M., Takebayashi Т.: Prevalence of ulcerative colitis and Crohn's disease in Japan. // J Gastroenterol 2009, 44 (7): 659-665).
Поэтому поиск новых лекарственных средств для профилактики и лечения язвенного колита является актуальной проблемой медицинской и фармацевтической науки.
Среди соединений, использованных в исследованиях по изучению вопроса профилактики и лечения язвенного колита, высокую значимость имеет цинк. Цинк незаменимый нутриент, играющий множественную роль при иммунных ответах (участвует в образовании и активации Т- и В-лимфоцитов), включая противовоспалительные эффекты. В основе механизма противомикробного действия соединений цинка лежит коагуляция белков микроорганизмов. Цинк также является ростовым кофактором, антиапоптическим и цитопротективным антиоксидантом. Эпидемиологическими исследованиями была выявлена связь между понижением концентрации цинка в крови и повышением риска развития сепсиса и рака (Besecker B.Y., Exline М.С., Hollyfield J., Phillips G., Disilvestro R.A., Wewers M.D., Knoell D.L. A comparison of zinc metabolism, inflammation, and disease severity in critically ill infected and noninfected adults early after intensive care unit admission. // Am. J. Clin. Nutr., 2011, 93, 1356-1364.). Кроме того, известно, что у крыс, имеющих дефицит цинка, повышена способность к развитию острого воспалительного ответа в печени в ответ на липополисахаридную стимуляцию. Цинк обладает потенциальным протекторным действием при развитии некоторых состояний, что подтверждено результатами исследований (Maret W. and Sandstead Н.Н. Zinc requirements and the risks and benefits of zinc supplementation. // J. Trace Elem. Med. Biol., 2006, 20, 3-18).
Как известно, у пациентов с язвенным колитом имеется дефицит цинка. В экспериментальных работах установлено, что эндогенный дефицит цинка не влияет на барьерную функцию кишечника, не влияет на пролиферацию эпителиальных клеток кишечника, однако опосредованно через изменения выработки цитокинов (в частности ФНО-α через NF-kB) и как сигнальная внутриклеточная молекула активирует иммунитет и влияет на выраженность воспалительного процесса (Prasad A.S., Clinical, immunological, anti-inflammatory and antioxidant roles of zinc. Exp. Gerontol., 2008, 43, 370-377), (Hitoshi Iwaya, Munenori Kashiwaya, Aki Shinoki, Jae-Sung Lee, Kumiko Hayashi, Hiroshi Hara and Satoshi Ishizuka. Marginal Zinc Deficiency Exacerbates Experimental Colitis Induced by Dextran Sulfate Sodium in Rats. // The Journal of Nutrition and Disease, 2011, vol. 141 N. 6, 1077-1082).
На сегодняшний день из соединений цинка в медицинской практике нашли применение препараты на основе цинка сульфата и цинка оксида. До недавнего времени они использовались преимущественно наружно в качестве антисептических, вяжущих и противовоспалительных и ранозаживляющих средств (в виде растворов, капель, примочек, суспензий, мазей и присыпок). В последние годы данные препараты стали привлекать внимание как средства не только местного, но и системного действия, влияющие на метаболические и иммунные процессы.
Так, на фармацевтическом рынке России лекарственные средства, содержащие соединения цинка и обладающие системным ранозаживляющим действием на слизистую оболочку толстого кишечника, представлены суппозиториями ректальными отечественного производства: «Анузол» (ОАО "Нижфарм" (г. Нижний Новгород) и ОАО "Биосинтез" (г. Пенза)); «Нео-Анузол» и «Ректобелол» (ОАО "Дальхимфарм" (г. Хабаровск)); «Анестезол» (ОАО "Нижфарм" (г. Нижний Новгород)), а также импортного производства: «Релиф Ультра» (Институт де Ангели С.р.Л. Италия и Сагмел Инк., США).
Небольшой ассортимент данной фармакологической группы лекарственных средств и недостаточная их активность при лечении язвенного колита обосновывает необходимость разработки более эффективных препаратов на основе соединений цинка, что и является задачей данного изобретения.
Техническим результатом настоящего изобретения является создание оригинального средства - фармацевтической композиции в виде мягкой лекарственной формы для наружного применения системного действия, представляющей собой гидрофобную ректальную мазь для профилактики и лечения язвенного колита.
Указанный технический результат достигается тем, что средство для профилактики и лечения язвенного колита, содержащее в качестве действующих фармакологически активных компонентов: комплексное соединение цинка с транс-(+)-2R3R дигидрокверцетином с количественным содержанием ионов цинка 8,8-9,2% (Патент РФ №2553428), а также воск коры лиственницы сибирской и Гмелина, который является еще и структурообразователем гидрофобной основы, в которую дополнительно входит вазелиновое масло и диметилсульфоксид, при следующем соотношении компонентов, мас. %:
| Комплексное соединение цинка | |
| с транс-(+)-2R3R дигидрокверцетином | 1,0-2,0 |
| Воск коры лиственницы сибирской и Гмелина | 39,5-40,5 |
| Вазелиновое масло | 39,5-40,5 |
| Диметилсульфоксид | до 100,0 |
Все дополнительные компоненты гидрофобной основы разрешены для медицинского применения.
Технический результат разработанной фармацевтической композиции достигается использованием комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином, в котором количественное содержание ионов цинка составляет 8,8-9,2% (Патент РФ №2553428 от 10.06.2015), за счет чего композиция приобретает высокую антиоксидантную и противомикробную активности, а воск коры лиственницы сибирской и Гмелина придает ей дополнительно противовоспалительную и ранозаживляющую активности (Костыро Я.А., Даваа В.В., Гоголь Е.С., Лепехова С.А., Гольдберг О.А., Бабкин В.А., Трофимова Н.Н. // Патент РФ №2582984 от 27.04.2016, МПК А61K 36/15, А61Р 17/02, А61Р 17/14).
Изучение фармакологической активности разработанного средства на основе комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином и воска коры лиственницы сибирской и Гмелина проводили на модели индуцированного язвенного колита (Ким А.Д., Григорьев Е.Г., Гольдберг О.А., Лепехова С.А., Чашкова Е.Ю., Коваль Е.В., Фадеева Т.В., Зарицкая Л.В. // Патент РФ 2604044 «Способ моделирования язвенного колита» от 10.12.2016, МПК G09B 23/28).
Экспериментальное исследование выполнено на базе вивария ФГБНУ «ИНЦХТ» (виварий I категории, вет. удостоверение 238 №0015220 от 25 марта 2009 г, служба ветеринарии Иркутской области) на 60-ти крысах линии Wistar массой 280-350 гр. Возраст животных был более 6 месяцев. Животные содержались в условиях вивария при свободном доступе к воде и пище соответственно нормативам ГОСТа «Содержание экспериментальных животных в питомниках НИИ».
Эксперименты выполнялись в соответствии с нормами гуманного обращения с животными, которые регламентированы «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. №755) и №48 от 23.01.85 г. «О контроле за проведением работ с использованием экспериментальных животных», а также основывались на положениях Хельсинской Декларации Всемирной Медицинской Ассоциации от 1964 г., дополненной в 1975, 1983 и 1989 гг.), согласно протоколу, одобренному Комитетом по биомедицинской этике.
При моделировании язвенного колита экспериментальным животным ежедневно превентивно ректально вводили исследуемую фармацевтическую композицию в виде ректальной мази, в качестве препарата сравнения были использованы ректальные суппозитории «Анузол» производства ОАО "Нижфарм", содержащие цинка сульфат (50 мг/суппозиторий).
Лечебный эффект исследуемой фармацевтической композиции и препарата сравнения оценивался на 3, 7 и 10 сутки эксперимента по результатам общеклинического наблюдения за животными (поведение животных, вес до и после), лабораторных данных (общий анализ крови, оценка фагоцитарной системы крови), гистологического исследования препаратов толстой кишки, бактериологического исследования качественного и количественного состава пристеночной микрофлоры толстой кишки.
Изобретение иллюстрируется следующими чертежами.
Фиг. 1. Стенка толстой кишки на 3 сутки эксперимента (экспериментальная группа), митотическая активность в клетках крипт.
Фиг. 2. Стенка толстой кишки на 7 сутки эксперимента (контрольная группа), острая язва.
Фиг. 3. Стенка толстой кишки на 7 сутки эксперимента (контрольная группа), васкулит в стенке язвенного дефекта слизистой.
Фиг. 4. Стенка толстой кишки на 10 сутки эксперимента (экспериментальная группа), продуктивное воспаление в брыжейке кишки.
Фиг. 5. Стенка толстой кишки на 7 сутки эксперимента (экспериментальная группа), васкулит в сосудах брыжейки толстой кишки.
Фиг. 6. Язвенный дефект слизистой толстой кишки на 10 сутки эксперимента в контрольной группе животных (макропрепарат).
Фиг. 7. Стенка толстой кишки на 10 сутки эксперимента (контрольная группа), прогрессия язвенного дефекта с пенетрацией в брыжейку.
Фиг. 8. Стенка толстой кишки на 10 сутки эксперимента (группа препарата сравнения), заживший язвенный дефект.
Следующие примеры иллюстрируют изобретение.
Пример 1.
1,5 г Комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином растворяли в 15 мл диметилсульфоксида, полученный раствор вносили при постоянном перемешивании в подогретую на водяной бане фарфоровую чашку (при температуре не выше 40°С), содержащую 82 г сплава лиственничного воска и вазелинового масла (1:1). Полученную смесь охлаждали. Гомогенизацию продукта осуществляли до получения однородной по консистенции мази желтого цвета.
Пример 2. Иммуномодулирующая активность.
Иммуномодулирующую активность исследуемой фармацевтической композиции в экспериментальной группе животных оценивали по показателям фагоцитарной системы их крови. Фагоцитарный индекс (ФИ) - это процент фагоцитов, поглотивших бактерии через 30 и 120 мин, к общему количеству просмотренных клеток. Фагоцитарное число (ФЧ) - количество частиц, поглощенное одним фагоцитом. НСТ (нитросиний тетразоль) спонтанный (НСТ сп.) - метаболический потенциал покоящихся фагоцитирующих клеток крови. НСТ индуцированный (НСТ инд.) - метаболический потенциал фагоцитирующих клеток при стимуляции. ЦИК-комплексы, состоящие из антигена, антитела и связанных с ними компонентов комплемента С3, С4, C1q (Лабораторные методы исследования в клинике: Справочник // Под ред. В.В. Меньшикова. М., 1987. С. 310-311).
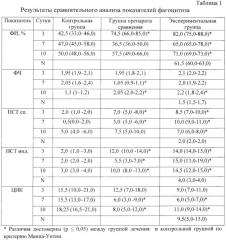
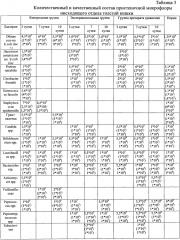
Результаты представлены в таблице 1.
Выявлено, что фагоцитарный индекс в экспериментальной группе животных на 3 сутки в среднем составил 83%, что в 2 раза превышало данный показатель в группе контроля. В группе сравнения данный показатель составил 74,5%, что существенно ниже, чем в экспериментальной группе. Имелись достоверно значимые различия в показателях тестов с НСТ. В экспериментальной группе животных показатель НСТ сп. превышал таковой в контрольной группе в 4 раза. Имелись достоверные различия при сравнении показателей НСТ инд., в экспериментальной группе данный показатель был достоверно выше, чем в группе контроля и группе сравнения (рU≤0,05). При этом в группе контроля соотношение между НСТ сп. и НСТ инд. составляло менее минимального значения (1,5 раза), в то время как в группах лечения нормальное соотношение было сохранно, что означает развитие физиологического воспалительного процесса в организме подопытных животных групп лечения (табл. 1). Эти данные указывают на иммуномодулирующие свойства препарата «Анузол» и фармацевтической композиции на основе цинксодержащего металлокомплексного производного дигидрокверцетина - комплексное соединение цинка с транс-(+)-2R3R дигидрокверцетином и лиственничного воска.
Кроме этого было выявлено, что фагоцитарный индекс (ФИ) в группах животных, получавших лечение, достоверно превышал аналогичный показатель в контрольной группе, что в совокупности с достоверным различием в показателях как индуцированного, так и спонтанного НСТ (pU≤0,05) указывало на сохранность иммунной системы на фоне применения исследуемых препаратов на 3 сутки лечения.
На 7 сутки лечения имелись достоверные различия в показателях НСТ между группой контроля и группами лечения. Между группой препарата сравнения и экспериментальной группой имелось достоверное различие в показателях фагоцитарного числа (ФЧ), НСТ сп., НСТ инд. Данные показатели были выше в экспериментальной группе, кроме этого сохранялось нормальное соотношение НСТ сп. к НСТ инд., что отражало более высокую фагоцитарную активность, сохраняющуюся к 7 суткам, на фоне применения разработанной фармацевтической композиции. К 7 суткам в группе препарата сравнения нормального соотношения между показателями НСТ не наблюдалось. Кроме этого, отмечался низкий показатель ФИ, достоверно отличающийся от таковых у экспериментальной группы и контроля (рU≤0,05).
На 10 сутки имелись различия между группами лечения и контрольной группой, показатели фагоцитоза были достоверно выше в группах лечения, показатель ЦИК был выше в контрольной группе, что указывало на иммуномодулирующие свойства препаратов. Показатель ФЧ в экспериментальной группе был существенно выше, чем в группе контроля (pU=0,002).
Таким образом, нами выявлено, что фармацевтическая композиция на основе комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином и лиственничного воска стимулирует фагоцитоз.
Пример 3.
Противовоспалительная активность.
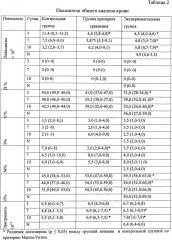
Противовоспалительную активность оценивали по результатам общеклинического наблюдения за животными (поведение животных, вес до и после) и данных общего анализа крови. Результаты представлены в таблице 2.
На 3 сутки эксперимента средняя потеря веса лабораторными животными в экспериментальной группе составила 23 г, в группе препарата сравнения 48 г, что превышает показатель потери веса в контрольной группе животных (12 г). В общем анализе были выявлены различия в показателях лейкоцитов и моноцитов между группами контроля и препарата сравнения, показателей лейкоцитов, сегментоядерных нейтрофилов и лимфоцитов между экспериментальной группой и контролем, в показателе моноцитов между экспериментальной группой и группой препарата сравнения (рU≤0,05). Таким образом, на 3 сутки действие исследуемых препаратов проявлялось снижением интенсивности воспалительного процесса.
На 7 сутки в экспериментальной группе животных была выявлена прибавка в весе в среднем на 11,6 г, в то время как в контрольной группе потеря веса животными составила в среднем 25 г, в группе препарата сравнения 15 г.
На 7 сутки имелось достоверное различие в уровне эритроцитов, между контрольной группой и группами лечения животных, что указывало на наличие более активного воспалительного процесса в контрольной группе с потерей крови. Имелись достоверные различия в показателях лейкоцитов, сегментоядерных нейтрофилов и лимфоцитов между экспериментальной группой и контролем, что также указывало на менее интенсивный воспалительный процесс в экспериментальной группе. Между группами лечения имелась разница в показателе моноцитов (рU≤0,05).
На 10 сутки потеря массы подопытных животных в экспериментальной группе составила в среднем 48 г, в группе препарата сравнения 97 г, в контроле данный показатель составил в среднем 68 г. В показателях лейкоцитов на 10 сутки наиболее благоприятная картина сохранялась в экспериментальной группе, что отражалось в менее значимом увеличении количества лейкоцитов, снижении показателя сегментоядерных нейтрофилов. Кроме того, в экспериментальной группе был наиболее высокий показатель эритроцитов, что может указывать на стимулирующий эффект препарата.
Таким образом, выявлено, что исследуемая фармацевтическая композиция на основе комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином и лиственничного воска ограничивает воспаление с существенным снижением количества лейкоцитов и сегментоядерных нейтрофилов, сохраняет неспецифическую резистентность организма.
Пример 4.
Антимикробная активность.
Антимикробную активность оценивали бактериологическим исследованием качественного и количественного состава пристеночной микрофлоры толстой кишки (ОСТ 91500.11.0004 - 2003. Протокол ведения больных. Дисбактериоз кишечника. Приказ МЗ РФ №231 от 09.06.2003). Результаты представлены в таблице 3.
По результатам бактериологического исследования животных контрольной группы на 3 сутки эксперимента: среднее общее кол-во E.coli 3,7*105.. В двух наблюдениях имелись лактоз «-», составляющие 50% от общего числа кишечной палочки. Средняя концентрация Bifidobacter 3,3*109, Proteus 5,5*106, Citobacter 4*105, Candida 4*103, Lactobacillus 7*105, (N=3); Bacteroides 3,7*106, Peptococcus spp. 1*107, Peptostreptococcus spp. 1*106 (N=2).
В группе препарата сравнения на 3 сутки 98,8% микрофлоры составляли бифидобактерии.
При расчете процентного содержания общей численности пристеночной микрофлоры толстой кишки крыс на 3 сутки лечения исследуемой фармацевтической композицией установлено, что 98,52% микрофлоры составляли бифидобактерии, менее 2% остальные бактерии.
По сравнению с нормой в экспериментальной группе на 3 сутки отмечалось:
1. Уменьшение общей численности микрофлоры в 2,5 раза.
2. Резкое преобладание бифидобактерий (98,52%), в то время как в нормальной флоре кишечника преобладающей флорой являлись лактобактерии (48,73%) и бактероиды (31,67%).
3. Резкое уменьшение концентрации лактобактерий (с 4*109 до 2*105), бактероидов (с 2,6*109 до 2,2*107), пептококков (с 1,2*109 до 2*107).
4. Отсутствие грамположительной палочки, энтерококков.
5. Появление пептострептококков.
По сравнению с контрольной группой животных отмечалось:
1. Снижение концентрации общей численности микрофлоры практически в 1,5 раза.
2. Резкое преобладание бифидобактерий (98,52% против 49,83%).
3. Снижение концентрации и абсолютного количества лактобактерий (в контрольной группе лактобактерии выявлены в 6 наблюдениях в средней концентрации 108, в экспериментальной группе - в 3 наблюдениях в средней концентрации 105).
4. Снижение концентрации кишечной палочки в экспериментальной группе в 10 раз, в контроле в 1000 раз по сравнению с нормой.
Таким образом, ежедневное введение в прямую кишку исследуемой фармацевтической композиции к 3 суткам позволяло сохранить преобладание нормофлоры толстой кишки (пробиотическое действие) и стимулировало увеличение количества бифидобактерий.
На 7 сутки в экспериментальной группе превалирующим в содержании микрофлоры являлись бифидо- и лактобактерии (по 49,92%). Содержание остальной микрофлоры составило менее 1%. В группе сравнения практически 50% составляли бифидобактерии, 33,2% пептококки и 16,6% пептострептококки.
В отличие от контрольной группы в экспериментальной группе отмечалось:
1. Более высокое процентное содержание бифидо- и лактобактерий. В контрольной группе лактобактерии и бифидобактерии составляли по 30%.
2. Отсутствие вейлонелл.
3. Общая численность микрофлоры превосходила аналогичный показатель в контрольной группе в 474 раза.
На 10 сутки в экспериментальной группе в процентном соотношении превалирующей флорой оставались бифидо- и лактобактерии, составлявшие по 47,597%. Появлялись пептококки 2,49%, увеличивалось содержание пептострептококков с 0,03 до 1,3%. В группе препарата сравнения превалирующей микрофлорой оставались бифидобактерии, составлявшие 63,25%, 30% составляли пептострептококки.
По сравнению с контролем у экспериментальной группы животных имелись следующие отличия:
1. Общее количество микрофлоры превосходило показатель контрольной группы в 368 раз.
2. Основную часть микрофлоры составляли бифидо- и лактобактерии, в то время как в контрольной группе на данные сроки 54,3% составляли бактероиды и пептококки.
Таким образом, выявлено, что применение исследуемой фармацевтической композиции на основе комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином и лиственничного воска увеличивает и поддерживает высокое процентное содержание пристеночного количества бифидо- и лактобактерий с 7 по 10 сутки эксперимента, предотвращает появление выраженного дисбактериоза, проявлявшегося появлением вейлонелл.
Пример 5.
Стимуляции регенерации.
Для гистологической оценки фармакологической активности фрагменты биоптатов толстой кишки вскрывали вдоль стенки, фиксировали иглами к плотному картону и помещали в 10% раствор формалина. Срезы после депарафинизации окрашивали гематоксилином и эозином. Оценку гистологического исследования выполняли методом световой микроскопии (Меркулов Г.А. Курс патологогистологической техники. - Л.: Медицина, 1969. - 422 с.).
На 3 сутки эксперимента в стенке толстого кишечника во всех группах развивалось:
1. Воспаление с вовлечением всех слоев и умеренной инфильтрацией стромы лейкоцитами.
2. В слизистой формировались очаги «выпадения» крипт, выпадение миоцитов мышечных слоев.
3. Выявлялась митотическая активность в клетках эпителия крипт (фиг. 1).
По результатам гистологического исследования в контрольной группе животных на 7 сутки получено развитие глубоких эрозий и острых язв с эпителизацией, продуктивным воспалением в стенке толстой кишки и ее брыжейке, отеком подслизистого слоя (фиг. 2). Кроме этого отмечалось развитие васкулита в стенке язвенного дефекта слизистой с плазматическим пропитыванием (фибриноидный некроз) стенок сосудов с утолщением интимы, в том числе и в микроциркуляторном русле (фиг. 3).
При этом в экспериментальной группе животных язвенных дефектов выявлено не было, однако отмечалось развитие продуктивного воспаления в брыжейке кишки (фиг. 4) и признаки васкулита в сосудах брыжейки толстой кишки (фиг. 5).
По результатам гистологического исследования выявлено, что в контрольной группе животных на 10 сутки имелась прогрессия язвенного дефекта с пенетрацией в брыжейку и с участками эпителизации по краям язвенного дефекта, в криптах которых прослеживались явления регенерации (фиг. 6 и 7).
На поверхности язвенного дефекта имелся ядерный детрит и фибрин, что является показателем экссудативного воспаления при продуктивном воспалении в подлежащей ткани. Также сохранялся васкулит в сосудах стенки толстой киши с пролиферацией эндотелия.
В группе препарата сравнения на 10 сутки был выявлен заживший язвенный дефект (фиг. 8). В экспериментальной группе на 10 сутки развития язвенных поражений на слизистой толстой кишки выявлено не было, однако сохранялись признаки васкулита.
Таким образом, выявлено, что применение исследуемой фармацевтической композиции на основе комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином и лиственничного воска предотвращает развитие индуцированного язвенного поражения слизистой нисходящего отдела толстой кишки к 10-м суткам эксперимента.
Таким образом, в результате изучения фармакологической активности исследуемой фармацевтической композиции на основе комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином и лиственничного воска были показаны ее иммунномодулирующие свойства, что имеет отражение в меньшей потере веса лабораторными животными, ограничивает воспаление с существенным снижением количества лейкоцитов и сегментоядерных нейтрофилов, стимулирует фагоцитоз, сохраняет неспецифическую резистентность организма.
Кроме этого, исследуемая фармацевтическая композиция обладает протективными и репаративными свойствами, о чем свидетельствуют данные гистологических исследований (предотвращает развитие индуцированного язвенного поражения слизистой нисходящего отдела толстой кишки к 10-м суткам эксперимента в отличие от животных групп препарата сравнения и контроля), а также стабильные показатели количества эритроцитов в экспериментальной группе животных, т.е. отсутствие потери крови через поврежденную слизистую толстой кишки.
Показано, что исследуемая фармацевтическая композиция по результатам бактериологического исследования оказывает благотворное влияние на количественный и качественный состав пристеночной микрофлоры толстой кишки в условиях индукции язвенного поражения слизистой оболочки, предотвращает появление выраженного дисбактериоза, выявленного в группе контроля.
1. Средство, обладающее противовоспалительной и антибактериальной активностями с пробиотическим эффектом, предотвращающее развитие язвенного поражения слизистой нисходящего отдела толстой кишки, системного действия на основе комплексного соединения цинка с транс-(+)-2R3R дигидрокверцетином с количественным содержанием ионов цинка 8,8-9,2%, выполненное в виде гидрофобной мази, дополнительно включающее воск коры лиственницы сибирской и Гмелина, а также содержащее в качестве пластификатора вазелиновое масло, а в качестве пенетратора – диметилсульфоксид, при следующем соотношении компонентов, мас. %:
| Комплексное соединение цинка с | |
| транс-(+)-2R3R дигидрокверцетином | 1,0-2,0 |
| Воск коры лиственницы сибирской и Гмелина | 39,5-40,5 |
| Вазелиновое масло | 39,5-40,5 |
| Диметилсульфоксид | до 100,0 |
2. Средство по п. 1, отличающееся тем, что оно выполнено в виде мягкой лекарственной формы, приемлемой для наружного применения в качестве ректальной мази.
3. Применение средства по п. 1 для профилактики и лечения язвенного колита у нуждающегося субъекта.