Средство для снижения функциональной активности и экспрессии гликопротеина-р
Иллюстрации
Показать всеИзобретение относится к фармакологии и медицине, а именно к неврологии и онкологии. Предложено применение афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) в качестве средства для снижения функциональной активности и экспрессии гликопротеина-Р. Техническим результатом изобретения является расширение арсенала средств, обладающих способностью ингибировать функциональную активность и экспрессию гликопротеина-Р для повышения эффективности фармакотерапии патологий ЦНС и онкологических заболеваний лекарственными веществами-субстратами данного белка-транспортера; средств, пригодных для прогнозирования принадлежности лекарственных препаратов к субстратам мембранного белка-транспортера гликопротеина-Р, и средств, применяемых в качестве положительного контроля пониженной активности гликопротеина-Р при поиске веществ аналогичного действия. В связи с низкой токсичностью и экономической доступностью афобазола его применение с целью ингибирования гликопротеина-Р является рациональным и безопасным, позволяет повысить эффективность терапии без риска усиления токсичности и имеет дополнительные преимущества, обусловленные анксиолитическим и нейропротекторным действиями препарата. 2 табл.
Реферат
Изобретение относится к медицине, а именно к фармакологии, клинической фармакологии, неврологии и онкологии, и предназначено для повышения эффективности фармакотерапии заболеваний центральной нервной системы и онкологических заболеваний лекарственными веществами-субстратами гликопротеина-Р (Pgp), прогнозирования возможной принадлежности изучаемых лекарственных препаратов к субстратам мембранного белка-транспортера гликопротеина-Р, использования афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола) в качестве положительного контроля пониженной активности Pgp при поиске веществ аналогичного действия.
Гликопротеин-Р (Pgp) является мембранным белком-транспортером, который использует энергию макроэргических связей АТФ для эффлюкса из клеток, различных по химической структуре эндо- и ксенобиотиков, среди которых большое число современных лекарственных средств. Pgp экспрессируется эпителиоцитами слизистой оболочки тонкого кишечника и проксимальных канальцев нефронов, гепатоцитами и эндотелиоцитами гистогематических барьеров. Транспортер ограничивает энтеральную абсорбцию лекарственных веществ, являющихся его субстратами в кишечнике, участвует в процессах их распределения и способствует их экскреции в желчь и мочу. Таким образом, от функциональной активности данного белка-транспортера зависит фармакокинетика лекарственных веществ-субстратов Pgp, а значит эффективность и безопасность фармакотерапии [F. Montanari, G.F. Ecker. Prediction of drug-ABC-transporter interaction - Recent advances and future challenges. // Adv. Drug. Rev. - 2015. - Vol. 86. - P. 17-26; Метаболизм лекарственных средств. Научные основы персонализованной медицины: руководство для врачей / В.Г. Кукес [и др.]. - М.: ГЭОТАР-Медиа, 2008. - 304 с.].
Pgp кодируется генами MDR (multidrug resistance gene), которые включают у человека два гена - MDR1 и MDR2. Ген MDR1 вовлечен в механизмы развития лекарственной устойчивости [Localization of the human multiple drug resistance gene, MDR1, to 7q21.1 / D.F. Callen [et al.] // Hum Genet. - 1987. - Vol. 77. - P. 142-144]. Pgp придается основное значение в формировании множественной резистентности опухолей к химиотерапии за счет эффлюкса лекарственных веществ из опухолевых клеток.
Известно, что в настоящее время для определения локализации Pgp в организме, а также обнаружения его потенциальных субстратов в качестве ингибиторов белка-транспортера предложено значительное количество веществ, таких как, верапамил, циклоспорин, кетоконазол, тариквидар, хинидин и др. [K.K. Machavaram, J. Gundu, M.R. Yamsani. Effect of ketoconazole and rifampicin on the pharmacokinetics of ranitidine in healthy human volunteers: a possible role of P-glycoprotein // Drug Metabol. Drug Interact. - 2006. - Vol. 22, №1. - P. 47-65; E. Fox, S.E. Bates Tariquidar (XR9576): a P-glycoprotein drug efflux pump inhibitor // Expert Rev. Anticancer Ther. - 2007. - Vol. 7, №4. - P. 447-459].
Известно применение верапамила в дозе 9 мг/кг в качестве средства ингибирования функциональной активности Pgp в эксперименте на кроликах для анализа участия данного белка-транспортера в фармакокинетике омепразола [Involvement of cytochrome Р450 3А4 and P-glycoprotein in first-pass intestinal extraction of omeprazole in rabbits / H.M. Fang [et al.] // Act. Pharmacologica Sinica. - 2009. - Vol. 30. - P. 1566-1572]. Однако верапамил оказывает существенное влияние на сердечно-сосудистую систему: снижает частоту сердечных сокращений и атриовентрикулярную проводимость, обладает гипотензивным действием. Таким образом, возможность использования верапамила у людей ограничено выраженными системными эффектами, поэтому данный препарат можно использовать лишь по строгим показаниям.
Известно использование тариквидара для селективного ингибирования функциональной активности Pgp в гематоэнцефалическом барьере. Указанное вещество применялось на культурах клеток с повышенной экспрессией генов MDR1 (человеческого) и mdrla (мышиного) [(R)-[(11)C] verapamil is selectively transported by murine and human P-glycoprotein at the blood-brain barrier, and not by MRP1 and BCRP / K. Romermann [et al.] // Nucl Med Biol. - 2013. - Vol. 40, №7. - P. 873-878], кодирующих данный белок-транспортер и на крысах wistar Unilever в дозе 15 мг/кг с последующей оценкой проницаемости гематоэнцефалического барьера для субстратов белка-транспортера методом позитронно-эмиссионной томографии [Tariquidar-induced P-glycoprotein inhibition at the rat blood-brain barrier studied with (R)-11C-verapamil and PET / J.P. Bankstahl [et al.] // J. Nucl. Med. - 2008. - Vol. 49. - P. 1328-1335]. Однако тариквидар является дорогостоящим веществом зарубежного производства, не зарегистрированным в качестве лекарственного средства в Российской Федерации, что не позволяет применять его на людях для повышения эффективности фармакотерапии заболеваний головного мозга препаратами-субстратами Pgp.
Известно применение циклоспорина в качестве средства для ингибирования функциональной активности Pgp, например, при оценке распределения, фармакокинетики и метаболизма его субстрата глибенкламида [Effects of Selected ОАТР and/or ABC Transporter Inhibitors on the Brain and Whole-Body Distribution of Glyburide / N. Tournier [et al.] // AAPS J. - 2013. - Vol. 15, №4. - P. 1082-1090]. В другом исследовании, выполненном на ВИЧ-инфицированных взрослых добровольцах было установлено, что циклоспорин в дозе 4 мг/кг ингибирует Pgp Т-лимфоцитов крови [Oral cyclosporin A inhibits CD4 Т cell P-glycoprotein activity in HIV-infected adults initiating treatment with nucleoside reverse transcriptase inhibitors / T. Hulgan [et al.] // J. Clin. Pharmacol. - 2009. - Vol. 65, №11 - P. 1081-1088], a в дозе 16 мг/кг/день в комплексной терапии антрациклин резистентной миелогенной лейкемии увеличивает продолжительность ремиссии [Benefit of cyclosporine (CsA) modulation of anthracycline resistance in high-risk AML: A Southwest Oncology Group study / A.F. List [et al.] // Blood. - 1998. - Vol. 92 (1). - P. 312а]. Однако циклоспорин является иммуносупрессором, при использовании в терапевтической дозе характеризуется значительной аллергенностью и токсичностью: нежелательным действием на желудочно-кишечный тракт, печень, почки, систему кроветворения, поэтому не может рекомендоваться в качестве ингибитора Pgp [Cyclosporine Nephrotoxicity / By Emmanuel [et al.] // Bennett Seminars in Nephrology. - 2003. - Vol. 23, №5. - Р. 465-476].
Применение кетоконазола в дозе 400 мг один раз в день в течение 4 дней на здоровых добровольцах также может вызывать состояние ингибирования функциональной активности Pgp [Inhibitory effect of ketoconazole on the pharmacokinetics of a multireceptor tyrosine kinase inhibitor BMS-690514 in healthy participants: assessing the mechanism of the interaction with physiologically-based pharmacokinetic simulations / Z. Yang [et al.] // J. Clin Pharmacol. - 2013. - Vol. 53, №2. - Р. 217-227]. Однако значительная гепатотоксичность кетокойазола [Human arylacetamide deacetylase hydrolyzes ketoconazole to trigger hepatocellular toxicity / T. Fukami [et al.] // Biochem Pharmacol. - 2016. - Vol. 116. - P. 153-161] ограничивает применение препарата в качестве ингибитора Pgp.
Продемонстрировано использование синтетического прогестина - линестренола (14-дневный курс перорального введения в дозе 110 мкг/кг однократно в сутки) с целью ингибирования функциональной активности Pgp [Пат. 2553362 Рос. Федерация, G09B 23/28. Способ моделирования состояния ингибирования функциональной активности гликопротеина-Р линестренолом в эксперименте / А.А. Котлярова, Е.Н. Якушева, РязГМУ им. акад. И.П. Павлова. - №2014100531 /15; заявл. 09.01.2014; опубл. 10.06.15, Бюл. №16]. Однако данное вещество является пролекарством гормонального вещества норэтистерона, связывающегося с рецепторами прогестерона. Таким образом, данный препарат может вызывать побочные эффекты, связанные с его гормональным действием.
Способность афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) ингибировать активность Pgp в настоящий момент в научной литературе не описана. Афобазол (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорид) - это оригинальный отечественный селективный анксиолитик с нейропротекторной активностью, предотвращающий стресс-индуцированное падение связывания в бензодиазепиновом участке ГАМКА-рецепторного комплекса, одобренный для клинического применения в РФ в 2005 году. Препарат не обладает характерными для бензодиаземинов гипноседативным, амнестическим и миорелаксантным эффектами, однако по анксиолитическим свойствам им не уступает [С.Б. Середенин, М.В. Воронин. Фармакология нового анксиолитика афобазола. // Экспериментальная и клиническая фармакология. - 2009. - Т. 72, №1. - С. 3-11].
Продемонстрировано отсутствие кумуляции афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) в связи с особенностями химического строения и тканевой доступности. Поэтому данный препарат может назначаться несколько раз в день в течение длительного времени [Фармакокинетическая оценка пролонгированной лекарственной формы афобазола в сравнении с таблетками препарата, выпускаемыми промышленностью / П.О. Бочков [и др.] // Экспериментальная и клиническая фармакология. - 2013. - Т. 76, №11. - С. 33-35].
Применение афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) не сопровождается гипноседативными эффектами (проявляются лишь в дозах, превышающих ED50 для анксиолитического действия более чем в 40 раз). У препарата не выявлены миорелаксантные свойства и отрицательное влияние на показатели внимания и памяти, к нему не формируется лекарственная зависимость и не развивается синдром отмены. Это позволяет отнести афобазол (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорид) к безопасным безрецептурным средствам [А.С. Аведисова. Афобазол - безопасный препарат для лечения тревоги в общей практике. // Русский медицинский журнал. - 2006. - Т. 14, №22. - С. 1-3].
Целью изобретения является поиск средств, обладающих способностью ингибировать функциональную активность и экспрессию Pgp.
Поставленная задача достигается тем, что в качестве ингибитора Pgp выбран безопасный и экономически доступный лекарственный препарат афобазол (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорид).
Для решения поставленной задачи нами выполнено исследование на 17 половозрелых кроликах-самцах породы Шиншилла средней массой 3500-4300 г в соответствии с правилами лабораторной практики (приказ МЗ РФ №199н от 1 апреля 2016 г.).
Животные были разделены на 2 серии: в первой серии (n=7) исследовали влияние афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) на функциональную активность Pgp, во второй (n=10) оценивали влияние тестируемого средства на экспрессию транспортера в печени, почках, тонком кишечнике и головном мозге животных.
В качестве маркерного субстрата Pgp использовали фексофенадин, который не подвергается метаболизму в организме и выводится печенью (90%) и почками данным белком-транспортером. Первая серия животных получала фексофенадин (таблетки, покрытые оболочкой Телфаст, 180 мг, Aventis Pharma, Италия) однократно внутрижелудочно (в/ж) в дозе 67,5 мг/кг [Функциональная активность гликопротеина-Р при экспериментальных манипуляциях. / Е.Н. Якушева [и др.] // Рос. мед.-биол. вестн. им. акад. И.П. Павлова. - 2014. - №2. - С. 74-77] до и после 14-дневного введения им препарата афобазол (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорид) (таблетки Афобазол, 10 мг, ОАО «Фармстандарт-Лексредства», Россия) в дозе 3,8 мг/кг массы в виде 10%-ной суспензии на воде, очищенной 3 раза в день (в/ж) [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Р.У. Хабриев; под общ. ред. чл.-кор. РАМН проф. Р.У. Хабриева. - 2-изд., перераб. и доп. - М.: ОАО Издательство «Медицина», 2005. - С. 48-51]. Следует отметить, что последнее введение афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) осуществлялось за 1 час до введения маркерного субстрата для возможности выявления непосредственного воздействия препарата на молекулу Pgp, но исключения взаимодействия веществ в ЖКТ. Затем забирали у кроликов кровь из краевой вены уха в объеме 5 мл в гепаринизированные пробирки, 10 мин центрифугировали при 3000 об/мин для получения плазмы. В плазме крови определяли концентрацию фексофенадина методом ВЭЖХ на хроматографической системе «Stayer» по методике, описанной ранее [Функциональная активность гликопротеина-Р при экспериментальных манипуляциях. / Е.Н. Якушева [и др.] // Рос. мед.-биол. вестн. им. акад. И.П. Павлова. - 2014. - №2. - С. 74-77].
Животные второй серии были разделены на 2 группы по 5 кроликов в каждой. Первая группа представляла собой интактных животных, которые подвергались эвтаназии методом воздушной эмболии, после чего у них для анализа забирали образцы печени и тонкой кишки и фиксировали ткани в 10%-ном растворе нейтрального формалина. Второй группе животных вводили афобазол (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорид) в дозе 3,8 мг/кг (в/ж) 14-дневным курсом, затем у них также забирались органы для иммуногистохимического исследования.
Гистологический материал подвергался стандартной обработке: обезвоживание в растворах этанола возрастающей концентрации, просветление ксилолом и помещение в парафин. Перед реакцией иммунного окрашивания производили демаскировку антигенов тканей посредством нагревания на водяной бане в 10 мМ цитратном буфере (pH 6,0), блокировали эндогенную пероксидазу 3% раствором пероксида водорода. Затем инкубировали срезы с первичными антителами к Pgp (ABCBl antibody-middle region, Aviva Systems Biology, США) в разведении 1:100 по стандартной методике. Для иммунного окрашивания использовали полимерную систему детекции с пероксидазной меткой («Ventana», США). Ядра клеток докрашивали гематоксилином.
Микропрепарат фотографировали с помощью цифровой камеры «ЛОМО ТС-500» (Россия) при увеличении в 400 раз. В каждом гистологическом препарате оценивали 10 репрезентативных участков (10 фотографий). В дальнейшем изображения анализировали с помощью медицинской программы для анализа и обработки цифровых изображений ImageJ (США). С помощью плагина Colour Deconvolution, имеющего встроенную схему для анализа окраски «гематоксилин + диаминобензидин», изображение разделяли на синий и коричневый цвет. Интенсивность окраски «диаминобензидина» на фотографиях кишечника оценивали с использованием модуля «гистограмма» в диапазоне от 0 (черное) до 255 (белое), а затем переводили полученные значения в «+»: где 255 - «+», а 0 - «+++» [Ингибирование активированных звездчатых клеток лизиноприлом для предупреждения фиброза поджелудочной железы в модели хронического алкогольного панкреатита / М.Е. Ничитайло [и др.] // Клiн. xip - 2012. - №7. - С. 52-56; Quantitative Immunohistochemical Analysis Reveals Association between Sodium Iodide Symporter and Estrogen Receptor Expression in Breast Cancer / R. Malhotra [et al.] // PLoS ONE. - 2013. - Vol. 8 (1). - P. 1-9]. В печени определяли относительную площадь мембран, экспрессирующих Pgp, которую рассчитывалась автоматически как: площадь мембран, экспрессирующих Pgp (pix2)/общая площадь поля зрения (pix2).
Фармакокинетические параметры фексофенадина рассчитывали модельно-независимым методом вручную.
Полученные результаты обрабатывали с помощью программы «StatSoft Statistica 7.0». Наличие достоверных различий между значениями Тmax фексофенадина оценивали с помощью критерия Вилкоксона, а полученные результаты представлены в виде медианы, нижнего и верхнего квартилей (Med, lq, uq). Статистическую значимость различий между фармакокинетическими параметрами, за исключением Тmax, оценивали исходя из представления о лог-нормальном распределении данных. Сравнение изучаемых фармакокинетических параметров проводили с применением дисперсионного анализа повторных измерений (ANOVA) после их логарифмирования. Статистически значимыми принимали различия при значении p<0,05. Дополнительно рассчитывали двухсторонний 90%-й доверительный интервал отношения геометрических средних значений фармакокинетических параметров на фоне введения афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) к параметрам интактных животных. Согласно рекомендациям U.S. Food and Drug Administration, Center for Drug Evaluation and Research значимыми считаются различия между фармакокинетическими параметрами, если двухсторонний 90%-й доверительный интервал их отношения находится вне диапазона 0,8-1,25 (80-125%). Полученные результаты представлены в таблицах в виде среднего геометрического и его 95% доверительного интервала.
Для сравнения показателей, характеризующих экспрессию гликопротеина-Р, использовали критерий Манна-Уитни. Полученные результаты представлены в виде медианы, нижнего и верхнего квартилей (Med, lq, uq).
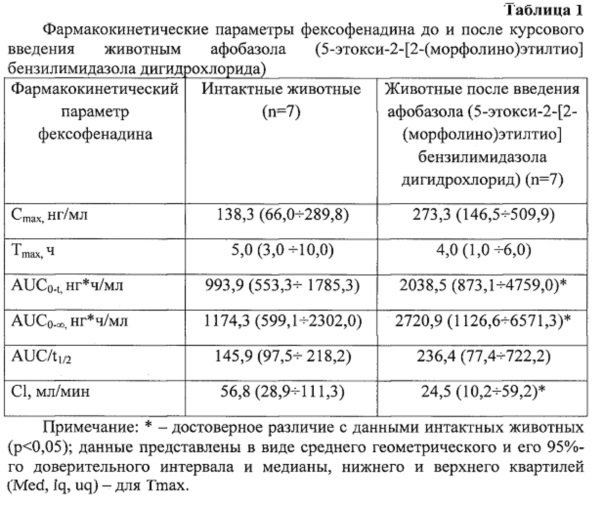
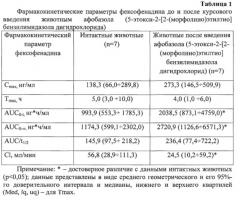
Введение кроликам-самцам афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) курсом 14 дней приводило к следующей динамике основных фармакокинетических параметров фексофенадина (табл. 1).
Было выявлено, что на фоне курсового введения животным афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) происходило увеличение AUC0-t, в 2,05 раза (90%-й ДИ 1,14; 5,06, р=0,053), AUC0-∞, в 2,32 раза (90%-й ДИ 1,3; 6,07, p=0,04) и снижение общего клиренса в 0,43 раза (90%-й ДИ 0,16; 0,76, p=0,04). Cmax фексофенадина, коэффициент абсорбции и Tmax достоверно от показателей интактных животных не отличались.
Курсовое введение кроликам афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) приводило к снижению экспрессии Pgp в печени на 23,2% (р=0,032) по сравнению с показателями интактных животных. В тонком кишечнике экспрессия транспортера статистически значимо не изменялась (см. табл. 2).
Изменение фармакокинетических параметров фексофенадина отражает динамику функциональной активности Pgp, в связи с тем, что всасывание, распределение и экскреция данного препарата контролируется преимущественно данным белком-транспортером [Design of Fexofenadine Prodrugs Based on Tissue-Specific Esterase Activity and Their Dissimilar Recognition by P-Glycoprotein / K. Ohura [et al.] // J. Pharm. Sci. -2015. - Vol. 104, №9. - P. 3076-3083].
Обнаруженная динамика фармакокинетики фексофенадина после курсового введения кроликам афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) свидетельствует о том, что содержание маркерного субстрата в плазме крови животных повысилось, а его экскреции замедлилась, что является доказательством ингибирования функциональной активности Pgp. Причем снижение функциональной активности транспортера коррелировало с ингибированием его экспрессии в печени.
В проведенном исследовании изучено влияние афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорид) на функциональную активность Pgp. Достоверное повышение значений AUC0-24, AUC0-∞, а также снижение значений Сl фексофенадина могут служить доказательством ингибирующего влияния афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) на функциональную активность белка-транспортера Pgp на уровне целостного организма.
Показанная способность афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорид) снижать функциональную активность и экспрессию Pgp позволяет применять его для ингибирования Pgp в гематоэнцефалическом барьере и опухолевой ткани для повышения проникновения лекарственных веществ-субстратов транспортера в головной мозг и клетки опухоли для более эффективной фармакотерапии заболеваний центральной нервной системы и онкологических болезней, а также использовать афобазол (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорид) в качестве положительного контроля пониженной функциональной активности белка-транспортера при поиске веществ аналогичного действия и для прогнозирования потенциальных субстратов Pgp при изучении лекарственных веществ на этапе доклинических исследований.
Применение афобазола (5-этокси-2-[2-(морфолино)этилтио]бензилимидазола дигидрохлорида) в качестве средства для снижения функциональной активности и экспрессии гликопротеина-Р.