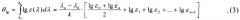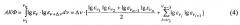Способ определения потенциала ионизации и сродства к электрону органических молекул кислород- и азотсодержащих соединений
Иллюстрации
Показать всеИзобретение относится к способам определения потенциалов ионизации и сродства к электрону органических молекул кислород- и азотсодержащих соединений. Целью изобретения является повышение точности методов определения ПИ и СЭ и его распространение на другие классы соединений, которые не относятся к ароматическим молекулам. Поставленная цель достигается за счет использования нового способа определения потенциалов ионизации и сродства к электрону молекул кислород- и азотсодержащих соединений. Способ определения потенциалов ионизации и сродства к электрону молекул кислород- и азотсодержащих соединений, включающий регистрацию спектров поглощения в химически чистых растворах образцов в ультрафиолетовой и видимой областях, при этом потенциал ионизации и сродство к электрону определяется по автокорреляционной функции, вычисленной по электронному спектру в видимом и (или) УФ-диапазонам. Потенциал ионизации и сродство к электрону определяются по формулам:
ПИ=α1+α2АКФ,
СЭ=β1+β2АКФ,
где ПИ - потенциал ионизации, эВ; СЭ - сродство к электрону, эВ; АКФ - автокорреляционная функция, 1015 Гц; (α1, α2), (β1, β2) - эмпирические коэффициенты, постоянные для близких по химической природе молекул, размерность которых эВ и эВ⋅10-17⋅Гц-1 соответственно. 4 табл.
Реферат
Изобретение относится к способам определения потенциалов ионизации и сродства к электрону органических молекул кислород- и азотсодержащих соединений.
Потенциалы ионизации (ПИ) и сродство к электрону (СЭ) молекул являются важными физическими характеристиками, отражающими электронное строение вещества. ПИ и СЭ имеют особое значение для количественной оценки энергетического состояния молекул при различных фотохимических, химико-технологических, радиохимических, биофизических процессах, а также в молекулярной и атомной физике, физике твердого тела и электронике.
Известен метод фотоэлектронной спектроскопии (ФЭС) для определения ПИ, который использует эмиссию электронов под влиянием жесткого УФ или рентгеновского излучения [Вовна В.И. Фотоэлектронная спектроскопия молекул // Соросовский образовательный журнал. - 1999. - №1. - С. 86-91 / Гурвич Л.В., Карачевцев Г.В., Кондратьев В.Н., Лебедев Ю.А., Медведев В.А. и др. Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. - М.: Наука, 1974. - 351 с.].
Недостатки данного способа определения ПИ:
1. Невозможность использовать способ для молекул с большим числом компонентов.
2. Невозможность использовать способ для метастабильных веществ.
Близким техническим решением к заявляемому способу является способ определения ПИ атомов и молекул по электронным абсорбционным спектрам поглощения излучения в УФ и видимом диапазоне электромагнитного спектра в интервале от 200 до 800 нм [Патент SU 1636734 с приоритетом от 02.07.88, кл. 5 G01N 21/25 «Способ определения иlg потенциалов ионизации молекул ароматических соединений» / Доломатов М.Ю., Мукаева Г.Р.]. В данном способе определение ПИ проводится по эмпирическим зависимостям, связывающим эти характеристики с интегральным показателем поглощения, являющимся по существу аналогом интегральных сил осцилляторов:
где θlg - логарифмическая функция интегральной силы осциллятора, нм-1;
ελ - коэффициент экстинкции;
λ1 и λ2 - длины волн, определяющие границы спектра поглощения в видимой области.
Данная корреляция имеет следующий вид:
где E - энергия граничных орбиталей, ПИ, эВ;
A1, A2 - эмпирические коэффициенты, зависящие от типа орбитали, постоянные в данном ряду молекул, соответственно эВ, эВ⋅нм-1;
Интегральная функция иlg рассчитываются через площадь под кривой поглощения, которая определяется численным методом трапеций:
где ε(λ)- молярный коэффициент поглощения при определенных длинах волн в ультрафиолетовой области спектра, л⋅моль-1⋅см-1;
λ0, λn - границы спектра, нм;
n - число исследуемых точек спектра в области поглощения излучения.
В дальнейшем эта зависимость была подтверждена для ПИ сераорганических соединений, азокрасителей органических красителей.
Недостатки данного способа заключаются в недостаточной точности метода. Средняя ошибка определения ПИ составляет 15-20%. Кроме того, способ применим только к ароматическим молекулам, содержащих бензольные кольца.
Известен способ определения СЭ простых молекул методом фотоотрыва электрона от отрицательных ионов. Для сложных молекул органических соединений для нахождения СЭ используют метод полярографии [Гурвич Л.В., Карачевцев Г.В., Кондратьев B.H., Лебедев Ю.А., Медведев В.А. и др. Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. - М.: Наука, 1974. - С. 294], в котором о сродстве судят по потенциалу полуволны тока восстановления. Недостатками данного способа является его неприменимость к сложным и метастабильным системам и сложность аппаратуры.
Также известны расчетные квантово-химические способы оценки ПИ и СЭ путем решения соответствующих уравнений Рутана методом Хартри-Фока [Грибов Л.А., Муштаков С.П. Квантовая химия. Учебник. - М.: Гардарики, 1999. - 39 с.]. Недостатком является ограниченная точность расчетов применительно к сложным молекулам, так как существующие методы расчета не учитывают в полной мере взаимодействие системы электронов в молекулах и твердых телах.
Целью изобретения является повышение точности методов определения ПИ и СЭ и его распространение на другие классы соединений, которые не относятся к ароматическим молекулам.
Поставленная цель достигается за счет использования нового способа определения потенциалов ионизации и сродства к электрону молекул кислород- и азотсодержащих соединений.
Способ определения потенциалов ионизации и сродства к электрону молекул кислород- и азотсодержащих соединений, включающий регистрацию спектров поглощения в химически чистых растворах образцов в ультрафиолетовой и видимой областях, при этом потенциал ионизации и сродство к электрону определяется по автокорреляционной функции, вычисленной по электронному спектру в видимом и (или) УФ-диапазонам. Потенциал ионизации и сродство к электрону определяются по формулам:
ПИ=α1+α2АКФ,
СЭ=β1+β2АКФ,
где ПИ - потенциал ионизации, эВ;
СЭ - сродство к электрону, эВ;
АКФ - автокорреляционная функция, 1015 Гц;
(α1, α2), (β1, β2) - эмпирические коэффициенты, постоянные для близких по химической природе молекул, размерность которых эВ и эВ⋅10-17⋅Гц-1 соответственно.
Способ включает регистрацию спектров поглощения образцов в химически чистых растворах в УФ и видимой областях. Вводится новая физическая характеристика спектра - автокорреляционная функция (АКФ):
где АКФ - автокорреляционная функция, 1015 Гц;
ε - молярный коэффициент поглощения, л⋅моль-1⋅см-1;
н - частота электромагнитного излучения, Гц;
н1…нn - границы спектра поглощения;
Δн - шаг сканирования спектра;
где k(н) - коэффициент поглощения, л/(г⋅см);
M - среднечисловая молярная масса, г/моль.
где c - концентрация поглощающего вещества; г/л;
D - оптическая плотность, безразмерная величина;
L - толщина кюветы, см.
АКФ спектра характеризует взаимодействие возбужденных электронных состояний атомов и молекул во всей области видимого и УФ-спектра. АКФ спектра поглощения определяется в диапазоне частот от 1,58×1015 Гц до 0,40×1015 Гц (соответствует диапазону 190-760 нм).
Определение ПИ и СЭ молекул кислород- и азотсодержащих соединений производится по АКФ соответствующих спектров поглощения, линейно коррелирующих с ПИ и СЭ.
Благодаря введению АКФ повышается точность определения ПИ и СЭ.
Предлагаемый способ осуществляется следующим образом.
1. Навеску вещества растворяют в оптически прозрачном растворителе. Регистрацию спектра осуществляют при помощи спектрофотометра в прозрачной кварцевой кювете толщиной 1 см.
2. Регистрируют электронный спектр поглощения исследуемого соединения для оптически прозрачных сред, определяется оптическая плотность D в диапазоне частот от 1,58×1015 Гц до 0,40×1015 Гц (190-760 нм) с шагом 1 нм.
3. При этом волновая шкала переводится в частотную по формуле
где c - скорость света в вакууме, 299792458 м/с;
л - длина волны, нм.
4. Определяют коэффициент поглощения по формуле:
5. Определяют логарифмический молярный коэффициент поглощения lg ен,
εν=lg(k(ν)⋅M),
lg εν=lg(k(ν)⋅M).
6. Определяют АКФ исследуемого соединения интегрированием спектра в диапазоне от 1,58×1015 Гц до 0,40×1015 Гц (190-760 нм) численным методом трапеций:
7. ПИ и СЭ определяют по формулам:
ПИ=α1+α2Ac,
СЭ=β1+β2Ac.
Коэффициенты α1, α2, β1, β2 берут из таблиц 1, 2.
Пример 1. Определяют ПИ и СЭ для фенола(C6H6O). Раствор фенола в циклогексане концентрации менее 10-2 моль/л заливают в кювету спектрофотометра толщиной слоя 1 см. Регистрируют спектр в диапазоне длин волн от 9,91×1015 Гц до 2,48×1015 Гц (190-760 нм). По спектру поглощения фенола вычисляют автокорреляционную функцию Ас=15,78⋅1015 Гц. Фенол относится к группе спиртов и окси-групп, значит, по таблицам 1, 2 берут соответствующие коэффициенты зависимостей (7), (8): α1=9,35эВ, α2=-1,96⋅10-17⋅эВ⋅Гц-1; β1=0,08 эВ, β2=1,24⋅10-17⋅эВ⋅Гц-1. И определяют по соотношениям (7)-(8) ПИ и СЭ:
ПИ=9,35 эВ-1,96⋅10-17⋅эВ⋅Гц-1×15,78⋅1015 Гц=9,04 эВ,
СЭ=0,08 эВ+1,24⋅10-17⋅эВ⋅Гц-1×15,78⋅1015 Гц=0,28 эВ.
Пример 2. Определяют ПИ и СЭ для ксантона (C13H8O2). Раствор ксантона в диэтиловом эфире концентрации менее 10-2 моль/л заливают в кювету спектрофотометра толщиной слоя 1 см. Регистрируют спектр в диапазоне длин волн от 9,91×1015 Гц до 2,48×1015 Гц (190-760 нм). По спектру поглощения ксантона вычисляют автокорреляционную функцию Ас=49,79⋅1015 Гц. Ксантон относится к группе кетонов и альдегидов, значит, по таблицам 1, 2 берут соответствующие коэффициенты зависимостей (7), (8): α1=10,65 эВ, α2=-2,98⋅10-17⋅эВ⋅Гц-1; β1=-0,02 эВ, β2=1,76⋅10-17⋅эВ⋅Гц-1. И определяют по соотношениям (7)-(8) ПИ и СЭ:
ПИ=10,65эВ-2,98⋅10-17⋅эВ⋅Гц-1×49,79⋅1015 Гц=9,17 эВ,
СЭ=-0,02 эВ+1,76⋅10-17⋅эВ⋅Гц-1×49,79⋅1015 Гц=0,86 эВ.
Пример 3. Определяют ПИ и СЭ для акридина (C13H9N). Раствор акридина в этаноле концентрации менее 10-2 моль/л заливают в кювету спектрофотометра толщиной слоя 1 см. Регистрируют спектр в диапазоне длин волн от 9,91×1015 Гц до 2,48×1015 Гц (190-760 нм). По спектру поглощения пиридина вычисляют автокорреляционную функцию Ас=40,54⋅1015 Гц. Акридин относится к группе пиридинов и акридинов, значит, по таблицам 1, 2 берут соответствующие коэффициенты зависимостей (7), (8): α1=10,28эВ, α2=-3,85⋅10-17⋅эВ⋅Гц-1; β1=-0,21 эВ, β2=2,96⋅10-17⋅эВ⋅Гц-1. И определяют по соотношениям (7)-(8) ПИ и СЭ:
ПИ=10,28 эВ-3,85⋅10-17⋅эB⋅Гц-1×40,54⋅1015 Гц=8,72 эВ,
СЭ=-0,21 эВ+2,96⋅10-17⋅эВ⋅Гц-1×40,54⋅1015 Гц=0,99 эВ.
Значения ПИ и СЭ молекул кислород- и азотсодержащих соединений (примеры 1-3), определенные по методу ФЭС и предлагаемым способом, приведены в таблицах 3, 4.
Вывод: как следует из таблиц 3, 4, относительная погрешность определения ПИ и СЭ молекул кислород- и азотсодержащих соединений по предлагаемому способу по сравнению с методом Хартри-Фока составляют 0,86 и 10,95% соответственно. Следовательно, предлагаемый способ точнее способа определения ПИ и СЭ методом Хартри-Фока.
Преимущества заявляемого способа заключаются в следующем.
1. Возможность расширения класса исследуемых полициклических соединений.
2. Возможность применения к многокомпонентным соединениям.
3. Возможность одновременного определения ПИ и СЭ исследуемого соединения при регистрации только одного спектра.
4. Сокращается время определения значений ПИ и СЭ.
5. Точность определения ПИ и СЭ предлагаемым способом выше точности определения ПИ и СЭ методом Хартри-Фока.
Способ определения потенциалов ионизации и сродства к электрону молекул кислород- и азотсодержащих соединений, включающий регистрацию спектров поглощения в химически чистых растворах образцов в ультрафиолетовой и видимой областях, отличающийся тем, что потенциал ионизации и сродство к электрону определяется по автокорреляционной функции, вычисленной по электронному спектру в видимом и (или) УФ-диапазонам, при этом потенциал ионизации и сродство к электрону определяются по формулам:
ПИ=α1+α2АКФ,
СЭ=β1+β2АКФ,
где ПИ - потенциал ионизации, эВ;
СЭ - сродство к электрону, эВ;
АКФ - автокорреляционная функция, 1015 Гц;
(α1, α2), (β1, β2) - эмпирические коэффициенты, постоянные для близких по химической природе молекул, размерность которых эВ и эВ⋅10-17⋅Гц-1 соответственно;
где АКФ - автокорреляционная функция, 1015 Гц;
ε - молярный коэффициент поглощения, л⋅моль-1⋅см-1;
ν - частота электромагнитного излучения, Гц;
ν1…νn - границы спектра поглощения;
Δν - шаг сканирования спектра;
ε(ν)=k(ν)⋅м,
где k(ν) - коэффициент поглощения, л/(г⋅см);
М - среднечисловая молярная масса, г/моль;
где с - концентрация поглощающего вещества, г/л;
D - оптическая плотность, безразмерная величина;
L - толщина кюветы, см.