Способ получения природного биополимера апизана и его применение для активации культур клеток животных in vitro при репродукции вирусов
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Заявлена группа изобретений: способ получения природного биополимера апизана и применение апизана в качестве добавки в питательную среду. Способ получения природного биополимера апизана для активации культур клеток животных in vitro при репродукции вирусов предусматривает измельчение в порошок подмор пчел, предварительную сушку измельченного порошка подмора пчел до 4-6 % с последующим получением хитина путем депротеинирования 30%-ного раствора гидроокиси натрия в соотношении 1:3, в течение 6 ч при температуре 75°С и промыванием дистиллированной водой. Проводят активацию хитина путем радиолиза продукта на гамма-установке «Пума» в дозе 10,0 Гр при мощности экспозиционной дозы 3,13×10-5 Кл/кг⋅с, промывают дистиллированной водой до нейтрального значения рН и лиофилизируют с получением готового продукта – апизана. Полученный апизан добавляют в питательную среду в заданном соотношении компонентов. Группа изобретений позволяет повысить выход биомассы клеток животных. 8 табл., 7 пр.
Реферат
Изобретение относится к биотехнологии и может быть использовано для культивирования линий клеток животных тканей и репродукции на них вирусов.
Из практики культивирования клеток известно, что для повышения ростстимулирующей активности клеток in vitro в качестве активатора используют сыворотку крови, белковые гидролизаты животного происхождения (Л.П. Дьяконов. Животная клетка в культуре /Под ред. Л.П. Дьяконова) М.: Изд. Спутник+, 2009. - 656 с.) и растительного (Трошкова Г.П. и др. Совершенствование технологии питательных сред на основе ферментативных гидролизатов рисовой и соевой муки. - Биотехнология. - 2006. №4. - С. 74-78).
Известен также способ активации культур клеток путем использования биодобавки - фито-зооэкстракта из щуки и кабачков (Хазиев Л.Р. Влияние фито-зооэкстрактов на вируспродуцирующие свойства культивируемых клеток: Автореферат дисс… канд. биол. наук. - Казань, 2013. - 16 с.).
Общим недостатком этих способов является использование дорогостоящего животного и растительного сырья, сложность технологии их получения, а также возможность контаминации питательных сред микроорганизмами и прионами, содержащимися в сыворотке крови, гидролизатах тканей и органов животных.
Вместе с тем известно, что одним из важнейших достижений мирового научно-технического прогресса в области изыскания новых биологически активных веществ (БАВ) за последние тридцать лет стало изучение, создание и внедрение в биотехнологию, клеточную и генную инженерию высокомолекулярных соединений (ВМС) - биополимеров (белков и нуклеиновых кислот). Высокомолекулярные соединения - это полимеры и биополимеры, молекулы которых состоят из большого числа повторяющихся групп атомов или звеньев одинакового или различного химического строения (Осари С. Биополимеры / Пер. с японского М.К. Овечкиной и Е.И. Пичужкиной. - М.: Мир, 1988. - С. 353-383).
Наиболее высокой биологической активностью обладают природные биополимеры - хитин и хитозан, полученные от ракообразных (хитозан) и насекомых (апизан), которые, проникая в клетки макроорганизма и взаимодействуя с рибосомами, стимулируют РНК-синтезирующие белки и ферменты, усиливая, тем самым, рост и развитие клеток (Сорокин А.Я. и др. Йод-высокополимеры и биологические возможности организма. - Л.: Наука, 1979. - 259 с.).
Ценнейший биополимер - хитозан, обладающий уникальными свойствами (биосовместимость, легкоусвояемость, нетоксичность, метаболизмстимуляция, бактерицидность, содержание в составе белков, углеводов, аминокислот, макро- и микроэлементов и т.д.) обусловливает возрастающий интерес к нему не только фармакологов, терапевтов, геронтологов, физиологов, но и биотехнологов (Албулов А.И., Белоусов В.И. Промышленная технология получения биополимеров // Матер. 7-й Междунар. конф. - М.: Изд. ВНИРО, 2003. С. 215-217).
Хитозан обладает многими свойствами, которые делают его привлекательным для широкого применения: в качестве корма для животных, питания, продуктов биомедицины, сельского хозяйства и окружающей среды, и обладает способностью к стимулированию роста Bifidobacteria - полезной кишечной бактерии. Антибактериальные, противогрибковые и антивирусные свойства делают хитозан особенно полезным для биомедицинского применения.
В результате многочисленных исследований к настоящему времени обнаружен ряд биологических эффектов хитозана: антиоксидантный, антибактериальный, противовирусный, регенирующий, иммуностимулирующий, антитоксичный и другие.
Хитозан показал себя как эффективный радиопротектор, сорбент токсинов и тяжелых металлов в организме, иммуномодулятор в ветеринарии, а также других областях. На сегодняшний день известно более 70 направлений применения хитозана. Японские специалисты назвали хитозан веществом XXI века (Хитин и хитозан / Под. ред. К.Г. Скрябина, Г.А. Вихоревой, В.П. Варламова. - М.: Наука, 2002. - 368 с.).
Известно, что панцири ракообразных - достаточно дорогостоящее сырье и, несмотря на то, что разработано более 15 методов получения из них хитина, одомашненные и поддающиеся разведению насекомые, в силу своего воспроизводства, могут обеспечить большую биомассу, содержащую хитин. К таковым относятся тутовый шелкопряд, медоносная пчела и комнатная муха (Быкова В.М., Немцев С.В., Сырьевые источники и способы получения хитина и хитозана // Хитин и хитозан. - М.: Наука, 2002. - С. 7-23).
Потенциальным источником пчелиного хитозана служит кутикула, содержащая хитин. Сырьем для получения хитина и хитозана из пчелиных может служить подмор пчел, погибших, главным образом, в период зимовки и осыпавшихся на дно улья. Летом их гибель гораздо значительнее, чем зимой, но менее заметна, поскольку пчелы погибают вне улья. Пчелы осеннего вывода, не выполняющие интенсивную работу, хорошо переносят зимовку и живут 8-9 месяцев.
За счет широкого распространения пчеловодства в нашей стране существует возможность получать хитиновое сырье в значительных масштабах. Ежегодная сырьевая база подмора пчел является новым перспективным источником хитозана насекомых наряду с традиционными видами сырья.
Известен способ получения хитозана (пчелозана) из сухового подмора пчел путем одностадийной обработки 10% раствором щелочи NaOH, удаления щелочного гидролизата, промывания оставшуюся массы-хитина большим количеством воды до рН 7,0 при температуре 55±5°С, с последующей обработкой - дезацетилирования хитина пчел 50% раствором NaOH при температуре 125±5°С. После обработки хитина раствор сливают, а оставшиеся часть промывают до рН 7,0 проточных вод. Полученной остаток является хитозаном («пчелозаном») (Немцев С.В., Зуева О.Ю., Хисматуллин Р.Г., Хисматуллин М.Р., Варламова В.П. Пчела как потенциальный источник хитозана // Матер. VI Междун. конф. (Щелково, Московская обл., 22-24 окт. 2001 г)., Центр «Биоинженерия» РАН, 308 с.).
Известен также способ получения хитозана из пчел - апизана из сухого подмора пчел путем СO2-экстракции (см. Немцов С.В., Хисматуллин Р.Г., Хисматуллин М.Р., Лариков В.В., Варламова В.П. // интернет-сайт: http:// o beewellms.ru/ru/tentorium-shop-apizan).
Недостатком обоих способов является то, что обработке подвергается подмор пчел без их предварительного измельчения, необходимого для разрушения частей пчел и увеличения активной поверхности контакта частиц с реагентами. В результате отсутствия измельчения на всех стадиях обработки сохраняются части пчелы, а это свидетельствует о неглубокой обработке сырья и о неполном отделения белка, хитина других веществ.
Известен способ получения хитозана из кутикулярных оболочек насекомых, которые измельчают до частиц размером 0,2-0,3 мм, обрабатывают 40% раствором щелочи при температуре 100-110°С, жидкостном модуле 1:20 в течение 3-3,5 ч при одновременном воздействии ультразвуком с частотой 15-35 кГц (Патент RU №2067588, опубл. 10.10.1996 г.).
Недостатком данного способа является то, что измельчение исходного сырья, в том числе кутикул насекомых без предварительной сушки до величины частиц 0,2-0,3 мм, практически не выполнено из-за высокой влажности сырья (8-10%), кроме того, измельченная масса из-за своей вязкости слабо реагирует на ультразвук и не разрушается.
Наиболее близким к предлагаемому является способ получения хитозан - меланинового комплекса из подмора пчел, включающий сушку сырья до влажности 3-4% и его растирание до порошкообразного состояния, депротеирование 10%-ным раствором щелочи NaOH, в соотношении 1:10 по массе, при температуре 78-82°С в течение 1,5-2 часов, добавление в реакционную смесь 50%-ного раствора NaOH и доведение таким образом концентрации до 30% от исходной, дезацетилирование полученного хитозана в закрытом сосуде без доступа воздуха при температуре 90-95°С в течение 1,5-2,0 часов при постоянном перемешивании, фильтрацию, промывку массы дистиллированной водой до нейтрального значения рН, а из фильтрата - осаждение меланина воздействием концентрированной соленой кислотой до изменения рН в кислую область и выпавший осадок, представляющий собой меланин и раздельную сушку хитозана и меланина до влажности 8-10% и их смешивание (Патент RU №2382051, МПК С08В 37/00, опубл. 20.02.10 г., БН №5).
Недостатком способа является сложность технологии получения хитозан-меланинового комплекса, его многостадийность - 7 стадий, а главное - способ предназначен для использования его на животных (in vivo).
Технический результат, на достижение которого направлено изобретение, заключается в повышении эффективности культивирования клеток животных in vitro за счет активации их роста и пролиферации с использованием предлагаемого биополимера апизана, обеспечивающего высокую репродукцию вирусов, используемых для изготовления вирус-вакцин и упрощении технологии получения хитозана.
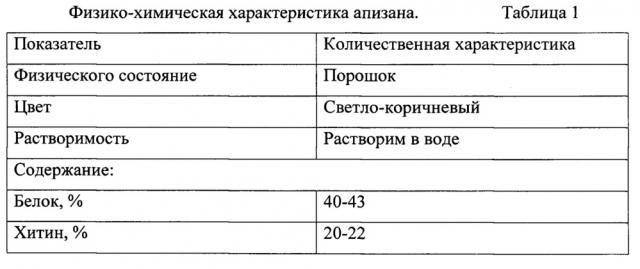
Для достижения названного технического результата в способе получения природного биополимера апизана для активации культур клеток in vitro при репродукции вирусов, предусматривающем предварительную сушку до 4-6%, измельчение хитинсодержащего сырья, депротеирование измельченного порошка подмора пчел с использованием 30%-ного раствора гидроокиси натрия, фильтрацию, промывку дистиллированной водой до нейтрального значения рН, депротеирование измельченного порошка подмора пчел с использованием гидроокиси натрия берут в соотношении 1:3 и проводят в течение 6 часов при температуре 75°С, а перед фильтрацией дополнительно осуществляют активацию хитина путем радиолиза продукта, в присутствии хлорной кислоты в соотношении 4:1 на гамма-установке «Пума» в дозе 10,0 Гр при мощности экспозиционной дозы 3,13×10-5 Кл/кг⋅с, а после промывки дистиллированной водой продукт подвергают лиофилизации и получают биополимер апизан - порошок светло-коричневого цвета, растворимый в воде и содержащий 40-43% белка, 20-22% хитина, 2-3% минеральных веществ, 10-20% меланина, 8-10% влаги, 1-2% золы, вязкость 5-10 с ПЭ и степенью дэацетиллирования 80-85%.
Для достижения этого же технического результата в способе активации культур клеток in vitro при репродукции вирусов, включающем внесение в питательную среду биодобавки, в качестве которой используют природный биополимер - апизан для стимуляции роста клеток из расчета 50-70 мг/мл, засевают питательную среду культурами клеток и выращивают клетки стандартным способом при одновременной деконтаминации питательной среды без использования антибиотиков.
Существенными отличиями способа получения природного биополимера апизана является то, что депротеирование измельченного порошка подмора пчел с использованием гидроокиси натрия берут в соотношении 1:3 и проводят в течение 6 часов при температуре 75°С, перед фильтрацией дополнительно осуществляют активацию хитина путем радиолиза продукта в присутствии хлорной кислоты в соотношении 4:1 на гамма-установке «Пума» в дозе 10,0 Гр при мощности экспозиционной дозы 3,13×10-5 Кл/кг⋅с, после промывки дистиллированной водой продукт подвергают лиофилизации и получают биополимер апизан - порошок светло- коричневого цвета, растворимый в воде и содержащий 40-43% белка, 20-22% хитина, 2-3% минеральных веществ, 12-20% меланина, 8-10% влаги, 1-2% золы, вязкость 5-10 с ПЭ и степенью дэацетиллирования 80-85%, оказывающий ростстимулирующее действие на клетки при одновременном антибактерицидном действии на микробные контаминанты, которые всегда присутствуют в сыворотках крови и тканевых экстрактах животных.
Существенными отличиями способа активации культур клеток in vitro при репродукции вирусов является внесение в питательную среду полученного природного биополимера - апизана для стимуляции роста клеток из расчета 50-70 мг/мл, выращивание клеток стандартным способом при одновременной деконтаминации питательной среды без использования антибиотиков, что приводит к существенному повышению пролиферации и чувствительности культур клеток к вирусам и выхода вирусной биомассы.
Таким образом, использование в качестве активатора метаболизма культур клеток апизана позволяет исключить из состава питательной среды дорогостоящую компоненту-сыворотку крови сельскохозяйственных животных и осуществить одновременно деконтаминацию питательных сред без применения антибиотиков. Ростстимулирующий эффект апизана на культуры клеток животных, а также растений и пищевых грибов связан, во-первых, с высокой сорбционной активностью биополимера, который способен сорбировать не только тяжелые металлы и радионуклиды, но и токсические радикалы и метаболиты, которые образуются при культивировании клеток и ингибируют дальнейший рост клеток; во-вторых, усиление роста, пролиферации клеток благодаря наличию в составе апизана меланинов, содержащих цитостимулирующий фактор (цитостимулирующие гормоны), в-третьих, меланин, содержащийся в хитине, хитозане и апизане, обладает выраженными антиоксидантными (антирадикальными) свойствами, нейтрализуя путем захвата и перевода их в неокисленные соединения, т.е. выполняет роль «щита», защищающего клетки от губительных активных форм кислорода, образующихся при метаболизме клеток в процессе культивирования; в-четвертых, антибактериальная активность хитозана по отношению к микроорганизмам (вероятных контаминантов питательных сред) путем нейтрализации протеиназы - основного - химического оружия патогенов.
Использование физического метода (ионизирующих излучений) для активации хитина и хитозана облегчает процесс их деацетилирования и снижения молекулярной массы, что придает биополимеру важнейшее свойство - водорастворимость, направленно влияя на их молекулярные и структурные параметры. В основе активации хитина и хитозана лежит радиолиз полисахаридов, который сопровождается взаимодействием молекул биополимера с радиоиндуцированными реакционно-активными радикалами ОН*, Н*, как основных реагентов, обусловливающих активацию субстрата. При этом активные радикалы реагируют с моно- и полисахаридами хитина с отрывом водорода от С-Н-связей. В результате образуются вторичные углеродные радикалы по полимерной цепи (постоянной константной радиолиза К=6,4⋅108дм3. М-1. С-1 (Хитин и хитозан / Под ред. К.Г. Скрябина, Г.А. Вихоревой, В.П. Варламова. - М.: Наука, 2002. - 318 с.). Образовавшиеся углеродные радикалы быстро преобразовываются в устойчивые продукты с отщеплением молекул воды и образованием карбоксильных групп. Последний процесс и обусловливает деструкцию цепей полисахаридов, уменьшение молекулярной массы, что придает хитозану растворимость и повышает его биологической активности.
Способ активации культур клеток для репродукции вирусов осуществляется следующим образом.
На первом этапе получают потенциальный активатор метаболизма клеток - биополимер - (апизан). В качестве хитинсодержащего технологического сырья используют пчелиный подмор. Для подготовки технологического сырья собирают свежие погибшие пчелы без признаков плесени и разложения. Сырье просевают через сито с крупными ячейками, чтобы отделить от мелкого мусора. Затем подмор подсушивают в сушильном шкафу, или печи при температуре +45-45°С, или над батареей центрального отопления. Сухой материал подвергают гомогенизации на шаровой мельнице или электрокофемолке. Степень дисперсности контролируют микроскопически, которая должна составлять в пределах 60-90 мкм. Полученный порошок упаковывают в бумажные пакеты и подвергают стерилизации путем автоклавирования при 100°С и давлении 1,0-1,5 атмосфер.
На втором этапе получают хитин путем депротеинирования измельченного подмора пчел в 30%-ном растворе гидроокиси натрия (NaOH), взятом в соотношении 1:3, и проводят в течение 6 часов в сушильном шкафу при температуре 75°С, промывают полученный материал дистиллированной водой, подсушивают.
На третьем этапе получают апизан путем облучения хитин-содержащего материала на гамма-установке «Пума» в дозе 10 Гр при мощности экспозиционной дозы 3,13⋅10-5 Кл/кг⋅с. Гидролиз хитина (радиолиз) проводят в присутствии 30%-ного раствора хлорной кислоты (HClO4) при соотношении компонентов 4:1. Полученный продукт радиоактивации (радиолиза) промывают дистиллированной водой до нейтрального значения рН, после анализа химического состава определяют концентрацию сухого вещества в гидролизате, которая колеблется в пределах 12-15 мг/мл, разливают в ампулы по 2,0 мл и подвергают лиофилизации. Содержание апизана в ампуле составляет 30±0,5 мг.
Физико-химическая характеристика апизана представлена в таблице 1.
Способ активации культур клеток в присутствии апизане иллюстрируется следующими примерами
Пример 1. Определение концентрации апизана в ростовой среде, обеспечивающей оптимальный рост культур клеток.
Перед испытаниями препарат, расфасованный в ампулы по 30±0,5 мг лиофильно высушенного порошка, вскрывали и вносили в питательные среды из расчета 6,28; 12,25, 25,0, 50,0, 70,0, 90, 100,0, 110, 120, 130 мг/мл. В качестве ростовой среды использовали среду Игла MEM, которую разливали во флаконы и вносили в них апизан из расчета 6,25-130,0 мг/л. Среды с биодобавкой апизаном засевали культурой клеток линии МДВК при посевной концентрации 40 тыс. кл/мл. В качестве контрольной среды опытах использовали среду Игла MEM, содержащую в качестве стимулятора роста клеток 20% сыворотки крови коров (СКК). В качестве критерия оценки ростстимуляции (активации) испытуемого активатора (апизана) использовали индекс пролиферации (ИП), которой рассчитывали общепринятым методом.
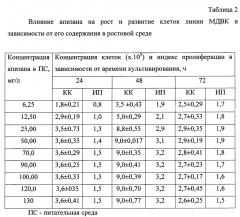
Результаты исследования по изучению влияния на метаболизм клеток МДВК природного биополимера апизана в зависимости от его содержания в питательной среде приведены в таблице 2.
Из материалов таблицы видно, что питательная среда, содержащая апизан в диапазоне концентраций 50,0-70,0 мг/л, обеспечивала максимальный рост и развитие клеток тест-культуры (МДВК), при котором концентрация клеток в культуральной среде через 48 ч (логарифмическая фаза) составляла 8,8±0,35 и 9,1±0,35 кл/мл соответственно при индексе пролиферации 2,7-2,9 соответственно.
Дальнейшее увеличение концентрации биополимера (90, 100, 120, 150 мг/мл) не приводило к увеличению концентрации клеток в культуральной жидкости и индекса пролиферации.
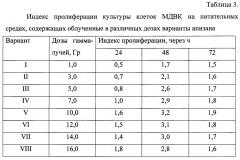
Пример 2. Определение оптимальной дозы облучения хитин содержащего материала для активации апизана.
Для оптимизации условий облучения с целью получения водорастворимого и низкомолекулярного апизана, хитин - содержащий деацетилированный материал подвергали гамма-облучению в дозах 1,3, 5, 7, 12, 14, 16 Гр, последующим испытанием облученных образцов апизана на степень ростстимулирующей активности клеток. Оптимальную дозу гамма-облучения с целью радиоактивации апизана определяли путем внесения полученных вариантов гидролизатов в питательную среду Игла MEM, которую засевали культурой клеток МДВК и через 48-часового культивирования клеток определяли индекс пролиферации.
Результаты определения оптимальных доз гамма-облучения апизана для его активации представлены в таблице 3.
Пример 3. Определение оптимальной концентрации HClO4 для осуществления радиолиза (гидролиза) хитина с целью получения апизана.
Для этого готовят различные концентрации реагента (НСlO4):10, 15, 20, 25, 30, 35, 40%, в которые вносят гидролизуемый (депротеинированный гидроокисью натрия (NaOH) хитинсодержащий материал) и проводят радиолиз путем облучения на гамма-установке в дозе 10,0 Гр. По завершению облучения гидролизат промывают дистиллированной водой до нейтрального значения рН и испытывают ростстимулирующую активность полученных вариантов апизана путем внесения их в питательные среды с последующим засевом в них клетки тест-культуры (МДВК). Дальнейшие исследования проводят как в примере 2.
Результаты испытаний ростстимулирующей активности вариантов апизана, полученного путем радиолиза в присутствии различных концентраций реагента (HClO4) представлены в таблице 4.
Пример 4. Определение оптимального соотношения реагента HClO4 и гидролизуемого материала (хитина) при радиолизе субстрата.
Для этого готовят 30%-ный раствор HClO4 и вносят его в гидролизуемый субстрат-хитинсодержащий материал в соотношениях 1:1, 1:2, 1:3, 1:4, 2:1, 3:2, 4:1, 5:1? затем смесь материал облучают гамма-лучами в дозе 10,0 Гр и полученные варианты гидролизат вносят в питательные среды, засевают тест-культурой клеток (МДВК) и дальнейшие исследования проводят согласно примеру 2.
Результаты исследования представлены в таблице 5.
Из данных таблиц 3, 4, 5 видно, что оптимальной дозой облучения хитинсодержащего материала является доза 10,0 Гр (табл. 3), оптимальная концентрация реагента HClO4 для гидролиза (радиолиза) хитина – 30% (табл. 4) при оптимальном соотношении хитина и реагента - 4:1 (табл. 5). Любые изменения указанных параметров гидролиза апизана ведут к снижению индекса пролиферации клеток культуры клеток МДВК.
Пример 5. Сравнительная оценка эффективности известного препарата-апизана, полученного по патенту RU №2382051 и апизана содержащего, полученного путем радиолиза.
Для сравнительной оценки ростстимулирующей активности известного (СО2-экстрагированного - апизана) и радиоэкстрагированного апизана (предлагаемого) препараты вносят в питательные среды из расчета 50-70 мг/мл, засевают среды клетками тест-культур (МДВК) плотностью 40 тыс. кл/мл, выращивают в течение 72 ч и определяют индекс пролиферации согласно примеру 2.
Результаты сравнительных опытов по оценке ростстимулирующей активности известного и предлагаемого препаратов представлены в таблице 6.
Из данных таблицы видно, что апизан, полученный по известной методике (Патент №2382051), не обладает ростстимулирующим действием поскольку индекс пролиферации значительно (в 2,06 раза) предлагаемому.
Пример 6. Определения чувствительности первичной культуры клеток МДВК, выращенных на среде, содержащей апизан.
Для определения чувствительности культур клеток МДВК к вирусам, ростовую среду Игла MEM, содержащую апизан, заражали вирусами ИРТ и ПГ-3. В опыт брали культуры после образования полного монослоя.
В ходе эксперимента было проведено 5 последовательных пассажей каждого вируса. Уровень накопления вируса в культуре клеток определяли методом титрования по общепринятой в вирусологии методике.
Результаты проведенных исследований по репродукции вирусов ИРТ и ПГ-3 клетками линии МДВК в апизансодержащей и контрольной (сывороточной) средах представлены в таблице 7.
Из представленных в таблице материалов видно, что наибольшее количество вирусной массы ИРТ и ПГ-3 было получено при использовании апизана в качестве ростстимулирующей добавки в ростовую среду Игла MEM, содержащую при выращивании линии клеток МДВК. При этом вирус ИРТ размножается значительно лучше по сравнению с вирусом ПГ-3 и его титр превышал контрольные значения в 1,19 раза, титр ПГ-3 – в 1,20 раза.
Пример 7. Оценка возможности деконтаминации питательных сред путем использования апизана.
Учитывая, что использование антибиотиков для контаминации питательных сред имеет существенные недостатки: цитотоксическое действие на клетки в культуре и индукция антибиотикорезистентности у микроорганизмов-контаминантов, проводили исследования на оценке деконтаминации активности апизана, включенного в ростовые среды для культивирования выращивания культур клеток. При этом исходили из того, что одним из важнейших свойств биополимеров (хитозана, апизана) является их разнонаправленное действие на биологические объекты: ростстимуляция полезной микрофлоры (бифидобактерии, лактобактерии) и клеток органов и тканей организма и подавление развитие патогенной и условно-патогенной микрофлоры.
Для проведения опытов в питательную среду Игла MEM с апизаном, выделенным из экстракта, контаминировали мезофильные аэробными и факультативно (МАФАиМ), мышечной ткани коров, используемых в биотехнологии в качестве добавки (активатора) в питательные среды. Плотность контаминации питательных сред составляла 1,5⋅103 КОЕ/мл.
Опыты сопровождали соответствующим контролем – питательную среду Игла MEM, содержащую 20% сыворотки КРС, по 100ЕД пенициллина, стрептомицина и канамицина, заражали указанными микроорганизмами в тех же дозах и условиях контаминации. Опытные и контрольные среды выдерживали в течение 48 ч, производя посевы через 1, 2, 4, 12, 24 и 48 ч на МПА и МПБ для подсчета количества выживших микроорганизмов.
Результаты бактериологических исследований по изучению влияния апизана и антибиотиков на мезофильных аэробные и факультативные анаэробные микроорганизмы (КМАФА и М) представлены в таблице 8.
Из данных таблицы видно, что внесения в питательную среду Игла MEM, содержащую 1,5⋅103 КОЕ/мл мезофильных аэробных и факультативно-анаэробных микроорганизмов апизана в количестве 50-70 мг/мл среды, оказывали бактерицидное действие на микроорганизмы. При этом наиболее интенсивная гибель микроорганизмов наблюдалась при 12-24-часовом контакте их с испытуемыми агентами, когда в питательных средах обнаруживалось 0,05-0,09⋅103 КОЕ/мл, что составляет 50-90 микробных клеток на 1 мл среды. Полная гибель микробной популяции в питательной среде Игла MEM с апизаном наступала через 48 ч после выяснения препарата. В контрольной питательной среде MEM, содержащей по 100 /мл пенициллина, стрептомицина и канамицина, полной гибели микроорганизмов не наступала, при 48-часовой экспозиции в посевах из контрольной среды обнаруживались единичные колонии микроорганизмов, что свидетельствует о неполной деконтаминации питательной среды.
Таким образом, полученный природный биополимер апизан и способ активации культур клеток in vitro для репродукции вирусов с помощью полученного биополимера апизана приводит к существенному (3-кратному) повышению пролиферативной активности клеток и позволяет исключить из состава питательной среды дефицитный компонент-сыворотку крови животных и упростить технологию получения хитозана.
1. Способ получения природного биополимера апизана для активации культур клеток животных in vitro при репродукции вирусов, предусматривающий предварительную сушку измельченного порошка подмора пчел до 4-6%, депротеинирование в 30%-ном растворе гидроокиси натрия, взятом в соотношении 1:3, в течение 6 часов при температуре 75°С, промывание дистиллированной водой до нейтрального значения рН, радиолиз продукта в присутствии хлорной кислоты в соотношении 4:1 на гамма-установке "Пума" в дозе 10,0 Гр при мощности экспозиционной дозы 3,13×10-5 Кл/кг⋅с, промывание дистиллированной водой до нейтрального значения рН и лиофилизацию.
2. Применение апизана, полученного способом по п. 1, в качестве биодобавки в питательную среду из расчета 50-70 мг/мл для активации роста культур клеток животных in vitro.