Способ определения электроанатомического субстрата при контактном картировании высокой плотности эндокардиальной поверхности левого предсердия для стратификации риска рецидива фибрилляции предсердий после циркулярной изоляции легочных вен у пациентов с пароксизмальной и персистирующей фибрилляцией предсердий
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к кардиологии, интервенционной аритмологии и кардиохирургии. Способ определения электроанатомического субстрата при контактном картировании высокой плотности эндокардиальной поверхности левого предсердия для стратификации риска рецидива фибрилляции предсердий после циркулярной изоляции легочных вен у пациентов с пароксизмальной и персистирующей фибрилляцией предсердий включает контактное картирование высокой плотности и трехмерную реконструкцию левого предсердия. Построение амплитудных и активационных карт левого предсердия осуществляют путем последовательного считывания амплитудной и активационной информации при контакте аблационно-картирующего электрода с поверхности эндокарда левого предсердия в корректных точках, где удаление точки от поверхности реконструкции не превышает 1 мм, стандартизированных как по дистанции между соседними точками, так и по расстоянию от кончика электрода до эндокардиальной поверхности предсердия. По полученным результатам выявляют на картах зоны миокарда сниженной вольтажности в спектре амплитуд ≤0,75 мВ, ассоциированные с замедлением скорости проведения электрического импульса менее 1 м/с, которые и являются электроанатомическим субстратом. Измеряют в процентах относительную площадь электроанатомического субстрата левого предсердия, в соответствии со значением которой рассчитывают относительный риск рецидива фибрилляции предсердий после циркулярной изоляции легочных вен в соответствии с формулами стратификации и расчетными таблицами стратификации риска рецидивов фибрилляции предсердий. Изобретение позволяет расширить функциональные возможности электроанатомического картирования эндокардиальной поверхности левого предсердия без искажения параметров амплитуды эндограммы. 6 з.п. ф-лы, 7 ил., 2 табл.
Реферат
Изобретение относится к медицине, в частности к кардиологии, интервенционной аритмологии и кардиохирургии. Может быть использовано для интраоперационной диагностики, прогнозирования риска рецидивов после циркулярной изоляции легочных вен и персонификации лечения у пациентов с фибрилляцией предсердий.
Катетерная аблация, направленная на элиминацию венозных триггеров, является стандартным методом лечения симптомной, рефрактерной к антиаритмической терапии, фибрилляции предсердий (ФП). Несмотря на достигнутые успехи в интервенционном лечении ФП, высокая частота рецидивирования аритмии, которая может быть связана не только с проблемой реконнекции легочных вен (ЛВ), требует дальнейшей разработки современных методов диагностики, прогнозирования и лечения. В экспериментальных и клинических исследованиях было доказано, что процессы развития фиброза миокарда и формирования восприимчивого предсердного субстрата с патологическими электрофизиологическими свойствами, также играют значимую роль в инициации и поддержании ФП [Allessie М., Ausma J., Schotten U. Cardiovasc Res 2002; 54:230-24; Nattel S. et al., Circulation: Arrhythmia and Electrophysiology 2008; 1: 62-73]. В частности, патогномоничным признаком аритмогенного субстрата ФП является локальное замедление и анизотропия скоростных параметров проведения электрического импульса [Verheule S., Olgin J. et al. 2004; 287: H634-H644; Roberts-Thomson K.C. et al. Heart Rhythm 2009; 6: 587-91; Miyamoto K., Tsuchiya T. et al., EP Europace; 2009, 30; Krul S.P., et al.: Circ Arrhythm Electrophysiol 2015; 8: 288-295]. Рубцовые зоны и миопатически измененная ткань предсердий, создавая аномальный паттерн проведения электрического импульса и формируя экстравенозные триггерные фокусы, вносят свой вклад в патофизиологию устойчивой ФП [Burstein В., and Nattel SJ Am Coll Cardiol 2008; 51: pp. 802-809, 15, Wong C.X. and Sanders P. EP Europace; 2013; 14 (7): 954-961]. Дисперсия рефрактерности и электрофизиологических свойств миокарда предсердий также является обязательным условием существования механизма микро ре-ентри при ФП и ассоциирована с увеличением индуцируемости и устойчивости аритмии [Wang J. et al., 1996, Olgin J. et al., 1998, Fareh S and Nattel S., Circulation. 1998; 98: 2202-2209; Li Z et al., Europace 2001; 3, 285-291; Olivera M. et al. Pacing Clin Electrophysiol. 2006; 29 (suppl I): S40. Rev Port Cardiol 2007; 26 (7-8): 691-702; Kojodjojo P, Peters NS, Davies DW, Kanagaratnam P.J Cardiovasc Electrophysiol 2007; 18: 269-275]. Визуализация аритмогенного субстрата в предсердиях и уточнение его прогностической ценности для определения риска рецидива ФП после циркулярной аблации ЛВ, позволит выявить пациентов высокого риска рецидива и персонифицировать выбор дальнейшей стратегии лечения.
Широко известен способ визуализации фиброзных и рубцовых зон миокарда методом магнитно-резонансной томографии (МРТ) с отсроченной задержкой гадолиния, при котором, оценка патологических изменений производится исходя из распределения интенсивности сигнала между нормальной и фиброзной тканью левого предсердия (ЛП) [Oakes RS, Badger TJ et al., Circulation: 2009; 119(13): 1758-67; Akoum N, Daccarett M et al., J Cardiovasc Electrophysiol. 2011; 22(1): 16-22]. Данный способ позволяет оценить степень структурного ремоделирования камер сердца и, с помощью современных компьютерных и математической технологий, количественно определить выраженность фиброзной и рубцовой ткани в ЛП.
Ограничением этого способа является невозможность определения плотности фиброзной и рубцовой ткани и дифференциации постаблационного рубца и нативных фиброзных изменений [Daccarett М., McGann C.J. et al., Expert Rev Cardiovasc Ther. 2011; 9(1): 105-111; Arujuna A et al., Circ Arrhythm Electrophysiol, 2012; 5: 691-700]. Кроме того, данный метод не учитывает электрофизиологических изменений патологической ткани и не позволяет дифференцировать плотный аритмически интактный рубец и поля интерстициального фиброза с высоким аритмогенным потенциалом, играющие ключевую роль в инициации и поддержании ФП [Spragg D et al. Heart Rhythm. 2012; 9 (12): 2003-9. Hunter R J, J Cardiovasc Electrophysiol 2013; 24: 396-40; Goette A., Nattel S et al. Heart Rhythm 2016].
Методика выявления рубцовой и фиброзной ткани в миокарде желудочков с применением нефлюороскопического навигационного картирования возникла в результате многочисленных экспериментальных и клинических исследований постинфарктных рубцов. В валидационных исследованиях электроанатомического катирования миокарда желудочков у пациентов, вольтаж биполярной ЭГ 1,5 мВ был постулирован в качестве параметра, который позволяет дифференцировать зоны фиброзно-измененного и здорового миокарда в желудочках. В настоящее время, биполярное и униполярное картирование субстрата желудочковых тахикардий (ЖТ) у пациентов с органическим поражением сердца является стандартом интраоперационной диагностики, позволяющим значительно улучшить результаты интервенционного лечения гемодинамически нестабильных и «некартируемых» ЖТ [Soejima K. et al., Circulation 2001; 104: 664-669, Aliot E. et al., Heart Rhythm, Vol 6, No 6, June 2009, 881-920; Kuck K. et al., Lancet 2010; 375: 31-40]. Валидация фиброзных изменений и аритмогенного субстрата в предсердиях до сих пор вызывает затруднения [Spragg D., J. Atr Fib 2013, №5, 93-100].
Впервые, способ интраоперационного биполярного картирования предсердий был применен в 2003 году группой австралийских исследователей при исследовании степени ремоделирования правого предсердия у пациентов с ФП [Sanders Р, Morton JB et al. Circulation, 2003; 108: 1461-1468; Sanders P. et al., Circulation, 2004; 109: 1514-1522]. Известный способ позволял считывать информацию о вольтажной характеристике ткани при контактном картировании эндокардиальной поверхности предсердия с кончика электрода. Зоны снижения вольтажа менее 0,5 мВ, постулированные, как рубцовая и фиброзная ткань, маркировались и измерялись методом сложения многоугольников. В 2005 году группой A. Verma были проанализированы биполярные карты ЛП 700 пациентов с ФП, выполненные на синусовом ритме. Рубцовые зоны в ЛП были верифицированы с помощью декаполярного диагностического электрода Lasso в случае отсутствия ЭГ на всех 10 полюсах при 3 различных позициях Lasso. В этом исследовании впервые была оценена негативная прогностическая значимость обширных рубцовых зон снижения вольтажа и «электрической тишины» и связанный с этим высокий инцидент рецидива после изоляции ЛВ [Verma A, Natale A. et al., J Am Coll Cardiol. 2005 Jan 18; 45(2): 285-92]. Хотя сходные данные были обнаружены в ряде клинических исследований, по результатам которых выраженность рубцовых зон в левом предсердии также рассматривалась как негативный прогностический индикатор отдаленной свободы от рецидива ФП [Olgin J, Marcus G. et al, Heart Rhythm, 2007; 4 (2): 138-44; Morady F, Yokokawa M. et al., J Interv Card Electrophysiol. 2012; 34 (3): 287-94], методика стратификации риска рецидива ФП на основании картирования электроанатомического субстрата не разрабатывалась.
Рядом исследователей также было выявлено локальное замедление проведения электрического импульса в миокарде с разными вольтажными характеристиками [Miyamoto K, Tsuchiya Т. Et al., ЕР Europace; 2009; 11: 1597-1605]. К сожалению, этот патогномоничный признак электрофизиологического ремоделирования миокарда пока не нашел своего применения в методиках идентификации аритмогенного субстрата ФП.
Кроме того, известна модификация способа контактного картирования с созданием биполярных карт высокой плотности [Stiles М.K. et al., J Am Coll Cardiol, 2009; 53: 1182-1191], которая позволяет собрать более детальную информацию о низкоамплитудных зонах миокарда предсердий и измерить их относительную площадь с помощью программного обеспечения навигационной системы.
Общим недостатком всех вариантов данного способа является отсутствие стандартизации биполярных карт как по дистанции между ближайшими точками, так и по расстоянию электрода от эндокардиальной поверхности предсердия в момент взятия корректной точки. Несоблюдение данных условий может в значительной степени искажать амплитудные параметры эндограммы и вольтажные карты в целом. Кроме того, ограничением данного способа является определение рубцовой/фиброзной зоны только на основании амплитудных характеристик, без учета патологических электрофизиологических свойств миокарда, играющих ведущую роль в формировании аритмогенного субстрата ФП.
Из известных аналогов в качестве прототипа к заявляемому способу выбран способ контактного биполярного картирования высокой плотности эндокардиальной поверхности предсердий [Stiles М.K., J Am Coll Cardiol, 2009; 53: 1182-1191].
Изобретение направлено на создание способа определения электроанатомического субстрата при контактном картировании высокой плотности эндокардиальной поверхности левого предсердия, обеспечивающего расширение функциональных возможностей способа за счет стандартизации биполярных карт высокой плотности и повышение точности и специфичности интраоперационой идентификации электроанатомического субстрата, а именно низкоамплитудных зон, ассоциированных с патологическими электрофизиологическими свойствами миокарда, для стратификации риска рецидива фибрилляции предсердий после циркулярной изоляции легочных вен у пациентов с пароксизмальной и персистирующей фибрилляцией предсердий.
Техническим результатом заявленного способа является расширение функциональных возможностей электроанатомического картирования эндокардиальной поверхности левого предсердия без искажения параметров амплитуды эндограммы, что позволяет добиться высокой точности и специфичности интраоперационой идентификации электроанатомического субстрата (ЭАС), за счет стандартизации биполярных карт высокой плотности как по дистанции между ближайшими точками, так и по расстоянию электрода от эндокардиальной поверхности предсердия и выявления низкоамплитудных зон, ассоциированных с патологическими электрофизиологическими свойствами миокарда (а именно, с замедлением, анизотропией проведения электрического импульса и дисперсией параметров рефрактерности), а также выполнение стратифицикации риска рецидива фибрилляции предсердий у пациентов после циркулярной изоляции легочных вен на основании измеренной относительной площади электроанатомического субстрата и расчетных таблиц стратификации, и персонификации дальнейшей тактики лечения пациентов, расширяющие функциональные возможности способа в целом.
Указанный технический результат при реализации изобретения достигается в способе определения электроанатомического субстрата при контактном картировании высокой плотности эндокардиальной поверхности левого предсердия для стратификации риска рецидива фибрилляции предсердий после циркулярной изоляции легочных вен у пациентов с пароксизмальной и персистирующей фибрилляцией предсердий, включающем контактное картирование высокой плотности и трехмерную реконструкцию левого предсердия, за счет того, что построение амплитудных и активационных карт левого предсердия осуществляют путем последовательного считывания амплитудной и активационной информации при контакте аблационно-картирующего электрода с поверхности эндокарда левого предсердия в корректных точках, стандартизированных, как по дистанции между соседними точками, так и по расстоянию от кончика электрода до эндокардиальной поверхности предсердия, по полученным результатам выявляют на картах зоны миокарда сниженной вольтажности в спектре амплитуд ≤0,75 мВ, ассоциированные с замедлением скорости проведения электрического импульса менее 1 м/с, которые и являются электроанатомическим субстратом, измеряют в процентах относительную площадь электроанатомического субстрата левого предсердия, в соответствии со значением которой рассчитывают относительный риск рецидива фибрилляции предсердий после циркулярной изоляции легочных вен в соответствии с формулами стратификации и расчетными таблицами стратификации риска рецидивов фибрилляции предсердий.
Указанный технический результат достигается также за счет того, что контактное амплитудное и активационное картирование высокой плотности с трехмерной реконструкцией левого предсердия выполняют на синусовом ритме или стимуляции предсердий с помощью аблационно-картирующего электрода NaviStar ThermoCool с уровнем разрешения реконструкции 14.
Указанный технический результат достигается также за счет того, что плотность контакта кончика аблационно-картирующего электрода и эндокардиальной поверхности левого предсердия при контактном картировании стандартизируют методом подтверждения корректных точек в режиме реального времени или редактирования offline, при условии, если удаление точки от поверхности реконструкции левого предсердия не превышает 1 мм.
Указанный технический результат достигается также за счет того, что плотность набора точек стандартизируют и определяют порогом интерполяции цвета, который соответствует 5 мм, при этом полное покрытие карты цветом свидетельствует о том, что расстояние между соседними точками не превышает 5 мм.
Указанный технический результат достигается также за счет того, что параметры проведения электрического импульса определяют путем 5-кратного измерения дистанции и времени активации между двумя соседними точками в проекции вектора активации, результат усредняют и производят расчет средней скорости проведения в каждой зоне миокарда, исходя из параметров LAT (Local Activation Time) и дистанции между соседними точками в проекции вектора активации на активационной карте (V=Distance/ΔLAT).
Указанный технический результат достигается также за счет того, что относительный риск рецидива фибрилляции предсердия после циркулярной изоляции легочных вен рассчитывают по формуле стратификации:
R=(1,05)%S ЭАС,
а относительный риск рецидива фибрилляции предсердия после повторной циркулярной изоляции легочных вен рассчитывают по формуле стратификации:
R=(1,09)%S ЭАС,
где
% S - относительная площадь электроанатомического субстрата.
Перечень фигур, поясняющих предлагаемый способ:
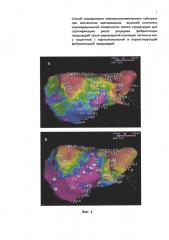
на фиг. 1 (А, Б) представлена стандартизация биполярных карт высокой плотности по расстоянию электрода от эндокардиальной поверхности предсердия: А - карта без стандартизации. Обширная низкоамплитудная зона с поражением крыши и задней стенки ЛП; Б - карта стандартизирована по плотности контакта (удаление точки от поверхности реконструкции не превышает 1 мм). Преимущественная локализация низкоамплитудной зоны - область крыши ЛП;
на фиг. 2 (А, Б) - представлена амплитудная (А) и изохронная активационная (Б) карты. Расчет скоростных параметров проведения электрического проведения в низковольтажных зонах левого предсердия;
на фиг. 3 (А, Б) - представлены локальные скорости проведения электрического импульса в вольтажных зонах ЛП с разным спектром амплитуды эндограмм: А - представлены скорости проведения электрического импульса в зонах ЛП с разной амплитудой эндограммы. В вольтажных зонах миокарда в спектре амплитуд ≤0,75 mV имеет место статистически значимое замедление скорости проведения электрического импульса; Б - в зоне с амплитудой эндограммы в спектре амплитуд 0,76-1 mV тенденция к замедлению проведения электрического импульса;
на фиг. 4 (А, Б) - представлены низковольтажные зоны левого предсердия и анизотропия проведения электрического импульса: А - выявлена высокая корреляция ЭАС и индекса гетерогенности скорости проведения. Индекс корреляции Спирмена (Rs) составил 0,89; Б - выявлена высокая корреляция локальной скорости проведения в вольтажной зоне ЛП в спектре амплитуд 0,5-0,75 mV и индекса гетерогенности локальной скорости проведения. Индекс корреляции Спирмена (Rs) составил 0,72;
на фиг. 5 (А, Б) - представлена дисперсия рефрактерности электроанатомического субстрата: А - точки стимуляции в правом и левом предсердии в LAO: R ant - передняя стенка правого предсердия (ПП), R post - задняя стенка ПП, R lat - латеральная стенка ПП, R sept - септальная стенка ПП, Cs d - дистальный отдел коронарного синуса (КС), Csp - проксимальный отдел КС, L sept - септальная стенка ЛП, L ant - передняя стенка ЛП, L lat - латеральная стенка ЛП; Б. - точки стимуляции в правом и левом предсердии в РА: Roof-область «крыши» ЛП, L post - задняя стенка ЛП, L inf - «дно» ЛП; С - высокая корреляция относительной площади ЭАС и дисперсии рефрактерности миокарда предсердий. Коэффициент Спирмена (Rs) составил 0,75;
на фиг. 6 (А, Б) - представлены идентификация и измерение относительной площади зон ЭАС в ЛП - методика идентификации измерения относительной площади ЭАС на примере пациента страдающего длительно персистирующей ФП: А - на передне-перегородочной стенке ЛП идентифицирована зона ЭАС с S 30,7 sm2, %S 16%; Б - в области крыши и задней стенки ЛП идентифицирована обширная зона ЭАС с S 50,4 sm2, %S 26,8%;
на фиг. 7 (А, Б) - представлена методика определения относительного риска рецидива ФП и персонификация дальнейшей стратегии лечения: А - иллюстрация интраоперационной идентификации и измерения зоны ЭАС с преимущественной локализацией в области крыши и задней стенки ЛП, относительной площадью 21,6% (пациент М. с персистирующей в течение 3 недель ФП, интервенционное лечение впервые). В соответствии с формулой стратификации R1=(1,05)n - риск рецидива ФП увеличен в 2,7 раза по сравнению с базовым риском рецидива у пациентов без ЭАС в ЛП, обусловленным риском реконнекции ЛВ. Был выполнена циркулярная изоляция ЛВ, но с учетом выраженности ЭАС в ЛП в послеоперационном периоде интенсифицирована антиаритмическая терапия (ААП III класса); Б - иллюстрация схемы повторного вмешательства. Интраопераоперационно была идентифицирована реконнекция с восстановлением проведения в правой верхней и нижней ЛВ, была выполнена повторная РЧА ЛВ антрально до достижения двунаправленной блокады проведения. По результатам повторного биполярного картирования относительная площадь ЭАС 22% - без отрицательной динамики по сравнению с первичным картированием. В соответствии с формулой стратификации R2=(1,09)n, был оценен риск повторного рецидива ФП, который был увеличен по сравнению с базовым риском рецидива, связанным с повторной реконнекцией ЛВ, в 6,8 раз. С учетом высокого риска повторного рецидива был выполнен персонифицированный протокол аблации с двунаправленной изоляцией зоны ЭАС, изоляция подтверждена стимуляционными пробами.
Способ осуществляют следующим образом:
1. Картирование:
Для картирования высокой плотности окружной изоляции ЛВ и аблации ЛП используется нефлюороскопическая система трехмерной эндокардиальной навигации CARTO 3 (Biosense Webster, США). Аблационно-картирующий электрод NaviStar ThermoCool (Biosense Webster, США) вводится в ЛП. В качестве референта для выполнения картирования используется одна из пар 10-полюсного электрода, позиционированного в коронарном синусе. Если пациент находится на ФП - проводится электрическая кардиоверсия. На синусовом ритме выполняется контактное амплитудное и активационное картирование высокой плотности с трехмерной реконструкцией эндокардиальной уровнем разрешения реконструкции 14. Одновременно проводится построение активационных и амплитудных карт ЛП высокой плотности в режиме мануальной регистрации точек «point by point». Контроль плотности контакта картирующего электрода и эндокардиальной поверхности ЛП осуществляется флюороскопически при условии регистрации стабильной ЭГ, а также с помощью функции проекции изображения кончика электрода на эндокард. Точка считается корректной и подтверждается мануально в режиме реального времени, если удаление точки от поверхности реконструкции не превышает 1 мм. Амплитудные и активационные карты также могут быть проанализированы в режиме «offline». На фиг. 1А, Б проиллюстрирован пример стандартизации биполярной карты высокой плотности по расстоянию электрода от эндокардиальной поверхности предсердия в момент взятия корректной точки. На фиг. 1А карта без стандартизации. Обширная низкоамплитудная зона с поражением крыши и задней стенки ЛП. На фиг. 1Б карта стандартизирована по плотности контакта (удаление точки от поверхности реконструкции не превышает 1 мм). Преимущественная локализация низкоамплитудной зоны - область крыши ЛП. Плотность набора точек также стандартизируется и определяется выбранным порогом интерполяции цвета, который соответствует 5 мм, что в случае полного покрытия карты цветом свидетельствует о том, что расстояние между соседними точками не превышает 5 мм. На фиг. 2А представлена амплитудная карта высокой плотности левого предсердия, стандартизированная по дистанции между соседними точками (порог интерполяции цвета 5 мм).
2. Расчет скоростных параметров:
Параметры проведения электрического импульса определяются путем 5-кратного измерения дистанции и времени активации между двумя соседними точками в проекции вектора активации, результат усредняется и производится расчет средней скорости проведения в каждой зоне. Расчет скоростных параметров производится исходя из параметров LAT (Local Activation Time) и дистанции между соседними точками в проекции вектора активации на изохронной карте (V=Distance/ΔLAT). На фиг. 2Б продемонстрована методика расчета скоростных параметров проведения электрического импульса на активационной (изохронной) карте левого предсердия.
3. Идентификация ЭАС и измерение его относительной площади.
При сопоставлении вольтажных и активационных карт могут быть выявлены зоны миокарда сниженной вольтажности в спектре амплитуд ≤0,75 мв, ассоциированные с замедлением скорости проведения электрического импульса менее 1 м/с (фиг. 2А, Б). Именно эти зоны миокарда сниженной вольтажности в спектре амплитуд ≤0,75 мВ ассоциированы с локальным замедлением скоростных параметров (фиг. 3А, Б) и анизотропией (фиг. 4А, Б) свойств миокарда (фиг. 5А, Б, С), что и является свойством, патогномоничным для аритмогенного субстрата. На фиг. 5А, Б проиллюстрирована методика определения дисперсии рефрактерности в стандартизированных зонах правого и левого предсердий: R ant - передняя стенка правого предсердия (ПП), R post - задняя стенка ПП, R lat - латеральная стенка ПП, R sept - септальная стенка ПП, Cs d - дистальный отдел коронарного синуса (КС), Csp - проксимальный отдел КС, L sept - септальная стенка ЛП, L ant - передняя стенка ЛП, L lat - латеральная стенка ЛП; Roof - область «крыши» ЛП, L post - задняя стенка ЛП, L inf - «дно» ЛП. На фиг. 5С продемонстрирована высокая корреляция относительной площади ЭАС и дисперсии рефрактерности миокарда предсердий. Коэффициент Спирмена (Rs) составил 0,75.
Данные зоны помечаются как электроанатомический субстрат (ЭАС), после может быть измерена их относительная площадь с функции программного обеспечения навигационой системы «area measurement». На фиг. 6 (А, Б) продемонстрирована методика измерения относительной площади зон ЭАС на примере пациента с персистирующей ФП и выраженным ремоделированием ЛП. В данном случае идентифицированы обширные зоны ЭАС с локализацией в области крыши, задней и передне-перегородочной стенки с общей относительной площадью поражения ЛП более 40% (фиг 6А, Б).
4. Определение риска рецидива ФП после циркулярной РЧ изоляции ЛВ.
Для того чтобы оценить прогноз и риск рецидива после циркулярной изоляции ЛВ (первичной или повторной) у пациентов с ФП, необходимо, измерив относительную площадь ЭАС (%S) ЛП пациента, рассчитать относительный риск рецидива в соответствии с формулой стратификации:
R=(1,05)%S ЭАС - риск рецидива ФП после циркулярной изоляции ЛВ
R=(1,09)%S ЭAC - риск рецидива ФП после повторной циркулярной изоляции ЛВ
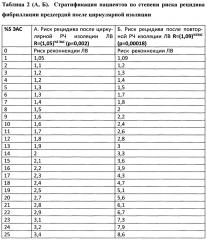
Данные расчетные формулы стратификации риска получены при статистической обработке результатов проспективного обсервационного исследования, в котором было доказано, что параметр % S ЭАС является независимым предиктором рецидива ФП после циркулярной РЧ изоляции ЛВ (таблица 1 А, Б).
Были созданы расчетные таблицы стратификации (таблица 2 А, Б) которые позволяют сделать процесс стратификации риска рецидивов максимально удобным, быстрым и персонифицировать стратегию лечения.
Пример
На фиг. 7 (А, Б) продемонстрирована методика определения относительного риска рецидива ФП и персонификация дальнейшей стратегии лечения. Пациент 56 лет с персистирующей ФП (длительностью 3 недели), до этого длительный (12 лет) анамнез пароксизмальной ФП. Интраоперационно было выполнено биполярное картирование высокой плотности, по результатам которого идентифицирована и измерена зона ЭАС с преимущественной локализацией в области крыши и задней стенки ЛП, относительной площадью 21,6% (фиг. 7А). Пациент был стратифицирован по риску рецидива ФП после циркулярной изоляции ЛВ в соответствии с унифицированной таблицей стратификации, коэффициент относительного риска составил 2,7. Было принято решение ограничиться стандартным протоколом изоляции ЛВ, но с учетом высокого риска рецидива ФП, интенсифицировать антиаритмическую терапию. Была продолжена терапия НОАК и назначена ААТ препаратом 3 класса в сочетании с b-блокаторами. Через 7 месяцев наблюдения, несмотря на достижение насыщения амиодароном, у пациента рецидивировала персистирующая ФП с выраженной тахисистолией предсердий. С учетом высокой симптомности аритмии были определены показания для повторного интервенционного лечения. Интраоперационно была идентифицирована зона реконнекции проведения в области нижнего полюса правой нижней ЛВ и правой верхней ЛВ в области задней стенки и между венами, которые не соответствовали тяжести клинического рецидива ФП. Зоны реконнекции были повторно изолированы, синусовый ритм восстановлен с помощью электроимпульсной терапии. При повторном картировании высокой плотности на синусовом ритме подтверждено наличие ЭАС с относительной площадью 22,5%. Пациент был повторно стратифицирован по риску рецидива ФП после повторной РЧ изоляции ЛВ, коэффициент относительного риска рецидива составил R=(1,09)22,5=6,8. С учетом высокого риска рецидивирования ФП, пациенту была выполнена модификация ЭАС с изоляцией крыши и задней стенки ЛП (фиг. 7Б), изоляция подтверждена стимуляционными пробами. В течение 6 месяцев после повторного интервенционного лечения пациенту была продолжена прежняя ААТ, с учетом устойчивого синусового ритма в течение всего времени наблюдения, амиодарон был отменен, продолжена терапия b-блокаторами, ингибиторами АПФ, НОАК. При наблюдении за пациентом в течение 40 месяцев после повторного интервенционного лечения клинически и по результатам суточного мониторирования ЭКГ (1 раз в 3-6 месяцев), ФП не рецидивировала и сохраняется устойчивый синусовый ритм.
Таким образом, предложенный способ определения электроанатомического субстрата при контактном картировании высокой плотности эндокардиальной поверхности левого предсердия для стратификации риска рецидива фибрилляции предсердий после циркулярной изоляции легочных вен у пациентов с пароксизмальной и персистирующей фибрилляцией предсердий позволил интраоперационно идентифицировать ЭАС на биполярных картах ЛП за счет выявления низкоамплитудных зон, ассоциированных с патологическими электрофизиологическими свойствами миокарда, а именно, с замедлением, анизотропией проведения электрического импульса и дисперсией параметров рефрактерности, количественно измерить относительную площадь ЭАС и, на этом основании, стратифицировать степень риска рецидива ФП у пациента после циркулярной аблации ЛВ.
Заявитель просит рассмотреть представленные материалы заявки «Способ определения электроанатомического субстрата при контактном картировании высокой плотности эндокардиальной поверхности левого предсердия для стратификации риска рецидива фибрилляции предсердий после циркулярной изоляции легочных вен у пациентов с пароксизмальной и персистирующей фибрилляцией предсердий» на предмет выдачи патента РФ на изобретение.
1. Способ определения электроанатомического субстрата при контактном картировании высокой плотности эндокардиальной поверхности левого предсердия для стратификации риска рецидива фибрилляции предсердий после циркулярной изоляции легочных вен у пациентов с пароксизмальной и персистирующей фибрилляцией предсердий, включающий контактное картирование высокой плотности и трехмерную реконструкцию левого предсердия, отличающийся тем, что построение амплитудных и активационных карт левого предсердия осуществляют путем последовательного считывания амплитудной и активационной информации при контакте аблационно-картирующего электрода с поверхности эндокарда левого предсердия в корректных точках, где удаление точки от поверхности реконструкции не превышает 1 мм стандартизированных, как по дистанции между соседними точками, так и по расстоянию от кончика электрода до эндокардиальной поверхности предсердия, по полученным результатам выявляют на картах зоны миокарда сниженной вольтажности в спектре амплитуд ≤0,75 мВ, ассоциированные с замедлением скорости проведения электрического импульса менее 1 м/с, которые и являются электроанатомическим субстратом, измеряют в процентах относительную площадь электроанатомического субстрата левого предсердия, в соответствии со значением которой рассчитывают относительный риск рецидива фибрилляции предсердий после циркулярной изоляции легочных вен в соответствии с формулами стратификации и расчетными таблицами стратификации риска рецидивов фибрилляции предсердий.
2. Способ по п. 1, отличающийся тем, что контактное амплитудное и активационное картирование высокой плотности с трехмерной реконструкцией левого предсердия выполняют на синусовом ритме или стимуляции предсердий с помощью аблационно-картирующего электрода NaviStar ThermoCool с уровнем разрешения реконструкции 14.
3. Способ по п. 1 и 2, отличающийся тем, что плотность контакта кончика аблационно-картирующего электрода и эндокардиальной поверхности левого предсердия при контактном картировании стандартизируют в режиме реального времени или редактирования offline методом мануального подтверждения эндограммы в корректных точках, где удаление точки от поверхности реконструкции левого предсердия не превышает 1 мм.
4. Способ по п. 1, отличающийся тем, что плотность набора точек стандартизируют и определяют порогом интерполяции цвета, который соответствует 5 мм, при этом полное покрытие карты цветом свидетельствует о том, что расстояние между соседними точками не превышает 5 мм.
5. Способ по п. 1, отличающийся тем, что параметры проведения электрического импульса определяют путем 5-кратного измерения дистанции и времени активации между двумя соседними точками в проекции вектора активации, результат усредняют и производят расчет средней скорости проведения в каждой зоне миокарда, исходя из параметров LAT (Local Activation Time) и дистанции между соседними точками в проекции вектора активации на активационной карте (V=Distance/ΔLAT).
6. Способ по п. 1, отличающийся тем, что при сопоставлении вольтажных и активационных карт выявляют зоны миокарда сниженной вольтажности в спектре амплитуд ≤0,75 мв, ассоциированные с замедлением скорости проведения электрического импульса менее 1 м/с, которые помечают как электроанатомический субстрат (ЭАС), и измеряют их относительную площадь с помощью функции программного обеспечения навигационой системы «area measurement».
7. Способ по п. 1, отличающийся тем, что относительный риск рецидива фибрилляции предсердия после циркулярной изоляции легочных вен рассчитывают по формуле стратификации:
R=(1,05)%S ЭАС,
а относительный риск рецидива фибрилляции предсердия после повторной циркулярной изоляции легочных вен рассчитывают по формуле стратификации:
R=(1,09)%S ЭАС,
где
% S - относительная площадь электроанатомического субстрата.