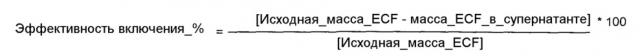Везикулы, содержащие эпидермальный фактор роста и его композиции
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к фармакологии, и может быть использована для получения новых систем доставки лекарственных средств. Везикула по изобретению содержит эпидермальный фактор роста (EGF), катионное поверхностно-активное вещество и холестерин или его производные. Способ получения везикулы включает стадии приготовления водного раствора EGF и катионного поверхностно-активного вещества, растворение холестерина или его производных в органическом растворителе и синтез везикулы сбросом давления раствора. Фармацевтическая композиция по изобретению содержит везикулу и фармацевтически приемлемое вспомогательное вещество. Применение везикулы по изобретению касается получения лекарственного средства для лечения ран, синдрома расстройства дыхания и поражений пищеварительного тракта, а также получения косметического продукта. Косметический продукт по изобретению предназначен для предотвращения старения кожи. Использование изобретений позволяет улучшить терапевтическую эффективность EGF за счет длительной стабильности везикул и высокого включения EGF в них. 6 н. и 21 з.п. ф-лы, 17 табл., 7 ил., 23 пр.
Реферат
Область техники
Данное изобретение относится к областям медицины человека и ветеринарии, косметики и тканевой инженерии, в особенности к области систем высвобождения везикулярного типа, содержащих эпидермальный фактор роста (EGF) в их композиции. Везикулы по изобретению имеют улучшенную терапевтическую эффективность в отношении свободного EGF.
Предшествующий уровень техники
Системы для доставки лекарственного средства на основе везикулярных систем, обычно липосом, составленные из амфифильных молекул, которые включают терапевтически активное вещество, составляют одну из наиболее широко используемых систем в фармацевтической отрасли, так как они обеспечивают повышенную устойчивость для действующего начала, повышают его проницаемость через биологические мембраны и позволяют медленное высвобождение активного ингредиента без потребности в повторных введениях.
EGF является одним из основных факторов роста, который стимулирует пролиферацию клеток и подвижность во время тканевой регенерации. Он также помогает поддерживать тканевой гомеостаз посредством регулирования эпителиальной пролиферации клеток и миграции. Кроме того, EGF индуцирует ангиогенез, что обеспечивает нутритивную поддержку ткани (Hudson and McCawley, Microsc. Res. Tech. 1998, 43: 444-455; Koivisto et al., Exp. Cell Res. 2006, 312: 2791-2805; Liang et al., Wound Repair Regen. 2008, 16:691-698). Этот фактор роста имеет множество применений в фармацевтической области (Wong et al., Biotechnol. Genet. Eng. Rev. 2001, 18: 51-71; Girdler et al., Am. J. Clin. Oncol. 1995, 18: 403-406; Haedo et al., Rev. Esp. Enferm. Dig. 1996, 88: 409-413; Majima, Ophthalmologica 1998, 212:250-256); в косметике (Hasegawa and Yamamoto, Mech. Ageing. Dev. 1992, 66: 107-114, Патент США №5,618,544) и в тканевой инженерии (Christopher et al., Biomacromolecules 2011, 12: 3139-3146).
Были разработаны EGF составы, использующие различные липосомальные системы. Некоторыми примерами является интеграция EGF в однослойные липосомы, содержащие фосфатидилглицерин (PG), фосфатидилхолин (PC) и холестерин (Brown et al., Ann. Surg. 1988, 208: 788-794). Также сообщалось о включении EGF в многослойные липосомы, содержащие PC, холестерин и гиалуроновую кислоту (Yerushalmi, et al., Arch. Biochem. Biophys. 1994, 313: 267-273) или содержащие холестерин и дипальмитоилфосфатидилхолин (DPPC) (Alemdaroğlu et al., J. Biomed. Mater. Res. A 2008, 85A: 271-283; Degim et al., Int. Wound. J. 2011, 8: 343-354). Другим классом липосом, о котором было сообщено, являются мультивезикулярные липосомы, содержащие диолеилфосфатидилхолин (DOPC), димиристоилфосфатидилглицерин (DMPG), холестерин и триолеин (Li et al., Arch. Pharm. Res. 2005, 28: 988-994). Но с другой стороны сообщалось о липосомах, которые содержат катионные липиды, конъюгированные с EGF (Kikuchi et al., Biochem. Biophys. Res. Commun. 1996, 227: 666-671); покрытые полиэтиленгликолем (ПЭГ) липосомы, которые также содержат холестерин и диолеилфосфатидилэтаноламин (DOPE) в комбинации с PC или DPPC (Li et al., Int. J. Pharm. 2003, 258: 11-19). Также было сообщено о липосомах, содержащих DPPC и лизофосфатидилхолин (LPC) (Saddi et al., The Angle Orthodontist 2008, 78: 604-609; Alves et al., Life Sci. 2009, 85: 693-699). EGF составы с применением липосомальных систем также были защищены патентами, такими как патент, раскрывающий гелевую композицию EGF/липосома, и способы, содержащие удерживание EGF в липосомах, содержащих нейтральные и отрицательно заряженные фосфолипиды (патент США No. 4944948); гелевая композиция липосом и способы, которые применяют отрицательно заряженные липосомы и EGF и включают в себя отрицательно заряженные липиды, такие как PG, PC и холестерин (международная заявка на патент No. WO 9009782). Другая заявка на патент относится к топическому нанесению EGF для предотвращения диабетической ампутации стопы, и в ней применяются липосомы, содержащие PC и дезоксихолат натрия. Эта заявка на патент ограничена применением любого типа липосом/ниосом EGF для местного лечения хронических ишемических повреждений диабетической стопы степеней IV и V (международная заявка на патент No. WO 2007/073704). В предшествующем уровне техники не была обнаружена интеграция EGF в везикулярные системы на основе холестерина и катионных поверхностно-активных веществ.
Традиционные способы получения липосом, такие как выпаривание тонких пленок (Agrawal et al., J. Liposome Res. 2005, 15: 141-155), дегидратация-регидрация (Kirby and Gregoriadis, Nat. Biotechnol. 1984, 2: 979-984), замораживание-оттаивание (Ristori et al., Biophys. J. 2005, 88: 535-547) и экструдирование (MacDonald et al., Biochim. Biophys. Acta 1991, 1061: 297-303) имеют некоторые недостатки. Некоторые из этих недостатков связаны с использованием больших количеств растворителей, которые трудно элиминировать впоследствии, или с высокими температурами, требуемыми для некоторых из этих способов, ограничивая их применением термически стабильных веществ. С другой стороны размер и наноструктурирование материала трудно контролировать, и эти способы имеют низкую воспроизводимость во время масштабирования (многостадийные способы). Другой проблемой в приготовлении липосомальных средств является их плохая устойчивость.
Обработка материалов сжатыми текучими средами (CFs) или плотными газами, как в жидком, так и в суперкритическом состоянии, в качестве растворителей, имела большие ожидания на академическом и промышленном уровнях, для приготовления микро- или наноструктурированных материалов, таких как зернистые материалы, везикулярные системы, композитные частицы, структурированные поверхности, и т.д., с большей структурной гомогенностью, чем была достигнута общепринятой обработкой (Holmes et al., Chem. Eur. J. 2003, 9: 2144-2150; Cooper, Adv. Mater. 2001, 13: 1111-1114; Cooper, Adv. Mater. 2003, 15: 1049-1059 и Woods et al., J. Mater. Chem. 2004, 14: 1663-1678). CF или плотный газ является веществом, которое при нормальных условиях давления и температуры существует в виде газа, но увеличением давления может быть конвертировано в жидкости или сверхкритические жидкие среды и быть использовано в качестве растворительной среды для химической и материальной обработки. Наиболее часто применяемым CF является диоксид углерода (CO2), классифицируемый как зеленый растворитель, так как он является нетоксичным, невоспламеняемым, легким в удалении, не оставляет остатков в частицах, является недорогим и легким в регенерировании. С ранних 90-х разработали ряд методологий, которые применяют CFs для приготовления тонкодисперсных материалов, с микро-, субмикро и наноразмерными размерами частиц (Jung и Perrut, J. Supercrit. Fluid, 2001, 20: 179-219). Сольватирующая сила CFs может быть модифицирована температурными и композиционными изменениями в случае общепринятых жидких растворителей и также посредством изменений давления, которые переносятся в растворах намного быстрее. Следовательно, эти способы осаждения в общем имеют возможность достижения очень высоких степеней пересыщения в очень короткие интервалы времени, стимулируя нуклеацию при росте кристалла и тем самым получение микро- или наночастиц с очень узким распределением размеров, при этом контролируя внутреннюю структуру и супрамолекулярную организацию.
Один из способов для получения микро- или наноструктурированных материалов с CFs является способом, называемым сброс давления экспандированного органического раствора DELOS-SUSP (Международная заявка на патент No. WO 2006/079889; патент No. EP 1843836; Cano-Sarabia et al., Langmuir 2008, 24: 2433-2437), который основан на сбросе давления органического раствора предварительно экспандированного посредством CF, генерируя или микро-, или нанодисперсую систему посредством упомянутого сброса давления. В этом способе CF действует как сорастворитель, при этом являясь полностью поддающимся смешению при некоторых условиях давления и температуры с органическим раствором растворенного вещества, которое должно быть стабилизировано в виде микро- или нанодисперсной системы. Указанная стабилизация достигается в присутствии добавок в среду, обычно водную, в которую происходит сброс давления экспандированного раствора. Добавки могут являться эмульгаторами, ионными и не ионными детергентами, поверхностными агентами, коллоидными стабилизаторами и протекторами. Применяя этот способ могут быть получены микро- и/или нанодисперсные системы, такие как липосомы, эмульсии или суспензии. Липосомы или везикулы составлены из холестерина и других мембранных агентов, таких как фосфолипиды и поверхностно-активные вещества, и для их приготовления требуется растворение холестерина и/или других липидов в экспандированном органическом растворе и сброс его давления в водный раствор поверхностно-активного вещества.
Для возможной включения активных веществ в везикулы или липосомы посредством DELOS-SUSP и для генерирования соответствующих везикул требуется растворить активный ингредиент в исходном экспандированном растворе или в водном растворе, в который осуществляется сброс давления указанного экспандированного раствора, и в обоих случаях это растворение должно быть осуществлено в присутствии липидов, детергентов или поверхностно-активных агентов.
Среди катионных поверхностно-активных веществ широко применяются в фармацевтике и косметике вещества типа четвертичного аммония (QUATs). В фармацевтической области они были применены посредством топического, офтальмического, орального, буккального и назального путей. Ранее сообщалось о приготовлении нановезикул холестерин:цетилтриметиламмония бромид (CTAB) с применением технологии DELOS-SUSP. Один пример включения водорастворимых соединений посредством этой технологии описан в источнике "Липосомы и другие везикулярные системы: структурные особенности, способы приготовления и применение в наномедицине" (Progress in Molecular Biology and Translational Science, Elsevier, 2011, vol.104, pp. 1-52), где везикулы холестерин:CTAB применены в качестве носителя для инкапсуляции и введения антибиотика гентамицина. Необходимо подчеркнуть, что сообщаемые инкапсуляции гентамицина являются очень низкими (<2%). Этот тип носителя никогда не применялся для включения белков. Известно, что ионные детергенты являются агентами, которые вызывают денатурирование белка (Akin et al., Anal. Biochem. 1985, 145:170-176; Andersen etal., J. Mol. Biol. 2009, 391: 207-226). Недавно с помощью рамановской спектроскопии было продемонстрировано денатурирование человеческого сывороточного альбумина после добавления CTAB (Vlasova and Saletsky, Laser Phys. 2011, 21: 239-244). Денатурация, как правило, сопровождается потерей функциональных свойств белка.
Вследствие всех вышеупомянутых причин все еще представляет интерес предоставление новых систем высвобождения EGF, легких в стандартизации, с высокой гомогенностью на структурном уровне и в их физико-химических свойствах, что улучшает фармацевтические и фармакологические свойства и/или увеличивает терапевтическую активность EGF.
Краткое описание изобретения
Данное изобретение относится к везикулам в качестве системы доставки лекарственного средства, которые содержат EGF, катионное поверхностно-активное вещество и холестерин или одно из его производных и имеют большую терапевтическую эффективность, чем ранее описанные системы.
Данное изобретение также относится к способу приготовления указанных везикул, содержащих EGF, катионное поверхностно-активное вещество и холестерин или его производные, который включает: a) приготовление водного раствора EGF и катионного поверхностно-активного вещества, b) растворение холестерина или одного из его производных в органическом растворителе, экспандированном с CF, c) синтез везикул сбросом давления раствора, полученного в результате стадии b), на раствор, полученный в результате стадии a).
Фармацевтическая композиция, характеризуемая содержанием везикул, которые включают в себя EGF, катионное поверхностно-активное вещество и холестерин или его производные, и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, также является задачей изобретения. Другой задачей изобретения является применение указанных везикул для получения лекарственных средств и косметических средств.
Фармацевтические композиции по этому изобретению, которые содержат везикулы EGF с другими компонентами, пригодны в качестве лекарственных средств для ускорения способа заживления диабетических язв стоп и других комбинированных ран, таких как среди прочего, венные язвы, язвы-пролежни, ожоги; для восстановления структур передней камеры в поврежденных глазах, при систематическом воспалении слизистой оболочки и во всех заболеваниях желудочно-кишечного тракта, для которых имеет место необходимость в регенерации слизистой оболочки и подслизистой оболочки. В частности, было обнаружено, что эти везикулы обладают значительно большей терапевтической эффективностью для заживления диабетических язв стоп и венных язв, чем везикулы, описанные в предшествующем уровне техники. Изобретение также относится к косметическому продукту, характеризуемому содержанием везикул EGF, катионного поверхностно-активного вещества и холестерина или его производных.
Краткое описание фигур
Фиг. 1. Схематическое представление оборудования для получения везикул, содержащих EGF, катионное поверхностно-активное вещество и холестерин или производное холестерина, где: C - Коллектор; H - Теплообменник; P - Насос; R - Реактор; V - Вентиль; RD - Разрывной диск; ST - Перемешиватель; FL - Фильтр; TI - Индикатор температуры; PI - Индикатор давления; PIC - Регулятор индикатора давления; F - Расходомер.
Фиг. 2. Распределение размеров частиц динамическим рассеянием света (DLS) везикул при сохранении постоянным соотношения CTAB:холестерин постоянным при 1М:1М и варьировании соотношения EGF:холестерин (0 мкМ:1Μ (--°--), 5 мкМ:1Μ (--▼--), 15 мкМ:1Μ (--◊--), 25 мкМ:1Μ (--|--) и 40 мкМ:1Μ (--*--) (A); и при сохранении отношения бромид тетрадецилметиламмония (цетримид):холестерин постоянным при 1M:1Μ и варьировании соотношения EGF:холестерин (0 мкМ:1Μ (--*--), 5 мкМ:1Μ (--°--), 15 мкМ:1Μ (-*--), 25 мкМ:1Μ (-|-) и 40 мкМ:1Μ (--°--) (Β).
Фиг. 3. Изображения крио-трансмиссионной электронной микроскопии (Cryo-TEM) везикул EGF с композицией холестерин:CTAB:EGF (A), холестерин:цетримид:EGF (B), композиции холестерин:бензалкония хлорид (BKC):EGF (C) и β-ситостерин:CTAB:EGF (D) с QUATs:холестерин или β-ситостерин с соотношением 1M:1M и EGF:холестерин или β-ситостерин с соотношением 5 мкМ:1М.
Фиг. 4. Специфическая биологическая активность различных средств EGF в испытании пролиферации клеток, где подвергаются сравнению свободный EGF, липосомы DPPC:холестерин (с соотношением DPPC:холестерин 1M:1M и EGF:холестерин 25 мкМ:1М) и везикулы CTAB:холестерин (A) и везикулы цетримид:холестерин (B) при сохранении соотношения QUATs:холестерин 1M:1M постоянным и варьировании соотношения EGF:холестерин (5 мкМ:1М, 15 мкМ:1Μ и 25 мкМ:1М).
Фиг. 5. Профиль протеолитической деградации после подвергания воздействию трипсина при 37°C в течение различных временных интервалов свободного EGF и различных везикулярных средств при сохранении постоянным соотношения CTAB:холестерин (A) и соотношения цетримид:холестерин (B) при 1M:1M и варьировании соотношения EGF:холестерин (5 мкМ:1Μ, 15 мкМ:1Μ и 25 мкМ:1Μ).
Фиг. 6. Фотографии развития заживления диабетической язвы стопы, соответствующие пациенту JLG в начале лечения(A), после 4 недель (B) и 8 недель (C) лечения с составом для топического распыления, содержащим везикулы с соотношением CTAB:холестерин 1M:1Μ и соотношением EGF:холестерин 5 мкМ:1Μ с концентрацией эквивалента EGF 15 мкг/мл.
Фиг. 7. Фотографии развития заживления диабетической язвы стопы, соответствующие пациенту ZEM в начале лечения(A), после 4 недель (B) и 8 недель (C) лечения. В течение первых 4 недель лечение осуществляли посредством инфильтрации с парентеральным составом, содержащим везикулы с соотношением BKC:холестерин 1M:1Μ и соотношением EGF:холестерин 5 мкМ:1Μ, с эквивалентной концентрацией EGF 75 мкг/мл. Другие 4 недели, до завершения 8 недель, лечение осуществляли посредством применения состава для топического распыления, содержащего везикулы с соотношением CTAB:холестерин 1M:1Μ и соотношением EGF:холестерин 5 мкМ:1Μ с эквивалентной концентрацией EGF 15 мкг/мл.
Подробное описание изобретения
Данное изобретение предоставляет везикулы, которые характеризуются содержанием эпидермального фактора роста (EGF), катионного поверхностно-активного вещества и холестерина или его производных. В варианте осуществления изобретения катионное поверхностно-активное вещество является веществом типа четвертичного аммония.
В контексте данного изобретения термин "EGF" относится к любому варианту молекул EGF, который сохраняет их биологическую активность; например, к укороченным на C-конце молекулам (Calnan et al., Gut 2000, 47: 622-627) или укороченным N-конце молекулам (Svodoca et. al., Biochim. Biophys. Acta 1994, 1206: 35-41; Shin et al., Peptides 1995, 16: 205-210). EGF могут быть получены технологией рекомбинантных ДНК с применением дрожжей, подобных Saccharomyces (Valdés et al., Biotecnol. Apl. 2009, 26: 1-9) или Pichia pastoris (Research Journal of International Studies 2009, 10:36-46); с применением бактерий, таких как Escherichia coli (Yoon et al., Biotechnol. Bioprocess Eng. 1997, 2: 86-89; Abdull Razis et al., Appl. Biochem. Biotechnol. 2008, 144: 249-261); или способами химического синтеза (Shin et al., Peptides 1995, 16:205-210). Объект EGF по изобретению также содержит любой вариант, полученный ранее описанными способами, после того как он будет модифицирован любой процедурой из предшествующего уровня техники, такой как: аминокислотная замена (Shiah et al., J. Biol. Chem. 1992, 267: 24034-24040; Lahti et al., FEBS Lett. 2011, 585: 1135-1139; Международная заявка на патент No. WO 2007/065464) и конъюгация с полиэтиленгликолем (Thomas et al., Bioconjugate Chem. 2001, 12: 529-537; Lee et al., Pharm. Res. 2003, 20: 818-825), или любым другим способом химической или генетической модификации.
Термин "катионное поверхностно-активное вещество" относится к поверхностно-активным веществам с по меньшей мере одним положительным зарядом в молекуле и также включает в себя комбинацию одного или более катионных поверхностно-активных веществ. Например, в соответствии с данным изобретением могут быть применены катионные поверхностно-активные вещества типа соли третичного амина, соли четвертичного аммония и алкиламмония в насыщенных и ненасыщенных гетероциклических соединениях.
В изобретении термин "катионное поверхностно-активное вещество типа четвертичного аммония (QUATs)" относится к соли четвертичного аммония, в которой по меньшей мере один азотный заместитель является длинной цепью. Соединения, такие как CTAB, цетримид и BKC или их смесь, включены в состав QUATs. В предпочтительном варианте осуществления данного изобретения применяемое катионное поверхностно-активное вещество является поверхностно-активным веществом, приемлемым в фармацевтике. QUATs, также как и остальные катионные поверхностно-активные вещества, могут быть получены из коммерчески доступных источников с фармацевтическими и косметическими уровнями качества.
В данном изобретении термин "везикулы" относится к коллоидальным микрочастицам и наночастицам, которые имеют размер между 25 нм и 5 мкм и образуются одним или более бислоев амфифильных молекул, которые содержат водную фазу. В одном варианте осуществления изобретения везикулы имеют молярное соотношение катионного поверхностно-активного вещества к холестерину (или его производным) в пределах от 10M:1Μ до 1M:5Μ и молярное соотношение EGF к холестерину (или его производным), которое находится в пределах от 0,5 мкМ:1Μ до 100 мкМ:1М.
Термин "производные" холестерина в данном изобретении относится к молекулам семейства стероидов, обычно полученных из молекулы-предшественника холестерина и имеющих липофильный характер.
В одном варианте осуществления изобретения везикулы, содержащие EGF, характеризуются тем, что имеют однослойную структуру и приблизительный средний размер между 25 и 500 нм, предпочтительно между 50 и 300 нм. В конкретном варианте осуществления изобретение относится к везикулам, в которых EGF включен в бислой везикул. Приблизительный размер и морфологию везикул оценивают посредством Cryo-TEM и распределение размера везикул характеризуется посредством DLS.
Неожиданно, везикулы по изобретению продемонстрировали значительное возрастание биологической активности EGF (измеренной in vitro) по сравнению со свободным EGF и EGF в липосомах холестерин:DPPC. Кроме того, такие везикулы способны к защите EGF от повреждения протеазой, что является очень важной особенностью для достижения достаточной биодоступности EGF в месте воздействия; тем самым увеличивая его терапевтическую эффективность.
В данном изобретении впервые были синтезированы везикулы EGF, которые улучшают некоторые из фармацевтических и фармакологических свойств этого фактора роста, такие как его активность и устойчивость. Было продемонстрировано, что степень включения EGF в структуру везикул остается стабильной в течение по меньшей мере одного года. Дополнительно, они могут повышать проницаемость через биологические мембраны.
Везикулы по изобретению имеют дополнительное преимущество противомикробного и противогрибкового эффекта, который является желательным в композиции, применяемой в лечении комбинированных ран и других поражений, подверженных лечению с EGF.
В варианте осуществления изобретения везикулы, содержащие EGF, получены посредством технологии CF. В конкретном варианте осуществления технология CF, которую применяют для получения везикул, включает в себя способ, содержащий a) приготовление водного раствора EGF и катионного поверхностно-активного вещества, b) растворение холестерина или его производных в органическом растворителе, экспандированном с CF, и c) синтез везикул сбросом давления раствора, полученного в результате стадии b), на растворы, полученные в результате стадии a). В предпочтительном варианте осуществления катионное поверхностно-активное вещество, применяемое на стадии a), является веществом типа четвертичного аммония.
Изобретение также предоставляет способ приготовления везикул, которые содержат EGF, катионное поверхностно-активное вещество и холестерин или его производные, характеризуемый содержанием следующего: a) приготовление водного раствора EGF и катионного поверхностно-активного вещества, b) растворение холестерина или его производных в органическом растворителе, экспандированном с CF, и c) синтез везикул сбросом давления раствора, полученного в результате стадии b), на раствор, полученный в результате стадии a). В одном варианте осуществления изобретения вышеописанный способ включает в себя катионное поверхностно-активное вещество типа четвертичного аммония.
В одном варианте осуществления изобретения органический растворитель на стадии b) вышеупомянутого способа является растворителем, выбранным из группы, образованной одноатомными спиртами, такими как: этанол, метанол, 1-пропанол, 2-пропанол, 1-бутанол, 1-гексанол, 1-октанол и трифторэтанол; полиатомные спирты, такие как: пропиленгликоль, ПЭГ 400 и 1,3-пропандиол; кетоны, такие как ацетон, метилэтилкетон и метилизобутилкетон; этилендиамин, ацетонитрил, этилацетат и их смеси. В любом случае, какой бы ни была природа органического растворителя, липидный компонент должен являться растворимым в нем и дополнительно указанный растворитель обязательно должен поддаваться смешению c CF и водой. Кроме того, выбранный органический растворитель должен иметь относительно низкую токсичность.
Относительная концентрация EGF и поверхностно-активного вещества в исходном буферном растворе и концентрация холестерина в органическом растворителе определяются требуемым соотношением холестерин:катионное поверхностно-активное вещество:EGF в итоговой везикуле. В целом, соотношение холестерин:катионное поверхностно-активное вещество:EGF может влиять на физико-химические и биологические свойства различных полученных везикул.
В другом варианте осуществления изобретения CF, применяемый в способе, описанном ранее, представляет собой компонент, выбранный между CO2, этаном, пропаном, гидрохлорфторуглеродами (например, CFC-22) и гидрофторуглеродами (например, HFC-134A). Предпочтительно, CF на стадии b) представляет собой CO2, считаемый экологическим растворителем, так как он является нетоксичным, невоспламеняющимся, некорродирующим, не является вредным для окружающей среды и кроме того является широко распространенным в природе.
В одном варианте осуществления изобретения способ приготовления EGF везикул выполняется в устройстве, показанном на фиг. 1. Оно состоит из реактора высокого давления (R), в который добавляется раствор холестерина в этаноле в концентрации (C1) при атмосферном давлении и рабочей температуре (T=TW). На второй стадии, сжатый CO2 добавляется до достижения рабочего давления (P=PW), при этом вырабатывая объемное расширение раствора до молярной доли XCO2. Добавление осуществляется через вентиль V-1 с применением насоса P1 при сохранении остальных вентилей закрытыми. Система поддерживается при давлении Pw и температуре Tw в течение установленного промежутка времени для обеспечения полной гомогенизации и теплового баланса. После этого времени V-4 открывают для соединения реактора R с фильтром FL, который был предварительно приведен под давление с N2 до Pw при сохранении остальных вентилей закрытыми. Открытие V-6 позволяет сброс давления объемно экспандированного раствора на водный раствор EGF с концентрацией (C2) и поверхностно-активное вещество с концентрацией (C3), прокачанные через P2. В этой итоговой стадии поток N2, добавляемый через V-2 при Pw, применяется в качестве поршня для продавливания экспандированного раствора и поддержания постоянного давления внутри реактора во время стадии сброса давления. Наличие фильтра FL позволяет сбор любого осадка, который может образоваться во время способа. Сформированные везикулы собирают в контейнер C и впоследствии хранят в стеклянных флаконах при 4°C. Когда сброс давления окончен, V-6 и V-2 закрывают и происходит сброс давления оборудования посредством повторного открытия V-6.
В одном варианте осуществления изобретения взаимоотношение между количеством CF и органического растворителя соответствует молярной доле CF приблизительно от 0,3 до 0,95; предпочтительно от 0,5 до 0,8. В конкретном варианте осуществления растворение холестерина (или его производных) в CF выполняется в реакторе при давлении Pw приблизительно от 1 до 30 МПа и Tw приблизительно от 10 до 70°C. Предпочтительно приблизительная температура реактора составляет между 10 и 50°C.
В способе по изобретению EGF растворяют в водном растворе, содержащем катионное поверхностно-активное вещество, концентрация которого выше его критической концентрации мицеллообразования.
Неожиданно, везикулы холестерин:QUATs:EGF, синтезированные с применением способа, описанного выше, имеют выходы включения EGF в везикулу очень близкие к 100%, что значительно выше, чем ожидаемые выходы для включения любой растворимой в воде молекулы, принимая во внимание ранее сообщаемые результаты для гентамицина. Эти выходы везикул холестерин:QUATs:EGF также заметно выше, чем полученные для включения других белков со структурными свойствами, подобными EGF, как растворимый в воде белок альбумин бычьей сыворотки (БСА). Это происходит даже, когда ранее описанная процедура DELOS-SUSP применяется для указанного включения БСА, при этом получен выход включения только 42%.
Более того, также неожиданным образом эти выходы включения EGF в везикулы холестерин:QUATs были однозначно больше, чем выходы, полученные для везикул холестерин:DPPC:EGF, даже если для их приготовления применяется способ DELOS-SUSP.
Другим аспектом данного изобретения является фармацевтическая композиция, содержащая везикулы, содержащие EGF, катионное поверхностно-активное вещество и холестерин или его производные и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество. Фармацевтически приемлемое вспомогательное вещество или вспомогательные вещества, которые формируют часть фармацевтической композиции по данному изобретению, могут усилить активность везикулы. Альтернативно, они могут содействовать манипулированию и обработке композиции по данному изобретению. Везикулы EGF по данному изобретению могут быть сформулированы в нескольких фармацевтических формах, таких как инъецируемая, спрей, гели, вязкие растворы, кремы, мази, трансдермальные пластыри, депо, ингаляционные составы и другие известные специалисту в данной области.
Разнообразные вспомогательные вещества могут быть смешаны во время синтеза везикул по этому изобретению или после этого для образования подходящего материала для вышеупомянутой формы дозировки. Обычно вспомогательные вещества; такие как солюбилизаторы или растворители, поверхностно-активные вещества, pH модификаторы, антиоксиданты, разбавители, матричные системы, комплексообразующие агенты, загустители, диспергаторы, увлажнители, красители, ароматизаторы, консерванты, усилители проницаемости и другие могут быть применены для обычных целей и в типичных количествах без воздействия на характеристики композиции по данному изобретению, как известно специалисту в данной области (Remington’s Pharmaceutical Sciences (1995)). Дополнительные примеры вспомогательных веществ, которые могут быть применены в фармацевтических составах везикулы EGF можно найти в Handbook of Pharmaceutical Excipients (6th edition).
В варианте осуществления данного изобретения фармацевтическая композиция имеет форму для контролируемого или пролонгированного высвобождения. Формы пролонгированного или контролируемого высвобождения обычно включают в себя матричные системы, ионообменные смолы или индивидуальные барьеры для контроля диффузии везикул EGF.
В одном варианте осуществления изобретения приготовление фармацевтических композиций везикул EGF обусловлено способом концентрации-диафильтрации с применением устройства, известного в этой технической отрасли. Фармацевтические композиции изобретения могут быть введены разнообразными путями, среди них: системный, внутриочаговый, мукозальный, топический, трансдермальный, офтальмический или в виде ингаляционного состава.
В другом аспекте данное изобретение содержит применение везикул EGF, катионного поверхностно-активного вещества и холестерина или его производных в получении лекарственного средства. В варианте осуществления изобретения указанное лекарственное средство предназначено для лечения заболеваний, для которых требуется содействие способам заживления и тканевой регенерации в любом млекопитающем виде; где катионные поверхностно-активные вещества, холестерин и EGF, образующие указанные везикулы, приемлемы в фармацевтике. В предпочтительном варианте осуществления млекопитающее является человеком.
Указанное медицинское применение содержит введение эффективного количества указанных везикул для лечения заболевания, для которого требуется экзогенное введение EGF для регулирования способов пролиферации, роста и миграции эпителиальных клеток или для индуцирования ангиогенеза. В целом, считается, что эффективная концентрация для введения везикул EGF по данному изобретению (или композиции, содержащей их) должна составлять от 1,0 до 200 мкг/мл эквивалентов EGF, предпочтительно от 5,0 до 100 мкг/мл эквивалентов EGF в расчете на введение. Объем и частота введения зависит от типа повреждения, его размера и применяемого устройства для введения, как хорошо известно специалистам в данной области. Также может являться подходящим введение требуемой дозы в двух, трех, четырех или более частей дозы в соответствующие интервалы в течение дня.
Точная дозировка и частота введения зависит от конкретного состояния, подвергаемого лечению и его тяжести, возраста, веса, пола, степени заболевания и общего физического состояния пациента, также как и от каких-либо других сопутствующих лекарственных средств, вводимых индивиду, как хорошо известно специалистам в данной области. Дополнительно, очевидно, что эффективное суточное количество может снижаться или возрастать в зависимости от того, как пациент отвечает на лекарственное лечение и/или оценки, сделанной врачом, который прописал лекарственное средство по данному изобретению. Таким образом, суточные эффективные количества, приведенные выше, должны считаться указаниями или рекомендациями.
В одном варианте осуществления изобретения лекарственное средство, произведенное с везикулами по изобретению, применяется для лечения комбинированных ран любой периферический мягкой ткани. В конкретном варианте осуществления комбинированная рана является диабетической язвой стопы. В другом конкретном варианте осуществления лекарственное средство применяется для лечения венных язв, язв-пролежней или ожогов.
В другом варианте осуществления изобретения лекарственное средство применяется для лечения заболевания, такого как синдром расстройства дыхания у взрослых. Лекарственное средство, произведенное с везикулами по изобретению, также пригодно для лечения поражений пищеварительного тракта, таких как язвенный колит, дуоденальные язвы и дистальный колит. В другом варианте осуществления лекарственное средство применяется для лечения поражения глаза.
Косметический продукт, характеризуемый содержанием везикул EGF, катионного поверхностно-активного вещества и холестерина или его производных и по меньшей мере одного приемлемого вспомогательного вещества для косметики или дермальной фармацевтики также является частью данного изобретения. В этом аспекте изобретения катионные поверхностно-активные вещества, холестерин (или его производные) и EGF являются приемлемыми в фармацевтике и косметике. Везикулы EGF по данному изобретению могут быть сформулированы в разнообразные косметические или дермальные фармацевтические формы в виде твердых, жидких и полутвердых форм, таких как и без ограничения ими: инъекции, распыляемые спреем жидкости, гели, кремы, множественные эмульсии, водные дисперсии, виды молочка, бальзамы, лосьоны, пены, сыворотки, мази, трансдермальные пластыри, обтирания, депо, благоухания, порошки, пластинки, ингаляционные составы и тому подобное, во всех случаях, включая ополаскивающие и стойкие составы.
В целом, косметическая или дермальная фармацевтическая композиция изобретения может содержать вспомогательные вещества, такие как, но без ограничения ими, солюбилизаторы или растворители, поверхностно-активные вещества, pH модификаторы, антиоксиданты, разбавители, матричные системы, комплексообразующие агенты, загустители, диспергаторы, увлажнители, гелеобразующие полимеры, загустители, смягчители, стабилизаторы, поглотители запаха, хелатирующие агенты, растительные экстракты, эфирные масла, экстракты из морских водорослей, агенты из способа биоферментации, минеральные соли, клеточные экстракты и солнечные фильтры (фотозащитные агенты органической или минерально природы, активные против A и/или Β ультрафиолетовых лучей), пигменты или красители, ароматизаторы, консерванты, усилители проницаемости и другие, и их смеси, при условии, что они физически и химически совместимы с другими компонентами композиции по данному изобретению. Эти вспомогательные вещества могут быть применены для обычных целей в типичных количествах без воздействия на характеристики композиции по данному изобретению, как известно специалисту в данной области (дополнительные примеры описаны в CTFA Cosmetic Ingredient Handbook, Twelfth Edition (2008)). Такие дополнительные адъюванты могут иметь синтетическое или натуральное происхождение, как например растительные экстракты или могут происходить из способа биоферментации.
Следовательно, применение везикул EGF, ранее описанное для получения косметического продукта, также является задачей данного изобретения. В варианте осуществления изобретения косметический продукт предназначен для предотвращения одряхления и старения кожи.
Примеры
Следующие примеры продемонстрированы в иллюстративных целях и не должны рассматриваться в качестве ограничений изобретения.
Пример 1. Синтез везикул холестерин:DPPC:EGF с применением технологии сжатой текучей среды
Сначала раствор 12 мг холестерина и 24 мг DPPC в 1,2 мл этанола вводили в реактор высокого давления в объеме 6 мл при атмосферном давлении и температуре (Tw=35°C). Добавляли сжатый CO2, вызывая объемное расширение раствора до достижения молярной доли XCO2=0,7 и рабочего давления Pw=10 МПа. Систему оставляли при перемешивании в течение приблизительно 60 минут при 10 МПа и 35°C, до достижения полной гомогенизации и теплового баланса. В конечном счете давление экспандированного органического раствора снижалось от рабочего давления до атмосферного давления на 24 мл водного раствора EGF с требуемой концентрацией (между 15 мкМ и 40 мкМ). В этом последнем этапе поток N2 при 10 МПа применяется в качестве поршня для продавливания объемного экспандированного раствора для поддержания постоянного рабочего давления в реакторе во вр