Липосомный состав и его получение
Иллюстрации
Показать всеГруппа изобретений относится к химико-фармацевтической промышленности и представляет собой способ получения терапевтического состава и сам состав для лечения состояний с вовлечением моноцитов и/или макрофагов, где данный состав, содержащий множество липосом, получают следующим образом: (а) смешивание раствора, содержащего бисфосфонат, с раствором, содержащим липиды, содержащие DSPC, DSPG и холестерин в молярном отношении 3:1:2, с образованием везикул, таким образом, что массовое отношение указанного бисфосфоната к липиду составляет от 1:5 до 1:8, (b) экструзия указанных везикул в одну стадию через фильтр, имеющий размер пор 100 нм, и (с) ультрафильтрация везикул. Группа изобретений позволяет повысить однородность и стабильность состава с множеством требуемых физических характеристик, которые могут контролироваться независимо друг от друга. 2 н. и 17 з.п. ф-лы, 6 ил., 6 табл., 4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому липосомному составу и процессу получения липосомного состава.
УРОВЕНЬ ТЕХНИКИ
Липосомы известны в области техники как носители для доставки терапевтических агентов целевым клеткам для лечения различных медицинских состояний. В одном из применений липосомы можно получать для инкапсулирования фармацевтического агента, который может быть селективно фагоцитирован макрофагами. После фагоцитоза липосомы, помимо прочих эффектов, внутриклеточно высвобождают агент, подавляя воспалительные функции макрофагов.
В области техники описано несколько способов получения таких липосом (см., например, , J. и др., 1994, J. Drug Target, 2:299-308; , J. и др., 1993, Calcif. Tissue Int., 53:139-145; Lasic DD., Liposomes Technology Inc., Elsevier, 1993, 63-105. (глава 3); Winterhalter M, Lasic DD, Chem Phys Lipids, 1993; 54(1-3):35-43). В одном из таких способов, известному как способ гидратации тонкой липидной пленки, липосомы формируются в стеках кристаллических бислоев, которые гидратируют в гидратированные липидные пласты, которые отрываются в ходе перемешивания и закрываются в многослойные везикулы (MLV). После образования указанных частиц, их размер зависит от последующего используемого способа, например, использования ультразвуковой энергии (обработка ультразвуком) или механической энергии (экструзия). В результате обработки ультразвуком получают маленькие однослойные везикулы (SUV) и для нее требуется использование ультразвуковых диспергаторов типа ванны и/или погружного типа. Альтернативно, в результате экструзии липидов, в ходе которой липидную суспензию продавливают под высоким давлением (до 3,45 Мпа (500 psi)) через ряд поликарбонатных фильтров, обычно мембран с порами в 0,8, 0,4, 02, и 0,1 мкм, получают частицы с размером, примерно равным диаметру пор используемого фильтра. Эти способы применимы только для мелкомасштабного производства, преимущественно для исследовательских целей. Более того, способы экструзии под высоким давлением связаны с высокой стоимостью и длительными сроками проведения. Таким образом, существует потребность в способе получения липосом, подходящем для получения в промышленных масштабах, воспроизводимом и отвечающем требованиям контроля качества, стабильности, масштабируемости и стерилизации липосомной продукции.
К тому же, известные в области техники липосомные составы не являются по существу однородными по размеру и форме, что является ключевым свойством фармацевтической композиции, необходимым для обеспечения стерильности продукта и избегания потенциальных токсических побочных эффектов от больших аберрантных липосом. В настоящее время трудно получить липосомный состав, имеющий однородные по размеру липосомы. В ходе процесса экструзии многослойных везикул через серию фильтров, включая, например, поликарбонатные фильтры с порами в 100 нм, не удается получить состав, состоящий из популяции по существу однородных липосом размером в 100 нм. В действительности, в зависимости от физических характеристик липосом, таких как сжимаемость и/или стабильность, средний диаметр экструдированных везикул может сильно различаться в зависимости от типа и размера используемых фильтров. Таким образом, существует потребность в способе подходящем для получения по существу однородных по размеру и форме липосомных составов.
Кроме того, многие физические характеристики липосомного состава влияют на клеточный ответ на липосомы и воздействуют на эффективность липосомы в качестве фармацевтической композиции. Способ получения во многом влияет на физические характеристики липосомного состава. Однако в области техники не раскрыто, как можно контролировать характеристики липосом в процессе получения состава таким образом, чтобы повысить эффективность получения и стабильность липосом. Таким образом, существует потребность в разработке рентабельного крупномасштабного процесса получения липосомных составов, позволяющего регулировать характеристики липосомного состава, обеспечивающего получение однородных и подходящих для клинического использования липосом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящим изобретении описаны новые липосомы, инкапсулирующие терапевтические агенты. Изобретение также относится к липосомным составам, имеющим высокую степень однородности размера, что приводит к минимизации побочных эффектов и увеличению надежности в процессе стерилизации. В изобретении также описан эффективный и рентабельный способ крупномасштабного получения липосом в условиях экструзии под низким давлением. Полученные таким образом липосомы имеют желательные характеристики и эффективные терапевтические свойства.
Липосомный состав характеризуется липосомами, имеющими требуемый состав и физические характеристики. Липосома содержит липидный ингредиент, инкапсулирующий терапевтический агент. Согласно одному из аспектов настоящего изобретения липидный ингредиент содержит дистеароил фосфатидилхолин (DSPC), дистеароил фосфатидилглицерин (DSPG) и холестерин, предпочтительно в молярном отношении 3:1:2 (DSРС:DSРG:холестерин).
Липосома состоит из липидного ингредиента и терапевтического агента, при этом отношение массы терапевтического агента к массе липидного ингредиента, называемое отношение лекарственное средство: липид, составляет примерно от 1:5 до 1:8 по массе, предпочтительно от 1:6 до 1:7. Отношение лекарственное средство: липид увеличивает стабильность и эффективность, а также влияет на скорость потери лекарства липосомами и на целостность липосом. Эти и другие структурные характеристики придают неожиданные преимущества составу, описанному в настоящем изобретении.
Липосомы, описанные в настоящем изобретении имеют размер 30-500 нм, предпочтительно 70-120 нм, 100-300 нм, 100-180 нм и 70-150 нм в зависимости от типа терапевтического агента и/или используемого носителя. В одном предпочтительном варианте реализации изобретения липосомы могут составлять в размере 80±5 нм.
Другие физические характеристики липосомной композиции также значительно влияют на ее стабильность и эффективность. Например, электрическая проводимость липосом может повлиять на их селективное поглощение фагоцитарными клетками. В одном из вариантов реализации значение проводимости составляет 13,5-17,5 мСм/см. Также внутренняя и внешняя осмоляльность состава похожим образом влияет на его стабильность и эффективность. Предпочтительно, чтобы внешняя осмоляльность совпадала с осмоляльностью человеческого организма, причем внутренняя осмоляльность должна оставаться достаточно низкой, чтобы повысить стабильность состава. В одном из вариантов реализации изобретения внутренняя осмоляльность составляет 340-440 мО/кг. Другим важным параметром является рН липосом и/или липосомного состава. Например, внутреннее значение рН около 6,9 липосомного состава улучшает долговременную стабильность, как и скорость выведения лекарственного препарата, а также на способность к инкапсуляции лекарственного средства.
Представленные в настоящем изобретении липосомы являются достаточно жесткими, по сравнению с известными из области техники, поскольку они имеют менее сжимаемые липосомные мембраны. Липосомы, представленные в настоящем изобретении, имеют сжимаемость менее чем 0,7 мл/г. Благодаря увеличенной жесткости представленные в настоящем изобретении липосомы имеют увеличенные стабильность и время хранения.
Липосомный состав также имеет новые и полезные характеристики. Липосомные состав согласно настоящему изобретению состоит из по существу единородных по размеру и форме и при этом сравнительно жестких липосом. Варьирование по размеру между липосомами представленного состава является небольшим. Однородность липосом, измеренная с помощью индекса разнообразия (Poly Diversity Index ("PDI")), составляет менее 0,075, предпочтительно в диапазоне примерно 0,02-0,05, что указывает на высокую степень однородности состава. Соответственно липосомный состав согласно настоящему изобретению значительно снижает вероятность побочных эффектов, связанных с большими липосомами, а также позволяет проводить стерилизующую фильтрацию более эффективно.
Другим аспектом настоящего изобретения является способ получения липосомного состава. Способ получения включает этапы (1) смешивания терапевтического агента с предварительно выбранными липидами с образованием везикул, (2) экструзии везикул через фильтр с одним размером пор в одну стадию и (3) ультрафильтрации. После ультрафильтрации продукт может быть стандартизирован до получения желаемой конечной концентрации. Поскольку экструзию на этапе 2 проводят в одну стадию и при низком давлении, настоящий способ снижает производственные затраты и время, а также увеличивает выход продукта по сравнению с экструкцией при высоком давлении и с использованием множества стадий. Данные производственные этапы можно приспособить для крупномасштабного производства.
В одном из вариантов реализации, состав получают (1) смешиванием терапевтического агента с липидами, содержащими DSPC, DSPG и холестерин в молярном отношении 3:1:2 с образованием везикул, причем отношение массы терапевтического агента к липидам составляет от примерно 1:5 до 1:8, (2) экструзией везикул через фильтр с размером пор примерно 100 нм в одну стадию, и (3) ультрафильтрацией.
Также другим аспектом настоящего изобретения является липосомный состав, полученный согласно описанным выше этапам полуения. Состав включает множество липосом, состоящих из некоторого количества липидного ингредиента, инкапсулирующего терапевтический агент. Например, такой липидный ингредиент может содержать DSPC, DSPG и холестерин в молярном отношении 3:1:2, и массовое отношение терапевтического агента и липидного ингредиента может составлять примерно от 1:5 до 1:8. Состав получают в ходе следующих этапов: (1) смешивание терапевтического агента с предварительно выбранными липидами с образованием везикул, (2) экструзия везикул через фильтр с одним размером пор в одну стадию и (3) ультрафильтрация. После ультрафильтрации продукт может быть стандартизирован до получения требуемой конечной концентрации. Предпочтительно, состав, полученный указанным способом, имеет значение PDI менее чем 0,075, более предпочтительно в диапазоне от 0,02 до 0,05. В ходе этого процесса получают липосомный состав, имеющий новые и полезные свойства, включая, например, отношение липидных ингредиентов 3:1:2, отношение лекарственное средство: липид, PDI, жесткость, рН, осмоляльность и электрическая проводимость.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 изображена схема процесса получения липосомного состава согласно настоящему изобретению.
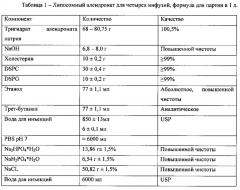
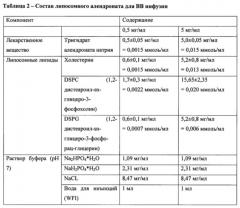
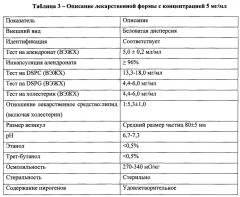
На Фиг. 2 показана схема, описывающая процесс получения 1 л липосомного алендроната для в.в. инфузий при дозировке 5 мг/мл, причем в этом процессе контролируются параметры, описанные в одном из аспектов настоящего изобретения.
На Фиг. 3 показано изображение ТЕМ липосомного алендроната согласно одному из аспектов настоящего изобретения.
На Фиг. 4 показан график сравнения удельной сжимаемости различных липосомных составов.
На Фиг. 5А показан график распределения размера липосом в составе, описанном в настоящем изобретении.
На Фиг. 5В показан график распределения размера липосом в составе, известном из уровня техники.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретения относится к новым липосомам, составу и способу его получения для применения для лечения различных заболеваний. Состав состоит из множества липосом, инкапсулирующих терапевтический агент, или «инкапсулируемый агент». Физические характеристики каждой липосомы улучшают стабильность и эффективность липосомного состава. Состав определяется липосомами, являющимися по существу однородными по форме и размеру. Также в настоящем изобретении описан эффективный и рентабельный способ получения липосомного состава, и при этом подходящий для крупномасштабного производства. Далее, изобретение относится к полученному данным способом липосомному составу, имеющему новые и полезные характеристики.
А. Компоненты липосом
Настоящее изобретение относится к новой и полезной форме липосом. Для получения липосом согласно изобретению могут использоваться различные липосомные ингредиенты. Предпочтительно липидный ингредиент является нетоксичным биосовместимым липидом, таким как, например, липиды, полученные из фосфатидил-холина, фосфоглицерина и/или холестерина. В одном из вариантов реализации настоящего изобретения липидный ингредиент включает дистеароилфосфатидилхолин (DSPC), дистеароилфосфатидилглицерин (DSPG) и холестерин, предпочтительно в молярном отношении примерно 3:1:2 (DSРС:DSРG:холестерин).
Липидный ингредиент инкапсулирует терапевтический агент, причем оба компонента имеют заданную массу. В настоящем документе термин «отношение лекарственного средства к липиду» (или «отношение лекарственное средство:липид») относится к отношению массы лекарства к массе липидного ингредиента, которые составляют липосомы и/или состав. В одном из вариантов реализации настоящего изобретения, липосомы имеют отношение лекарственное средство:липид примерно от 1:5 до 1:8, предпочтительно между 1:6 и 1:7 по массе.
В. Физические свойства липосом
Различные физические параметры и характеристики липосом могут повлиять на однородность, стабильность и эффективность состава. Указанные физические характеристики включают (1) осмоляльность липосом (внешнюю и внутреннюю), (2) проводимость липосом (внешнюю и внутреннюю по отношению к липосоме), (3) отношение лекарственного средства к липиду, (4) рН липосом (внешний и внутренний по отношению к липосоме) и (5) тип липидов и лекарственных средств, использованных в композиции.
Осмоляльность является мерой концентрации растворенных веществ липосомного состава. В настоящем документе термин «осмоляльность» относится к мере концентрации растворенных веществ, определенной как число растворенных молекул в осмолях (осмоль) растворенного вещества на килограмм растворителя (мО/кг). Под внутренней осмоляльностью понимают концентрацию растворенных веществ внутри липосомы, в то время как под внешней осмоляльностью понимают концентрацию растворенных веществ вне липосомы. В одном из вариантов реализации настоящего изобретения липосомы имеют низкую внутреннюю осмоляльность. Внутреннюю осмоляльность можно регулировать путем изменения количества инкапсулируемого в липосоме лекарственного вещества. В области техники описаны липосомы, содержащие так много лекарства, насколько это возможно, что приводит к получению липосом с высокой осмоляльностью (высоким инкапсулирующим отношением). Однако в настоящем изобретении описаны липосомы, имеющие более низкую осмоляльность (или более низкое инкапсулирующее отношение) по сравнению с известными из уровня техники. Сниженная осмоляльность (например, примерно 340-440 мО/кг), описанная в настоящем документе, повышает стабильность и однородность липосом в липосомном составе. Одним из способов получить низкую осмоляльность является снижение количества инкапсулируемого терапевтического агента в липосомном составе. Другим путем снижения внутренней осмоляльности, не требующим изменения отношения лекарственное средство:липид, является использование незаряженного агента, такого как некоторые полисахариды или сахара, известные из уровня техники.
Внешняя осмоляльность является предпочтительно изотонической по отношению к организму, что особенно важно для инъецируемых составов. Таким образом, внешняя осмоляльность является предпочтительно относительно постоянной. Внутренняя и внешняя осмоляльность в настоящем изобретении приводят к получению высокостабильного продукта, низкой скорости потери лекарственного и надежной способности к инкапсуляции у липосом.
Использованный в настоящем документе термин «проводимость» относится к способности липосом проводить электричество за счет ионного состава раствора. Проводимость относится к ионному составу липосом и влияет на стабильность, скорость потери лекарственного вещества липосомами и способности к инкапсуляции липосомного состава. Проводимость липосом составляет примерно 13,5-17,5 мСм/см. В одном из вариантов реализации настоящего изобретения инкапсулируемое лекарственное средство заряжено. Нужно отметить, что заряженное лекарственное средство имеет уровень корреляции 1:1 между проводимостью и осмоляльностью липосом. Поэтому изменение количества инкапсулируемого агента пропорционально влияет на обе характеристики. В альтернативном варианте реализации используется нейтральный (незаряженный) лекарственный агент. При использовании нейтральных агентов, таких как, например, полисахариды, для изменения проводимости, осмоляльность становится независимой от концентрации лекарства и, таким образом, может регулироваться независимо от концентрации лекарственного агента.
Другим новым аспектом липосом согласно изобретению, является относительная жесткость строения, то есть стабильность липосом в различных условиях окружающей среды и условиях внутри организма, а также их подверженность разрушению. Жесткость липосом является мерой прочности липосомной мембраны и ее способности противостоять сдвиговым силам и давлению, что может повысить время хранения липосом. Жесткость липосом обратно пропорциональна их сжимаемости. Липосомы, имеющие низкую сжимаемость, имеют большую жесткость. Одним из возможных способов определения жесткости липосом является ультразвуковая вискозиметрия и денситометрия. Способы определения жесткости липосом известны из области техники и описаны, например, Cavalcanti, Leide Р., и др., ((Compressibility study of quaternary phospholipid blend monolayers)), Colloids and Surfaces B: Biointerfaces 85(2011) 153-160; и Hianik, Tibor и др., "Specific volume and compressibility of bilayer lipid membranes with incorporated Na, K-ATPase" General Physiology and Biophisics 30 (2011) 145-153, содержание которых полностью включено в настоящую заявку посредством ссылки.
Липосомы имеют значения рН во внешней среде липосомы (внешний рН) и во внутренней инкапсулируемой части липосомы (внутренний рН). рН влияет на стабильность, скорость потери лекарственного средства липосомой и инкапсулирующую способность липосомного состава. В одном из вариантов реализации состав имеет значение внутреннего рН примерно 6,8-7,0. Внутренний рН 6,8-7,0 является важным условием для стабильности состава. рН растворенного терапевтического агента может поддерживаться, кроме прочего, путем постоянного титрования раствора для поддержания уровня рН 6,8-7,0 или поддерживаться на заданном значении рН, например, примерно рН 6,9 с помощью растворения терапевтического агента в известном буфере. Внешний рН липосомы может отличаться от внутреннего рН липосомы. Разный рН может достигаться путем изменения рН растворов, которые составляют внутреннюю и внешнюю среды липосомы.
С. Состав
Липосомный состав, описанный в настоящем изобретении включает множество липосом, имеющих описанные выше характеристики, и по существу однородных по размеру и форме, при этом имея небольшое варьирование по размеру между липосомами. Однородность состава измеряется по его индексу полидисперсности (Poly Dipersity Index) (PDI). PDI измеряется в по нелинейной шкале от 0 до 1, где 0 означает идеально однородный состав, а состав, имеющий значение PDI равное 1 является высоко разнородным (неоднородным). Состав согласно настоящему изобретению имеет значение PDI менее 0,075, предпочтительно между 0,02 и 0,05. Значение PDI может быть посчитано, как описано в Zetasizer nano user manual, 2003, Malvern Instruments, pp 5.5-5.6 и в Kazuba M., Nano Series and HPPS Training Manual Chapter 1, 2003, Malvern Instruments, pp 9, содержание которой включено в настоящую заявку посредством ссылки. Более того, значение PDI настоящего состава близко к значению стандартов измерения, где значение PDI составляет менее 0,02. Составы, ранее описанные в уровне технике, имели заметно отличающийся уровень однородности по сравнению с настоящим изобретением, со значением PDI обычно примерно 0,3. Поскольку PDI имеет нелинейную шкалу, значение PDI настоящего изобретения значительно отличается от известных из области техники. Причем низкое значение PDI настоящего изобретения выгодно снижает токсичные эффекты, связанные с большими липосомами, и характеризует состав, более подходящий для фильтровой стерилизации.
Описанный в настоящем изобретении состав содержит липосомы с повышенными показателями жесткости и однородности, что повышает их стабильность и время хранения. Можно также предположить, что составы согласно настоящему изобретению являются эффективными. Banai, Shmuel, и др., "Targeted anti-inflammatory systemic therapy for restenosis: The Biorest Liposomeal Alendronate with Stent sTudy (BLAST) - a double blind, randomized clinical trial", Am Heart J. (2013) 165(2): 234-40.
Липосомы настоящего состава имеют специальный размер, подходящий для поглощения макрофагами и моноцитами. Липосомы могут иметь размеры 30-500 нм. Хотя, в зависимости от типа используемого агента и/или носителя эти размеры включают, но не ограничиваются ими, 70-120 нм, 100-500 нм, 100-300 нм, 100-180 нм и 80-120 нм. Данные диапазоны, однако, являются примерами и другие конкретные размеры, подходящие для поглощения в ходе фагоцитоза, будут понятны без выхода за рамки сущности и объема настоящего изобретения. В одном предпочтительном варианте реализации размер липосом в составе составляет примерно 80±5 нм.
Липосомы согласно настоящему изобретению способны инкапсулировать множество видов терапевтических агентов. После фагоцитоза липосомы терапевтический агент становится веществом, которое может снизить или ингибировать активность и/или уничтожить некоторое число клеток фагоцитов в организме пациента. Терапевтический агент может быть химическим соединением, включая малые и большие молекулы, смесью химических соединений, органическим или неорганическим веществом, биологическими макромолекулами, такими как белки, углеводы, пептиды, антитела или нуклеиновые кислоты. Терапевтический агент может быть натуральным продуктом, полученным из известных организмов, или синтетическим соединением.
Одним из типов полезных терапевтических агентов являются бисфосфонаты. Бисфосфонаты (ранее называемые дифосфонатами) являются соединениями, характеризуемыми двумя связями С-Р. Если обе связи расположены на одном атоме углерода (Р-С-Р), их называют геминальными бисфосфонатами. Бисфосфонаты являются аналогами эндогенных неорганических пирофосфатов, которые участвуют в регуляции и резорбции формирования костей. Бисфосфонаты иногда могут формировать полимерные цепи. Будучи высоко гидрофильными и отрицательно заряженными, бисфосфонаты в свободном виде практически неспособны пересекать клеточные мембраны.
В настоящем документе термин «бисфосфонаты» относится и к геминальным и негеминальным бисфосфонатам. Предпочтительный агент, являющийся бисфосфонатом, имеет следующую формулу (I):
причем R1 является Н, ОН или атомом галогена;
R2 является галогеном, линейным или разветвленным C1-С10 алкилом или С2-С10 алкенилом, необязательно замещенным гетероарил или гетероциклил C1-С10 алкиламином или С3-C8 циклоалкиламином, где амин может быть первичным, вторичным или третичным; -NHY, где Y является водородом, С3-С8 циклоалкилом, арилом или гетероарилом; или R2 является -SZ, где Z является хлорзамещенным фенилом или пиридинилом.
Одним из примеров бисфосфонатного агента является алендронат, имеющий следующую формулу (II):
Многие бисфосфонаты имеют схожую с алендронатом активность и полезны в качестве терапевтических агентов для настоящего изобретения. Такие бисфосфонаты можно выбирать на основании их способности имитировать биологическую активность аледроната. Такая активность включает, например: ингибирующую активность in vitro у фагоцитарных клеток, например, макрофагов и фибробластов, при попадании в данные клетки; ингибирование секреции IL-2 и/или IL-6 и/или TNF-α макрофагами; и активность in vivo, например, способность испытанных составов к истощению или инактивации моноцитов крови в животных моделях или у человека или к лечению инфаркта миокарда и сокращению зоны инфаркта.
Бисфосфонаты, применимые в настоящем изобретении, включают, без ограничения, клодронат, тилудронат, 3-(N,N-диметиламино)-1-гидроксипопан-1,1-дифосфоновую кислоту, например, диметил-APD; 1-гидрокси-этилиден-1,1-бисфофоновую кислоту, например, этидронат; 1-гидрокси-3(метилпентиламино)-пропилиден-бисфосфоновую кислоту (ибандроновую кислоту), например, ибандронат; 6-амино-1-гидроксигексан-1,1-дифосфоновую кислоту, например, амино-гексил-БФ; 3-(N-метил-N-пентиламино)-1-гидроксипропан-1,1-дифосфоновую кислоту, например, метил-пентил-APD; 1-гидрокси-2-(имидазол-1-ил)этан-1,1-дифосфоновую кислоту, например, золедроновую кислоту; 1-гидрокси-2-(3-пиридил)этан-1,1-дифосфоновую кислоту (ризедроновая кислота), например, ризедронат; 3-[N-(2-фенилтиоэтил)-N-метиламино]-1-гидроксипропан-1,1-бисфосфоновую кислоту; 1-гидрокси-3-(пирролидин-1-ил)пропан-1,1-бисфосфоновую кислоту, 1-(N-фениламинотиокарбонил)метан-1,1-дифосфоновую кислоту, например FR 78844 (Fujisawa); тетраэтиловый эфир 5-бензоил-3,4-дигидро-2Н-пиразол-3,3-дифосфоновой кислоты, например U81581 (Upjohn); и 1-гидрокси-2-(имидазо[1,2-а]пиридин-3-ил)этан-1,1-дифосфоновую кислоту, например YM 529.
В некоторых вариантах реализации, таких как, например, алендронат натрия, инкапсулированный в DSPC, DSPG и холестерине, может использоваться массовое отношение лекарственное средство:липид равное 1:5,7, что примерно равно молярному отношению 1:3. В случае клодроната натрия, другого терапевтического агента, инкапсулируемого в том же липидном ингредиенте, можно использовать примерное массовое отношение 1:5,4, что примерно равно молярному отношению 1:3. В настоящем изобретении можно использовать и другие терапевтические агенты, которые ингибируют или истощают фагоцитарные клетки путем прекращения, замедления пролиферации или/и нисходящей регуляции активности фагоцитарных клеток. Специфичные терапевтические агенты включают любой агент, являющийся цитотоксичным или цитостатичным, включая без ограничений, например, галлий, золото, диоксид кремния, 5-флюроурацил, цисплатин, алкилирующие агенты, митрамицин и пакликаксел. При использовании любого из вышеперечисленных терапевтических агентов отношение лекарство/липид в липосоме составляет примерно от 1:5 до 1:8, предпочтительно между 1:6 и 1:7 по массе.
В одном из вариантов реализации, состав включает инкапсулируемый терапевтический агент, способный избирательно попадать в клетку через фагоцитоз и селективно действовать на макрофаги и моноциты, при этом не оказывая воздействия на нефагоцитарные клетки. Поскольку макрофаги и моноциты в их нормальном состоянии стягиваются в поврежденные на клеточном уровне области и вызывают воспаление, выходящее за пределы того, что было вызвано самой болезнью или состоянием, ингибирование и/или истощение моноцитов/макрофагов может смягчить состояние поврежденной области. При попадании в фагоцитную клетку агент высвобождается и ингибирует, инактивирует, повреждает, убивает и/или истощает моноциты и/или макрофаги для лечения различных заболеваний, включающих фагоцитарный иммунный ответ, таких как, например, ишемическое реперфузиторное повреждение или воспалительное повреждение, такое как, например, инфаркт миокарда, или для сокращения зоны инфаркта в финальной стадии и усиления восстановления сердца после острого инфаркта миокарда. Липосомы, входящие в описанный в настоящем изобретении состав, имеют особые характеристики, включая размер, заряд, рН, проводимость и осмоляльность, которые способствуют прямому всасыванию посредством фагоцитоза.
После поглощения моноцитами/макрофагами, агент проявляет пролонгированную ингибиторную активность по отношению к моноцитам/макрофагам. Этой пролонгированной активности достаточно для изменения воспалительной активности моноцитов/макрофагов. Таким образом, для устойчивого ингибирования активности не требуется продолжительное высвобождение агента. Соответственно способ лечения некоторых заболеваний путем ингибирования моноцитов/макрофагов, например, с использованием инкапсулируемого агента, предпочтительно является системной терапией, в которой мишенью терапевтической композиции являются циркулирующие моноциты и макрофаги. Фагоцитарные клетки могут проявлять разную реакцию, в зависимости от типа используемого инкапсулируемого терапевтического агента. Например, инкапсулируемый липосомами алендронат вызывает апоптоз, в то время как инкапсулируемый липосомами клодронат вызывает некроз. Нефагоцитарные клетки сравнительно неспособны к поглощению состава за счет специфических физико-химических свойств липосомного состава.
Более того липосомы согласно настоящему изобретению не только удерживают терапевтический агент на время, достаточное для того, чтобы агент не высвобождался в жидкости организма, но и также эффективно высвобождают его внутри целевой клетки. Липосомы, описанные в настоящем изобретении, доставляют эффективное количество агента в целевые клетки. Термин «эффективное количество» означает количество состава, которое является эффективным для достижения желаемого терапевтического результата, например, лечения эндометриоза, рестеноза, ишемического реперфузионного повреждения (ИРП), инфаркта миокарда или других связанных заболеваний. Например, снижение числа и/или активности активированных макрофагов и моноцитов уменьшает зону инфаркта и/или улучшает ремоделирование, когда заболевание связано с повреждением миокарда. Эффективное количество также зависит от ряда факторов, включая без ограничений следующие: вес и пол проходящего лечение пациента; способ введения состава (а именно вводится ли он системно или прямо в область поражения); терапевтический режим (например, вводится ли состав одни раз в день, несколько раз в день, один раз в несколько дней или разово); клинические признаки воспаления; клинические факторы, влияющие на скорость развития основного заболевания, такие как курение, гиперхолестеринемия, провоспалительный статус, заболевания почек; и от типа дозировки композиции. Успешная доставка и применение липосомного состава зависит от его стабильности и эффективности. Важными факторами, определяющими терапевтический индекс продукта, являются число молекул терапевтического агента, инкапсулированных в каждой липосоме (полезная нагрузка) и уровень свободного неинкапсулированного материала.
D. Дозировка и введение
Липосомный состав можно вводить любым способом, который эффективно перенесет липосомы в соответствующее или требуемое место действия. Предпочтительные типы введения включают внутривенное (ВВ) или внутриартериальное (ВА) (в частности подходящее для он-лайн введения) введение. Другие подходящие способы введения включают внутримышечный (ВМ), подкожный (ПК) и внутрибрюшной (ВБ) способы введения. Подобные способы введения могут представлять собой болюсные инъекции или инфузии. Другим способом введения может быть периваскулярное введение. Введение состава может осуществляться сразу непосредственно или после разведения. Согласно настоящему изобретению могут быть использованы любые комбинации описанных выше способов введения. Может быть использован любой способ введения, обеспечивающий контакт частиц с фагоцитарными клетками (например, циркулирующими моноцитами или брюшными макрофагами).
Фармацевтические композиции для использования согласно настоящему изобретению могут быть получены из одного или более физиологически приемлемых носителей, включая наполнители и вспомогательные вещества, известные в области техники, которые облегчают преобразование активных ингредиентов в препараты, которые могут быть использованы в фармацевтике.
Величина и частота дозировки могут быть установлены индивидуально для обеспечения уровней плазмы, достаточных для индукции или подавления биологического эффекта (минимально эффективная концентрация «МЭК»). Значение МЭК меняется в зависимости от препарата, но может быть определено на основе данных in vitro. Дозировки, необходимые для достижения МЭК будут зависеть от состояния пациента и способа введения. Для определения концентрации агента в плазме можно использовать способы детекции.
В зависимости от тяжести состояния пациента и его восприимчивости к лечению дозировка может осуществляться разово, или в ходе многочисленных введений, с периодом лечения от нескольких часов до нескольких недель или до того, как подействует лечение. Частота введения может зависеть от условий и тяжести заболевания. В одном из вариантов реализации состав вводят периодически. Дозировка может составлять любое количество или объем, необходимый для желаемого лечения. Например, дозировки и в 1 мкг или 10 мкг могут быть назначены пациентам, проходящим через интраваскулярные процедуры, например, имплантацию стента, с целью предотвращения дальнейшего распространения и тяжести поздней потери просвета стента. В качестве дополнительного примера, дозировка может составлять по меньшей мере 100 мкг. В таком случае состав может вводится один раз, несколько раз и/или непрерывно, например, с помощью непрерывной(ых) инфузии(ий) в течение периода времени. Например, дозы могут вводиться в соответствии с способами, описанными в Banai, Am Heart J. (2013), supra.
Ε. Способ получения липосом
Другой аспект настоящего изобретения относится к способу получения липосом и липосомного состава для коммерческого производства продукта. Этот способ получения позволяет управлять описанными выше физическими характеристиками, а также контролировать некоторые параметры процесса, включая отношение воды к растворителю, состав растворителя и отношения растворителя, температуру получения везикул, показателя сдвиговых усилий для везикул, температуру экструзии, давление экструзии и размер мембран и тип мембран, используемых для экструзии.
Получение липосомного состава включает этапы (1) смешивания терапевтического агента с предварительно выбранными липидами с образованием везикул, (2) экструзии везикул через фильтр с одним размером пор в одну стадию и (3) ультрафильтрации. Фраза «экструзия через фильтр в одну стадию» означает, что этап экструзии подразумевает этап фильтрации через фильтр с одним размером пор. В нее могут входить многократные прохождения через фильтр с одним размером пор, но не требуются многократные и/или последовательные прохождения через фильтры с разными размерами пор, что известно из уровня техники, например, последовательное прохождение через мембраны с порами в 1,0, 0,8, 0,6, 0,4 и 0,2 мкм. После ультрафильтрации продукт может быть стандартизирован до желаемой конечной концентрации. Поскольку экструзия на этапе (2) проводится в одну стадию и при низком давлении, настоящий способ снижает производственные затраты и время, а также увеличивает выход продукта по сравнению с экструзией при высоком давлении и с использованием множества стадий. На Фиг. 1 показаны этапы процесса получения липосомного состава.
Первый этап включает смешивание в растворе терапевтического агента и предварительно выбранных липидных ингредиентов для получения везикул. Во многих случаях до смешивания друг с другом терапевтический агент и липидный ингредиент солюбизируют в виде раствора терапевтического агента и раствора липидного ингредиента. В данном варианте реализации раствор терапевтического агента имеет некоторые физические характеристики, включая рН, осмоляльность и проводимость. Раствор терапевтического агента включает внутреннюю среду липосомного состава. Поэтому рН, проводимость и осмоляльность раствора терапевтического агента влияют на внутренние рН, проводимость и осмоляльность липосомного состава. Предпочтительное значение внутренней осмоляльности находится в диапазоне 340-440 мО/кг, в то время как предпочтительная внешняя липосомная осмоляльность составляет 270-340 мО/кг. рН раствора предназначено для поддержания рН раствора терапевтического агента в требуемом диапазоне рН. Таким образом, если используется кислый тера