Желудочно-резистентная фармацевтическая или нутрицевтическая композиция с устойчивостью к воздействию этанола
Иллюстрации
Показать всеИзобретение относится к области медицины и представляет собой желудочно-резистентную фармацевтическую или нутрицевтическую композицию, которая содержит ядро, содержащее фармацевтический или нутрицевтический активный ингредиент, и желудочно-резистентный покрывающий слой, причем указанный покрывающий слой содержит по меньшей мере 30 мас.% (мет)акрилатного сополимера, состоящего из полимеризованных звеньев: от 10 до 40 мас.% метакриловой кислоты, от 10 до 50 мас.% этилакрилата, от 10 до 80 мас.% С4-С18 алкилового эфира акриловой или метакриловой кислоты и необязательно от 0 до 20 мас.% метилметакрилата, где (мет)акрилатный сополимер обладает средней молекулярной массой Mw, равной 90000 или больше, причем высвобождение фармацевтического или нутрицевтического ингредиента составляет не более чем 10% в условиях in-vitro при рН 1,2 через 2 часа в среде 0,1 молярной HCl с добавлением или без добавления 20% об./об. этанола. Изобретение обеспечивает возможность создания желудочно-резистентной композиции с уменьшенной чувствительностью к влиянию этанола на высвобождение активного ингредиента. 12 з.п. ф-лы, 14 пр., 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к желудочно-резистентной фармацевтической или нутрицевтической композиции, содержащей ядро, которое содержит фармацевтический или нутрицевтический активный ингредиент, и на ядре желудочно-резистентный покрывающий слой, посредством которой высвобождение фармацевтического или нутрицевтического активного ингредиента составляет не более чем 10% в условиях in-vitro при pH 1,2 после 2 часов в среде согласно USP с добавлением 20% (об./об.) этанола и без него.
Уровень техники изобретения
(Мет)акрилатные сополимеры, содержащие анионные группы, раскрыты, например, в Европейском патенте ЕР 0704208 B1, Европейской патентной заявке ЕР 0704207 A2, международной заявке WO 03/072087 A1, международной заявке WO 2004/096185 A1.
Из международной патентной заявки WO 2010/105672 A1 известны фармацевтические композиции с контролируемым высвобождением и с устойчивостью к влиянию этанола, использующие покрытие, содержащее нейтральные виниловые полимеры и наполнители.
Из международной патентной заявки WO 2010/105673 A1 известны фармацевтические композиции с контролируемым высвобождением и с устойчивостью к влиянию этанола, использующие покрытие, содержащее полимерную смесь и наполнители.
Из международных патентных заявок WO 2009/036812 A1 и WO 2010034342 A1 известны фармацевтические композиции с контролируемым в зависимости от pH высвобождением для наркотических препаратов (опиоидов) с уменьшенной чувствительностью к влиянию этанола на высвобождение активного соединения.
Из международных патентных заявок WO 2009/036811 A1 и WO 2010034344 A1 известны фармацевтические композиции с контролируемым в зависимости от pH высвобождением для лекарственных препаратов, которые не являются опиоидами, с уменьшенной чувствительностью к влиянию этанола на высвобождение активного соединения.
Международная патентная заявка WO 2008/049657 описывает применение желудочно-резистентных (мет)акрилатных сополимеров в ретардированных лекарственных пероральных формах в качестве матрицеобразующих веществ для активного ингредиента, которые включены для сведения к минимуму эффекта ускорения или замедления высвобождения активного ингредиента под влиянием этанола в условиях in-vitro.
Основные определения
Термин "(мет)акрилатный сополимер" в единственном числе будет иметь значение одного или более (мет)акрилатных сополимеров в пределах данного определения или ограничений мономерной композиции. Таким образом, смеси различных (мет)акрилатных сополимеров в пределах данного определения или ограничений мономерной композиции включены в смысле изобретения. Данные в единственном числе термины, такие как "C14-C18-алкиловый эфир акриловой или метакриловой кислоты" или "другой виниловый мономер", следует понимать таким же образом для включения одного или более этих мономеров.
Предпочтительно соотношения мономеров для сополимеров, раскрытых в данном документе, в сумме составляют 100 мас.%
Проблема и решение
Фармацевтические или нутрицевтические композиции разработаны для высвобождения активного ингредиента согласно воспроизводимым кривым высвобождения. Это приведет к желательным и надежным профилям уровня в крови, которые будут обеспечивать оптимальный терапевтический эффект. Если уровни содержания в крови являются слишком низкими, активный ингредиент не вызовет достаточный терапевтический эффект. Если уровни содержания в крови являются слишком высокими, это может вызвать токсические эффекты. В обоих случаях не оптимальные концентрации уровня в крови активного ингредиента могут быть опасными для пациента, и, следовательно, этого следует избегать. Проблема заключается в том, что идеальные соотношения, которые принимаются для высвобождения активного ингредиента в ходе разработки фармацевтической или нутрицевтической композиции, могут изменяться из-за основных жизненных привычек, невнимательности или вызывающего привыкание поведения пациентов по отношению к применению этанола или напитков, содержащих этанол. В этих случаях, фармацевтическая или нутрицевтическая форма, которая разработана фактически только для водной среды, дополнительно подвергается воздействию среды, содержащей этанол, большей или меньшей силы. Так как органы здравоохранения, такие как, например, Управление по контролю над продуктами и лекарствами США (FDA), все больше концентрируются на проблеме этанола, устойчивость к этанолу может быть важным требованием при регистрации в ближайшем будущем. Так как не все пациенты знакомы с риском одновременного приема фармацевтической или нутрицевтической формы с контролируемым высвобождением и напитков, содержащих этанол, или не следуют или не способны следовать соответствующим предупреждениям, советам или рекомендациям, существует потребность в таких фармацевтических или нутрицевтических композициях с контролируемым высвобождением, особенно в желудочно-резистентных фармацевтических или нутрицевтических композициях, чтобы присутствие этанола влияло на их механизм действия настолько незначительно, насколько это возможно.
Традиционные устойчивые к действию желудочного сока фармацевтические или нутрицевтические композиции, либо покрытые, либо непокрытые, обычно совсем не устойчивы к спирту. Следовательно, одна проблема настоящего изобретения заключалась в предоставлении желудочно-резистентных фармацевтических или нутрицевтических композиций, которые устойчивы к воздействию этанола.
Особенно существует проблема для желудочно-резистентных или кишечнорастворимых лекарственных композиций. Эти виды составов обычно покрыты на ядре желудочно-резистентным покрывающим слоем (кишечнорастворимым покрытием), функция которого заключается в том, что высвобождение фармацевтического или нутрицевтического активного ингредиента в желудке, особенно при pH 1,2 в течение 2 часов согласно USP, не должно превышать 10, 8 или может быть 5%. Эта функция гарантирует, что чувствительные к кислоте фармацевтические или нутрицевтические активные ингредиенты защищены от инактивации и что фармацевтические или нутрицевтические активные ингредиенты, которые могут раздражать слизистую желудка, не осаждаются свободными в слишком больших количествах. С другой стороны, во многих случаях высвобождение фармацевтического или нутрицевтического активного ингредиента в кишечнике, особенно при pH 6,8 в течение одного часа или менее согласно способу USP, разрабатывается таким образом, чтобы оно превышало по меньшей мере 50, 60, 80% или более. Присутствие этанола в концентрациях 20, 30 или 40% (об./об.) в желудочной текучей среде обычно приводит к увеличению скоростей высвобождений в желудке. Из-за распределительного эффекта эффект поглощенного этанола не так важен в кишечнике, как в желудке. Таким образом, в первую очередь эффективная защита от влияния этанола должна предотвращать подобное нежелательное увеличение фармацевтического или нутрицевтического активного ингредиента в желудке в первую очередь. Кроме того, может быть желательно, чтобы защита от влияния этанола по меньшей мере не влияла на сравнительно быстрые скорости высвобождения при pH 6,8 в среде без этанола.
Некоторые проблемы, которые обсуждались выше, решены желудочно-резистентной фармацевтической или нутрицевтической композицией, содержащей ядро, которое содержит фармацевтический или нутрицевтический активный ингредиент, и на ядре желудочно-резистентный покрывающий слой, где желудочно-резистентный покрывающий слой содержит, по существу содержит или включает:
по меньшей мере 30 мас.% (мет)акрилатного сополимера, содержащего полимеризованные звенья:
от 10 до 40 мас.% акриловой или метакриловой кислоты
от 10 до 80 мас.% C4-C18-алкилового эфира акриловой или метакриловой кислоты и необязательно
от 0 до 60 мас.% другого винилового мономера,
посредством которой высвобождение фармацевтического или нутрицевтического активного ингредиента составляет не более чем 10% в условиях in-vitro при pH 1,2 после 2 часов в среде согласно USP с добавлением 20% (об/об) этанола и без него.
Подробное описание изобретения
Изобретение относится к желудочно-резистентной фармацевтической или нутрицевтической композиции, содержащей ядро, которое содержит фармацевтический или нутрицевтический активный ингредиент, и на ядре желудочно-резистентный покрывающий слой.
Желудочно-резистентный покрывающий слой
Как заявлено, желудочный устойчивый покрывающий слой содержит по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 80, по меньшей мере 90 или 100 мас.% (мет)акрилатного сополимера, содержащего полимеризованные звенья (мет)акрилатного сополимера.
(Мет)акрилатный сополимер
Предпочтительно соотношение мономеров для сополимеров, раскрытых в данном документе, в сумме составляет 100 мас.%
(Мет)акрилатный сополимер содержит, по существу содержит или состоит из полимеризованных звеньев
от 10 до 40 мас.% акриловой или метакриловой кислоты
от 10 до 80 мас.% C4-C18-алкилового эфира акриловой или
метакриловой кислоты и необязательно
от 0 до 60 мас.% другого винилового мономера.
C4-C18-алкиловый эфир акриловой или метакриловой кислоты предпочтительно выбирают из н-бутилметакрилата, 2-этилгексилакрилата, 2-этилгексилметакрилата, изодецилметакрилата и лаурилметакрилата.
Другим виниловым мономером является мономер, который не является акриловой или метакриловой кислотой или C4-C18-алкиловым эфиром акриловой или метакриловой кислоты. Другим виниловым мономером может быть предпочтительно C1-C3-алкиловый эфир акриловой или метакриловой кислоты, которые представляют собой метилакрилат, этилакрилат, пропилакрилат, метилметакрилат, этилметакрилат или пропилметакрилат. Другим виниловым мономером может быть гидроксиэтилметакрилат, гидроксипропилметакрилат, акрилат простого поли(этиленгликоль)метилового эфира, метакрилат простого поли(этиленгликоль)метилового эфира, акрилат простого поли(пропиленгликоль)метилового эфира, метакрилат простого поли(пропиленгликоль)метилового эфира или стирол.
Предпочтительно (мет)акрилатный сополимер содержит, по существу содержит или включает полимеризованные звенья
от 10 до 40 мас.% акриловой или метакриловой кислоты
от 10 до 50 мас.% этилакрилата
от 10 до 80 мас.% C4-C18-алкилового эфира акриловой или метакриловой кислоты и необязательно от 0 до 20 мас.% метилметакрилата.
Предпочтительно (мет)акрилатный сополимер содержит, по существу содержит или включает полимеризованные звенья
от 20 до 40 мас.% метакриловой кислоты
от 20 до 40 мас.% н-бутилметакрилата и
от 30 до 50 мас.% этилакрилата.
Предпочтительно (мет)акрилатный сополимер содержит, по существу содержит или включает полимеризованные звенья
от 20 до 40 мас.% метакриловой кислоты
от 30 до 50 мас.% 2-этилгексилакрилата
от 15 до 40 мас.% этилакрилата и необязательно
от 0 до 20 мас.% метилметакрилата.
Предпочтительно (мет)акрилатный сополимер содержит, по существу содержит или включает полимеризованные звенья
от 10 до 40 мас.% метакриловой кислоты
от 20 до 70 мас.% 2-этилгексилметакрилата и
от 10 до 50 мас.% этилакрилата.
Предпочтительно (мет)акрилатный сополимер содержит, по существу содержит или включает полимеризованные звенья
от 20 до 40 мас.% метакриловой кислоты
от 20 до 50 мас.% 2-этилгексилметакрилата и
от 20 до 50 мас.% этилакрилата.
Предпочтительно (мет)акрилатный сополимер содержит, по существу содержит или включает полимеризованные звенья
от 10 до 35 мас.% метакриловой кислоты
от 40 до 70 мас.% 2-этилгексилметакрилата и
от 10 до 30 мас.% этилакрилата.
Предпочтительно (мет)акрилатный сополимер содержит, по существу содержит или включает полимеризованные звенья
от 20 до 40 мас.% метакриловой кислоты,
от 20 до 40 мас.% изодецилметакрилата и
от 40 до 50 мас.% этилакрилата.
Предпочтительно (мет)акрилатный сополимер содержит, по существу содержит или включает полимеризованные звенья
от 20 до 40 мас.% метакриловой кислоты,
от 20 до 40 мас.% лаурилметакрилата и
от 30 до 50 мас.% этилакрилата.
Способ получения (мет)акрилатного сополимера
(Мет)акрилатный сополимер можно получить посредством радикальной полимеризации мономеров в присутствии инициаторов полимеризации.
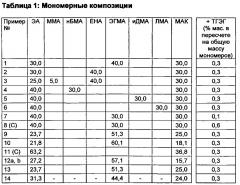
Для улучшения стабильности процесса и воспроизводимости молекулярной массы (Mw) можно добавить агент передачи цепи. Обычное количество агента передачи цепи может составлять от 0,05 до 1 мас.% Типичный агент передачи цепи может представлять собой, например, 2-этилгексиловый эфир тиогликолевой кислоты (ТГЭГ) или н-додецилмеркаптан (нДДМ). Однако агент передачи цепи можно опустить во многих случаях без влияния на свойства согласно изобретению.
Способы получения (со)полимеров известны специалистам в данной области техники. В основном будет применяться эмульсионная полимеризация, полимеризация в растворе или полимеризация в массе, предпочтительно получать сополимеры эмульсионной полимеризацией.
Если применяют эмульсионную полимеризацию, операцию можно выгодно осуществлять посредством, соответственно, процесса подачи мономерной эмульсии или процесса подачи мономеров. Для этого в реакторе для полимеризации воду нагревают до температуры реакции. На этой стадии можно добавить поверхностно-активные вещества и/или инициаторы. Затем - в зависимости от режима операции - в реактор подают мономер, смесь мономеров или эмульсию любого материала. Эта дозированная жидкость может содержать инициаторы и/или поверхностно-активные вещества или инициатор и/или поверхностно-активное вещество можно дозировать параллельно.
В альтернативном случае все мономеры для ядра можно загружать в реактор до добавления инициатора. Этот способ часто именуется периодическим процессом.
Также возможно комбинировать оба процесса, полимеризуя часть мономеров способом периодического процесса и после этого загружая другую часть.
Как известно специалисту в данной области техники, можно подбирать тип процесса и режим операции для достижения желательного размера частиц, достаточной стабильности дисперсии, стабильного процесса производства и так далее.
Эмульгаторы, которые можно применять, представляют собой особенно анионные и неионогенные поверхностно-активные вещества. Количество применяемого эмульгатора составляет, как правило, не более чем 5 мас.% в пересчете на полимер.
Типичными поверхностно-активными веществами являются, например, алкилсульфаты (например, додецил сульфат натрия),
алкилэфирсульфаты, диоктилсульфосукцинат натрия, полисорбаты (например, полиоксиэтилен (20) сорбитан моноолеат), нонилфенолэтоксилаты (ноноксинол-9) и другие.
Кроме этих инициаторов, традиционно применяемых в эмульсионной полимеризации (например, пероксидных соединений, таких как пероксодисульфат аммония (APS), можно применять окислительно-восстановительные системы, такие как натрия дисульфит-APS-железо. Также можно использовать растворимые в воде азоинициаторы и/или можно применять смесь инициаторов. Количество инициатора обычно составляет между 0,005 до 0,5 мас.% в пересчете на массу мономера.
Температура полимеризации зависит от инициаторов в определенных пределах. Например, в случае применения APS выгодно оперировать в интервале от 60 до 90°C; в случае применения окислительно-восстановительных систем также возможно полимеризовать при более низких температурах, например при 30°C.
Средний размер частиц полимера, полученных в эмульсионной полимеризации, может колебаться в пределах от 10 до 1000, от 20 до 500 или от 50 до 250 нм. Средний размер частиц полимера можно определить способами, хорошо известным специалистам в данной области техники, например способом лазерной дифракции. Размер частиц можно определять лазерной дифракцией, применяя Mastersizer 2000 (Malvern). Значения могут быть указаны как радиус частиц rMS [нм], который является половиной медианы распределения размера частиц на основе объема d(v,50).
Полученную дисперсию можно непосредственно применять для получения суспензии покрытий, или - в редких случаях - можно применять в качестве суспензии покрытия даже без добавления дополнительных ингредиентов.
Также дисперсию можно высушить, предпочтительно посредством распылительной сушки, лиофильной сушки или коагуляции. Таким образом, можно получить твердое вещество, которое предлагает определенные преимущества в отношении обработки и перевозки.
Высушенный полимеризат можно затем превратить в суспензию для покрытия посредством повторного диспергирования твердого вещества в воде, например (при необходимости) посредством применения смесителя с большими сдвиговыми усилиями.
Высушенный полимеризат также можно растворить в растворителе, например органическом растворителе, с получением раствора для покрытия.
Если нанесения покрытия с растворами для покрытий является предпочтительным, получение полимера посредством полимеризации в растворе или полимеризации в массе может также быть хорошим выбором.
Высвобождение фармацевтического или нутрицевтического активного ингредиента
Высвобождение фармацевтического или нутрицевтического активного ингредиента согласно USP составляет не более чем 10, не более чем 8 или не более чем 5% в условиях in-vitro при pH 1,2 через 2 часа в 0,1 молярной HCl с добавлением или без добавления 20, 30 или 40% (об./об.) этанола.
Высвобождение фармацевтического или нутрицевтического активного ингредиента согласно USP составляет по меньшей мере 50, по меньшей мере 60, по меньшей мере 80% в условиях in-vitro при pH 6,8 через 45 или через 60 минут в буферной среде (фосфатно-солевой буферный раствор, pH 6,8, Европейская фармакопея 4003200).
USP (USP = Фармакопея Соединенных Штатов), которую можно предпочтительно применять, представляет собой USP32/NF27 (NF = национальный формуляр), прибор II, лопаточный способ, 50 об./мин для таблеток или лопаточный или сеточный способ от 50 до 100 об./мин в зависимости от фармакопейной статьи, для гранул.
Дополнительные характеристики (мет)акрилатного сополимера
(Мет)акрилатный сополимер может характеризоваться средней температурой стеклования от 10 до 120 или от 20 до 100, предпочтительно от 25 до 80°C (определенной посредством DSC согласно DIN EN ISO 11357).
(Мет)акрилатный сополимер может характеризоваться минимальной температурой пленкообразования, равной 75°C или менее, предпочтительно 50°C или менее (определенной согласно DIN ISO 2115).
(Мет)акрилатный сополимер может характеризоваться средней молекулярной массой Mw, равной 90000 или более (определенной посредством гель-проникающей хроматографии (ГПХ).
Ядро, содержащее фармацевтический или нутрицевтический активный ингредиент
Ядро содержит один или более фармацевтических или нутрицевтических активных ингредиентов в качестве ядра или в качестве части ядра. Один или более фармацевтических или нутрицевтических ингредиентов могут быть более или менее гомогенно распределены в матричной структуре внутри структуры ядра или могут формировать ядро как кристаллическую структуру. В альтернативном случае один или более фармацевтических или нутрицевтических активных ингредиентов могут присутствовать как часть ядра в форме слоя на грануле-носителе. Таким образом, ядро является незаконченным, покрытым или непокрытым, но все же должна быть покрыта фармацевтическая или нутрицевтическая лекарственная форма.
Ядро, соответственно фармацевтическая или нутрицевтическая лекарственная форма, которую следует покрыть покрывающей композицией, может содержать или может включать нейтральную гранулу-носитель, например сахарную сферу или нонпарель, сверху которой активный ингредиент является связанным в связующем веществе, таком как лактоза или поливинилпирролидон.
Ядро может в альтернативном случае содержать гранулу в форме полимерной матрицы, в которой связан активный ингредиент. Ядро может содержать непокрытую гранулу, состоящую из кристаллического активного ингредиента. Также ядро может содержать свое собственное покрытие, например покрытие, обеспечивающее высвобождение. Такое уже покрытое ядро можно затем покрыть описанной здесь покрывающей композицией.
Ядро может быть непокрытым или может содержать покрытие, которое отличается от покрытия, полученного из покрывающей композиции, описанной в настоящем документе. Ядро может быть покрытой гранулой, например покрытием, обеспечивающим замедленное высвобождение, непокрытой или покрытой таблеткой, непокрытой или покрытой минитаблеткой или непокрытой или покрытой капсулой. Ядро также может содержать в качестве внешнего слоя так называемый "подслой".
Ядро содержит по меньшей мере более чем 80, более чем 90, более чем 95, более чем 98, предпочтительно 100% общего количества одного или более фармацевтических или нутрицевтических активных ингредиентов, присутствующих в желудочно-резистентной фармацевтической или нутрицевтической лекарственной форме.
В некоторых случаях может быть полезным, что покрывающая композиция может содержать кроме активного ингредиента, присутствующего в ядре, частичное количество, предпочтительно менее чем 20, менее чем 10, менее чем 5, менее чем 2 мас.% от общего количества одного или более фармацевтических или нутрицевтических активных ингредиентов, например для предоставления первоначальной дозировки активного ингредиента. В этом случае покрывающая композиция имеет функцию связывающего агента или связующего для дополнительного активного ингредиента. Предпочтительно покрывающая композиция содержит любой активный ингредиент.
Фармацевтические или нутрицевтические активные ингредиенты
Термин "фармацевтический или нутрицевтический активный ингредиент" имеет значение одного или более фармацевтических или нутрицевтических активных ингредиентов. Таким образом, в определение включены смеси различных фармацевтических и/или нутрицевтических активных ингредиентов.
Нутрицевтические активные ингредиенты
Изобретение предпочтительно подходит для нутрицевтических лекарственных форм.
Нутрицевтики можно определить как пищевые экстракты, в которых заявлено наличие медицинских эффектов на здоровье человека. Нутрицевтик обычно содержится в медицинском формате, таком как капсула, таблетка или порошок в предписанной дозировке. Примеры нутрицевтических активных ингредиентов представляют собой ресвератрол из виноградных продуктов в качестве антиоксиданта, растворимые диетические волокнистые продукты, такие как шелуха семян подорожника, для снижения гиперхолестеринемии, брокколи (сульфан) в качестве предохранительного средства от рака и соя или клевер (изофлавоноиды) для улучшения здоровья артерий. Другими примерами нутрицевтиков являются флавоноиды, антиоксиданты, альфа-линолевая кислота из льняного семени, бета-каротин из лепестков календулы или антоцианины из ягод. Иногда как синоним для нутрицевтиков применяют выражение нейтрацевтики.
Желудочно-резистентная фармацевтическая или нутрицевтическая композиция содержит ядро, содержащее фармацевтический или нутрицевтический активный ингредиент. Фармацевтический или нутрицевтический активный ингредиент может быть фармацевтическим или нутрицевтическим активным ингредиентом, который может инактивироваться под влиянием желудочных текучих сред при pH 1,2, или фармацевтическим или нутрицевтическим активным ингредиентом, который может раздражать слизистую желудка, когда высвобождается в желудке.
Фармацевтические активные ингредиенты
Также изобретение предпочтительно подходит для фармацевтических лекарственных форм с кишечнорастворимым покрытием.
Предпочтительные классы лекарств представляют собой такие (включая, но не ограничиваясь ими), которые связаны с соображениями перехода от парентеральной к пероральной форме и/или сильнодействующие лекарственные средства (например, цитостатики, гормоны, агонисты гормональных рецепторов, антагонисты гормональных рецепторов) и/или лекарственных средств с сильными побочными эффектами и токсическими эффектами (включая метаболизирование пролекарственных препаратов; например пептиды, пептидомиметики, нуклеотиды, нуклеозиды, аналоги нуклеозидов, таксоиды).
Особенно предпочтительными являются следующие лекарственные средства
Remicade® (Инфликсимаб, Johnson & Johnson, Schering-Plough, Mitsubishi Tanabe Pharma - болезнь Крона, ревматоидный артрит),
Enbrel® (Этанерцепт, Wyeth - ревматоидный артрит),
Zyprexa® (Оланзапин, Eli Lilly and Company - психоз),
Seroquel® (Кветиапин, AstraZeneca - шизофрения),
Herceptin® (Трастузумаб, Roche, Genentech, Chugai Pharmaceutical - рак молочной железы),
Lexapro®, Cipralex® (Эсциталопрам, Forest Laboratories, H. Lundbeck - депрессия, тревожный невроз),
Gleevec®, Glivec (Иматиниб, Novartis - лейкемия),
Avastin® (Бевацизумаб, Roche, Genentech - колоректальный рак),
Taxotere® (Доцетаксел, Sanofi-Aventis - рак),
Eloxatin®, Eloxatine® (Оксалиплатин, Sanofi-Aventis - колоректальный рак),
Wellbutrin® (Бупропион, GlaxoSmithKline, Biovail - депрессия, сезонные аффективные расстройства (SAD)),
Abilify® (Арипипразол, Otsuka Pharmaceutical, Bristol-Myers Squibb - психоз, депрессия),
Avonex® (Интерферон-бета-1a, Biogen Idec - рассеянный склероз),
Viagra® (Силденафил, Pfizer - эректильная дисфункция),
Lupron®, Leuplin (Лейпролид, Takeda Pharmaceutical, TAP Pharmaceuticals - рак простаты),
Zofran® (Ондансетрон, GlaxoSmithKline - тошнота и рвота),
Arimidex® (Анастрозол, AstraZeneca - рак груди),
Prograf® (Такролимус, Astellas Pharma - отторжение трансплантата),
CellCept® (Микофенолятмофетил, Roche, Chugai Pharmaceutical - отторжение трансплантата),
Gemzar® (Гемцитабин, Eli Lilly and Company - рак),
Cymbalta® (Дулоксетин, Eli Lilly and Company - депрессия, тревожный невроз),
Duragesic® (Фентанил, Johnson & Johnson - боль),
Casodex® (Бикалутамид, AstraZeneca - рак простаты),
Truvada® (Тенофовир + Эмтрибитацин, Gilead Sciences - ВИЧ инфекция),
Flomax® (Тамсулосин, Boehringer Ingelheim - доброкачественная гиперплазия предстательной железы),
Lyrica® (Прегабалин, Pfizer - невропатическая боль),
Paxil®, Seroxat® (Пароксетин, GlaxoSmithKline - депрессия, тревожный невроз),
Kaletra® (Лопинавир, Abbott Laboratories - ВИЧ инфекция),
Erbitux® (Цетуксимаб, Bristol-Myers Squibb, Merck KGaA - колоректальный рак),
Zoladex® (Госерелин, AstraZeneca - рак простаты),
Combivir® (Ламивудин+Зидовудин, GlaxoSmithKline - ВИЧ инфекция),
Cialis® (Тадалафил, Eli Lilly and Company, Lilly Icos - эректильная дисфункция),
Reyataz® (Атазанавир, Bristol-Myers Squibb - ВИЧ инфекция),
Concerta® (Метилфенидат, Johnson & Johnson - синдром гиперактивности с дефицитом внимания),
Camptosar® (Иринотекан, Pfizer - колоректальный рак),
Adderall® (Амфетамин, Shire Pharmaceuticals - синдром гиперактивности с дефицитом внимания),
Ultane®, Sevorane® (Севофлуран, Abbott Laboratories - анестезия),
Xeloda® (Капецитабин, Roche, Chugai Pharmaceutical - рак),
Femara® (Летрозол, Novartis, Chugai Pharmaceutical - рак молочной железы),
Viread® (Тенофовир, Gilead Sciences - ВИЧ инфекция),
Tarceva® (Эрлотиниб, Roche, Genentech - немелкоклеточный рак легкого),
Alimta® (Пеметрексед, Eli Lilly and Company - немел коклеточный рак легкого),
Actiq® (Фентанил, Цефалон - раковая боль),
Lidoderm® (Лидокаин, Endo Pharmaceuticals - боль),
Taxol® (Паклитаксел, Bristol-Myers Squibb - рак),
Trizivir® (Абакавир+Ламивудин+Зидовудин, GlaxoSmithKline - ВИЧ инфекция),
Epzicom®, Kixeva® (Абакавир+Ламивудин, GlaxoSmithKline - ВИЧ инфекция),
Venlafaxine® (Эффексор, Wyeth - антидепрессант),
а также лекарственные средства соответствующих классов соединений и/или соответствующего механизма действия, предполагаемого указанными примерами (так как последний является идентификатором не только физической химии активного фармацевтического ингредиента (API), а также его физиологического поведения и фармацевтического характера).
Терапевтические и химические классы лекарственных средств, применяемые в фармацевтических лекарственных формах с кишечнорастворимым покрытием, представляют собой, например, анальгетики, антибиотики или противоинфекционные препараты, антитела, противосудорожные средства, антигены из растений, противоревматические средства, бетаблокаторы, производные бензимидазола, бетаблокаторы, сердечно-сосудистые лекарственные средства, химиопрепараты, препараты для ЦНС, гликозиды дигиталиса, желудочно-кишечные средства, например ингибиторы протонного насоса, ферменты, гормоны, жидкие или твердые природные экстракты, олигонуклеотиды, белки, являющиеся пептидными гормонами, лечебные бактерии, пептиды, белки, ингибиторы протонного насоса, соли (металлов), например аспартаты, хлориды, ортаты, урологические лекарственные средства, вакцины.
Примерами лекарственных средств, которые являются кислото-неустойчивыми, раздражающими или нуждающимися в контролированном высвобождении, являются: Акампросат, аэсцин, амилаза, ацетилсалициловая кислота, адреналин, 5-аминосалициловая кислота, ауреомицин, бацитрацин, балсалазин, бета-каротин, бикалутамид бисакодил, бромелаин, будесонид, кальцитонин, карбамаципин, карбоплатин, цефалоспорины, цетрореликс, кларитромицин, хлоромицетин, циметидин, цизаприд, кладрибин, клоразепат, кромалин, 1-дезаминоцистеин-8-D-аргинин-вазопрессин, дерамциклан, детиреликс, декслансопразол, диклофенак, диданозин, дигитоксин и другие гликозиды дигиталиса, дигидрострептомицин, диметикон, дивалпроекс, дроспиренон, дулоксетин, ферменты, эритромецин, эзомепразол, эстрогены, этопозид, фамотидин, фториды, чесночное масло, глюкагон, гранулоцитарный колониестимулирующий фактор (G-CSF), гепарин, гидрокортизон, гормон человеческого роста (hGH), ибупрофен, илапразол, инсулин, интерферон, интерлейкин, интрон A, кетопрофен, лансопразол, лейпролидацетат липаза, липоевая кислота, литий, кинин, мемантин, месалазин, метенамин, миламелин, минералы, минопразол, напроксен, натамицин, нитрофурантион, новобиоцин, олсалазин, омепразол, оротаты, панкреатин, пантопразол, паратироидный гормон, пароксетин, пенициллин, перпразол, пиндолол, полимиксин, калий, правастатин, преднизон, преглуметацина прогабид, просоматостатин, протеаза, хинаприл, рабепразол, ранитидин, ранолазин, ребоксетин, рутозид, соматостатин, стрептомицин, субтилин, сульфасалазин, сульфаниламид, тамсулозин, тенатопразол, трипсин, вальпроевая кислота, вазопрессин, витамины, цинк, включая их соли, производные, полиморфы, изоморфы или любые типы их смесей или комбинаций. Другими примерами подходящих фармацевтических или нутрицевтических ингредиентов являются дипрофиллин, метопропола сукцинат и цитидин (в качестве модельного вещества, соответственно, для нуклеозидных молекул и их аналогов.
Фармацевтические или нутрицевтические наполнители
Желудочно-резистентный покрывающий слой может содержать, по существу содержать или включать в себя вплоть до 70, вплоть до 60, вплоть до 50, вплоть до 40, вплоть до 30, вплоть до 20 мас.% любых фармацевтических или нутрицевтических наполнителей.
Фармацевтические или нутрицевтические наполнители можно выбирать из группы антиоксидантов, осветлителей, связующих агентов, ароматизаторов, агентов для повышения текучести, отдушек, скользящих агентов, улучшающих пенетрацию агентов, пигментов, пластификаторов, полимеров, которые отличаются от (мет)акрилатного сополимера желудочно-резистентного покрывающего слоя, описанного в пункте 1 формулы изобретения, порообразователей или стабилизаторов.
Добавление дополнительных полимеров к желудочно-резистентному покрывающему слою
Желудочно-резистентный покрывающий слой может дополнительно содержать, по существу содержать или включать в себя необязательно от 0 до 70, от 0 до 60, от 0 до 50, от 0 до 40, от 0 до 30, от 0 до 20, от 0 до 10 мас.% любого одного или более полимеров, которые отличаются от (мет)акрилатных сополимеров, содержащих полимеризованные звенья
от 10 до 40% масс, акриловой или метакриловой кислоты
от 10 до 80 мас.% C4-C18-алкилового эфира акриловой или метакриловой кислоты и необязательно
от 0 до 60 мас.% другого винилового мономера.
Такие дополнительные полимеры могут быть, например, нерастворимыми в воде полимерами.
Дополнительные полимеры предпочтительно добавляют отдельно к покрывающей суспензии. Эти дополнительные полимеры не получают совместно с (мет)акрилатным сополимером, описанным выше, в одиночном процессе эмульсионной полимеризации в качестве полимеризата ядро/оболочка.
Нерастворимые в воде полимеры
Нерастворимые в воде полимеры представляют собой полимеры, которые не растворяются в воде, или они только способны набухать в воде во всем интервале pH 1-14. Нерастворимые в воде полимеры могут быть одновременно полимерами, содержащими не более чем 12% мономерных остатков с ионными боковыми группами, такими как, например, полимеры EUDRAGIT® NE/NM или EUDRAGIT® RL/RS.
Один или более нерастворимых в воде полимеров может предпочтительно содержать менее чем 10 мас.% мономерных остатков с ионными боковыми группами, предпочтительно не более чем 12 мас.% мономерных остатков с катионными боковыми группами.
Один или более нерастворимых в воде полимеров или один или более полимеров на основе целлюлозы могут предпочтительно содержать менее чем 5 мас.%, предпочтительно не более чем 2 мас.%, более предпочтительно не более чем 1 или от 0,05 до 1 мас.% мономерных остатков с анионными боковыми группами.
Другими типами нерастворимых в воде полимеров в контексте изобретения могут быть виниловые сополимеры, такие как поливинилацетат, включая производные поливинилацетата. Поливинилацетат может присутствовать в форме дисперсии. Один пример представляет собой тип Kollicoat® SR 30 D (BASF), дисперсию поливинилацетата, стабилизированную повидоном и лаурилсульфатом натрия.
Нерастворимые в воде полимеры могут предпочтительно принадлежать к группе (мет)акрилатных сополимеров.
Полимеры типа EUDRAGIT® NE 30D/EUDRAGIT® NM 30D
Желудочно-резистентный покрывающий слой может содержать нерастворимый в воде сополимер, который является сополимером, имеющим в составе звенья, полученные в результате свободно-радикальной полимеризации, более чем 90 мас.% или более чем 95 мас.%, в частности до степени, равной по меньшей мере 98 мас.%, предпочтительно до степени, равной по меньшей мере 99 мас.%, в частности до степени, равной по меньшей мере 99 мас.%, более предпочтительно до степени, равной 100 мас.%, (мет)акрилатных мономеров с нейтральными фрагментами, особенно C1-C4-алкильными фрагментами. Эти виды полимеров не растворяются в воде или только способны набухать в воде во всем интервале pH 1-14.
Подходящие (мет)акрилатные мономеры с нейтральными фрагментами представляют собой, например, метилметакрилат, этилметакрилат, н-бутилметакрилат, метилакрилат, этилакрилат, н-бутилакрилат. Предпочтение отдается метилметакрилату, этилакрилату и метилакрилату.
Метакрилатные мономеры с анионными фрагментами, например акриловой кислоты и/или метакриловой кислоты, могут присутствовать в небольших количествах, равных менее чем 5 мас.%, предпочтительно не более чем 2 мас.%, более предпочтительно не более чем 1 или от 0,05 до 1 мас.%
Подходящими примерами являются нейтральные или практически нейтральные (мет)акрилатные сополимеры, имеющие в составе от 20 до 40 мас.% этилакрилата, от 60 до 80 мас.% метилметакрилата и от 0 до менее чем 5 мас.%, предпочтительно от 0 до 2 или от 0,05 до 1 мас.% метакриловой кислоты или любой метакриловой кислоты (тип EUDRAGIT® NE 30D или EUDRAGIT® NM 30D).
EUDRAGIT® NE 30D и Eudragit® NM 30D являются дисперсиями, содержащими 30 мас.% сополимеров, имеющих в составе полученные в результате свободно-радикальной полимеризации звенья 30 мас.% этилакрилата и 70 мас.% метилметакрилата.
Предпочтение отдается нейтральным или по существу нейтральным метилакрилатным сополимерам, которые, согласно заявке WO 01/68767, были получены как дисперсии с применением 1-10 мас.% неионогенного эмульгатора, имеющего значение ГЛБ от 15,2 до 17,3. Последний предлагает преимущество, что нет фазового разделения с образованием кристаллических структур посредством эмульгатора (тип Eudragit® NM 30D).
Согласно европейской патентной заявке ЕР 1571164А2, соответствующие фактически нейтральные (мет)акрилатные сополимеры с небольшими долями от 0,05 до 1%мас. моноолефиново-ненасыщенных C3-C8-карбоновых кислот, однако также можно получить эмульсионной полимеризацией в присутствии сравнительно небольших количеств анионных эмульгаторов, например от 0,001 до 1 мас.%
Полимеры типа EUDRAGIT® RL/RS
Желудочно-резистентный покрывающий слой может содержать нерастворимый в воде сополимер, который является сополимером, имеющим в составе полученные в результате свободно-радикальной полимеризации