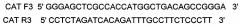Средство для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена сат и/или уменьшением активности белка каталазы на основе генно-терапевтических субстанций с геном сат, способ получения и использования
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается средства для коррекции состояний клеток различных органов и тканей, а также собственно органов и тканей человека, связанных с уменьшением экспрессии гена САТ и/или уменьшением активности белка каталазы, на основе генно-терапевтических субстанций с геном CAT, где клетки органов и тканей выбраны из фибробластов, эпителиальных клеток роговицы глаза, органы и ткани выбраны из кожи, слизистой оболочки полости рта или мышечной ткани, представляющего собой по крайней мере одну генно-терапевтическую субстанцию, выбранную из группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена CAT, с кодирующей последовательностью белка каталазы, с делециями 5'- и 3'-нетранслируемых областей, а именно полученной на основе участка нативной немодифицированной кДНК гена CAT SEQ ID No: 1 или модифицированной кДНК гена CAT, при этом в качестве модифицированной кДНК гена CAT используют SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций. Группа изобретений также касается способа получения указанного средства для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена CAT и/или уменьшением активности белка каталазы; способа использования указанного средства для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена CAT и/или уменьшением активности белка каталазы. Группа изобретений обеспечивает высокий и стабильный уровень целевого белка в клетках при одновременной минимизации вероятности встраивания элементов генетической конструкции в геном пациента. 3 н. и 2 з.п. ф-лы, 18 пр., 20 ил.
Реферат
Область, к которой относится изобретение
Изобретение относится к молекулярной биологии, биотехнологии, генной инженерии и медицине и может быть использовано для коррекции патологических состояний клеток различных органов и тканей, а также собственно органов и тканей человека, связанных с уменьшением уровня экспрессии гена CAT и/или уменьшением активности белка каталазы, в частности, в терапевтических целях.
Предшествующий уровень.
В настоящее время доказана роль окислительного (оксидативного) стресса в заболеваниях различных систем органов: при сердечно-сосудистых заболеваниях (атеросклероз, повреждения при ишемии/реперфузии, рестеноз и гипертензия), при злокачественных и воспалительных заболеваниях (синдром острой дыхательной недостаточности, астма, воспалительные заболевания кишечника, воспаление глаз и кожи, артриты), при метаболических заболеваниях (диабет), при патологиях центральной нервной системы (боковой амиотрофический склероз - болезнь Шарко, болезнь Альцгеймера, болезнь Паркинсона, инсульт и др.). Наиболее предрасположены к оксидативному стрессу кожа, дыхательная система, мозг, глаза, система кровообращения и репродуктивная система.
Нарушение баланса между процессами образования активных форм кислорода (свободных радикалов) и процессами их нейтрализации за счет работы системы антиоксидантной защиты является основной характеристикой оксидативного стресса, в результате которого происходит повреждение активными формами кислорода различных клеток, тканей и органов. В процессе повреждения данных биологических систем участвуют три активные формы кислорода: супероксид-анион (O2.-), перекись водорода (H2O2) и гидроксид-анион (OH).
В нормальных условиях свободные радикалы быстро нейтрализуется естественными антиоксидантами - внутриклеточными, мембранными и внеклеточными. Уровни антиоксидантов и обеспечение хорошей защиты со стороны антиоксидантных систем очень важны для предотвращения оксидативного стресса. Для оценки состояния антиоксидантной системы необходимо определение содержания/ активности наиболее важных антиоксидантов, что позволит выявлять лиц с повышенным риском развития заболеваний, связанных с оксидативным стрессом, проводить мониторинг за течением заболевания и эффективностью применяемой терапии, обосновывать применение в комплексном лечении больного генно-терапевтических средств на основе генов антиоксидантов. Антиоксидантные механизмы могут быть энзиматическими (практически всегда внутриклеточные) и не энзиматические (как внутриклеточные, так и внеклеточные). Ферментные (энзиматические) антиоксиданты являются средствами внутриклеточной защиты, поскольку в плазме крови и в лимфе они обнаруживаются лишь в следовых количествах. К внутриклеточным энзиматическим антиоксидантам относятся белки супероксиддисмутазы, пероксидазы и белок каталазы. Супероксиддисмутазы катализируют превращение супероксид-аниона в кислород и перекись водорода, которая затем утилизируется глутатионпероксидазами и каталазой.
Каталаза - фермент, относящийся к классу оксидоредуктаз, который катализирует гетеролитическое расщепление O-O-связи в перекиси водорода при реакции разложения пероксид водорода на воду и молекулярный кислород (2H2O2→2H2O+O2), а также участвует в окислении в присутствии пероксида водорода низкомолекулярных спиртов и нитритов. Таким образом, функция каталазы сводится к утилизации токсичного пероксида водорода, который образуется в ходе различных окислительных процессов в организме. Каталаза - хромопротеид с молекулярной массой около 240000 Д, состоит из 4 субъединиц, имеющих по одной группе гема. Это высокоактивный фермент, который не требует энергии для активации. При избытке метионина, цистина, меди, цинка возникает снижение активности каталазы.
Ген каталазы CAT имеет длину 34 кБ, содержит 13 экзонов, его кодирующая последовательность 1581 н.п.
Фермент каталаза содержится почти во всех организмах, и участвует в тканевом дыхании, в процессах окисления и восстановления гемоглобина, заживления поверхностных дефектов роговицы. По данным иммуногистохимических методов, максимальная активность каталазы (в 6 раз выше средней) определяется в ретинальном пигментном эпителии глаза. Она локализована преимущественно в пероксисомах клетки и цитоплазме. Пероксисомы встречаются в клетках всех тканей организма человека, но особенно они многочисленны в гепатоцитах, в клетках проксимальных почечных канальцев, корковом слое надпочечников, миелиновых структурах нервных клеток и жировой ткани. У человека высокое содержание каталазы обнаружено в лейкоцитах и эритроцитах, а также в печени (до 60% общей активности) и почках. Энзиматическая активность каталазы в нервных тканях, в частности, в мозге, составляет лишь несколько процентов от ее уровня в печени (Биополимеры и клетка, 1992, 8(6): 3). Для защиты от активных форм кислорода нейтрофилы содержат каталазу и глутатион-пероксидазу (Klebanoff, Clark, 1978). Также каталазу содержат моноциты.
Каталаза относится к наиболее важным компонентам антиоксидантной системы в коже. Описан полиморфизм гена каталазы в промоторной области (-262С>Т), который приводит к нарушению связывания транскрипционных факторов и вызывает снижение экспрессии гена каталазы, а также дальнейшее изменение активности фермента. Показано, что данный полиморфизм ассоциирован с повышением риска развития рака молочной железы. Также определено снижение частоты носителей мутантного аллеля Т/Т среди больных плоскоклеточным раком кожи, что может указывать на роль каталазы в развитии данного новообразования (Онкология. 2013. - N 3. - С. 45-47). У больных псориазом отмечено повышение активности каталазы в эритроцитах и фибробластах кожи (Марков Х.М. Российский педиатрический журнал. 2005. - N 6. - С. 31-35)
Исторически первым подходом к проблеме использования ферментов для лечения заболеваний было их включение в полимерные микрокапсулы. Примером использования микрокапсулированной каталазы в клинической практике является применение микрокапсул с каталазой для лечения в ротовой полости человека ран, образующихся при акаталаземии в результате накопления выделяемой бактериями перекиси водорода (Chang Т.М. S.J Dent. Res., 1972, 51, p. 319-321.).
Было разработано лекарственное средство в виде назального спрея, в основе которого использовали экзосомы, полученные из лейкоцитов пузырьки, состоящие из протеинов и липидов, в которые была помещена каталаза. Экзосомы формируются мембранами клеток для перемещения химических сигналов. Такой способ доставки фермента был использован для преодоления гемато-энцефалического барьера и доставки антиоксиданта в головной мозг для лечения болезни Паркинсона и других нейродегенеративных заболеваний. (Matthew J. Haney, Natalia L. Klyachko, Yuling Zhao, Richa Gupta, Evgeniya G. Plotnikova, Zhijian He, Tejash Patel, Aleksandr Piroyan, Marina Sokolsky, Alexander V. Kabanov, Elena V. Batrakova. Exosomes as drug delivery vehicles for Parkinson's disease therapy. Journal of Controlled Release, 2015; 207, 10 June 2015, Pages 18-30). Недостаток данного подхода состоит в том, что при данном методе введения желаемый терапевтический эффект может оказаться недостигнутым, а также в том, что получение подобных препаратов высокой чистоты является дорогостоящим, а при недостаточной степени очистки возможны побочные реакции.
В патенте RU 2538675 С2 описано изобретение, которое заключается в применении комбинации экзогенного легочного сурфактанта, CuZn-супероксиддисмутазы и каталазы для одновременного, последовательного или раздельного использования в предотвращении бронхолегочной дисплазии (BPD) у недоношенных детей с респираторным дистресс-синдромом (RDS). Набор для предотвращения BPD состоит из: а) экзогенного легочного сурфактанта (предпочтительным модифицированным природным легочным сурфактантом является порактант альфа, состоящему из полярных липидов, в основном фосфолипидов, и белков SP-B и SP-C.) и фармацевтически приемлемого носителя или разбавителя в первой стандартной лекарственной форме; b) CuZn-супероксиддисмутазы человека из эритроцитов или печени или данный рекомбинантный белок человека и фармацевтически приемлемого носителя или разбавителя во второй стандартной лекарственной форме (необязательно), с) каталазы человека из эритроцитов или печени или данный рекомбинантный белок человека и, фармацевтически приемлемого носителя или разбавителя в третьей стандартной лекарственной форме (необязательно); d) контейнера для хранения указанных первой, второй и третьей лекарственных форм. Использование комбинации повышает эффективность лечения BPD за счет синергетического эффекта совместного действия компонентов. Описанное в патенте лекарственное средство находится в форме, подходящей для ингаляции или интратрахеального введения. Данное изобретение основывается на данных о том, что CuZn-супероксиддисмутаза и каталаза в конкретных дозах действуют синергично на утилизационную активность экзогенных легочных сурфактантов по отношению к активным формам кислорода, и при этом применение указанных антиоксидантных ферментов в заявленных однократных дозах не инактивирует модифицированный природный легочный сурфактант. Недостаток данного подхода состоит в том, что при использовании белкового препарата антиоксиданта желаемый терапевтический эффект может оказаться недостигнутым или кратковременным, а также - при недостаточной степени очистки белка-фермента возможны побочные реакции или проявление его недостаточной ферментативной активности.
Известно также введение в организм генетических конструкций, модулирующих активность природного гена. За прототип авторами было принято решение по заявке WO 2000054595, содержащее способы применения аденоассоциированных вирусных композиций, в частности, использование rAAV конструкций, экспрессирующих каталазу и супероксиддисмутазу в композиции для доставки к зрительному нерву, а также - способы лечения и облегчения симптомов демиелинизирующих заболеваний животного, такие как рассеянный склероз, аллергический энцефаломиелит и неврит зрительного нерва. В изобретении использован рекомбинантный адено-ассоциированный вирус для доставки терапевтического гена CAT или SOD в трансформированные клетки, чтобы защитить такие клетки от негативного воздействия перекиси водорода. Эти эффекты включают в себя классическую демиелинизацию и разрушение гематоэнцефалического барьера, которые являются отличительными чертами многих заболеваний, связанных с демиелинизирующими нарушениями центральной нервной системы. В примерах описано применение сегментов нуклеиновых кислот, которые кодируют, в том числе полипептиды супероксиддисмутазы, каталазы и подобные белки. В некоторых вариантах осуществления изобретения, предложен сайт-направленный мутагенез кодирующих полинуклеотидных последовательностей для изменения активности или эффективности векторных конструкций. Также предполагается проведение внесение изменений в аминокислотную последовательность за счет изменения нуклеотидной последовательности таким образом, чтобы был получен биологически функционально эквивалентный белок.
В изобретении описан способ подавления окислительного повреждения путем применения вирусно-опосредованного переноса генов человека, которые снижают уровни перекиси водорода или супероксида в зрительных нервах на модели in vivo. Показано, что при введении гена CAT активность каталазы была увеличена примерно в два раза в различных типах клеток зрительного нерва. Также выявлено, что при введении этого гена демиелинизация снижается на 38%, отек зрительного нерва снижается на 29%, клеточная инфильтрация - на 34%, нарушение гематоэнцефалического барьера - на 64%, a in vivo уровень H2O2 на 61%. Таким образом, результаты исследований подтверждают эффективность использования системы доставки генов каталазы (CAT) или супероксиддисмутазы (SOD) с использованием вирусных векторов в качестве терапевтической стратегии для подавления рассеянного склероза. Основным преимуществом такой генной терапии с генами CAT, SOD или других генов, подавляющих оксидативный стресс, является то, что после однократного введения, ген(ы) непрерывно работает(ют) в клетках нервной системы, тем самым обеспечивая долговременную защиту от воздействия активных форм кислорода или перекиси водорода. Следовательно, пациенты требуют менее частой госпитализации или дополнительного лечения.
Недостатком данного подхода является то, что при создании генно-терапевтического средства в этом изобретении использован аденоассоциированный вирус, который может интегрироваться в хромосому клетки-хозяина, а также - не учитываются индивидуальные характеристики пациента, в связи с которыми может понадобиться группа вариаций для данного средства.
Раскрытие изобретения
Задачей данного изобретения является создание высокоэффективного средства для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена CAT и/или уменьшением активности белка каталазы, на основе генно-терапевтических субстанций с геном CAT.
Указанная задача решается за счет того, что создано средство для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена CAT и/или уменьшением активности белка каталазы на основе генно-терапевтических субстанций с кДНК гена CAT, представляющее собой, по крайней мере, одну генно-терапевтическую субстанцию, выбранную из группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена CAT, с кодирующей последовательностью белка каталазы, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена CAT SEQ ID No: 1, или модифицированной кДНК гена CAT, при этом в качестве модифицированной кДНК гена CAT используют SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций, каждая из которых содержит также регуляторные элементы, обеспечивающие высокий уровень экспрессии гена CAT в эукариотических клетках, в частности в клетках органов и тканей человека, и способную увеличить активность белка каталазы в клетках органов и тканей и/или органах и тканях человека, в частности в эритроцитах, или лейкоцитах, или моноцитах, или нейтрофилах, или гепатоцитах, или эпителиальных клетках роговицы, или в нефронах, или в клетках проксимальных почечных канальцев, или в клетках коркового слоя надпочечников, или в нервных клетках, или клетках жировой ткани, или клетках кожи (например, фибробластах), в эпителиальных клетках, или клетках мышечной ткани в сочетании с транспортной молекулой или без нее при трансфекции этими биологически активными генно-терапевтическими субстанциями клеток органов и тканей человека и/или в органах и тканях человека в частности, в печени, надпочечниках, почках, головном и спинном мозге, глазе, роговице, коже, в крови, в нервной ткани, в жировой ткани, в мышечной ткани, в эпителиальной ткани, в дерме в сочетании с транспортной молекулой или без нее при введении этих генно-терапевтических субстанций в органы и ткани человека. При этом каждая генетическая конструкция с модифицированной кДНК гена CAT содержит последовательность нуклеотидов, включающую в себя белок-кодирующую область кДНК гена CAT, которая несет модификации, не затрагивающие структуру белка каталазы, а именно: нуклеотидные замены, не приводящие к аминокислотным заменам или обрыву аминокислотной цепи, или комбинации вышеперечисленных модификаций и, не влияющие на кодируемую этой последовательностью аминокислотную последовательность. В качестве транспортной молекулы используют липосомы, или дендримеры 5-го и выше поколений, или амфифильные блоксополимеры.
Способ получения средства для лечения состояний человеческого организма связанного с уменьшением экспрессии гена CAT и/или уменьшением активности белка каталазы заключается в получении каждой генно-терапевтической субстанции из группы созданных генно-терапевтических субстанций., при этом получают кДНК гена CAT, затем помещают кДНК в векторную плазмиду, способную обеспечить высокий уровень экспрессии этой кДНК в клетках различных органов и тканей человека, наращивают и выделяют необходимое количество генетической конструкции, затем комбинируют генетическую конструкцию с транспортной молекулой для трансфекции полученной генно-терапевтической субстанцией клеток органов и тканей и/или введения полученной генно-терапевтической субстанции в органы и ткани человека, при этом используют кДНК гена CAT с кодирующей последовательностью белка каталазы, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена CAT SEQ ID No: 1, или модифицированной кДНК гена CAT, при этом в качестве модифицированной кДНК гена CAT используют, или SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций.
Способ использования средства для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена CAT и/или уменьшением активности белка каталазы, заключается в трансфекции генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций, клеток органов и тканей пациента и/или во введении в органы и ткани пациента аутологичных клеток пациента, трансфицированных генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций и/или во введении в органы и ткани пациента генно-терапевтической субстанции или нескольких субстанций, выбранной/ выбранных из группы созданных генно-терапевтических субстанций, или сочетанием обозначенных способов.
Описание фигур
На фиг. 1
Представлена нуклеотидная последовательность немодифицированной кДНК гена CAT длиной 1584 н.п. SEQ ID No: 1, которая имеет высокую гомологию с приводимой в базе данных GenBank под номером NM_001752 и кодирует белок каталазу (GenBank NP_001743.1.)
На фиг. 2
Представлена нуклеотидная последовательность модифицированной кДНК гена CAT, SEQ ID No: 2, которая содержит 1 нуклеотидную замену G→C в позиции 152, 1 нуклеотидную замену T→G в позиции 230 и 3 нуклеотидных замены A→G в позициях 194, 221 и 287, не приводящие к изменениям в аминокислотной последовательности белка каталазы.
На фиг. 3
Представлена нуклеотидная последовательность модифицированной кДНК гена CAT, SEQ ID No: 3, которая
содержит 2 нуклеотидных замены G→C в позициях 152, 449; 2 нуклеотидных замены T→G в позициях 230, 479; 4 нуклеотидных замены A→G в позициях 194, 221, 287, 386; 1 нуклеотидную замену А→С в позиции 566; не приводящие к изменениям в аминокислотной последовательности белка каталазы.
На фиг. 4
Представлена нуклеотидная последовательность модифицированной кДНК гена CAT, SEQ ID No: 4, которая
содержит 5 нуклеотидных замены G→C в позициях 152, 449, 626, 839, 842; 3 нуклеотидных замены T→G в позициях 230, 479, 653; 6 нуклеотидных замены A→G в позициях 194, 221, 287, 386, 653, 1043; 1 нуклеотидную замену А→С в позиции 566;; 1 нуклеотидную замену Т→С в позиции 1041; не приводящие к изменениям в аминокислотной последовательности белка каталазы.
На фиг. 5
Представлена нуклеотидная последовательность модифицированной кДНК гена CAT, SEQ ID NO: 5, которая
содержит 6 нуклеотидных замены G→C в позициях 152, 449, 626, 839, 842, 1262; 5 нуклеотидных замены T→G в позициях 230, 479, 653, 1229, 1253; 7 нуклеотидных замены A→G в позициях 194, 221, 287, 386, 653, 1043, 1235; 3 нуклеотидных замены А→С в позициях 566, 1085, 1208; 1 нуклеотидную замену Т→С в позиции 1041; не приводящие к изменениям в аминокислотной последовательности белка каталазы.
На фиг. 6
Представлена нуклеотидная последовательность модифицированной кДНК гена CAT, SEQ ID NO: 6, которая
содержит 8 нуклеотидных замен G→C в позициях 152, 449, 626, 839, 842, 1262, 1325, 1523; 6 нуклеотидных замены T→G в позициях 230, 479, 653, 1229, 1253, 1463; 7 нуклеотидных замены A→G в позициях 194, 221, 287, 386, 653, 1043, 1235; 3 нуклеотидных замены А→С в позициях 566, 1085, 1208; 1 нуклеотидную замену Т→С в позиции 1041; не приводящие к изменениям в аминокислотной последовательности белка каталазы.
На фиг. 7
Представлена нуклеотидная последовательность модифицированной кДНК гена CAT, SEQ ID No: 7, которая
содержит 10 нуклеотидных замен G→C в позициях 152, 449, 626, 839, 842, 1262, 1325, 1523, 1613, 1649; 6 нуклеотидных замены T→G в позициях 230, 479, 653, 1229, 1253, 1463; 7 нуклеотидных замены A→G в позициях 194, 221, 287, 386, 653, 1043, 1235; 3 нуклеотидных замены А→С в позициях 566, 1085, 1208; 1 нуклеотидную замену Т→С в позиции 1041; не приводящие к изменениям в аминокислотной последовательности белка каталазы.
На фиг. 8
С целью последующего корректного определения генно-терапевтического эффекта после трансфекции фибробластов генно-терапевтической субстанцией с кДНК гена CAT проводили анализ эндогенной экспрессии гена CAT в культуре первичных фибробластов. На фигуре представлены графики накопления продуктов полимеразной цепной реакции (ПЦР), соответствующих:
1 - кДНК гена CAT, фибробласты со сниженной экспрессией гена CAT,
2 - кДНК гена CAT, фибробласты с нормальной экспрессией гена CAT,
3 - кДНК гена В2М, фибробласты со сниженной экспрессией гена CAT,
4 - кДНК гена В2М, фибробласты с нормальной экспрессией гена CAT.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 9
С целью подтверждения увеличения экспрессии гена CAT в клеточной культуре фибробластов со сниженной экспрессией гена CAT при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена CAT с генетической конструкцией pCMV6-САТ SEQ ID No: 1 представлены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена CAT в фибробластах с нормальной экспрессией гена CAT,
2 - кДНК гена CAT в фибробластах со сниженной экспрессией гена CAT до трансфекции ГТС с кДНК гена CAT,
3 - кДНК гена CAT в фибробластах со сниженной экспрессией гена CAT после трансфекции ГТС с кДНК гена CAT,
4 - кДНК гена CAT в фибробластах со сниженной экспрессией гена CAT после трансфекции вектором без кДНК гена CAT,
5 - кДНК гена В2М в фибробластах с нормальной экспрессией гена CAT,
6 - кДНК гена В2М в фибробластах со сниженной экспрессией гена САТ до трансфекции ГТС с кДНК гена CAT,
7 - кДНК гена В2М в фибробластах со сниженной экспрессией гена CAT после трансфекции ГТС с кДНК гена CAT,
8 - кДНК гена В2М в фибробластах со сниженной экспрессией гена CAT после трансфекции вектором без кДНК гена CAT.
Из графиков следует, что в случае трансфекции вектором без вставки кДНК гена САТ уровень кДНК гена CAT в фибробластах не изменился, а в случае трансфекции вектором с кДНК гена CAT - уровень кДНК фибробластов со сниженной экспрессией гена CAT многократно увеличился (до уровня выше, чем уровень кДНК гена CAT в нормальных фибробластах).
На фиг. 10
С целью подтверждения увеличения активности белка каталазы, в клеточной культуре фибробластов с нормальной экспрессией гена CAT при трансфекции данных клеток генно-терапевтической субстанцией содержащей кДНК гена CAT представлен график изменения активности белка каталазы, нетрансфицированных фибробластов (культура А), трансфицированных вектором pCDNA 3.1 (+) не содержащим кДНК гена CAT (культура В) и трансфицированных генно-терапевтической субстанцией с генетической конструкцией pCDNA 3.1-CAT SEQ ID No: 1 (культура С). Из графика следует, что при трансфекции фибробластов генно-терапевтической субстанцией с кДНК гена CAT происходит увеличение активности белка каталазы, в клеточном лизате.
Культура А
Культура В
Культура С
На фиг. 11
С целью подтверждения увеличения активности белка каталазы, в коже человека при введении в кожу клеточной культуры фибробластов, трансфицированной генно-терапевтической субстанцией, представлен анализ изменения активности белка каталазы, в коже пациентов. При этом пациентам вводили три варианта культуры аутологичных фибробластов - нетрансфицированные (А), трансфицированные вектором pCMV6-XL5 (В) и трансфицированные генно-терапевтической субстанцией с генетической конструкцией pCMV6- CAT SEQ ID No: 7 (С) - в кожу предплечья. Также анализировали активность белка каталазы, в интактной коже (D). Показано повышение активности белка каталазы, в коже пациента в области введения фибробластов, трансфицированных генно-терапевтической субстанцией кДНК гена CAT (С).
A - аутологичные нетрансфицированные фибробласты
B - трансфицированные вектором pCMV6-XL5 фибробласты
C - трансфицированные субстанцией с pCMV6-CAT SEQ ID No: 7
D - активность белка CAT в интактной коже
На фиг. 12
С целью подтверждения увеличения активности белка каталазы до различного индивидуального уровня в клеточных культурах фибробластов пациентов при трансфекции данных клеток генно-терапевтическими субстанциями с участком нативной немодифицированной кДНК гена CAT и модифицированных кДНК гена CAT, представлен анализ изменения уровня активности белка каталазы в культурах фибробластов кожи человека в зависимости от наличия и типа модификаций в кДНК гена CAT, используемой для трансфекции фибробластов.
Культуры фибробластов 18 пациентов делили на 8 частей каждую с (А) по (Н); первые части (А) клеточных культур пациентов трансфицировали генно-терапевтической субстанцией pCMV6-CAT SEQ ID No: 1, части (В) трансфицировали генно-терапевтической субстанцией pCMV6-CA7 SEQ ID No: 2, части (С) трансфицировали генно-терапевтической субстанцией pCMV6-CAT SEQ ID No: 3, части (D) трансфицировали генно-терапевтической субстанцией pCMV6-CAT SEQ ID No: 4, части (E) трансфицировали генно-терапевтической субстанцией pCMV6-CAT SEQ ID No: 5, части (F) трансфицировали генно-терапевтической субстанцией pCMV6-CAT SEQ ID No: 6, части (G) трансфицировали генно-терапевтической субстанцией pCMV6-CA7 SEQ ID No: 7, части (H) трансфицировали векторной плазмидой, не содержащей кДНК гена CAT.
По итогам анализа уровня активности белка каталазы, выбрали показатели, касательно каждой части клеточной культуры от каждого пациента, продемонстрировавшие максимальную активность белка каталазы, и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальная активность белка каталазы, наблюдалась при трансфекции pCMV6-CAT SEQ ID No: 1,
в группе 2 максимальная активность белка каталазы, наблюдалась при трансфекции pCMV6-CAT SEQ ID No: 2,
в группе 3 максимальная активность белка каталазы, наблюдалась при трансфекции pCMV6-CAT SEQ ID No: 3,
в группе 4 максимальная активность белка каталазы, наблюдалась при трансфекции pCMV6-GA7 SEQ ID No: 4,
в группе 5 максимальная активность белка каталазы, наблюдалась при трансфекции pCMV6-CA7 SEQ ID No: 5,
в группе 6 максимальная активность белка каталазы, наблюдалась при трансфекции pCMV6-CAT SEQ ID No: 6,
в группе 7 максимальная активность белка каталазы, наблюдалась при трансфекции pCMV6-CA7 SEQ ID No: 7.
Ни в одной из клеточных культур не наблюдалось того, что максимальная активность белка каталазы присутствует при трансфекции вектором без вставки кДНК гена CAT.
На фигуре 12 для каждой группы клеточных культур приведены диаграммы показателей ингибирования цветной реакции (усредненных в рамках группы, в случае, если в группу входит более одной клеточной культуры) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после трансфекции этих клеточных культур генно-терапевтическими субстанциями, содержащими модифицированные и нативную кДНК гена CAT.
Из фигуры следует, что достижение максимальной активности белка каталазы, в культурах фибробластов кожи различных пациентов при их трансфекции генно-терапевтическими субстанциями, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена CAT, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей необходимо предварительное персонализированное исследование пациента.
Обозначения:
части клеточных культур, трансфицированных ГТС CAT SEQ ID No: 1(A)
части клеточных культур, трансфицированных ГТС CAT SEQ ID No: 2 (В)
части клеточных культур, трансфицированных ГТС CAT SEQ ID No: 3 (С)
части клеточных культур, трансфицированных ГТС CAT SEQ ID No: 4 (D)
части клеточных культур, трансфицированных ГТС CAT SEQ ID No: 5 (E)
части клеточных культур, трансфицированных ГТС CAT SEQ ID No: 6 (F)
части клеточных культур, трансфицированных ГТС CAT SEQ ID No: 7 (G)
части клеточных культур, трансфицированных плацебо (Н)
На фиг. 13
С целью подтверждения увеличения экспрессии гена CAT в клеточной культуре эпителиальных клеток глаза человека при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена CAT в генетической конструкции pCMV6-Kan/Neo CAT SEQ ID No: 2 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена CAT, эпителий роговицы до трансфекции
2 - кДНК гена CAT, эпителий роговицы после трансфекции
3 - кДНК гена В2М, эпителий роговицы до трансфекции
4 - кДНК гена В2М, эпителий роговицы после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена CAT в культуре клеток эпителия роговицы человека многократно вырос.
На фиг. 14
С целью подтверждения увеличения экспрессии гена CAT в клеточной культуре эпителия слизистой оболочки полости рта при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена CAT приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена CAT, до трансфекции
2 - кДНК гена CAT, после трансфекции
3 - кДНК гена В2М, до трансфекции
4 - кДНК гена В2М, после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена САТ вырос многократно.
На фиг. 15
С целью подтверждения увеличения активности белка каталазы, в коже человека при введении в кожу генно-терапевтической субстанции представлен анализ изменения активности белка каталазы в коже. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена CAT pCMV6-CA7 SEQ ID No: 4(В) и параллельно вводили плацебо, представляющее собой комбинацию векторной плазмиды pCMV-XL5 не содержащей кДНК гена CAT с транспортной молекулой (А) - в кожу предплечья. Показано увеличение активности белка каталазы, в биоптате кожи пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена CAT, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
На фиг. 16
С целью подтверждения увеличения активности белка каталазы в слизистой оболочке полости рта человека при введении в слизистую оболочку полости рта генно-терапевтической субстанции представлен анализ изменения активности белка каталазы, в слизистой оболочке полости рта. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена CAT pCDNA 3.1 CAT SEQ ID No: 5 (В) и параллельно вводили плацебо pCDNA 3.1(+), представляющее собой комбинацию векторной плазмиды, не содержащей кДНК гена CAT с транспортной молекулой (А) - в слизистую оболочку полости рта.
Показано увеличение активности белка каталазы, в лизате биоптата слизистой оболочки полости рта пациента 1В, которому вводилась генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена CAT, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент1А
пациент 1В
пациент 1В до введения ГТС
На фиг. 17
С целью подтверждения увеличения активности белка каталазы, в мышечной ткани человека при введении в мышечную ткань генно-терапевтической субстанции представлен анализ изменения активности белка каталазы в мышечной ткани. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазм иду с кДНК гена CAT - pCMV6-Kan/Neo CAT SEQ ID No: 6 (В) и параллельно вводили плацебо pCMV6-Kan/Neo, представляющее собой комбинацию векторной плазмиды, не содержащей кДНК гена CAT с транспортной молекулой (А) - в мышечную ткань в зоне предплечья. Показано увеличение активности белка каталазы, в биоптате мышечной ткани пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена CAT, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
На фиг. 18
С целью подтверждения увеличения активности белка каталазы до различного индивидуального уровня при введении в кожу пациентов генно-терапевтических субстанций с модифицированными кДНК гена CAT и участком нативной немодифицированной кДНК гена CAT анализировали уровень активности белка каталазы в коже человека в зависимости от наличия и типа модификаций в кДНК гена CAT.
Каждому из 21-го пациента, которые были отобраны в случайном порядке, вводили в кожу предплечья 7 генно-терапевтических субстанций pCMV6- SEQ ID No: 1, pCMV6- SEQ ID No: 2, pCMV6- SEQ ID No: 3, pCMV6- SEQ ID No: 4, pCMV6- SEQ ID No: 5, pCMV6- SEQ ID No: 6, pCMV6- SEQ ID No: 7, и плацебо pCMV6- XL5.
По итогам анализа уровня активности белка каталазы, в биоптатах выбрали показатели, касательно каждого биоптата от каждого пациента, продемонстрировавшие максимальные уровни активности белка каталазы, и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальная активность белка каталазы, наблюдалась при введении pCMV6-CAT SEQ ID No: 1,
в группе 2 максимальная активность белка каталазы, наблюдалась при введении pCMV6-CAT SEQ ID No: 2,
в группе 3 максимальная активность белка каталазы, наблюдалась при введении pCMV6-CAT SEQ ID No: 3,
в группе 4 максимальная активность белка каталазы, наблюдалась при введении pCMV6-CAT SEQ ID No: 4,
в группе 5 максимальная активность белка каталазы, наблюдалась при введении pCMV6-CAT SEQ ID No: 5,
в группе 6 максимальная активность белка каталазы, наблюдалась при введении pCMV6-CAT SEQ ID No: 6,
в группе 7 максимальная активность белка каталазы, наблюдалась при введении pCMV6-CAT SEQ ID No: 7.
Ни в одном из биоптатов не наблюдалось того, что максимальная активность белка каталазы, присутствует в случае введения плацебо.
На фигуре 18 для каждой группы биоптатов приведены диаграммы показателей ингибирования цветной реакции, (усредненных в рамках группы, в случае, если в группу входит более одного биоптата) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после введения пациентам этих генно-терапевтических субстанций, содержащих модифицированные кДНК гена CAT и участок нативной немодифицированной кДНК гена CAT.
Из данного примера следует, что достижение максимальной активности белка каталазы, в биоптатах кожи различных пациентов при введении им в кожу генно-терапевтических субстанций, связано с индивидуальными особенностями паци