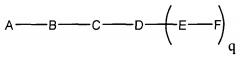Композиции и способы модулирования экспрессии аполипопротеина c-iii
Иллюстрации
Показать всеИзобретение относится к пригодному для применения в медицине соединению, содержащему модифицированный олигонуклеотид и конъюгирующую группу
при этом модифицированный олигонуклеотид состоит из 20 связанных азотистых оснований, комплементарных равной по длине части азотистых оснований 3533-3552 в SEQ ID NO: 3, при этом модифицированный олигонуклеотид содержит сегмент гэп, состоящий из связанных дезоксинуклеозидов; сегмент крыла 5', состоящий из связанных нуклеозидов; сегмент крыла 3', состоящий из связанных нуклеозидов; при этом сегмент гэп расположен между сегментом крыла 5' и сегментом крыла 3', и при этом каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар, и где по меньшей мере один нуклеозид содержит модифицированное азотистое основание; и модифицированный олигонуклеотид содержит по меньшей мере одну модифицированную межнуклеозидную связь. Предложены новые конъюгаты модифицированных олигонуклеотидов и композиции на их основе для лечения, предупреждения или замедления прогрессирования заболевания, связанного с повышенным уровнем аполипопротеина C-III (ApoCIII). 5 н. и 16 з.п. ф-лы, 120 пр., 119 табл.
Реферат
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящее изобретение зарегистрировано вместе с перечнем последовательностей в электронном формате. Перечень последовательностей приведен в виде файла под названием BIOL0249WOSEQ_ST25.txt, созданного 1 мая 2014 года, размером 68 Кб. Информация о перечне последовательностей в электронном формате в полном объеме включена в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Принцип, лежащий в основе антисмысловой технологии, заключается в том, что антисмысловое соединение гибридизуется с целевой нуклеиновой кислотой и модулирует количество, активность и/или функцию целевой нуклеиновой кислоты. Например, в некоторых случаях антисмысловые соединения приводят к изменению транскрипции или трансляции мишени. Такое модулирование экспрессии может быть достигнуто, например, разрушением целевой мРНК или замещающим ингибированием. Пример модулирования целевой функции РНК за счет разрушения представляет собой разрушение за счет РНКазы Н целевой РНК при гибридизации с ДНК-подобным антисмысловым соединением. Другой пример модулирования генной экспрессии за счет нацеленного разрушения представляет собой РНК-интерференция (РНКи). РНКи относится к антисмысл-опосредованному сайленсингу гена по механизму, в котором применяется РНК-индуцируемый комплекс сайленсинга (RISC). Дополнительный пример модулирования целевой функции РНК представляет собой механизм замещения, такой как использует в естественных условиях микроРНК. МикроРНК представляют собой небольшие некодирующие РНК, которые регулируют экспрессию РНК, кодирующих белки. Связывание антисмыслового соединения с микроРНК препятствует связыванию микроРНК с ее матричными РНК мишенями, и, следовательно, затрудняет функцию микроРНК. МикроРНК-миметики могут усиливать естественную функцию микроРНК. Некоторые антисмысловые соединения изменяют сплайсинг пре-мРНК. Независимо от конкретного механизма, специфичность в отношении последовательностей делает антисмысловые соединения перспективными в качестве средств для подтверждения нацеленности и функционализации генов, а также в качестве терапевтических средств для селективного модулирования экспрессии генов, участвующих в патогенезе заболеваний.
Антисмысловая технология представляет собой эффективный способ модулирования экспрессии одного или более специфических генных продуктов и, следовательно, может быть признана исключительно подходящей в ряде терапевтических, диагностических и исследовательских применений. Химически модифицированные нуклеозиды могут быть внедрены в антисмысловые соединения для усиления одного или более свойств, таких как устойчивость к нуклеазе, фармакокинетика или аффинность к целевой нуклеиновой кислоте. В 1998 году антисмысловое соединение Vitravene® (фомивирсен; разработанный компанией Isis Pharmaceuticals Inc., Карлсбад, штат Калифорния) стал первым антисмысловым лекарством, получившим разрешение на продажу от Администрации США по пищевым продуктам и лекарственным веществам (FDA), и в настоящее время представляет собой средство для лечения вызванного цитомегаловирусом (CMV) ретинита у пациентов со СПИДом.
Новые химические модификации обладают улучшенной активностью и эффективностью антисмысловых соединений, раскрывая потенциал для пероральной доставки, а также для усовершенствования подкожного введения, снижения возможных побочных эффектов, и приводят к улучшению удобства для пациента. Химические модификации, усиливающие активность антисмысловых соединений, позволяют осуществлять введение более низких доз, что снижает возможность токсичности, а также уменьшает общую стоимость лечения. Модификации, увеличивающие устойчивости к разрушению, приводят к более медленному выведению из организма, обеспечивая возможность менее частого введения доз. Различные типы химических модификаций могут быть комбинированы в одном соединении для дальнейшей оптимизации эффективности соединения.
Аполипопротеин C-III (называемый также АРОС3, APOC-III, АроCIII и APOC-III) входит в состав липопротеинов высокой плотности (HDL) и богатых на триглицериды (TG) липопротеинов. Повышенные уровни АроCIII связаны с повышенными уровнями TG и такими заболеваниями, как сердечно-сосудистые заболевания, метаболический синдром, ожирение и диабет (Chan et al., Int J Clin Pract, 2008, 62: 799-809; Onat et at., Atherosclerosis, 2003, 168: 81-89; Mendivil et al., Circulation, 2011, 124: 2065-2072; Mauger et al., J. Lipid Res, 2006. 47: 1212-1218; Chan et al., Clin. Chem, 2002. 278-283; Ooi et al., Clin. Sci, 2008. 114: 611-624; Davidsson et al., J. Lipid Res. 2005. 46: 1999-2006; Sacks et al., Circulation, 2000. 102: 1886-1892; Lee et al., Arterioscler Thromb Vasc Biol, 2003. 23: 853-858). АроCIII замедляет клиренс богатых на TG липопротеинов путем ингибирования липолиза из-за подавления липопротеин-липазы (LPL) и за счет взаимодействия с липопротеином, связанным с гликозаминогликановой матрицей клеточной поверхности (Shachter, Curr. Opin. Lipidol, 2001, 12, 297-304).
Антисмысловая технология развивается как эффективное средство снижения экспрессии определенных генных продуктов, и может быть подтверждена ее уникальная полезность в ряде терапевтических, диагностических и исследовательских применений для модулирования АроCIII. Ранее были описаны антисмысловые соединения, нацеленные на АроCIII, и родственные способы ингибирования АроCIII (см., например, патент США 7598227, патент США 7750141, публикацию РСТ WO 2004/093783, публикацию РСТ WO 2012/149495 и PCT/US 14/016546, которые включены в настоящий документ посредством ссылки). Антисмысловое соединение, нацеленное на АроCIII, ISIS-APOCIIIRx, было испытано в клинических испытаниях I и II фазы. Однако ни одно антисмысловое соединение, нацеленное на АроCIII, не было одобрено для промышленного применения, соответственно, все еще существует необходимость в обеспечении пациентов дополнительными и более эффективными возможностями лечения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В некоторых вариантах реализации настоящего описания приведены конъюгированные антисмысловые соединения. В некоторых вариантах реализации настоящего описания приведены конъюгированные антисмысловые соединения, содержащие антисмысловый олигонуклеотид, комплементарный транскрипту нуклеиновой кислоты. В некоторых вариантах реализации настоящего описания приведены способы, включающие контакт клетки с конъюгированным антисмысловым соединением, содержащим антисмысловый олигонуклеотид, комплементарный транскрипту нуклеиновой кислоты. В некоторых вариантах реализации настоящего описания приведены способы, включающее контакт клетки с конъюгированным антисмысловым соединением, содержащим антисмысловый олигонуклеотид, и уменьшение количества или активности транскрипта нуклеиновой кислоты в клетке.
Ранее был описан асиалогликопротеиновый рецептор (ASGP-R). См., например, Paik et al., PNAS, том 102, №47, cc. 17125-17129 (2005). Такие рецепторы экспрессируются на клетках печени, в частности, гепатоцитах. Кроме того, было показано, что соединения, содержащие кластеры трех N-ацетилгалактозаминовых (GalNAc) лигандов, способны связываться с ASGP-R, приводя к захвату указанного соединения в клетку. См., например, Khorev et al., Bioorganic and Medicinal Chemistry, 16, 9, cc. 5216-5231 (май, 2008). Соответственно, конъюгаты, содержащие такие кластеры GalNAc, применяли для облегчения захвата некоторых соединений в клетки печени, в частности, гепатоциты. Например, было показано, что некоторые GalNAc-содержащие конъюгаты увеличивают активности дуплексных миРНК соединений в клетках печени in vivo. В таких случаях GalNAc-содержащий конъюгат, как правило, прикрепляется к смысловой спирали дуплекса миРНК. Поскольку смысловая спираль отбрасывается перед окончательной гибридизацией антисмысловой спирали с целевой нуклеиновой кислотой, то маловероятно, что такой конъюгат будет влиять на активность. Как правило, конъюгат присоединяется к 3'-концу смысловой спирали миРНК. См., например, патент США 8106022. Некоторые конъюгирующие группы, описанные в настоящем документе, более активны и/или синтезируются легче, чем конъюгирующие группы, описанные ранее.
В некоторых вариантах реализации настоящего изобретения конъюгаты присоединяются к односпиральным антисмысловым соединениям, включая, но не ограничиваясь ими, антисмысловые соединения на основе РНКазы Н и антисмысловые соединения, которые изменяют сплайсинг целевой нуклеиновой кислоты пре-мРНК. В таких вариантах реализации конъюгат должен оставаться присоединенным к антисмысловому соединению достаточно долго для обеспечения преимущества (улучшенного захвата в клетки), но затем он должен либо расщепляться, либо иным образом не препятствовать последующим стадиям, необходимым для активности, таким как гибридизация с целевой нуклеиновой кислотой и взаимодействие с РНКазой Н или ферментами, связанными со сплайсингом или модулированием сплайсинга. Такой баланс свойств более важен при осаждении односпиральных антисмысловых соединений, чем соединений миРНК, где конъюгат может быть просто присоединен к смысловой спирали. В настоящем документе описаны односпиральные антисмысловые соединения, обладающие улучшенной активностью в клетках печени in vivo, по сравнению с таким же антисмысловым соединением, не имеющим конъюгата. Учитывая необходимый баланс свойств для этих соединений, такая улучшенная активность является неожиданной.
В некоторых вариантах реализации конъюгирующие группы по настоящему документу содержат расщепляемый фрагмент. Как было отмечено, не ограничиваясь каким-либо механизмом, логично, что конъюгат должен сохраняться у соединения достаточно долго для обеспечения усиления захвата, но после этого желательно, чтобы некоторая его часть или, в идеале, весь конъюгат расщеплялся, выделяя исходное соединение (например, антисмысловое соединение) в его наиболее активной форме. В некоторых вариантах реализации расщепляемый фрагмент представляет собой расщепляемый нуклеозид. Такие варианты реализации обладают преимуществом эндогенных нуклеаз в клетке за счет присоединения остальной части конъюгата (кластера) к антисмысловому олигонуклеотиду через нуклеозид при помощи одной или более расщепляемых связей, таких как фосфодиэфирные связи. В некоторых вариантах реализации кластер связан с расщепляемым нуклеозидом через фосфодиэфирную связь. В некоторых вариантах реализации расщепляемый нуклеозид присоединен к антисмысловому олигонуклеотиду (антисмысловому соединению) фосфодиэфирной связью. В некоторых вариантах реализации конъюгирующая группа может содержать два или три расщепляемых нуклеозида. В таких вариантах реализации указанные расщепляемые нуклеозиды связаны друг с другом, с антисмысловым соединением и/или с кластером посредством расщепляемых связей (таких как фосфодиэфирная связь). Некоторые конъюгаты по настоящему документу не содержат расщепляемый нуклеозид, а вместо этого содержат расщепляемую связь. Показано, что достаточное расщепление конъюгата из олигонуклеотида обеспечивается по меньшей мере за счет одной связи, которая легко поддается расщеплению в клетке (расщепляемая связь).
В некоторых вариантах реализации конъюгированные антисмысловые соединения представляют собой пролекарства. Такие пролекарства вводят животному, и они в конечном итоге метаболизируются до более активной формы. Например, конъюгированные антисмысловые соединения расщепляются с удалением всего или части конъюгата, приводя к активной (или более активной) форме антисмыслового соединения, не содержащего всего или части конъюгата.
В некоторых вариантах реализации конъюгаты присоединены на 5'-конце олигонуклеотида. Некоторые такие 5'-конъюгаты расщепляются более эффективно, чем аналоги, имеющие такую же конъюгирующую группу, присоединенную на 3'-конце. В некоторых вариантах реализации улучшенная активность может коррелировать с улучшенным расщеплением. В некоторых вариантах реализации олигонуклеотиды, содержащие конъюгат на 5'-конце, обладают более высокой эффективностью, чем олигонуклеотиды, содержащие конъюгат на 3'-конце (см., например, Примеры 56, 81, 83 и 84). Кроме того, 5'-присоединение обеспечивает более простой синтез олигонуклеотида. Как правило, олигонуклеотиды синтезируют на твердой подложке в направлении от 3' к 5'. Для получения 3'-конъюгированного олигонуклеотида, как правило присоединяют предварительно конъюгированный 3'-нуклеозид к твердой подложке, а затем обычным путем создают олигонуклеотид. Однако присоединение такого конъюгированного нуклеозида к твердой подложке усложняет синтез. Кроме того, применяя такой подход, конъюгат затем присутствует в ходе всего синтеза олигонуклеотида и может разрушаться во время последующих стадий или может ограничивать типы реакций и реагентов, которые можно применять. Применяя структуры и методики, описанные в настоящем документе для 5'-конъюгированных олигонуклеотидов, можно синтезировать олигонуклеотид при помощи стандартных автоматизированных методик и внедрять в конъюгат окончательный (5'-ближайший) нуклеозид или после отделения олигонуклеотида от твердой подложки.
С учетом известного уровня техники и настоящего описания, специалисты в данной области техники могут легко получить любые из конъюгатов и конъюгированных олигонуклеотидов, описанных в настоящем документе. Кроме того, синтез некоторых таких конъюгатов и конъюгированных олигонуклеотидов, описанных в настоящем документе, проще и/или требует меньше стадий и, следовательно, менее дорогой, чем синтез ранее описанных конъюгатов, что дает преимущество при производстве. Например, синтез некоторых конъюгирующих групп состоит из меньшего количество синтетических стадий, что приводит к увеличению выхода, по сравнению с ранее описанными конъюгирующими группами. Конъюгирующие группы, такие как GalNAc3-10 в Примере 46 и GalNAc3-7 в Примере 48, гораздо проще, чем ранее описанные конъюгаты, такие как описаны а публикациях U.S. 8106022 или U.S. 7262177, для которых необходима сборка большего количества химических промежуточных соединений. Соответственно, эти и другие конъюгаты, описанные в настоящем документе, обладают преимуществом по сравнению с ранее описанными соединениями для применения с любым олигонуклеотидом. включая односпиральные олигонуклеотиды и любую спираль двухспиральных олигонуклеотидов (например, миРНК).
Точно так же в настоящем документе описаны конъюгирующие группы, имеющие только один или два лиганда GalNAc. Как показано, такие конъюгированные группы усиливают активность антисмысловых соединений. Такие соединения гораздо проще получить, чем конъюгаты, содержащие три лиганда GalNAc. Конъюгирующие группы, содержащие один или два лиганда GalNAc, могут быть присоединены к любым антисмысловым соединениям, включая односпиральные олигонуклеотиды и любую спираль двухспиральных олигонуклеотидов (например, миРНК).
В некоторых вариантах реализации конъюгаты, описанные в настоящем документе, существенно не изменяют некоторые показатели переносимости. Например, в настоящем документе показано, что конъюгированные антисмысловые соединения являются не более иммуногенными, чем неконъюгированные исходные соединения. Поскольку активность улучшается, то варианты реализации, в которых переносимость остается такой же (или, в действительности, если даже переносимость ухудшается лишь незначительно, по сравнению с приростом активности), обладают улучшенными характеристиками для терапии.
В некоторых вариантах реализации конъюгация позволяет изменять антисмысловые соединения так, чтобы они обладали менее выраженными последствиями в отсутствие конъюгации. Например, в некоторых вариантах реализации замена одной или более тиофосфатных связей полностью тиофосфатного антисмыслового соединения w фосфодиэфирные связи приводит к улучшению некоторых показателей переносимости. Например, в некоторых случаях такие антисмысловые соединения, имеющие один или более фосфодиэфиров, являются менее иммуногенными, чем такие же соединения, в которых каждая связь представляет собой тиофосфат. Однако в некоторых случаях, как показано в Примере 26, такое же замещение одной или более тиофосфатных связей на фосфодиэфирные связи приводит также к снижению клеточного захвата и/или к снижению активности. В некоторых вариантах реализации конъюгированные антисмысловые соединения, описанные в настоящем документе, допускают такое изменение связей с небольшим снижением или без снижения захвата и активности, по сравнению с конъюгированным полностью тиофосфатным аналогом. В действительности, в некоторых вариантах реализации, например в Примерах 44, 57, 59 и 86, олигонуклеотиды, содержащие конъюгат и по меньшей мере одну фосфодиэфирную межнуклеозидную связь, фактически демонстрируют повышенную активность in vivo даже по сравнению с полностью тиофосфатным аналогом, также содержащим такой же конъюгат. Более того, поскольку конъюгация приводит к значительному увеличению захвата/активности, то небольшое снижение такого существенного прироста может быть приемлемым для достижения улучшенной переносимости. Соответственно, в некоторых вариантах реализации конъюгированные антисмысловые соединения содержат по меньшей мере одну фосфодиэфирную связь.
В некоторых вариантах реализации конъюгация антисмысловых соединений по настоящему документу приводит к улучшенной доставке, захвату и активности в гепатоцитах. Следовательно, в ткань печени доставляется большее количество соединения. Однако в некоторых вариантах реализации изобретения такая улучшенная доставка сама по себе не объясняет общего увеличения активности. В некоторых таких вариантах реализации изобретения большее количество соединения поступает в гепатоциты. В некоторых вариантах реализации изобретения даже такой улучшенный захват гепатоцитов сам по себе не объясняет общего увеличения активности. В таких вариантах реализации изобретения увеличивается продуктивный захват конъюгированного соединения. Например, как показано в Примере 102, некоторые варианты реализации GalNAc-содержащих конъюгатов увеличивают обогащение антисмысловых олигонуклеотидов в гепатоцитах, по сравнению с не паренхимальными клетками. Такое обогащение преимущественно для олигонуклеотидов, которые нацелены на гены, экспрессируемые в гепатоцитах.
В некоторых вариантах реализации конъюгированные антисмысловые соединения ненастоящему документу приводят к уменьшению воздействия на почки. Например, как показано в Примере 20, концентрации антисмысловых олигонуклеотидов, содержащих некоторые варианты реализации GalNAc-содержащих конъюгатов, в почках ниже, чем концентрации антисмысловых олигонуклеотидов, не имеющих GalNAc-содержащего конъюгата. Это имеет несколько преимущественных терапевтических применений. Для терапевтических показаний, в которых не требуется проявление активности в почках, воздействие на почки подвергает их риску токсичности без соответствующей пользы. Более того, высокая концентрация в почках обычно приводит к выводу соединения с мочой, обеспечивая более быстрое выведение. Соответственно, для внепочечных мишеней накопление в почках является нежелательным.
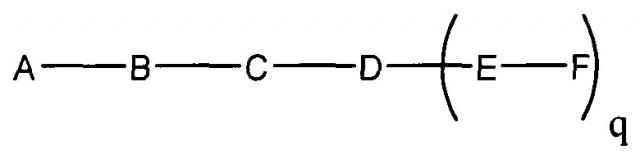
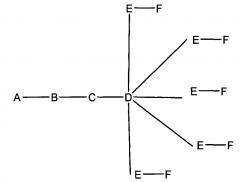
В некоторых вариантах реализации настоящего описания приведены конъюгированные антисмысловые соединения, приведенные формулой:
где
А представляет собой антисмысловый олигонуклеотид;
В представляет собой расщепляемый фрагмент;
С представляет собой линкер конъюгата;
D представляет собой группу ветвления;
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
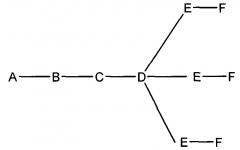
На приведенной выше схеме и в аналогичных схемах в настоящем документе группа ветвления «D» разветвляется такое количество раз, которое необходимо для соответствия количеству групп (E-F), указанному количеством «q». Так, если q=1, то формула представляет собой:
если q=2, то формула представляет собой:
если q=3, то формула представляет собой:
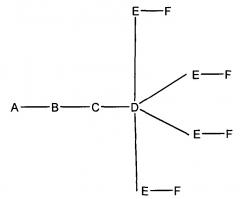
если q=4, то формула представляет собой:
если q=5, то формула представляет собой:
В некоторых вариантах реализации изобретения приведены конъюгированные антисмысловые соединения, имеющие структуру:
В некоторых вариантах реализации изобретения приведены конъюгированные антисмысловые соединения, имеющие структуру:
В некоторых вариантах реализации изобретения приведены конъюгированные антисмысловые соединения, имеющие структуру:
В некоторых вариантах реализации изобретения приведены конъюгированные антисмысловые соединения, имеющие структуру:
В настоящем описании приведены следующие неограничивающие варианты реализации изобретения:
В вариантах реализации изобретения, имеющих более одной конкретной переменную (например, более одного «m» или «n»), если не указано иное, каждая такая конкретная переменная выбрана независимо. Следовательно, для структуры, имеющей более одного n, каждый n выбран независимо, так что они могут быть или не быть одинаковыми между собой.
В некоторых вариантах реализации изобретения приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на АроCIII, и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид с конъюгирующей группой состоит из 20 связанных нуклеозидов.
В некоторых вариантах реализации изобретения приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на АроCIII, и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и содержит последовательность азотистых оснований, комплементарную равной по длине части азотистых оснований 3533-3552 в SEQ ID NO: 3, причем указанная последовательность азотистых оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна к SEQ ID NO: 3.
В некоторых вариантах реализации изобретения приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на АроCIII, и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и содержит последовательность азотистых оснований, комплементарную равной по длине части азотистых оснований 3514-3558 в SEQ ID NO: 3, причем указанная последовательность азотистых оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна к SEQ ID NO: 3,
В некоторых вариантах реализации изобретения приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на АроCIII, и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO: 19-96, 209-221. В некоторых вариантах реализации изобретения конъюгированный модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO: 19-96, 209-221. В некоторых вариантах реализации изобретения соединение состоит из любой из SEQ ID NO: 19-96, 209-221 и конъюгирующие группы.
В некоторых вариантах реализации изобретения приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на АроCIII, и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований SEQ ID NO: 87. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид с конъюгирующей группой имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований последовательности азотистых оснований SEQ ID NO: 87. В некоторых вариантах реализации соединение состоит из SEQ ID NO: 87 и конъюгирующие группы.
В некоторых вариантах реализации настоящего описания предложены конъюгированные антисмысловые соединения, приведенные следующей структурой. В некоторых вариантах реализации изобретения антисмысловое соединение содержит модифицированный олигонуклеотид ISIS 304801 с 5'-Х, где Х представляет собой конъюгирующую группу, содержащую GalNAc. В некоторых вариантах реализации изобретения антисмысловое соединение состоит из модифицированного олигонуклеотида ISIS 304801 с 5'-Х, где Х представляет собой конъюгирующую группу, содержащую GalNAc.
В некоторых вариантах реализации настоящего описания предложены конъюгированные антисмысловые соединения, приведенные следующей структурой. В некоторых вариантах реализации изобретения антисмысловое соединение содержит конъюгированный модифицированный олигонуклеотид ISIS 678354. В некоторых вариантах реализации изобретения антисмысловое соединение состоит из конъюгированного модифицированного олигонуклеотида ISIS 678354.
В некоторых вариантах реализации настоящего описания предложены конъюгированные антисмысловые соединения, приведенные следующей структурой. В некоторых вариантах реализации изобретения антисмысловое соединение содержит конъюгированный модифицированный олигонуклеотид ISIS 678357. В некоторых вариантах реализации изобретения антисмысловое соединение состоит из конъюгированного модифицированного олигонуклеотида ISIS 678357.
В некоторых вариантах реализации настоящего описания предложены конъюгированные антисмысловые соединения, приведенные следующей структурой. В некоторых вариантах реализации изобретения антисмысловое соединение содержит модифицированный олигонуклеотид с последовательностью азотистых оснований SEQ ID-NO: 87 с 5'-GalNAc с вариабельностью в сахарных структурах крыльев. В некоторых вариантах реализации изобретения антисмысловое соединение состоит из модифицированного олигонуклеотида с последовательностью азотистых оснований SEQ ID NO: 87 с 5'-GalNAc с вариабельностью в сахарных структурах крыльев.
Где либо R1 представляет собой -OCH2CH2OCH3 (МОЕ), и R2 представляет собой Н; либо R1 и R2 вместе образуют мостик, где R1 представляет собой -O-, и R2 представляет собой -CH2-, -СН(СН3)- или -CH2CH2-, и R1 и R2 связаны напрямую, так что образующийся мостик выбран из: -O-CH2-, -О-СН(СН3)- и -O-CH2CH2-;
и для каждой пары R3 и R4 у одного кольца, независимо для каждого кольца: либо R3 выбран из Н и -OCH2CH2OCH3, и R4 представляет собой Н; либо R3 и R4 вместе образуют мостик, где R3 представляет собой -O-, и R4 представляет собой -CH2-, -СН(СН3)- или -CH2CH2-, и R3 и R4 связаны напрямую, так что образующийся мостик выбран из: -O-CH2-, -О-СН(СН3)- и -O-CH2CH2-;
и R5 выбран из Н и -СН3;
и Z выбран из S- и О-.
В настоящем описании приведены следующие неограничивающие нумерованные варианты реализации изобретения:
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует понимать, что и приведенное выше общее описание, и следующее подробное описание являются лишь типичными и пояснительными, и они не ограничивают настоящее-описание. В настоящем документе использование единственного числа включает множественное число, если специально не указано иное. При использовании в настоящем документе, термин «или» означает «и/или», если не указано иное. Кроме того, использовании термина «включая», а также других форм, таких как «включает» и «включенный», не является ограничивающим. Также, такие термины как «элемент» или «компонент» охватывают как элементы и компоненты, содержащие одну единицу, так и элементы и компоненты, которые содержат более одной субъединицы, если специально не указано иное.
Названия разделов, используемые в настоящем документе, предназначены лишь для организационных целей, и их не следует толковать как ограничение описанного объекта изобретения. Все документы или части документов, цитируемые в настоящей заявке, включая, но не ограничиваясь ими, патенты, патентные заявки, статьи, книги и монографии, в явной форме включены в настоящий документ посредством ссылки в полном объеме для всех целей.
А. Определения
При отсутствии конкретных определений, номенклатура, используемая в связи с ними, а также в связи с приемами и методиками аналитической химии, синтетической органической химии, а также медицинской и фармацевтической химии, описанная в настоящем документе, является общеизвестной и общепринятой в данной области техники. Для химического синтеза и химического анализа могут быть использованы стандартные методики. Некоторые такие методики и приемы приведены, например, в публикациях "Carbohydrate Modifications in Antisense Research" под редакцией Sangvi и Cook, American Chemical Society, федеральный округ Вашингтон, 1994; "Remington's Pharmaceutical Sciences," Mack Publishing Co., Истон, штат Пенсильвания, 21е издание, 2005; и "Antisense Drug Technology, Principles, Strategies, and Applications" под редакцией Stanley Т. Crooke, CRC Press, Бока-Ратон, штат Флорида; а также в книге Sambrook et al., "Molecular Cloning, A laboratory Manual," 2е издание, Cold Spring Harbor Laboratory Press, 1989, которые включены в настоящий документ посредством ссылки для всех целей. Если это допустимо, все патенты, заявки, опубликованные заявки и другие публикации, а также другие данные, упоминаемые в тексте настоящего описания, включаны в настоящий документ посредством ссылки в полном объеме.
Если не указано иное, следующие термины имеют следующие значения:
При использовании в настоящем документе, «нуклеозид» означает соединение, содержащее фрагмент азотистого основания и сахарный фрагмент. Нуклеозиды включают, но не ограничиваются ими, природные нуклеозиды (которые находятся в ДНК и РНК) и модифицированные нуклеозиды. Нуклеозиды могут быть связаны с фосфатным фрагментом.
При использовании в настоящем документе, «химическая модификация» означает химическое отличие в соединении, по сравнению с природным аналогом. Химические модификации олигонуклеотидов включают нуклеозидные модификации (включая модификации сахарного фрагмента и модификации азотистых оснований) и модификации межнуклеозидных связей. В отношении олигонуклеотида химическая модификация включает не только отличия в последовательности азотистых оснований.
При использовании в настоящем документе, «фуранозил» означает структуру, содержащую 5-членное кольцо, содержащее четыре атома углерода и один атом кислорода.
При использовании в настоящем документе, «природный сахарный фрагмент» означает рибофуранозил, встречающийся в природной РНК, или дезоксирибофуранозил, встречающийся в природной ДНК.
При использовании в настоящем документе, «сахарный фрагмент» означает природный сахарный фрагмент или модифицированный сахарный фрагмент нуклеозида.
При использовании в настоящем документе, «модифицированный сахарный фрагмент» означает замещенный сахарный фрагмент или заменитель сахара.
При использовании в настоящем документе, «замещенный сахарный фрагмент» означает фуранозил, который не является природным сахарным фрагментом. Замещенные сахарные фрагменты включают, но не ограничиваются ими, фуранозилы, содержащие заместители в 2'-положении, 3'-положении, 5'-положении и/или 4'-положении. Некоторые замещенные сахарные фрагменты представляют собой бициклические сахарные фрагменты.
При использовании в настоящем документе, «2'-замещенный сахарный фрагмент» означает фуранозил, содержащий заместитель в 2'-положении, отличный от Н или ОН. Если не указано иное, то 2'-замещенный сахарный фрагмент не является бициклическим сахарным фрагментом (т.е. 2'-заместитель 2'-замещенного сахарного фрагмента не образует мостик с другим атомом радикала фуранозного кольца).
При использовании в настоящем документе, «МОЕ» означает -OCH2CH2OCH3.
При использовании в настоящем документе, «2'-F нуклеозид» относится к нуклеозиду, содержащему сахар, который содержит фтор в 2'-положении. Если не указано иное, то фтор в 2'-F нуклеозиде находится в рибо-положении (заменяя ОН природной рибозы).
При использовании в настоящем документе, термин «заменитель сахара» означает структуру, которая не содержит фуранозила и способна заменять природный сахарный фрагмент нуклеозида, так что образующиеся нуклеозидные субъединицы могут связываться вместе и/или связываться с другими нуклеозидами с образованием олигомерного соединения, которое может гибридизоваться с комплементарным олигомерным соединением. Такие струтуры включают кольца, содержащие другое количество атомов, чем фуранозил (например, 4, 6 или 7-членные кольца); замену кислорода фуранозила некислородным атомом (например, углеродом, серой или азотом); или одновременное изменение количество атомов и замену кислорода. Такие структуры также могут содержать замещения, соответствующие замещениям, описанным для замещенных сахарных фрагментов (например, 6-членные карбоциклические бициклические заменители сахара, необязательно содержащие дополнительные заместители). Заменители сахара включают также более сложные сахарные заместители (например, некольцевые системы пептидной нуклеиновой кислоты). Заменители сахара включают, без ограничения, морфолино, циклогексенилы и циклогекситолы.
При использовании в настоящем документе, «бициклический сахарный фрагмент» означает модифицированный сахарный фрагмент, содержащий 4-7-членное кольцо (включая, но не ограничиваясь фуранозилом), содержащее мостик, связывающий два атома 4-7-членного кольца с образованием второго кольца, что приводит к получению бициклическом структуры. В некоторых вариантах реализации 4-7-членное кольцо представляет собой сахарное кольцо. В некоторых вариантах реализации 4-7-членное кольцо представляет собой фуранозил. В некоторых таких вариантах реализации мостик соединяет 2'-углерод и 4'-углерод фуранозила.
При использовании в настоящем документе, «нуклеотид» означает нуклеозид, дополнительно содержащий фосфатную связывающую группу. При использовании в настоящем документе, «связанные нуклеозиды» могут быть или не быть связаны фосфатными связями и, следовательно, включают, но не ограничиваются ими, «связанные нуклеотиды». При использовании в настоящем документе, «связанные нуклеозиды» представляют собой нуклеозиды, которые связаны в непрерывную последовательность (т.е. между связанными нуклеозидами нет дополнительных нуклеозидов).
Используемый в настоящем документе термин «нуклеиновая кислота» относится к молекулам, состоящим из мономерных нуклеотидов. Нуклеиновая кислота включает рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), одноцепочечные нуклеиновые кислоты (оцДНК), двухцепочечные нуклеиновые кислоты (дцДНК), малые интерферирующие рибонуклеиновые кислоты (миРНК) и микроРНХ (микроРНК). Нуклеиновая кислота может также содержать любую комбинацию этих элементов в одной молекуле.
Используемый в настоящем документе термин «нуклеотид» означает нуклеотид, дополнительно содержащий фосфатную линкерную группу. При использовании в настоящем документе, «связанные нуклеозиды» могут быть или не быть связанными фосфатными линкерами, и, следовательно, этот термин включает, но не ограничивается этим, «связанные нуклеотиды». При использовании в настоящем документе, «связанные нуклеозиды» представляют собой нуклеозиды, которые связаны в непрерывную последовательность (т.е. между связанными нуклеозидами нет дополнительных нуклеозидов).
При использовании в настоящем документе, «азотистое основание» означает группу атомов, которая может быть связана с сахарным фрагментом с образованием нуклеозида, который может быт