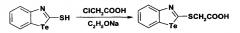Синтез новых производных 2-меркаптобензтеллуразола, обладающих биологической активностью
Иллюстрации
Показать всеИзобретение относится к новым производным 2-меркаптобензтеллуразола, имеющим структурную формулу
Соединения обладают биологической активностью, а именно обладают способностью снижать содержание тиоловых групп в плазме крови и содержание глюкозы, что позволяет применять их для борьбы с грызунами. 1 табл., 6 пр.
Реферат
Изобретение относится к области химии гетероциклических соединений, а именно к способу получения производных 2-меркаптобензотеллуразола - веществ, обладающих биологически активным действием.
Алкилирование 2-меркаптобензимидазола, -оксазола и -тиазола различными галогенпроизводными осуществляют в присутствии основания (KOH, K2CO3, NaOMe, пиридин) в таких растворителях как вода, этанол, ацетон (1. Synthesis, antioxidant properties and radioprotective effects of new benzothiazoles and thiadiazoles / D. Cressier, C. Prouillac, P. Hernandez et al. // Bioorganic & Medicinal Chemistry. - 2009. - №7. - P. 5275-5284. 2. New anticandidous 2-alkylthio-6-aminobenzothiazoles / E. Sidoova, D. Loos, H. Bujdakova, J. Kallova // Molecules. - 1997. - №. 2. - P. 36-42. 3. Huang, W. Microwave-assisted one-pot synthesis and fungicidal activity of polyfluorinated 2-benzylthiobenzothiazoles / W. Huang, G.F. Yang. // Bioorg. Med. Chem. - 2006. - №14. - P. 8280-8285. 4. Organic reactions in ionic liquids: an efficient method for selective s-alkylation of 2-mercaptobenzothia(oxa)zole with alkyl halides / Y. Hu, Z.C. Chen, Z.G. Le, Q.G. Zheng // Synth. Commun. - 2004. - Vol. 34, №11. - P. 2039-2046. 5. Ultrasound promoted synthesis of thioesters from 2-mercaptobenzoxa(thia)zoles / A. Duarte, W. Cunico, C.M.P. Pereira et al. // Ultrason. Sonochem. - 2010. - Vol. 17. - P. 281-283. 6. Dalai, D.S. Synthesis of 2-mercaptobenzothiazole and of 2-mercaptobenzimidazole derivativesusing polimer-supported anions / D.S. Dalai, N.S. Pawar, P.P. Mahulikar // Organic Preparations and Procedures Int. - 2005. - Vol. 37, №6. - P. 539-546. 7. An easy and fast ultrasonic selective S-alkylation of hetarylthiols at room temperature / T. Deligeorgiev, S. Kaloyanova, N. Lesev, Juan J. Vaquero // Ultrason. Sonochem. - 2010. - Vol. 17. - P. 783-788. 8. Thiazole orange derivatives: synthesis, fluorescence properties, and labeling cancer cells / X. Fei, Y. Gu, Y. Ban et al. // Bioorg. Med. Chem. - 2009. - Vol. 17. - P. 585-591. 9. Патент 48244645 США 1990 г. H. Turn, N. Eiki, S. Ryo, M. Konichi. 10. Патент 3901909 США 1976 г. N.Y. Lakashmi, H.R. Dieter. 11. Заявка. № 63-208579 Япония 1990 г. О. Сусуму, С. Кацу, Я. Томио, Н. Ютака, X. Масатоси. «Производные бензимидазола, их получение и противоязвенные лекарственные препараты на их основе». 12. Патент 5091399 США 1993 г. Osei-Gyimah, S.E. Sherba, RohmmHaas).
В последние годы все большее внимание исследователей привлекают гетарилокси(амино,тио)уксусные кислоты и их функциональные производные, так как среди них найдены вещества с высокой биологической активностью и полезными прикладными свойствами.
Известен способ получения (1H-Бензотиазол-2-ил-тио)уксусной кислоты и этил(1,3-бензотиазол-2-ил-сульфанил)ацетата при нагревании и перемешивании в течение 1 ч взаимодействием с эфиром и бром- или хлоруксусной кислот в безводном ацетоне в присутствии K2CO3 или КОН, описанных в (DeshmukhSU, Zaheeruddin, RajeevaB, ShantakumarSM, PuttaRajeshKumar. Synthesis, Chemical Characterization and Antimicrobial Activity of Some Novel Benzimidazole Derivatives. // Journal of Biomedical and Pharmaceutical Research 1 (3) 2012, 126-133, Chetna A, Diwaker S, Rajat A„ and Suresh C.A. // Indo. J. Chem., 2010, 10. (3), P. 376-381., V. Mohan Goud, N. Sreenivasulul, Avanapu SrinivasaRao and Srinivas Chigiri. Synthesis, antimicrobial and pharmacological evaluation of substituted novel benzimidazoles// Der Pharma Chemica, 2011, 3. (1), 446-452., Ashish L. Asrondkar, Vrushali N. Patil, Anil S. Bobade and Abhay S. Chowdhary // Der Pharma Chemica, 2015, 7. (4) P. 225)
,
Авторами работы (T.G. Deligeorgiev, А.А. Kurutos, N.I. Gadjev, A.A. Alexiev. An easy and fast one-pot preparation of 2-thiomethyl and 2-thioacyl benzothiazoles, benzoxazoles, and benzimidazoles. // Bulgarian Chemical Communications, 2015. Vol. 47. №4. p. 1034-1038) были синтезированы 2-бензоилмеркаптобезотиазол, -имидазол и -оксазол с использованием ультразвукового облучения бензоилхлорида с сульфидами в течение 5 мин в мягких условиях при комнатной температуре с хорошими выходами 85-95%.
, X=NH, S, О
2-р-Нитробензоилмеркаптобензоимидазол был получен авторами работы (MahasinF.Alias, DoaaH. Mahal. Synthesis, Structural Diagnosis, Theoretical Treatment and Antibacterial Study of Pd(II), Rh(III), Pt(IV) and Au(III) Complexes Containing 2-(P-NitroBenzoyl)ThioBenzimidazole. // International Journal of Science and Research (IJSR). 2015.(7) Vol. 4 I. 7. p. 1469-1476) кипячением в течение 4 ч реакционной смеси 2-меркаптобензоимидазола и п-нитробензоилхлорида в этиловом спирте в присутствии карбоната натрия, с выходом 69%.
Как известно, в условиях основного катализа азолин-2-тионы реагируют в виде амбидентного аниона и, в зависимости от условий и строения реагентов, дают S- или N- производные.
Известен способ получения 2,2' [этан-1,2-диилбис (тио)] бис-1,3-бензтиазола и 3-[2-(1,3-бензтиазол-2-илтио)этил]-1,3-бензтиазол-2(3Н)-тиона при взаимодействии 2-меркаптобензотиазола с 1,2-дибромэтаном в присутствии карбоната калия с выходами 70 и 12% соответственно (, Dominique Lorcy, Ivan Leban, Alenka Majcen-Le . A novel approach to n, n'-dimethyl and n, n'-ethylene bridged dibenzodithiadiazafulvalene // ActaChim. Slov. 2002. Vol. 49. P. 871-883).
Однако все вышеуказанные способы для получения производных 2-меркаптобензтеллуразола могут быть использованы только в видоизмененном виде.
Ранее нами были синтезированы 2-меркаптобензтеллуразол, который является исходным веществом (патент RU 2546674 С2, 10.04.2015), и производные 2-меркаптобезтеллуразола, которые являются близкими аналогами для заявленных соединений (патент RU 2602499 С1, 2016) (Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «ДАГЕСТАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ») Ali А.А.М., Ramazanova Р.А., Abakarov G.М., Tarakanova А.V., AnisimovA.V. // Russ. J. Gen. Chem. 2015. Vol. 85. No 3. P. 722. [Али A.A.M., Рамазанова П.А., Абакаров Г.М., Тараканова А.В., Анисимов А.В. // ЖОХ. 2015. Т. 85. No 3. С. 570.] Ali А.А.М., Ramazanova Р.А., Abakarov G.М., Tarakanova А.V., Anisimov А.V. // Russ. J. Gen. Chem. 2016. Vol. 86. No. 4. P. 830. [Али A.A.M., Рамазанова П.А., Абакаров Г.М., Тараканова А.В., Анисимов А.В. // ЖОХ. 2016. Т. 86. No 4. С. 643]
Задача - синтез новых гетероциклических соединений, обладающих биологически активным действием, а также поиск биологически активных веществ среди азотсодержащих гетероциклических соединений теллура.
Технический результат заключается в разработке методов синтеза новых биологически активных производных класса меркаптобензтеллуразолов.
Сущность изобретения в том, что синтезированы новые производные 2-меркаптобензтеллуразола, имеющие структурную формулу
при этом способ получения производных 2-меркаптобензтеллуразола, обладающих биологической активностью, разработан нами и описан в Патенте №2602499 от 25.10.2016 г., и включает взаимодействие 2-меркаптобензтеллуразолята натрия с соответствующими галогенидами при перемешивании от 1 до 5 часов.
Таким образом, нами синтезированы 6 новых производных 2-меркаптобензтеллуразола:
1. (1,3-Бензтеллуразол-2-илтио)уксусная кислота (вещество 1);
2. Этил(1, 3-бензтеллуразол-2-илтио)ацетат (вещество 2);
3. S-(1,3-Бензтеллуразол-2-ил)тиофен-2-карботиоат (вещество 3);
4. S-(1,3-Бензтеллуразол-2-ил)бензолкарботиоат (вещество 4);
5. S-(1,3-Бензтеллуразол-2-ил)-4-нитробензолкарботиоат (вещество 5);
6. S-(l,3-Бензтеллуразол-2-ил)(2-тиоксо-1,3-бензтеллуразол-3-ил)этантиоат (вещество 6).
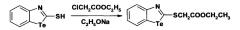
(1,3-Бензтеллуразол-2-илтио)уксусная кислота, полученная взаимодействием в этилате натрия с α-хлоруксусной кислотой, имеет структурную формулу
Синтез (1,3-Бензтеллуразол-2-илтио)уксусной кислоты заключается в том, что к раствору этилата натрия небольшими порциями при перемешивании добавляют 2-меркаптобензтеллуразол, затем добавляют раствор α-хлоруксусной кислоты в абсолютном этаноле. Смесь перемешивают при температуре 50-60°С в течение 2 ч и в течение 2 ч при комнатной температуре. Контроль за реакцией осуществляют методом ТСХ, образовавшийся осадок отфильтровывают, промывают этиловым спиртом, сушат и перекристаллизовывают.
Пример 1.
В трехгорлую колбу, снабженную мешалкой, холодильником и капельной воронкой, помещали этилат натрия, полученный из 0.18 г (7.6 ммоль) Na и 25 мл абсолютного этилового спирта. К полученному раствору этилата натрия при перемешивании маленькими порциями в течение 30 минут при температуре 30°С добавляли 2 г (4 ммоль) 2-меркаптобензтеллуразола, затем в реакционную массу добавляли 0.72 г (7.6 ммоль) α-хлоруксусной кислоты в 15 мл абсолютного этанола. Смесь перемешивали при температуре 55-60°С в течение 2 ч и в течение 2 ч при комнатной температуре. Контроль за реакцией осуществляли методом ТСХ, образовавшийся осадок отфильтровывали, промывали этиловым спиртом, сушили на воздухе и перекристаллизовывали из тетрагидрофурана. Выход 1.13 г (87%), коричневые кристаллы, т.пл. 242-243°С. ИК-спектр, ν, см-1: 3452, 3107, 3066 (ОН), 2961, 2897 (-CH2), 1754, 1697 (С=O), 1653, 1635 (N=C), 1497, 1452, 1424 (N=C в цикле), 1117, 1080, 742 (C-N), 671, 654, 610, 537, 463 (C-S). Спектр ЯМР1 Н δ, м.д.: 11.48 с (1Н, СН12), 7.93 д (1Н, СН7, J 5.7 Гц), 7.25 м (СН4, 1Н), 7.18-7.10 д (1Н, СН6), 7.01-6.73 м (1Н, СН5), 3.04 м (2Н, СН11). Спектр ЯМР13 С, δс, м.д.: 170.80 (С12), 168.91 (С2), 127.96 (С9), 123.80 (С5), 60.21 (С7), 45.48 (С4), 40.62 (С6), 36.92 (С8), 21.22 (С11). Масс-спектр, m/z (Iотн, %): 290 (100), 264 (96), 2134 (86), 305 (32). Найдено, %: С 33.73; Н 2.27; N 4.43; S 10.03; Те 39.81. C9H7NSO2Te. Вычислено, %: С 33.69; Н 2.20; N 4.37; S 9.99, Те 39.77.
Этил(1,3-бензтеллуразол-2-илтио)ацетат, полученный взаимодействием 2-метилмеркаптобензтеллуразола с этиловым эфиром α-хлоруксусной кислоты в этилате натрия, имеет структурную формулу
Пример 2.
В трехгорлую колбу, снабженную мешалкой, холодильником и капельной воронкой, помещали этилат натрия, полученный из 0.18 г (7.6 ммоль) Na и 25 мл абсолютного этилового спирта. К полученному раствору этилата натрия при перемешивании маленькими порциями в течение 30 минут при температуре 30°С добавляли 2 г (4 ммоль) 2-меркаптобензтеллуразола, затем в реакционную массу добавляли 0.93 г (0.96 мл, 7.6 ммоль) этилового эфира α-хлоруксусной кислоты в 15 мл абсолютного этанола. После 15 минут перемешивания начинает выпадать осадок, смесь перемешивали еще в течение 1 ч при комнатной температуре. Выпавший осадок отфильтровывали, промывали этиловым спиртом, сушили на воздухе и перекристаллизовывали из тетрагидрофурана. Выход 1.76 г (66%), оранжевые кристаллы, т.пл. 229-231°С. ИК-спектр, ν, см-1: 3452, 3107, 3066 (С-Н), 2961, 2897 (-СН2), 1754, 1735, 1697 (С=O), 1653, 1635 (N=C), 1497, 1542, 1424 (N=C в цикле), 1117 (С-О-С), 1080, 742 (C-N), 671, 654, 610, 537, 463 (C-S). Спектр ЯМР1 Н, δ, м.д.: (1Н, СН5), 4.15 м (2H, -SCH2), 4.14 д (2Н, ОСН2, J 7.1 Гц), 1.21 с (3Н, СН3). Спектр ЯМР 13С, δc, м.д.: 168.51 (С12), 164.54 (С2), 159.35 (С9), 133.78 (С5), 132.06 (С7), 126.54 (С4), 123.68 (С6), 123.63 (С8), 61.09 (С14), 35.04 (С11), 14.08 (С15). Масс-спектр, m/z (Iотн, %): 290 (100), 102 (79), 135 (48), 303 (31), 264 (14). Найдено, %: С 37.83; Н 3.22; N 4.06; S 9.22; Те 36.61. C11H11NSO2Te. Вычислено, %: С 37.87; Н 3.18; N 4.02; S 9.19; Те 36.57.
S-(1,3-Бензтеллуразол-2-ил)тиофен-2-карботиоат, полученный взаимодействием 2-меркаптобензтеллуразола с тиофен-2-карбонил хлоридом в этилате натрия, имеет структурную формулу
Пример 3.
В трехгорлую колбу, снабженную мешалкой, холодильником и капельной воронкой, помещали этилат натрия, полученный из 0.12 г (4 ммоль) Na и 30 мл абсолютного этилового спирта. К полученному раствору этилата натрия при перемешивании маленькими порциями в течение 30 минут при температуре 30°С добавляли 1.31 г (5 ммоль) 2-меркаптобензтеллуразола, затем в реакционную массу добавляли 0.73 г (0.53 мл, 5 ммоль) тиофен-2-карбонил хлорида, растворенного в 10 мл абсолютного этилового спирта. Моментально выпадает осадок, реакционную массу перемешивали еще в течение 1 ч при комнатной температуре. Осадок отфильтровывали, промывали этиловым спиртом, сушили на воздухе и перекристаллизовывали из этилового спирта. Выход 1.45 г (3.88 ммоль, 77%), желтые кристаллы, т.пл. 218-220°С. ИК-спектр, ν, см-1: 3584, 3525 (С-Н), 3045, 735 (C-S-C в цикле), 2901 (CHAr), 1613 (С=O), 1577 (N=C), 1455, 1425 (N=C в цикле), 713 (C-N), 600, 463 (C-S). Спектр ЯМР 1Н, δ, м.д.: 8.31 дд (1Н, СН7, J 4.9 Гц), 8.25 дд (1Н, СН13, J 3.9 Hz, 1H), 8.21 дд (1Н, СН14, J 7.8 Гц), 8.03 д (1Н, СН4, J 8.0 Гц), 7.52-7.43 д (1Н, СН5, J 4.9 Гц), 7.40 д (1Н, СН6, J 4.0 Гц), 7.29 м (1Н, СН15). Спектр ЯМР 13С, δc, м.д.: 180.82 (С11), 158.78 (С2), 156.75 (С9), 139.13 (С13), 137.53 (С12), 134.05 (С5), 132.15 (С7), 131.66 (С15), 129.51 (С14), 126.74 (С4), 125.34 (С6), 124.58 (С8). Масс-спектр, m/z (Iотн, %): 263 (50), 90 (28), 135 (21), 102 (17). Найдено, %: С 38.70; Н 1.95; N 3.80; S 17.22, Те 34.27. C12H7NS2OTe. Вычислено, %: С 38.65; Н 1.89; N 3.76; S 17.20; Те 34.22.
S-(1,3-Бензтеллуразол-2-ил)бензолкарботиоат, полученный взаимодействием 2-меркаптобензтеллуразола с бензоилхлоридом в этилате натрия, имеет структурную формулу
Пример 4.
В трехгорлую колбу, снабженную мешалкой, холодильником и капельной воронкой, помещали этилат натрия, полученный из 0.2 г (5 ммоль) Na и 30 мл абсолютного этилового спирта. К полученному раствору этилата натрия при перемешивании маленькими порциями в течение 30 минут при температуре 30°С добавляли 1.31 г (5 ммоль) 2-меркаптобензтеллуразола, затем в реакционную массу добавляли 0.70 г (0.58 мл, 5 ммоль) бензоилхлорида, растворенного в 10 мл абсолютного этилового спирта. Смесь кипятили при температуре 50-60°С в течение 2 ч, затем в течение 3 ч перемешивали при комнатной температуре. Осадок отфильтровывали, промывали этиловым спиртом, сушили и перекристаллизовывали из смеси растворителей гексан, бензол, этанол в соотношении 8:5:5. Выход 0.54 г (29%), оранжевые кристаллы, т.пл. 238-240°С. ИК спектр, ν, см-1: 3520 (С-Н), 3045 (CHAr), 1643-1596 (С=O), 1577, 1649 (N=C), 1456-1415 (N=C в цикле), 770, 761 (C-N), 694, 683 (C-S). Спектр ЯМР1 Н, δ, м.д.: 8.12 д (1Н, СН7, J 7.6 Гц), 8.04 д (1Н, СН4, J 7.9 Гц), 7.96 д (1Н, СН5, J 8.2 Гц), 7.79 дд (1H, СН6, J 1.1 Гц), 7.55 д (1H, СН14,16, J 7.8 Гц), 7.46 д (Н, СН13,17, J 7.9 Гц), 7.24 м (1H, СН15). Спектр ЯМР13 С, δс, м.д.: 189.43 (С11), 154.71 (С2), 147.32 (С9), 136.49 (С7), 134.60 (С5), 132.88 (С14,16), 131.78 (С6), 129.17 (С4), 124.65 (С8), 122.83 (С15), 120.57 (С13,17), 120.77 (С13). Масс-спектр, m/z (Iотн, %): 263 (100), 77 (50), 90 (28), 135 (21), 290 (17). Найдено, %: С 45.78; Н 2.41; N 3.78; S 8.77; Те 34.82. C14H9NSOTe. Вычислено, %: С 45.83; Н 2.47; N 3.82; S 8.74, Те 34.78.
S-(1,3-Бензтеллуразол-2-ил)-4-нитробензолкарботиоат, полученный взаимодействием 2-меркаптобензтеллуразола с р-нитробензоилхлоридом в этилате натрия, имеет структурную формулу
Пример 5.
В трехгорлую колбу, снабженную мешалкой, холодильником и капельной воронкой, помещали этилат натрия, полученный из 0.2 г (5 ммоль) Na и 30 мл абсолютного этилового спирта. К полученному раствору этилата натрия при перемешивании маленькими порциями в течение 30 минут при температуре 30°С добавляли 1.31 г (5 ммоль) 2-меркаптобензтеллуразола, затем в реакционную массу добавляли 0.92 г (5 ммоль) р-нитробензоилхлорида, растворенного в 10 мл абсолютного этилового спирта. Смесь кипятили при температуре 50-60°С в течение 1.5 ч. После охлаждения до комнатной температуры в реакционную массу приливали 100 мл ледяной воды. Осадок отфильтровывали, промывали этиловым спиртом, сушили на воздухе и перекристаллизовывали из ацетонитрила. Выход 1.14 г (56%), темно-красные кристаллы, т.пл. 219-221°С. ИК-спектр, ν, см-1: 3626-3423 (С-Н), 3045, 2955, 2890 (CHAr), 1653-1617 (С=O), 1567 (N=C), 1444, 1431 (N=C в цикле), 1328, 1308, 1278 (NO2), 792 (C-N), 756 (C-S). Спектр ЯМР 1Н, δ, м.д.: δ 8.23-8.15 м (2Н, СН13,17), 8.10 д (1Н, СН7, J 1.2 Гц), 7.85 д (1Н, СН4, J 1.3 Гц), 7.70 д (1Н, СН5, J 0.6 Гц), 7.66-7.59 м (2Н, СН14,16), 7.27 дд (1Н, СН6, J 1.3, 0.6 Гц). Спектр ЯМР 13С, δс, м. д.: 171.61 (С11), 168.07 (С2), 161.45 (С9), 140.61 (С7), 133.70 (С5), 133.38 (С14,16), 132.10 (С6), 126.81 (С4), 124.13 (С8), 123.60 (С15), 121.07 (С13,17), 120.26 (С12). Масс-спектр, m/z (Iотн, %): 290 (100), 263 (91), 134 (86), 76 (63), 102 (50). Найдено, %: С 40.79; Н 1.93; N 6.77; S 7.82, Те 31.05. C14H8N2SO3Te. Вычислено, %: С 40.82; Н 1.96; N 6.80; S 7.78, Те 30.98.
S-(1,3-Бензтеллуразол-2-ил)(2-тиоксо-1,3-бензтеллуразол-3-ил)этантиоат, полученный взаимодействием 2-меркаптобензтеллуразола с оксалилхлоридом в этилате натрия, имеет структурную формулу
Пример 6.
В трехгорлую колбу, снабженную мешалкой, холодильником и капельной воронкой, помещали этилат натрия, полученный из 0.16 г (7 ммоль) Na и 30 мл абсолютного этилового спирта. К полученному раствору этилата натрия при перемешивании маленькими порциями в течение 30 минутпри температуре 30°С добавляли 6 г (2,3 ммоль) 2-меркаптобензтеллуразола, затем в реакционную массу добавляли 0.22 г (0.15 мл, 3.5 ммоль) оксалилхлорида, растворенного в 5 мл абсолютного этилового спирта. Смесь перемешивали при температуре 55-60°С в течение 2 ч и при комнатной температуре в течение 1 ч. Осадок отфильтровывали, промывали горячим этанолом, сушили на воздухе и перекристаллизовывали из ацетонитрила. Выход 1.45 г (66%), желтые кристаллы, т.пл. 254-256°С. ИК спектр, ν, см-1: 3627-3425 (С-Н), 2950 (CHAr), 1653 (N-C(O), 1617 (С=O), 1561 (N=C), 1445, 1430 (N=C в цикле), 1388 (C=S), 755, 670 (C-S). Спектр ЯМР 1Н δ, м.д.: 8.00 дд (1H, СН7, J 7.8, 1.7 Гц), 7.83 д (1Н, СН14, J 8.4 Гц), 7.38 д (1Н, СН4, J 13 Гц), 7.11 м (1H, СН17), 6.73 д (1Н, СН5, J 9.1 Гц), 6.60 м (1Н, СН16), 6.38 м (1Н, СН6), 6.23 д (1H, СН15, J 9.1 Гц). Спектр ЯМР 13С, δс, м.д.: 171.61 (С11), 168.45 (С12), 161.45 (С9), 160.81 (С2), 140.62 (С19), 140.62 (С21), 133.70 (С17), 132.38 (С5), 132.10 (С7), 132.10 (С15), 126.81 (С16), 124.13 (С14), 123.60 (С4), 121.07 (С6), 120.26 (С18), 97.05 (С8). Спектр ЯМР 13С, δс, м. д.: 171.61 (С11), 168.45 (С12), 161.45 (С9), 160.81 (С2), 140.62 (С19), 140.62 (С21), 133.70 (С17), 132.38 (С5), 132.10 (С7), 132.10 (С15), 126.81 (С16), 124.13 (С14), 123.60 (С4), 121.07 (С6), 120.26 (С18), 97.05 (С8). Найдено, %: С 33.23; Н 1.37; N 4.79; S 11.14, Те 44.13. C16H8N2S2O2Te2. Вычислено, %: С 33.16; Н 1.39; N 4.83; S 11.06, Те 44.03.
Мы провели испытания биологической активности в лаборатории биохимии и биофизики (акт прилагается).
Содержание сульфгидрильных групп в белках и тканях является важным показателем конформационной модификации белков под влиянием различных факторов.
Содержание сульфгидрильных групп определяли в плазме крови беспородных лабораторных крыс, содержащихся в виварии ФГБОУ ВПО «Дагестанский государственный университет» на стандартном рационе. В эксперименте были использованы животные обоих полов, возрастом 2-3 месяца, весом от 180 до 200 г.
Были проведены следующие серии испытаний.
1. Изучение общего содержания SH-групп в плазме крови интактных животных (контроль).
2. Изучение общего содержания SH-групп в плазме крови животных с введением раствора 0,01 г/мл изученных веществ в диметилсульфоксиде (ДМСО) в дозе 25 мг на кг живого веса (опыт).
3. Изучение содержания общего белка, глюкозы, холестерина, билирубина в плазме крови интактных животных (контроль).
4. Изучение содержания общего белка, глюкозы, холестерина, билирубина в плазме крови животных с введением раствора 0,01 г/мл изученных веществ в диметилсульфоксиде (ДМСО) в дозе 25 мг на кг живого веса (опыт).
Все испытания проводились в трехкратной повторности, при экспериментах с лабораторными животными соблюдались все правила гуманного обращения с животными. Всего в каждой серии было использовано по 3 экземпляра животных.
Результаты были подвергнуты вариационно-статистической обработке с использованием t-критерия Стьюдента. Различия считались достоверными при р<0,05.
Результаты исследования содержания сульфгидрильных групп плазмы крови лабораторных крыс при введении синтезированных производных 2-меркаптобензтеллуразола отражены в таблице 1.
* - достоверное различие относительно контроля
Как следует из таблицы 1, внутрибрюшинное введение испытуемых синтезированных производных 2-меркаптобензтеллуразола вызывает достоверное снижение общего содержания SH-групп в плазме крови крыс, за исключением вещества 6 (S-(1,3-Бензтеллуразол-2-ил)(2-тиоксо-1,3-бензтеллуразол-3-ил)этантиоат).
Наиболее сильный эффект проявил 2 S-(1,3-Бензтеллуразол-2-ил)тиофен-2-карботиоат (вещество 3): снижение общих сульфгидрильных групп составило 32% относительно контроля.
Таким образом, синтезированные и испытанные производные 2-меркаптобензтеллуразола in vivo возможно изменяют конформацию белков за счет снижения содержания сульфгидрильных групп.
Таким образом, наиболее выраженным эффектом введения испытуемых синтезированных производных 2-меркаптобензтеллуразола является снижение содержания тиоловых групп в плазме крови и снижение содержания глюкозы.
Новые производные 2-меркаптобензтеллуразола, обладающие биологической активностью, имеющие структурную формулу