Бесцветные органические люминофоры
Иллюстрации
Показать всеИзобретение относится к производным фенилбензазола, общей формулы (А), где X обозначает О или S; Q представляет собой группу (а), где R1 обозначает -Cl, -NH(CH2)5CH3, -NHAr; R2 обозначает -NH(CH2)5CH3, -N[(CH2)3CH3]2, -NHAr, или группу (б), где R3 обозначает -Ar(CH2)5CH3. Соединения по изобретению применяют в качестве органических люминофоров, более конкретно - не имеющих окраски при дневном освещении, растворимых в органических растворителях (жидких углеводородах, спиртах, эфирах, кетонах и т.п.) органическим люминофорам. Новые люминофоры флуоресцируют в области от белого до оранжевого цвета и могут быть использованы в качестве компонентов флуоресцентных сольвентных, бесцветных при дневном освещении, чернил для струйных принтеров, а также в качестве компонентов штемпельных красок на органической основе. 1 табл., 6 пр.
, (a), (б)
Реферат
Изобретение относится к органическим люминофорам, а более конкретно - к растворимым в органических растворителях (жидких углеводородах, спиртах, эфирах, кетонах и т.п.) органическим люминофорам, не имеющим окраски при дневном освещении. Основная область использования изобретения - невидимые при дневном освещении флуоресцентные штемпельные краски и чернила на органической основе, используемые при мануальной (персонифицированной) защите офисной, бухгалтерской и другой важной деловой документации.
Подавляющая часть известных в настоящее время растворимых в органических растворителях (сольвентах) люминофоров - это окрашенные, т.е. поглощающие в видимой области спектра люминофоры, такие как оксазолоны, амиды нафталевой кислоты, 3-метоксибензантрон, полиметины и некоторые другие (ЕР 1291396 А1). Это ограничивает возможность их использования для мануальной защиты.
Среди почти бесцветных растворимых в органических растворителях люминофоров в качестве аналога можно назвать только некоторые растворимые в органических растворителях оптические отбеливатели (Б.М. Красовицкий, Б.М. Болотин «Органические люминофоры», изд. «Химия» Л.О., 1976 г., с. 222-240). Однако эти отбеливатели обладают только сине-голубой флуоресценцией.
Техническая задача, на решение которой направлено данное изобретение, заключается в создании новых органических люминофоров, растворимых в органических растворителях (жидких углеводородах, спиртах, эфирах, кетонах и т.п.), не поглощающих в видимой области спектра и флуоресцирующих различными цветами в области от белого до оранжевого.
Поставленная задача решается синтезом известными методами новых, ранее не описанных соединений - производных ряда фенилбензазолов, содержащих функциональные группы, обеспечивающие растворимость в органических растворителях, и группы, образующие внутримолекулярную водородную связь. Наличие внутримолекулярной водородной связи обуславливает аномально большой сдвиг Стокса, который является причиной возникновения голубой, зеленой, желтой или оранжевой флуоресценции соединений, не поглощающих в видимой области спектра.
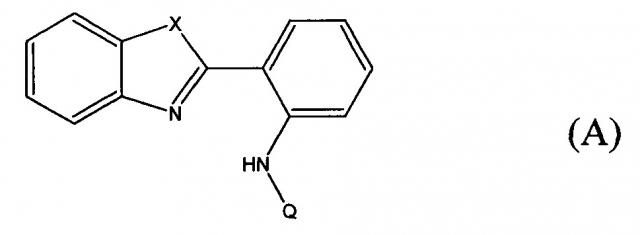
Синтезированные соединения имеют общую структурную формулу (А):
где X обозначает О или S;
Q представляет собой
R1 обозначает -Cl, -NH(CH2)5CH3, -NHAr;
R2 обозначает -NH(CH2)5CH3, -N[(CH2)3CH3]2, -NHAr,
или
R3 обозначает Ar(СН2)5СН3.
Нижеприведенные примеры иллюстрируют предлагаемое изобретение.
Получают 2-(2-аминофенил)бензтиазол (I) следующим способом.
Растворяют 50 мл (0,465 моль) 2-аминотиофенола в 125 мл диметилацетамида. Растворение и реакцию проводят в токе аргона. При температуре не выше 60°C добавляют 84 г (0,515 моль) изатового ангидрида. Окончание реакции определяют методом ТСХ (элюент-хлороформ) по исчезновению пятна исходного 2-аминотиофенола. После охлаждения до комнатной температуры реакционную массу выливают на смесь 1,5 л воды, 400 г льда и 170 мл концентрированной соляной кислоты. Выпавший осадок отфильтровывают и промывают на фильтре 5%-ным водным раствором NaOH до исчезновения голубой люминесценции фильтрата, затем водой до нейтральной реакции по универсальной индикаторной бумаге. Осадок тщательно отжимают и, не высушивая, кристаллизуют из смеси 1200 мл изопропилового спирта (ИПС) и 600 мл воды. Осадок на фильтре промывают 300 мл смеси ИПС:вода = 2:1, затем водой. Сушат при комнатной температуре. Выход 45 г (42,8% от теории). Найдено: С-68,8; Н-4,5; N-12,3; S-14,0. Вычислено для C13H10N2S: С-69,00; Н-4,45; N-12,38; S-14,17.
Получают 2-[2-(4,6-дихлор-1,3,5-триазин-2-иламино)фенил]бензтиазол (II) следующим способом.
В колбу на 1 л, снабженную двумя капельными воронками на 150 мл, мешалкой и термометром, загружают 20.0 г (0,088 моль) соединения I и 300 мл ацетона. 28.5 г (0,15 моль) цианурхлорида растворяют в 200 мл ацетона и фильтруют в капельную воронку. При интенсивном перемешивании из двух капельных воронок прикапывают при комнатной температуре - из первой раствор цианурхлорида в ацетоне, а из второй - 100 мл 10%-ный водного раствора Na2CO3. Окончание реакции определяют методом ТСХ (элюент - хлороформ) по исчезновению пятна исходного I.
После окончания реакции продукт II отфильтровывают и промывают на фильтре ацетоном. Сушат при комнатной температуре. Выход 16,7 г (50,7%). Найдено: С 15,3; Н-2,4; Cl-19,0; N-18,6; S-8,5. Вычислено для C16H9Cl2N5S: С-15,35; Н-2,42; Cl-18,95; N-18,71; S-8,57. Соединение II используют в дальнейшем синтезе без дополнительной очистки.
Пример 1
2- [(4-N,N-дибутил-6-хлор-1,3,5-триазин-2-иламино)фенил]бензтиазол (III)
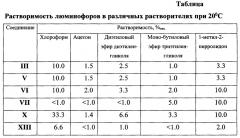
41 г (0,11 моль) продукта II и 25,0 мл (0,15 моль) ди-н-бутиламина кипятят в 300 мл бензола 1 час, затем прикапывают 50 мл 10%-ного водного раствора карбоната натрия и продолжают кипячение 3 часа. Окончание реакции определяют методом ТСХ (элюент - хлороформ) по исчезновению пятна исходного продукта II. После окончания реакции реакционную массу фильтруют. Остаток солей удаляют из фильтрата экстракцией водой. Бензол отгоняют на роторном испарителе. Продукт III кристаллизуют из ацетона. Выход 31,7 г (61,7%). Тпл=101-102°C. Белый порошок продукта III обладает оранжевой люминесценцией с максимумом 600 нм. Найдено: С-61,6; Н-5,7; Cl-7,6; N-17,9; S-6,8. Вычислено для C24H27ClN6S: С-61,72; Н-5,83; С1-7,59; N-17,99; S-6,87. Растворимость полученного продукта указана в таблице.
Пример 2
2-[(4-N-гексил-6-хлор-1,3,5-триазин-2-иламин)фенил]бензтиазол (V)
где X: S
R1: -Cl, R2: -NH(CH2)5CH3.
3,74 г (0,01 моль) продукта II и 3,0 мл (0,023 моль) н-гексиламина кипятят в 50 мл бензола. Окончание реакции определяют методом ТСХ (элюент-хлороформ:бензол - 1:1) по исчезновению пятна исходного продукта II. Реакционную массу охлаждают до комнатной температуры и промывают водой. Бензол отгоняют на роторном испарителе. Продукт V кристаллизуют из ацетона. Выход 3,4 г (77,0%). Тпл.=180-184°C. Белый порошок продукта V обладает желтой люминесценцией с максимумом 562 нм. Найдено: С-60,0; Н-5,3; Cl-8,0; N-19,0; S-7,2. Вычислено для C22H23ClN6S: С-60,19; Н-5,28; Cl-8,08; N-19,14; S-7,30. Растворимость полученного продукта указана в таблице.
Пример 3
2-[(4,6-N-гексил-1,3,5-триазин-2-иламин)фенил]бензтиазол (VI)
где X: S
R1: -NH(CH2)5CH3, R2: -NH(CH2)5CH3.
20 г (0,053 моль) продукта II и 25,0 мл (0,19 моль) н-гексиламина кипятят в 300 мл бензола 2 часа, затем прикапывают 40 мл 10%-ного водного раствора карбоната натрия и продолжают кипячение. Окончание реакции определяют методом ТСХ (элюент-хлороформ:бензол - 1:1) по исчезновению пятна исходного продукта II. Реакционную массу охлаждают до комнатной температуры и промывают водой. Бензол отгоняют на роторном испарителе. Продукт VI кристаллизуют из ацетона. Выход 18,7 г (37,1%). Тпл=127-128°C. Белый порошок продукта VI обладает желто-оранжевой люминесценцией с максимумом 586 нм. Найдено: С-66,8; Н-7,3; N-19,5; S-6,3. Вычислено для C28H37N7S: С-66,77; Н-7,40; N-19,47; S-6,37. Растворимость полученного продукта указана в таблице 1.
Пример 4
2-[(4,6-N-фенил-1,3,5-триазин-2-иламин)фенил]бензтиазол (VII)
где X: S
R1: NHAr; R2: NHAr.
4.0 г (0,011 моль) продукта II и 4,0 мл (0,044 моль) анилина кипятят в 150 мл бензола 1 час, затем прикапывают 25 мл 10%-ного водного раствора карбоната натрия и продолжают кипячение. Окончание реакции определяют методом ТСХ (элюент-хлороформ:бензол - 1:1) по исчезновению пятна исходного продукта II. После окончания реакции реакционную массу фильтруют. Остаток солей удаляют из фильтрата экстракцией водой. Бензол отгоняют на роторном испарителе. Продукт VII кристаллизуют из ацетона дважды. Выход 2,61 г (65.3%). Тпл=164-165°C. Белый порошок продукта VII обладает оранжевой люминесценцией с максимумом 603 нм. Найдено: С-69,0; Н-4,5; N-19,9. Вычислено для C24H21N7S: С-68,97; Н-4,34; N-20,11. Растворимость полученного продукта указана в таблице.
Пример 5
2-[(4-N,N-дибутил-6-хлор-1,3,5-триазин-2-иламино)фенил]бензоксазол (X)
где X: О;
R1: -Cl, R2: N[(CH2)3CH3]2
1) 2-(2-аминофенил)бензоксазол (VIII)
Растворяют 28,4 г (0,26 моль) 2-аминофенола в 300 мл диметилацетамида. Растворение и дальнейшую реакцию проводят в токе аргона. Затем загружают 80,5 г (0,26 моль) хлорангидрида N-тозилантраниловой кислоты. Нагревают реакционную массу до кипения и кипятят 5 часов. Окончание реакции определяют методом ТСХ (элюент-хлороформ) по исчезновению пятна исходного продукта 2-аминофенола. После охлаждения до комнатной температуры реакционную массу выливают при интенсивном перемешивании на 1 л 10%-ного водного раствора NaOH. Выпавший осадок отфильтровывают, промывают на фильтре 100 мл 10%-ного раствора NaOH и водой до нейтральной реакции по универсальной индикаторной бумаге. Сушат продукт при 50°C. Получают 40,7 г 2-(2-N-тозиламинофенил)бензоксазола.
40,7 г 2-(2-N-тозиламинофенил)бензоксазола при комнатной температуре растворяют, перемешивая, в 200 мл концентрированной серной кислоты. Раствор вливают при интенсивном перемешивании в 1 л воды. Выпавший осадок отфильтровывают, отжимают, перемещают в стакан с 450 мл 10%-ного водного раствора NaOH, перемешивают, отфильтровывают и промывают на фильтре водой до нейтральной реакции по универсальной индикаторной бумаге. Сушат при комнатной температуре. Выход 38,6 г (70,6%).
2) 2-[2-(4,6-дихлор-1,3,5-триазин-2-иламино)фенил]бензоксазол (IX)
20 г (0,095 моль) продукта VIII. помещают в литровую колбу и заливают 400 мл ацетона. При комнатной температуре прикапывают в реакционную массу раствор 20,6 г (0,11 моль) цианурхлорида в 150 мл ацетона. После прикапывания всего цианурхлорида из другой воронки прикапывают 50 мл 10%-ного водного раствора Na2CO3. Через 4 часа реакционную массу фильтруют. Осадок промывают на фильтре ацетоном до исчезновения синего свечения фильтрата. Продукт суспендируют в 600 мл воды, фильтруют, промывают на фильтре 600 мл ацетона. Выход 29 г (85,3%).
3) 2-[(4-N,N-дибутил-6-хлор-1,3,5-триазин-2-иламино)фенил]бензоксазол (X)
15 г (0,042 моль) продукта IX загружают в 500 мл колбу, приливают 200 мл бензола и 7,3 мл (0,043 моль) ди-н-бутиламина. Перемешивают при кипении 1 час, затем в реакционную массу прикапывают 25 мл 10%-ного водного раствора Na2CO3 и продолжают кипячение. Окончание реакции определяют методом ТСХ (элюент-хлороформ) по исчезновению пятна исходного продукта IX. Из реакционной массы отгоняют воду с насадкой Дина-Старка. Реакционную массу охлаждают и отфильтровывают NaCl. Бензол отгоняют на роторном испарителе. Продукт кристаллизуют из гексана. Выход 13 г (59,4%). Тпл=82-84°C. Белый порошок продукта X обладает зеленой люминесценцией с максимумом 533 нм. Найдено: С-63,8; Н-5,9; Cl-7,6; N-18,5. Вычислено для C24H27ClN6O: С-63,92; Н-6,03; Cl-7,69; N-18,64. Растворимость полученного продукта указана в таблице.
Пример 6
2-[2-(4-гексилбензамидо)фенил]бензтиазол (XIII)
где X: S
R3: -ArR4, где R4: -(СН2)5СН3.
В колбе емкостью 250 мл растворяют 5 г (0,022 моль) продукта I в 100 мл пиридина. Затем при комнатной температуре и интенсивном перемешивании добавляют 17 г (0,076 моль) 4-гексилбензоилхлорида. Продукт реакции выпадает в осадок. Температуру поднимают до 100°C и продолжают перемешивать. Окончание реакции определяют методом ТСХ (элюент-хлороформ) по исчезновению пятна исходного продукта I. Выпавший осадок отфильтровывают и переносят в стакан, содержащий смесь 100 мл концентрированной соляной кислоты и 200 мл воды, перемешивают 1 час и фильтруют. После высушивания продукт кристаллизуют из 750 мл ацетона. Получают белый порошок с белым свечением, что обусловлено присутствием в спектре люминесценции двух полос с максимумами при 417 нм и 566 нм в соотношении 1:2 по интенсивности. Повторная перекристаллизация из ИПС, ацетона или бензола не приводит к изменениям в спектре люминесценции.
Тпл.=159-160°C. Найдено: С-75,4; Н-6,2; N-6,8; S-7,5. Вычислено для C26H26N2OS: С-75,33; Н-6,32; N-6,76; S-7,73. Растворимость полученного продукта указана в таблице.
В таблице приведены растворимости веществ в некоторых органических растворителях.
Таким образом, синтезированы новые бесцветные люминофоры, растворимые в органических растворителях в концентрациях, достаточных для получения на их основе флуоресцентных сольвентных, бесцветных при дневном освещении, чернил для струйных принтеров, а также для применения в качестве компонентов штемпельных красок на органической основе.
Соединения общей формулы (А):
где X обозначает О или S;
Q представляет собой
R1 обозначает -Cl, -NH(CH2)5CH3, -NHAr;
R2 обозначает -NH(CH2)5CH3, -N[(CH2)3CH3]2, -NHAr,
или
R3 обозначает -Ar(CH2)5CH3.