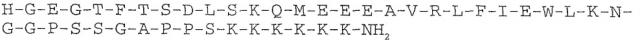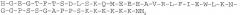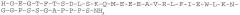Фармацевтическая комбинация для применения при гликемическом контроле у пациентов с сахарным диабетом 2 типа
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа улучшения гликемического контроля у пациентов с сахарным диабетом 2 типа, у которых диабет 2 типа неадекватно контролируется лечением одним глитазоном, включающего введение нуждающемуся в этом пациенту комбинации, содержащей (a) desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль в суточной дозе 10-20 мкг и (b) глитазон и/или его фармацевтически приемлемую соль в суточной дозе 10-20 мг. Изобретение обеспечивает значимое улучшение гликемического контроля. 14 з.п. ф-лы, 1 пр., 8 ил., 30 табл.
Реферат
Предметом настоящего изобретения является фармацевтическая комбинация для применения при гликемическом контроле у пациентов с сахарным диабетом 2 типа, причем указанная комбинация содержит (a) desPro36Exendin-4(1-39)-Lys6-NH2 (AVE0010, ликсисенатид) и/или его фармацевтически приемлемую соль, и (b) глитазон и/или его фармацевтически приемлемую соль.
У здорового индивида высвобождение инсулина поджелудочной железой строго связано с концентрацией глюкозы в крови. Повышенный уровень глюкозы в крови, возникающий после приема пищи, быстро уравновешивается соответствующим увеличением секреции инсулина. В состоянии натощак уровень инсулина в плазме падает до базальной величины, которая достаточна для обеспечения непрерывной подачи глюкозы в чувствительные к инсулину органы и ткани и для поддержания печеночной продукции глюкозы на низком уровне в ночное время.
В отличие от сахарного диабета 1 типа, при сахарном диабете 2 типа в целом нет недостатка инсулина, но во многих случаях, в частности, в прогрессирующих случаях, лечение инсулином рассматривается как наиболее подходящее лечение, если требуется, в комбинации с перорально вводимыми противодиабетическими лекарственными средствами.
Повышенный уровень глюкозы в крови в течение нескольких лет без первоначальных симптомов представляет значительный риск для здоровья. Крупномасштабное исследование DCCT (Исследовательской группы, проводящей испытания по контролю сахарного диабета и его осложнений) в США (The Diabetes Control and Complications Trial Research Group (1993) N. Engl. J. Med. 329, 977-986) ясно показало, что хронически повышенные уровни глюкозы крови являются основной причиной развития осложнений сахарного диабета. Примерами осложнений сахарного диабета являются микро- и макрососудистые поражения, которые могут проявляться ретинопатиями, нефропатиями или нейропатиями, и привести к слепоте, почечной недостаточности и потере конечностей, и сопровождаются повышенным риском сердечно-сосудистых заболеваний. Таким образом, можно сделать вывод, что усовершенствованное лечение сахарного диабета в первую очередь должно быть нацелено на удерживание глюкозы крови как можно ближе к физиологическому диапазону.
Особый риск имеется для пациентов с избыточной массой тела, страдающих сахарным диабетом 2 типа, например, пациентов с индексом массы тела (BMI) ≥30. У этих пациентов факторы риска, связанные с сахарным диабетом, перекрываются факторами риска, связанными с избыточной массой тела, приводящими, например, к увеличению сердечно-сосудистой заболеваемости, по сравнению с пациентами, страдающими сахарным диабетом 2 типа, имеющими нормальную массу тела. Таким образом, особенно необходимо лечить сахарный диабет у этих пациентов при одновременном снижении избыточной массы тела.
Глитазоны (также называемые тиазолидиндионами), такие как пиоглитазон, представляют собой антигипергликемические средства, которые снижают устойчивость к инсулину путем сенсибилизации мышц, печени и жировой ткани (Dormandy et al., Lancet 2005, 366:1270-89, Yki-Jarvinen, N Engl J Med 2004, 351: 1106-18).
Метформин представляет собой гипогликемическое средство из группы бигуанидов, применяемое при лечение инсулиннезависимого сахарного диабета (сахарного диабета 2 типа), не реагирующего на модификацию режима питания. Метформин улучшает гликемический контроль повышением чувствительности к инсулину и уменьшением кишечного всасывания глюкозы. Метформин обычно вводится перорально. Однако контроль сахарного диабета 2 типа у страдающих ожирением пациентов с помощью метформина может быть недостаточным. Таким образом, у этих пациентов могут потребоваться дополнительные меры для контроля сахарного диабета 2 типа.
Соединение desPro36Exendin-4(1-39)-Lys6-NH2 (AVE0010, ликсисенатид) представляет собой производное эксендина-4. Ликсисенатид описан в виде SEQ ID NO:93 в документе WO 01/04156:
SEQ ID NO: 1: Ликсисенатид (44 AS)
SEQ ID NO: 2: Эксендин-4 (39 AS)
Эксендины представляют собой группу пептидов, которые могут снижать концентрацию глюкозы в крови. Аналог эксендина ликсисенатид характеризуется C-концевым усечением последовательности нативного эксендина-4. Ликсисенатид содержит шесть C-концевых остатков лизина, не присутствующих в эксендине-4.
В контексте настоящего изобретения, ликсисенатид включает фармацевтически приемлемые соли. Специалисту в данной области техники известны фармацевтически приемлемые соли ликсисенатида. Предпочтительной фармацевтически приемлемой солью ликсисенатида, используемой в настоящем изобретении, является ацетат.
В примере настоящего изобретения было продемонстрировано у пациентов с сахарным диабетом 2 типа, что ликсисенатид при дополнительной терапии к глитазону значительно улучшал гликемический контроль:
- Ликсисенатид в комбинации с пиоглитазоном («группа ликсисенатида») значительно уменьшали содержание глюкозы в плазме натощак по сравнению с группой пиоглитазона («группа плацебо») от исходного уровня до 24 недели.
- В группе ликсисенатида величины HbA1c были значительно снижены по сравнению с группой плацебо от исходного уровня до 24 недели.
- В группе ликсисенатида процентная доля пациентов, достигших величин HbA1c ≤6,5% или ≤7% в неделю 24, была значимо выше, чем в группе плацебо.
- Концентрация инсулина в плазме натощак была ниже в группе ликсисенатида по сравнению с группой плацебо.
Один аспект настоящего изобретения относится к фармацевтической комбинации, причем указанная комбинация содержит
(a) desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, и
(b) глитазон и/или его фармацевтически приемлемую соль.
Комбинация по настоящему изобретению может применяться для лечения пациентов с сахарным диабетом 2 типа и/или для лечения состояний, связанных с сахарным диабетом 2 типа. Такие состояния включают снижение устойчивости к глюкозе, увеличенную концентрацию глюкозы в плазме после приема пищи, увеличенную концентрацию глюкозы в плазме натощак, бόльшую величину HbA1c и/или увеличенную концентрацию инсулина в плазме натощак.
Предпочтительный аспект настоящего изобретения представляет собой фармацевтическую комбинацию для применения в гликемическом контроле у пациентов с сахарным диабетом 2 типа, причем указанная комбинация содержит:
(a) desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, и
(b) глитазон и/или его фармацевтически приемлемую соль.
Как демонстрируется примером настоящего изобретения, описанная здесь комбинация может применяться для улучшения гликемического контроля. В настоящем изобретении термин «улучшение гликемического контроля» или «гликемический контроль», в частности, относится к повышению устойчивости к глюкозе, коррекции концентрации глюкозы в плазме натощак, коррекции величины HbA1c и/или коррекции концентрации инсулина в плазме натощак.
В частности, повышение устойчивости к глюкозе включает коррекцию концентрации глюкозы в плазме после приема пищи и/или коррекцию концентрации инсулина в плазме натощак. Конкретнее, повышение устойчивости к глюкозе включает коррекцию концентрации глюкозы в плазме после приема пищи.
В частности, коррекция концентрации глюкозы в плазме после приема пищи представляет собой снижение концентрации глюкозы в плазме после приема пищи. Снижение, в частности, значит, что концентрация глюкозы в плазме достигает нормогликемических величин или по меньшей мере приближается к этим величинам.
В частности, коррекция концентрации глюкозы в плазме натощак представляет собой снижение концентрации глюкозы в плазме натощак. Снижение, в частности, значит, что концентрация глюкозы в плазме достигает нормогликемических величин или по меньшей мере приближается к этим величинам.
В частности, коррекция величины HbA1c представляет собой уменьшение величины HbA1c. уменьшение величины HbA1c, в частности, значит, что величина HbA1c снижается ниже 6,5% или 7%, например, после лечения в течение по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере трех месяцев, по меньшей мере четырех месяцев, по меньшей мере пяти месяцев, по меньшей мере шести месяцев или по меньшей мере одного года.
В частности, коррекция концентрации глюкозы в плазме натощак представляет собой снижение концентрации глюкозы в плазме натощак. Концентрация инсулина в плазме взаимосвязана с концентрацией глюкозы в плазме. В условиях описанного здесь лечения, в состоянии натощак инсулин плазмы может достичь величин по меньшей мере для обеспечения непрерывной подачи глюкозы в чувствительные к инсулину органы и ткани и/или для поддержания на низком уровне печеночной продукции глюкозы в ночное время. В состояниях натощак концентрация инсулина может по меньшей мере достичь или приблизиться к величинам, связанным с нормогликемией, или концентрации глюкозы в плазме, приближающейся к нормогликемии.
В контексте настоящего изобретения, используемый здесь термин «глитазон» включает его фармацевтически приемлемые соли. Глитазон может быть выбран из пиоглитазона, троглитазона, росиглитазона и их фармацевтически приемлемых солей.
В настоящем изобретении, глитазон, в частности, пиоглитазон, может вводиться перорально. Специалисту в данной области техники известны препаративные формы глитазона, в частности, пиоглитазона, пригодные для лечения сахарного диабета 2 типа, пероральным введением. Пиоглитазон можно вводить нуждающемуся в нем пациенту в количестве, достаточном для получения терапевтического эффекта. Глитазон, в частности, пиоглитазон, можно вводить в дозе по меньшей мере 10 мг/день, по меньшей мере 20 мг/день, по меньшей мере 30 мг/день или по меньшей мере 40 мг/день. Максимальная суточная доза глитазона, в частности, пиоглитазона, может составлять 50 мг/день или 60 мг/день. Предпочтительный диапазон дозировки составляет от 10 мг/день до 50 мг/день или от 30 мг/день до 40 мг/день. Более предпочтительная доза составляет примерно 30 мг/день. Для перорального введения глитазон, в частности, пиоглитазон, может быть включен в состав твердой лекарственной формы, такой как таблетка или пилюля. Глитазон, в частности, пиоглитазон, может быть включен в состав с пригодными фармацевтически приемлемыми носителями, адъювантами и/или вспомогательными веществами.
Фармацевтическая комбинация по настоящему изобретению может дополнительно содержать метформин и/или его фармацевтически приемлемую соль. Метформин представляет собой международное непатентованное наименование 1,1-диметилбигуанида (Номер по CAS 657-24-9). В настоящем изобретении термин «метформин» включает его любую фармацевтически приемлемую соль.
В настоящем изобретении метформин можно вводить перорально. Специалисту в данной области техники известны препаративные формы метформина, пригодные для лечения сахарного диабета 2 типа пероральным введением. Метформин можно вводить нуждающемуся в нем пациенту в количестве, достаточном для получения терапевтического эффекта. Метформин можно вводить в дозе по меньшей мере 1,0 г/день или по меньшей мере 1,5 г/день. Для перорального введения метформин может быть включен в состав твердой лекарственной формы, такой как таблетка или пилюля. Метформин можно включать в состав с пригодными фармацевтически приемлемыми носителями, адъювантами и/или вспомогательными веществами.
Если метформин присутствует в комбинации по настоящему изобретению, то метформин и глитазон, в частности, пиоглитазон, могут быть предоставлены в одной препаративной форме, например, в твердой лекарственной форме, такой как таблетка или пилюля. Метформин и глитазон, в частности, пиоглитазон, можно включать в состав с пригодными фармацевтически приемлемыми носителями, адъювантами и/или вспомогательными веществами.
В настоящем изобретении desPro36Exendin-4(1-39)-Lys6-NH2 и/или фармацевтически приемлемую соль можно вводить при терапии, дополнительной к введению глитазона, в частности, пиоглитазона.
В настоящем изобретении термины «дополнительное», «дополнительное лечение» «дополнительная терапия» и «в добавление к» относятся к лечению сахарного диабета 2 типа глитазоном, в частности, пиоглитазоном и ликсисенатидом. Также может быть включено лечение метформином, как описано в настоящей заявке. Глитазон, в частности, пиоглитазон и ликсисенатид, можно вводить в пределах интервала времени 24 ч. Каждый из глитазона, в частности, пиоглитазона и ликсисенатида, можно вводить в дозировке один раз в день. Глитазон, в частности, пиоглитазон и ликсисенатид, можно вводить различными путями введения. Глитазон, в частности, пиоглитазон, можно вводить перорально, а ликсисенатид можно вводить парентерально.
Пациент, подлежащий лечению лекарственным средством по настоящему изобретению, может представлять собой пациента, страдающего сахарным диабетом 2 типа. Пример демонстрирует у этих пациентов, что введение ликсисенатида в комбинации с глитазоном, в частности, пиоглитазоном, обеспечивает имеющую преимущества терапию.
Подлежащий лечению лекарственным средством по настоящему изобретению пациент, страдающий сахарным диабетом 2 типа, может представлять собой пациента, страдающего сахарным диабетом 2 типа, причем сахарный диабет 2 типа неадекватно контролируется лечением одним глитазоном, в частности, пиоглитазоном, например, дозой, выбранной из диапазона от 10 мг/день до 50 мг/день, в частности, примерно 30 мг/день, в течение по меньшей мере 2 или по меньшей мере 3 месяцев. В настоящем изобретении пациент, у которого сахарный диабет 2 тип контролируется неадекватно, может иметь величину HbA1c в диапазоне от 7% до 10%.
Подлежащий лечению лекарственным средством по настоящему изобретению пациент, страдающий сахарным диабетом 2 типа, может представлять собой страдающего ожирением пациента. В настоящем изобретении страдающий ожирением пациент может иметь индекс массы тела по меньшей мере 30 кг/м2.
Подлежащий лечению лекарственным средством по настоящему изобретению пациент, страдающий сахарным диабетом 2 типа, может иметь нормальную массу тела. В настоящем изобретении пациент, имеющий нормальную массу тела, может иметь индекс массы тела в диапазоне от 17 кг/м2 до 25 кг/м2, от 17 кг/м2 до <30 кг/м2 или <30 кг/м2.
Пациент, подлежащий лечению лекарственным средством по настоящему изобретению, может представлять собой взрослого пациента. Возраст пациента может составлять по меньшей мере 18 лет или находиться в диапазоне от 18 до 80 лет, от 18 до 50 лет или от 40 до 80 лет или от 50 до 60 лет. Пациенту может быть меньше 50 лет.
Пациент, подлежащий лечению лекарственным средством по настоящему изобретению, предпочтительно не получает противодиабетическое лечение, например, инсулином и/или родственными соединениями.
Пациент, подлежащий лечению лекарственным средством по настоящему изобретению, может страдать сахарным диабетом 2 типа в течение по меньшей мере 1 года или по меньшей мере 2 лет. В частности, у пациента с сахарным диабетом 2 типа сахарный диабет 2 типа был диагностирован по меньшей мере 1 год или по меньшей мере 2 года до начала терапии лекарственным средством по настоящему изобретению.
У пациента с сахарным диабетом 2 типа величина HbA1c может составлять по меньшей мере примерно 8% или по меньшей мере примерно 7,5%. Величина HbA1c у пациента может также составлять от примерно 7% до примерно 10%. Пример настоящего изобретения демонстрирует, что лечение ликсисенатидом приводит к уменьшению величины HbA1c у пациентов с сахарным диабетом 2 типа.
В еще одном аспекте настоящего изобретения описанную здесь комбинацию можно применять для коррекции величины HbA1c у пациента, страдающего сахарным диабетом 2 типа, как описано здесь.
В еще одном аспекте настоящего изобретения описанную здесь комбинацию можно применять для коррекции устойчивости к глюкозе у пациента, страдающего сахарным диабетом 2 типа, как описано здесь.
В еще одном аспекте настоящего изобретения описанную здесь комбинацию можно применять для коррекции концентрации глюкозы в плазме после приема пищи у пациента, страдающего сахарным диабетом 2 типа, как описано здесь.
В еще одном аспекте настоящего изобретения описанную здесь комбинацию можно применять для коррекции концентрации глюкозы в плазме натощак у пациента, страдающего сахарным диабетом 2 типа, как описано здесь.
В еще одном аспекте настоящего изобретения описанную здесь комбинацию можно применять для коррекции концентрации инсулина в плазме натощак у пациента, страдающего сахарным диабетом 2 типа, как описано здесь.
В настоящем изобретении нормогликемические величины представляют собой концентрации глюкозы крови, в частности, от 60 до 140 мг/дл (соответствующие величинам от 3,3 до 7,8 мМ/л). Этот диапазон относится, в частности, к концентрациям глюкозы в крови в условиях натощак и/или в условиях после приема пищи.
У пациента с сахарным диабетом 2 типа концентрация глюкозы в плазме через 2 часа после приема пищи может составлять по меньшей мере 10 ммоль/л, по меньшей мере 12 ммоль/л или по меньшей мере 14 ммоль/л. Эти концентрации глюкозы в плазме превышают нормогликемические концентрации.
У пациента с сахарным диабетом 2 типа колебание уровня глюкозы может составлять по меньшей мере 2 ммоль/л, по меньшей мере 3 ммоль/л, по меньшей мере 4 ммоль/л или по меньшей мере 5 ммоль/л. В настоящем изобретении колебание уровня глюкозы представляет собой, в частности, разность между концентрацией глюкозы в плазме через 2 часа после приема пищи и концентрацией глюкозы в плазме за 30 минут перед пробным приемом пищи.
«После приема пищи» представляет собой термин, который хорошо известен специалисту в данной области диабетологии. Термин «после приема пищи» описывает, в частности, фазу после приема пищи и/или воздействия глюкозы в экспериментальных условиях. У здорового индивида эта фаза характеризуется увеличением и последующим уменьшением концентрации глюкозы в плазме. Термин «после приема пищи» или «фаза после приема пищи» обычно заканчивается после периода до 2 ч после приема пищи и/или воздействия глюкозы.
Как описано здесь, у пациента с сахарным диабетом 2 типа концентрация глюкозы в плазме натощак может составлять по меньшей мере 8 ммоль/л, по меньшей мере 8,5 ммоль/л или по меньшей мере 9 ммоль/л. Эти концентрации глюкозы в плазме превышают нормогликемические концентрации.
В настоящем изобретении, desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить нуждающемуся в нем пациенту в количестве, достаточном для получения терапевтического эффекта. В настоящем изобретении desPro36Exendin-4(1-39)-Lys6-NH и/или его фармацевтически приемлемую соль можно включить в состав с пригодными фармацевтически приемлемыми носителями, адъювантами и/или вспомогательными веществами.
Соединение desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить парентерально, например, инъекцией (такой как внутримышечная или подкожная инъекция). Известны пригодные инъекционные устройства, например, так называемые «ручки», содержащие картридж, содержащий активный ингредиент и инъекционную иглу. Соединение desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить в подходящем количестве, например, в количестве в диапазоне от 10 до 15 мкг на дозу или от 15 до 20 мкг на дозу.
В настоящем изобретении desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить в суточной дозе в диапазоне от 10 до 20 мкг, в диапазоне от 10 до 15 мкг или в диапазоне от 15 до 20 мкг. DesPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить одной инъекцией в день.
В настоящем изобретении desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемая соль могут быть представлены в виде жидкой композиции. Специалисту в данной области техники известны жидкие композиции ликсисенатида, подходящие для парентерального введения. Жидкая композиция по настоящему изобретению может иметь кислотный или физиологический показатель pH. Кислотный показатель pH предпочтительно находится в диапазоне pH 1-6,8, pH 3,5-6,8 или pH 3,5-5. Физиологический показатель pH предпочтительно находится в диапазоне pH 2,5-8,5, pH 4,0-8,5 или pH 6,0-8,5. Показатель pH можно регулировать фармацевтически приемлемой разбавленной кислотой (обычно, HCl) или фармацевтически приемлемого разбавленного основания (обычно, NaOH).
Жидкая композиция, содержащая desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, может содержать подходящий консервант. Подходящий консервант может быть вызван из фенола, м-крезола, бензилового спирта и сложного эфира п-гидроксибензойной кислоты. Предпочтительным консервантом является м-крезол. Жидкая композиция, содержащая desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, может содержать вещество, регулирующее тоничность. Подходящее вещество, регулирующее тоничность, можно выбрать из глицерина, лактозы, сорбита, маннита, глюкозы, NaCl, соединений, содержащих кальций или магний, таких как CaCl2. Концентрация глицерина, лактозы, сорбита, маннита, глюкозы может находиться в диапазоне от 100 до 250 мМ. Концентрация NaCl может составлять вплоть до 150 мМ. Предпочтительным веществом, регулирующим тоничность, является глицерин.
Жидкая композиция, содержащая desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, может содержать метионин от 0,5 мкг/мл до 20 мкг/мл, предпочтительно от 1 мкг/мл до 5 мкг/мл. Предпочтительно, жидкая композиция содержит L-метионин.
Еще один аспект настоящего изобретения относится к способу лечения медицинского показания, как описано здесь. Например, способ может включать введение комбинации, как описано здесь. Способ может представлять собой способ лечения пациентов с сахарным диабетом 2 типа и/или лечения состояний, связанных с сахарным диабетом 2 типа, как описано здесь. Пациент может представлять собой пациента, как определено здесь.
Дополнительный аспект настоящего изобретения представляет собой способ улучшения гликемического контроля у пациентов с сахарным диабетом 2 типа, причем указанный способ включает введение desPro36Exendin-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемой соли в комбинации с глитазоном, в частности, пиоглитазоном, нуждающемуся в нем пациенту. В частности, может быть введена комбинация, описанная в настоящем документе. В способе по настоящему изобретению пациент может представлять собой пациента, определенного в настоящем описании.
Еще один аспект настоящего изобретения относится к применению комбинации, как описано здесь, для получения лекарственного средства для лечения медицинского показания, как описано здесь. Например, комбинацию по настоящему изобретению можно применять для получения лекарственного средства для лечения пациентов с сахарным диабетом 2 типа и/или для лечения состояний, связанных с сахарным диабетом 2 типа. В частности, комбинацию по настоящему изобретению можно применять для получения лекарственного средства для улучшения гликемического контроля, коррекции устойчивости к глюкозе, коррекции концентрации глюкозы в плазме после приема пищи, коррекции концентрации глюкозы в плазме натощак, коррекции величины HbA1C и/или коррекции концентрации инсулина в плазме натощак. Пациент может представлять собой пациента, как определено в настоящем описании.
Изобретение дополнительно иллюстрируется следующим примером и чертежами.
НАДПИСИ НА ЧЕРТЕЖАХ
Фиг.1 - Структура исследования.
Фиг.2 - График Каплана-Мейера времени до прекращения лечения по любой причине - Рандомизированная популяция.
Фиг.3 - График среднего изменения HbA1c (%) от исходного уровня по посещениям до недели 24 - mITT-популяция (модифицированная популяция пациентов, включенных в исследование). LOCF = метод переноса вперед данных последнего проведенного наблюдения. Примечание: График включает измерения перед введением средств, используемых при усугублении симптомов заболевания, и до 3 дней после последней инъецированной дозы исследуемого двойным слепым методом продукта во время или перед посещением 12 (неделя 24), или в день 169, если недоступны данные посещения 12 (неделя 24).
Фиг.4 - График среднего изменения глюкозы плазмы натощак (ммоль/л) от исходного уровня до недели 24 - mITT-популяция. LOCF = метод переноса вперед данных последнего проведенного наблюдения. Примечание: График включает измерения перед введением средств, используемых при усугублении симптомов заболевания, и до 1 дня после последней инъецированной дозы исследуемого двойным слепым методом продукта во время или перед посещением 12 (неделя 24), или в день 169, если недоступны данные посещения 12 (неделя 24).
Фиг.5 - График среднего изменения массы тела (кг) от исходного уровня по посещению до недели 24 - mITT-популяция. LOCF = метод переноса вперед данных последнего проведенного наблюдения. Примечание: График включает измерения перед введением средств, используемых при усугублении симптомов заболевания, и до 3 дней после последней инъецированной дозы исследуемого двойным слепым методом продукта во время или перед посещением 12 (неделя 24), или в день 169, если недоступны данные посещения 12 (неделя 24).
Фиг.6 - График среднего изменения HbA1c (%) от исходного уровня по посещению - mITT-популяция. LOCF = метод переноса вперед данных последнего проведенного наблюдения. EOT = Последняя величина при получении исследуемого лечения. Примечание: Анализ исключает измерения, полученные после введения средств, используемых при усугублении симптомов заболевания, и/или после прекращения лечения, плюс 3 дня. Для недели 24 (LOCF), анализ включает измерения, полученные до 3 дней после последней инъецированной дозы исследуемого двойным слепым методом продукта во время или перед посещением 12 (неделя 24), или в день 169, если недоступны данные посещения 12 (неделя 24).
Фиг.7 - График среднего изменения глюкозы в плазме натощак (ммоль/л) от исходного уровня по посещению - mITT-популяция. LOCF = метод переноса вперед данных последнего проведенного наблюдения. EOT = Последняя величина при получении исследуемого лечения. Примечание: Анализ исключает измерения, полученные после применения средств, используемых при усугублении симптомов заболевания, и/или после прекращения лечения, плюс 1 день. Для недели 24 (LOCF), анализ включает измерения, полученные до 1 дня после последней инъецированной дозы исследуемого двойным слепым методом продукта во время или перед посещением 12 (неделя 24), или в день 169, если недоступны данные посещения 12 (неделя 24).
Фиг.8 - График среднего изменения массы тела (кг) от исходного уровня по посещению - mITT-популяция. LOCF - метод переноса вперед данных последнего проведенного наблюдения, EOT = Последняя величина при получении исследуемого лечения. Примечание: Анализ исключает измерения, полученные после применения средств, используемых при усугублении симптомов заболевания, и/или после прекращения лечения, плюс 3 дня. Для недели 24 (LOCF), анализ включает измерения, полученные до 3 дней после последней инъецированной дозы исследуемого двойным слепым методом продукта во время или перед посещением 12 (неделя 24), или в день 169, если недоступны данные посещения 12 (неделя 24).
ПРИМЕР
РЕЗЮМЕ
Пример относится к рандомизированному, двойному слепому, працебо-контролируемому, 2-групповому, несбалансированно структурированному, параллельно-групповому, многоцентровому, многонациональному исследованию, оценивающему эффективность и безопасность ликсисенатида в дополнение к пиоглитазону у пациентов с сахарным диабетом 2 типа, неадекватно контролируемым пиоглитазоном. Приблизительная минимальная длительность двойного слепого исследования на одного пациента составила 79 недель (скрининг до 2 недель + 1-недельный вводный период + 24 недели основного периода лечения, исследуемого двойным слепым методом + варьирующееся продолжение + 3-дневное наблюдение).
Исследование проводили в 150 центрах в 13 странах. Первичной целью исследования была оценка эффективности ликсисенатида в отношении гликемического контроля, по сравнению с плацебо, в качестве дополнительного пиоглитазону терапевтического средства с точки зрения снижения уровня HbA1c (абсолютного изменения) в течение периода 24 недель.
В общей сложности 484 пациента методом рандомизации включали в одну из двух групп лечения (323 в группу ликсисенатида и 161 в группу плацебо). Все рандомизированные пациенты получали исследуемое лечение. Демографические и исходные характеристики были в целом одинаковыми в группах лечения. Пять пациентов (3, получавших ликсисенатид, и 2, получавших плацебо) были исключены из модифицированной популяция пациентов, включенных в исследование (mITT), для анализов эффективности вследствие отсутствия данных эффективности после оценки исходных показателей. В течение всего периода исследуемого лечения 136 (28,1%) пациентов преждевременно прекратили исследуемое лечение (26,0% в группе ликсисенатида и 32,3% в группе плацебо). Для группы ликсисенатида основной причиной прекращения лечения была «другие причины» (10,5%, в сравнении с 12,4% для плацебо), за которой следовала причина «побочные явления» (9,0%, в сравнении с 8,7% для плацебо).
Анализы эффективности базируются на 24-недельном основном периоде лечения, исследуемом двойным слепым методом. Изменения предела среднего (LS) HbA1c от исходного уровня до недели 24 составили -0,90% в группе ликсисенатида и -0,34% в группе плацебо (разность LS среднего в сравнении с плацебо = -0,56%; p-величина <0,0001). Процентные доли пациентов, достигающих уровня HbA1c ≤6,5% или <7% в неделю 24, были значимо выше в группе ликсисенатида, чем в группе плацебо (для HbA1c ≤6,5%, 28,9% в группе ликсисенатида, в сравнении с 10,1% в группе плацебо; для HbA1c <7%, 52,3% в группе ликсисенатида, в сравнении с 26,4% в группе плацебо). Анализ HbA1c у пациентов, реагирующих на лечение (HbA1c ≤6,5% или <7% в неделю 24), с использованием метода Кохрана-Мантеля-Хензеля (CMH) также показал значимое различие результатов лечения ликсисенатидом и плацебо в неделю 24 (p-величина <0,0001).
Для уровня глюкозы в плазме натощак (FPG) значимое снижение от исходного уровня до недели 24 наблюдали в группе ликсисенатида, по сравнению с группой плацебо (разность LS среднего в сравнении с плацебо = -0,84 ммоль/л; p-величина <0,0001). Для массы тела уменьшение LS среднего составила 0,21 кг от исходного уровня в неделю 24 в группе ликсисенатида, по сравнению с увеличением LS среднего на 0,21 кг в группе плацебо, и различие между 2 группами не было статистически значимым (разность LS среднего в сравнении с плацебо = -0,41 кг). В отношении стратегии тестирования для поправки на множественность, дедуктивное тестирование для последующих переменных величин эффективности было поисковым, поскольку анализ массы тела не смог показать статистически значимое различие. Не было релевантного различия, наблюдаемого в функции β-клеток, по данным оценки ΗΟΜΑ-β (модели оценки гомеостаза β-клеток) между ликсисенатидом и плацебо при различии LS среднего -0,25 (95% CI (ДИ, доверительный интервал)): [-6,579 до 6,070]). Процентная доля пациентов, требующих экстренной терапии в неделю 24, была значимо ниже в группе ликсисенатида (12 пациентов [3,8%]), по сравнению с группой плацебо (18 [11,3%]). Для уровня инсулина в плазме натощак (FPI), снижение LS среднего было бόльшим в группе ликсисенатида, чем в группе плацебо, при разности LS среднего -9,36 пмоль/л (95% ДИ: [от -16,586 до -2,124]).
Анализы безопасности базируются на периоде лечения всего исследования. Ликсисенатид был хорошо переносим. Доли пациентов, которые испытали возникновение связанных с лечением побочных эффектов (TEAE) составили 87,9% в группе ликсисенатида и 83,2% в группе плацебо. Случаев смерти пациентов в группе ликсисенатида не было, тогда как в группе плацебо умерли 2 пациента. У одного пациента развился связанный с лечением острый инфаркт миокарда, приведший к смерти, а другой пациент умер вследствие побочного эффекта (AE) после лечения (конечной стадии астения) ввиду дыхательной недостаточности с мультиорганной недостаточностью. Процентная доля пациентов, у которых были тяжелые TEAE, была ниже в группе ликсисенатида (7,4%), чем в группе плацебо (9,3%). Наиболее часто отмечаемыми TEAE в группе ликсисенатида были тошнота (26% в сравнении с 13,7% для плацебо), за которой следует назофарингит (16,4% в сравнении с 14,9% для плацебо) и головная боль (13,3% в сравнении с 11,8% для плацебо). В течение периода проведения лечения всего исследования, у 23 (7,1%) пациентов в группе ликсисенатида была клинически выраженная гипогликемия по протокольному определению, по сравнению с 7 (4,3%) в группе плацебо. Ни одно из клинически выраженных явлений гипогликемии не было тяжелым по интенсивности. 22 (6,8%) пациента в группе ликсисенатида и 8 (5,0%) в группе плацебо испытали побочные явления в виде реакции в участке инъекции. Общее число 12 пациентов (9 [2,8%] в группе ликсисенатида и 3 [1,9%] в группе плацебо) отметили 19 явлений, которые расценивались как аллергические реакции Комитетом по оценке аллергических реакций (ARAC). Из них, 5 явлений у 3 пациентов в группе ликсисенатида (1 пациент с аллергическим дерматитом, 1 с сыпью и 1 с ангиоотеком, анафилактической реакцией и аллергическим конъюнктивитом) расценивались как возможно связанные с IP (исследуемым продуктом). Ни одно явление в группе плацебо не расценивалось как возможно связанное с IP. В исследовании не был отмечено случаев панкреатита или рака щитовидной железы.
1. ЦЕЛИ
1.1. ПЕРВИЧНАЯ ЦЕЛЬ
Первичной целью настоящего исследования была оценка эффективности ликсисенатида в отношении гликемического контроля в качестве дополнительного терапевтического средства к пиоглитазону, по сравнению с плацебо, у пациентов с сахарным диабетом 2 типа, получавших лечение пиоглитазоном, с точки зрения абсолютного снижения HbA1c в течение периода 24 недели.
1.2 КЛЮЧЕВЫЕ ВТОРИЧНЫЕ ЦЕЛИ
Вторичными целями настоящего исследования были:
• Для оценки воздействий ликсисенатида на
- Процентную долю пациентов, достигших HbA1c <7%,
- Процентную долю пациентов, достигших HbA1c ≤6,5%,
- Уровень глюкозы в плазме натощак (FPG),
- Массу тела,
- Функцию β-клеток, по данным оценки ΗΟΜΑ-β,
- Уровень инсулина в плазме натощак (FPI).
• Для оценки безопасности и переносимости ликсисенатида.
2. СТРУКТУРА ИСПЫТАНИЯ
Это было несбалансированное (2:1), рандомизированное, двойное слепое, плацебо-контролируемое, 2-групповое, параллельное, многоцентровое, многонациональное исследование с варьирующимся периодом продолжения, сравнивающее лечение ликсисенатидом и плацебо у пациентов с сахарным диабетом 2 типа (300 пациентов в группе ликсисенатида и 150 пациентов в группе плацебо). Исследование было двойным слепым в отношении лечения активным средством и плацебо. Объем исследуемого лекарственного средства (т.е., доза активного лекарственного средства или соответствующей дозы плацебо) не был скрыт. Пациентов стратифицировали по величинам скрининга HbA1c (<8%, ≥8%) и применению метформина (Да, Нет) при скрининге.
Приблизительная минимальная продолжительность двойного слепого исследования на одного пациента составляла 79 недель (скрининг до 2 недель + 1-недельный вводный период + 24 недели основного периода лечения, исследуемого двойным слепым методом + варьирующееся продолжение + 3-дневное наблюдение). Пациентов, которые завершили 24-недельный основной двойной слепой период лечения, подвергали лечению в течение вариабельного двойного слепого периода продолжения, который заканчивался для всех пациентов приблизительно в запланированную дату посещения недели 76 (V25) для последнего рандомизированного пациента.
Структура испытания иллюстрируется фиг.1.
3. ПЕРВИЧНЫЕ И КЛЮЧЕВЫЕ ВТОРИЧНЫЕ ОЖИДАЕМЫЕ РЕЗУЛЬТАТЫ
3.1 ПЕРВИЧНЫЕ ОЖИДАЕМЫЕ РЕЗУЛЬТАТЫ
Первичным параметром эффективности было абсолютное изменение уровня HbA1c от исходного уровня до недели 24, который определяли как: величина HbA1c в неделю 24 - величина HbA1c в исходном состоянии.
Если пациент постоянно прекра