Лечение нарушений циркадного ритма
Иллюстрации
Показать всеИзобретение относится к области медицины и представляет собой способ подгонки циркадного ритма кортизола к 24-часовому циркадному ритму и сохранения 24-часового циркадного ритма. Способ включает пероральное введение пациенту эффективного количества тазимелтеона один раз в день перед отходом ко сну, предпочтительно за 0,5-1,5 ч до требуемого времени засыпания, предпочтительно доза тазимелтеона составляет 10-00 мг. Пациенты могут иметь нарушенное восприятие света или являться слепыми. Введение тазимелтеона могут начинать в день, когда акрофаза aMT6s в моче будет иметь место в период от 5,5 ч до требуемого времени пробуждения и до 2,5 ч после требуемого времени пробуждения. Осуществление изобретения обеспечивает нормализацию циркадного ритма кортизола. 7 з.п. ф-лы, 17 ил., 7 табл.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка претендует на эффект находящихся в совместном рассмотрении предварительных заявок на патент США №№61/590974, зарегистрированной 26 января 2012 г., 61/640067, зарегистрированной 30 апреля 2012 г., 61/650455, зарегистрированной 22 мая 2012 г., 61/650458, зарегистрированной 22 мая 2012 г., 61/714149, зарегистрированной 15 октября 2012 г., 61/738985, зарегистрированной 18 декабря 2012 г., 61/738987, зарегистрированной 18 декабря 2012, и 61/755896, зарегистрированной 23 января 2013 г., каждая из которых полностью включена в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Варианты осуществления изобретение относятся в целом к области нарушений циркадного ритма (CRD) и более конкретно к подгонке (биологических часов) к циркадному ритму у индивидуумов, страдающих нарушением суточного цикла сна (синдром не-24-часового цикла («сон-бодрствование»)) (синдром «не-24»).
Предпосылки создания изобретения
Биологические часы организма контролируют синхронизацию многих аспектов физиологии, поведения и метаболизма, характеризующихся суточными ритмами, включая циклы «сон-бодрствование», температуру тела, бдительность и работоспособность, метаболические ритмы и некоторые гормоны, для которых характерна вариация в течение суток. Сигналы супрахиазматического ядра (СХЯ) контролируют многие эндокринные ритмы, включая ритмы секреции мелатонина шишковидным телом, а также контролируют секрецию кортизола посредством воздействия на гипоталамус, гипофиз и надпочечник. Эти биологические часы организма, локализованные в СХЯ, спонтанно генерируют примерно 24,5-часовые ритмы. Такие не-24-часовые ритмы синхронизируются каждый день с 24-часовым циклом день-ночь под действием света, основного сигнала времени из окружающей среды, который обнаруживается специализированными клетками в сетчатке и передается в СХЯ через ретино-гипоталамический тракт. Отсутствие способности обнаруживать этот световой сигнал, имеющее место у большинства полностью слепых индивидуумов, приводит к неспособности биологических часов организма к ежедневной переустановке и поддержанию их подгонки к 24-часовым суткам.
Синдром не-24-часового цикла
Синдром «не-24», который обозначают также как синдром не-24-часового цикла «сон-бодрствование» (N24HSWD) или синдром не-24-часового цикла, представляет собой уникальное нарушение, поражающее примерно 65000-95000 людей в США и 140000 в Европе. Синдром «не-24» проявляется, когда индивидуумы, первично слепые, не воспринимающие свет, неспособны синхронизировать их эндогенный циркадный пейсмекер (ведущий осциллятор) к 24-часовому циклу свет/темнота. Без света в качестве синхронизатора и в результате того, что период внутренних часов, как правило, несколько превышает 24 ч, индивидуумы с синдромом «не-24» характеризуются тем, что у них водитель циркадного ритма инициирует сдвиг периода сна каждый день все на более и более поздний час. Индивидуумы с синдромом «не-24» имеют аномальные режимы ночного сна, что сопровождается тем, что в течение дня им трудно сохранять состояние бодрствования. Синдром «не-24» приводит к значительному нарушению с хроническими воздействиями на социальные и профессиональные функции этих индивидуумов.
Помимо проблем, связанных с засыпанием в нужное время, индивидуумы с синдромом «не-24» характеризуются избыточной сонливостью в дневное время, что часто приводит к дремоте в дневное время.
Серьезность жалоб на ночной сон и/или жалоб на сонливость в дневное время варьируется в зависимости от того, как согласуется цикл биологических часов индивидуума с особенностями его общественной жизни, работы или сна. «Свободное течение» часов приводит к повторяющемуся примерно через 1-4 месяца циклу, т.е. циркадному циклу, когда водитель циркадного цикла инициирует небольшой сдвиг продолжительности сна каждый день (примерно в среднем на 15 мин) вплоть до повторения указанного цикла. Вначале, когда циркадный цикл становится десинхронизированным относительно 24-часового цикла день-ночь, индивидуумы с синдромом «не-24» имеют трудность с засыпанием. С течением времени десинхронизация внутренних циркадных ритмов этих индивидуумов достигает 180 градусов относительно 24-часового цикла день-ночь, что постепенно делает практически невозможным сон в ночное время и приводит к очень сильной сонливости в дневные часы.
В конце концов, цикл сон-бодрствование индивидуума выравнивается относительно ночи, и индивидуумы со «свободным течением» часов могут хорошо спать в общепринятое или в социально приемлемое время. Однако выравнивание между внутренним циркадным ритмом и 24-часовым циклом день/ночь является лишь временным.
Помимо проблем, связанных с циклическим сном в ночное время и сонливостью в дневное время, такое состояние может вызывать вредные сдвиги в течение дня температуры тела и секреции гормонов, может вызывать метаболические нарушения и иногда ассоциируются с симптомами депрессии и расстройствами настроения.
Установлено, что 50-75% от общего количества полностью слепых людей в Соединенных Штатах (примерно 65000-95000) имеют синдром «не-24». Указанное состояние может поражать также зрячих людей. Однако такие случаи являются редкими для указанной популяции, и истинная частота встречаемости синдрома «не-24» в общей популяции неизвестна.
Конечная цель лечения индивидуумов с синдромом «не-24» заключается в том, чтобы подогнать или синхронизировать их циркадные ритмы, установив соответствующую фазовую взаимосвязь с 24-часовым днем, в результате чего они должны обладать повышенной сонливостью ночью и повышенной способностью к бодрствованию в дневное время.
Тазимелтеон
Тазимелтеон является регулятором циркадного ритма, который специфически связывается с двумя высокоаффинными рецепторами мелатонина, Me11a (MT1R) и Me11b (MT2R). Высокая плотность указанных рецепторов обнаружена в супрахиазматическом ядре головного мозга (СХЯ), которое ответственно за синхронизацию цикла сна/бодрствования. В предшествующих клинических исследованиях, в которых моделировали десинхронизацию циркадных часов, было установлено, что тазимелтеон улучшает параметры сна. К настоящему времени тазимелтеон был изучен на сотнях индивидуумов и был продемонстрирован его хороший профиль переносимости.
Краткое изложение сущности изобретения
Варианты осуществления изобретения относятся к открытию того, что тазимелтеон можно применять для лечения свободно текущего циркадного ритма у пациентов, включая пациентов с нарушенным восприятием света, например, слепых пациентов, у которых указанный свободно текущий циркадный ритм проявляется в виде синдрома «не-24».
Варианты осуществления настоящего изобретения относятся также к способу, предлагаемому в изобретении, определения циркадного ритма индивидуума (tau) и к применению указанной методологии к лечению свободно текущего циркадного ритма.
Варианты осуществления настоящего изобретения относятся также к лечению индивидуумов, которые имеют симптомы синдрома «не-24», такие, например, как ежедневный сдвиг сна на более позднее время, аномальная картина ночного сна и/или сложность в нахождении состояния бодрствования в течение дня, приводящие во многих случаях к значительному нарушению с хроническими воздействиями на социальные и профессиональные функции этих индивидуумов, а также возможным отрицательным воздействиям хронического смещения (рассогласования) на состояния здоровья.
Так, приведенные с целью иллюстрации варианты осуществления изобретения относятся к способу определения циркадного периода (τ) у человека, заключающемуся в том, что:
а) собирают по меньшей мере один биологический образец у пациента в течение каждого из нескольких регулярных интервалов сбора (CI), используя по меньшей мере две серии сбора, где продолжительность каждой серии сбора составляет по меньшей мере 48 ч;
б) если собирают несколько биологических образцов в течение каждого CI, то затем необязательно физически объединяют все образцы, собранные в данный CI, и в таком случае определяют момент времени сбора для каждого CI;
в) оценивают количество (абсолютное количество или концентрацию) мелатонина или косвенного параметра мелатонина в каждом из образцов или в объединенных образцах;
г) необязательно преобразовывают количества мелатонина или косвенного параметра мелатонина в каждый момент времени сбора в скорость производства;
д) подвергают количество мелатонина или косвенного параметра мелатонина или скорость производства мелатонина или косвенного параметра в каждый момент времени сбора анализу для моделирования у пациента цикла, включая акрофазу, количества или производства мелатонина или косвенного параметра мелатонина в каждый день;
е) подгоняют полученные величины акрофазы в сериях к модели методом взвешенной линейной регрессии для определения τ, где τ=24 + крутизна наклона кривой.
Другим приведенным с целью иллюстрации вариантом осуществления изобретения является способ лечения больного человека, который имеет симптомы синдрома «не-24», заключающийся в том, что у пациента определяют величину τ с помощью способа, представленного выше и более подробно описанного ниже, при этом, если величина τ пациента превышает 24 ч, то пациента лечат путем ежедневного введения пациенту внутрь в эффективном количестве агониста мелатонина.
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - пример отчета пациента, для которого на основе анализов aMT6s (анализ 6-сульфатоксимелатонина) определено, что он не должен иметь свободно текущий циркадный ритм;
на фиг. 2 - пример отчета пациента, для которого на основе анализов aMT6s определено, что он должен иметь свободно текущий циркадный ритм;
на фиг. 3 - пример отчета пациента, для которого на основе анализов кортизола определено, что он не должен иметь свободно текущий циркадный ритм;
на фиг. 4 - пример отчета пациента, для которого на основе анализов кортизола определено, что он должен иметь свободно текущий циркадный ритм;
на фиг. 5 - путь метаболизма тазимелтеона и нескольких его метаболитов;
на фиг. 6-11 - графики зависимости действия тазимелтеона и флувоксамина при их совместном введении на концентрацию соответственно тазимелтеона, метаболита М9, метаболита M11, метаболита M12, метаболита М13 и метаболита M14;
на фиг. 12-17 - графики зависимости действия курения на концентрацию соответственно тазимелтеона, метаболита М9, метаболита M11, метаболита M12, метаболита М13 и метаболита M14.
Подробное описание изобретения
Тазимелтеон имеет химическое название: транс-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил]метил]пропанамид, структуру формулы I:
формула I
и описан в US 5856529 и US 20090105333, содержание обоих полностью включено в настоящее описание в качестве ссылки.
Тазимелтеон представляет собой порошок от белого до беловатого цвета, температура плавления которого составляет 78°С (ДСК, дифференциальная сканирующая калориметрия), очень хорошо растворимый или полностью растворимый в 95% этаноле, метаноле, ацетонитриле, этилацетате, изопропаноле, полиэтиленгликолях (ПЭГ-300 и ПЭГ-400) и лишь слабо растворимый в воде. Значение рН, присущее насыщенному раствору тазимелтеона в воде, составляет 8,5 и его растворимость в воде практически не влияет рН. Тазимелтеон обладает в 2-4 раза более высокой аффинностью к MT2R по сравнению с MT1R. Его аффинность (Ki) к MT1R составляет 0,3-0,4, а к MT2R 0,1-0,2. Тазимелтеон можно применять для осуществления настоящего изобретения на практике, поскольку он является агонистом мелатонина, для которого продемонстрирована, среди других видов его активности, способность к подгонке (биологических часов) у пациентов с синдромом «не-24».
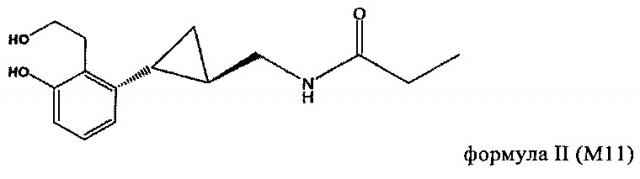
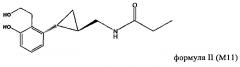
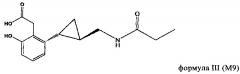
Родственные объекты настоящего изобретения относятся к применению метаболита тазимелтеона в качестве агониста мелатонина. Метаболиты тазимелтеона включают, например, аналог фенолкарбоновой кислоты (М9) и гидроксипропилфенольный аналог (M11). Каждый из них образуется в организме человека после орального введения тазимелтеона.
В частности, объектами изобретения является применение тазимелтеона или соединений формулы II или III, включая соли, сольваты и гидраты тазимелтеона или соединений формулы II или формулы III, в аморфной или кристаллической форме.
Хотя в настоящем описании соединения представлены в R-трас-конфигурации, в изобретении подразумевается также применение их стереоизомеров, т.е., R-цис-, S-транс- и S-цис-изомеров. Кроме того, изобретение относится к применению пролекарств тазимелтеона или соединений формулы II или формулы III, включая, например, сложные эфиры указанных соединений. Приведенное ниже обсуждение относится к тазимелтеону, но следует понимать, что соединения формул II и III можно также применять при воплощении на практике объектов изобретения.
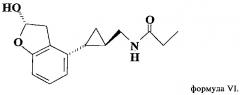
Метаболиты тазимелтеона, включают соединения, описанные, например, у Vachharajani и др., «Preclinical Pharmacokinetics and Metabolism of BMS-214778, a Novel Melatonin Receptor Agonist», J. Pharmaceutical Sci., 92(4), cc. 760-772, публикация включена в настоящее описание в качестве ссылки. Активные метаболиты тазимелтеона можно применять также в способе, предлагаемом в изобретении, также как и можно применять фармацевтические приемлемые соли тазимелтеона или его активных метаболитов. Например, помимо указанных выше метаболитов формул II и III, метаболиты тазимелтеона включают также моногидроксилированные аналоги М13 формулы IV, M12 формулы V и M14 формулы VI.
Таким образом, очевидно, что настоящее изобретение относится к подгонке (биологических часов) пациентов, страдающих свободно текущим циркадным ритмом, к 24-часовому циркадному ритму путем введения регулятора циркадного ритма (т.е. модификатора циркадного ритма), обладающего способностью продвигать фазу и/или подгонять циркадные ритмы, такого как агонист мелатонина типа тазимелтеона или активного метаболита тазимелтеона, или его фармацевтически приемлемой соли.
Другие агонисты MT1R и MT2R, т.е. агонисты мелатонина, могут оказывать аналогичные действия на биологические часы организма. Таким образом, например, настоящее изобретение относится также к применению агонистов мелатонина, таких как (но не ограничиваясь только ими) мелатонин, N-[1-(2,3-дигидробензофуран-4-ил)пирролидин-3-ил]-N-этилмочевина и структурно родственные соединения, которые описаны в US 6211,25, LY-156735 ((R)-N-(2-(6-хлор-5-метокси-1Н-индол-3-ил)пропил)ацетамид) (описанный в US 4997845), агомелатин (N-[2-(7-метокси-1-нафтил)этил]ацетамид) (описанный в US 5225442), рамелтеон ((S)-N-[2-(1,6,7,8-тетрагидро-2Н-индено[5,4-b]фуран-8-ил)этил]пропионамид), 2-фенилмелатонин, 8-M-PDOT, 2-йодмелатонин и 6-хлормелатонин.
Другие агонисты мелатонина включают (но не ограничиваясь только ими) соединения, указанные в публикации заявки на патент США №20050164987, которая включена в настоящее описание в качестве ссылки, а именно: TAK-375 (см. Kato K. и др., Int. J. Neuropsychopharmacol. 3 (дополнение 1), 2000, Abst Р.03.130; см. также рефераты Р.03.125 и Р.03.127), CGP 52608 (1-(3-аллил-4-оксотиазолидин-2-илиден)-4-метилтиосемикарбазон) (см. Missbach и др., J. Biol. Chem. 271, 1996, сс. 13515-13522), GR 196429 (N-[2-[2,3,7,8-тетрагидро-1Н-фуро(2,3-g)инолил-1-ил]этил]ацетамид) (см. Beresford и др., J. Pharmacol. Exp. Ther., 285, 1998, cc. 1239-1245), S 20242 N-[2-(7-метоксинафт-1-ил)этил]пропионамид) (см. Depres-Brummer и др., Eur. J. Pharmacol., 347, 1998, cc. 57-66), S-23478 (см. Neuropharmacology, июль 2000 г.), S 24268 (см. Naunyn Schmiedebergs Arch., июнь 2003 г.), S 25150 (см. Naunyn Schmiedebergs Arch., июнь 2003 г.), GW-290569, лузидол (2-бензил-N-ацетилтриптамин) (см. US 5093352), GR 135531 (5-метоксикарбониламино-N-ацетилтриптамин) (см. публикацию заявки на патент США №20010047016), находящееся на стадии исследования производное мелатонина A (Melatonin Research Compound А), агонист мелатонина А (см. IMSWorld R&D Focus, август 2002 г.), аналог мелатонина В (см. Pharmaprojects, август 1998 г.), агонист мелатонина С (см. Chem. Pharm. Bull. (Токио), январь 2002 г.), агонист мелатонина D (см. J. Pineal Research, ноябрь 2000 г.), агонист мелатонина Е (см. Chem. Pharm. Bull. (Токио), февраль 2002 г.), агонист мелатонина F (см. Reprod. Nutr. Dev., май 1999 г.), агонист мелатонина G (см. J. Med. Chem., октябрь 1993 г.), агонист мелатонина Н (см. Famaco, март 2000 г.), агонист мелатонина I (см. J. Med. Chem., март 2000 г.), аналог мелатонина J (см. Bioorg. Med. Chem. Lett., март 2003 г.), аналог мелатонина K (см. MedAd News, сентябрь 2001 г.), аналог мелатонина L, АН-001 (2-ацетамидо-8-метокситетралин) (см. US 5151446), GG-012 (4-метокси-2-(метиленпропиленпропиламид)индан) (см. Drijfhout и др., Eur. J. Pharmacol., 382, 1999, cc. 157-166), енол-3-IPA, ML-23 (N-2,4-динитрофенил-5-метокситриптамин) (см. US 4880826), SL-18.1616, IP-100-9 (US 5580878), индуцирующий сон пептид A, AH-017 (см. US 5151446), AH-002 (8-метокси-2-пропионамидотетралин) (см. US 5151446) и IP-101. При осуществлении на практике настоящего изобретения естественно можно применять метаболиты, пролекарства, стереоизомеры, полиморфы, гидраты, сольваты и соли указанных выше соединений, которые непосредственно или опосредованно обладают активностью.
Предпочтительными являются агонисты мелатонина, имеющие профиль связывания с MT1R и MT2R, аналогичный профилю тазимелтеона, который обладает в 2-4 раза более высокой специфичностью в отношении MT2R.
Тазимелтеон можно синтезировать с помощью методов, известных в данной области. Получение 4-винил-2,3-дигидробензофуранциклопропильного промежуточного продукта можно осуществлять согласно методу, описанному в US 7754902, содержание которого полностью включено в настоящее описании в качестве ссылки.
Пролекарства, например, сложные эфиры, и фармацевтически приемлемые соли можно получать с помощью процедуры, известной обычному специалисту в данной области.
У пациентов, страдающих синдромом «не-24», циркадные ритмы мелатонина и кортизола и естественный цикл день/ночь становятся десинхронизированными. Например, у пациентов, страдающих свободно текущим циркадным ритмом, акрофазы мелатонина и кортизола в каждый из предыдущих дней имеют место более чем за 24 ч, например, >24,1 ч, до акрофазы мелатонина и кортизола соответственно в каждый из последующих дней, что приводит к десинхронизации в течение дней, недель или даже месяцев, в зависимости от длины циркадного ритма пациента, до того, как циклы мелатонина, кортизола и цикл день/ночь вновь достигнут синхронизации по времени.
Хроническое смещение цикла кортизола ассоциировано с метаболическими, сердечными, когнитивными, неврологическими, неопластическими и гормональными нарушениями. Указанные нарушения включают, например, ожирение, депрессию, неврологические ухудшения состояния.
В настоящем изобретении продемонстрировано, что подгонка циркадного ритма мелатонина связана с подгонкой циркадного ритма кортизола.
Таким образом, приведенным в качестве иллюстрации вариантом осуществления одного из объектов изобретения является способ подгонки (биологических часов) пациента, страдающего аномальным циркадным ритмом мелатонина или аномальным циркадным ритмом кортизола, к 24-часовому циркадному ритму путем введения внутрь пациенту в эффективном количестве агониста мелатонина, в частности, тазимелтеона или его активного метаболита.
В родственных объектах настоящего изобретения предложен способ предупреждения или лечения нарушений, ассоциированных с десинхронизированным циркадным ритмом мелатонина или кортизола, т.е. циркадным ритмом, который не синхронизирован с естественным циклом день/ночь. Указанный способ заключается в том, что вводят внутрь пациенту, который имеет десинхронизированный циркадный ритм мелатонина или кортизола, в эффективном количестве агонист мелатонина, в частности, тазимелтеон или его активный метаболит, указанный в настоящем описании.
Способ лечения синдрома «не-24» (который включает продвижение фазы и/или подгонку циркадного ритма мелатонина и/или кортизола) у пациента, страдающего указанным синдромом, путем введения внутрь в эффективном количестве тазимелтеона, как указано в настоящем описании, имеет тенденцию к более частому достижению эффективности для пациентов, которые имеют более высокие эндогенные уровни мелатонина. Другими словами, вероятность того, что лечение будет эффективным, связана с количеством мелатонина, присутствующим в естественных условиях в организме пациента.
Способ лечения синдрома «не-24» (который включает продвижение фазы и/или подгонку циркадного ритма мелатонина и/или кортизола) у пациента, страдающего указанным синдромом, путем введения внутрь в эффективном количестве тазимелтеона, как указано в настоящем описании, имеет тенденцию к более частому достижению эффективности для пациентов, у которых циркадный ритм до начала лечения (т.е. tau (величина, характеризующая длину цикла)) был ниже определенного порога. Указанный порог может составлять, например, 25,0 ч, 24,9 ч, 24,8 ч, 24,7 ч, 24,65 ч или 24,6 ч, при этом вероятность того, что лечение будет эффективным, выше в случае пациентов, у которых величина tau ниже указанного порога.
Согласно настоящему изобретению регулирующее агентство, пациент, поставщик медико-санитарной помощи или страховщик или любой один или несколько из указанных органов или персон может выбирать вероятность эффективности, которая является достаточной для поддержания решения о начале лечения агонистом мелатонина, в частности, тазимелтеоном. Например, может быть принято решение о том, что, если вероятность эффективности ниже, чем выбранное пороговое значение вероятности, то пациента не следует лечить агонистом мелатонина.
Альтернативно этому, указанное пороговое значение вероятности можно использовать в качестве фактора при определении того, следует ли применять повышенный стандарт мониторинга эффективности и/или нежелательных явлений. Например, может быть принято решение, что, если вероятность эффективности ниже выбранного порогового значения вероятности, то у пациента следует оценивать признаки эффективности и/или нежелательных явлений в течение примерно 6-9 недель после начала лечения. Указанный усиленный мониторинг может предусматривать также большую частоту мониторинга и/или пониженную терпимость к отсутствию выраженной эффективности или проявлению побочных действий. Например, если эффективность отсутствует или является недостаточной или, если имеются признаки нежелательных явлений, возможно даже лишь минорные или ранние признаки, то лечение агонистом мелатонина можно прерывать или модифицировать. Усиленный мониторинг может включать требование, чтобы пациент продолжал вести дневник сна, который может включать, например, регистрацию времени сна и бодрствования пациента, частоту и продолжительность состояний дремоты, латентность засыпания, продолжительность сна в ночное время и т.д., указанную регистрацию можно осуществлять, например, в письменной, цифровой форме или по телефону.
Для этих целей эффективность можно определять многочисленными путями, включая, например, путем определения пациентом величины tau после начала терапии и после завершения по меньшей мере одного полного циркадного цикла, в течение которого пациент подвергался лечению, например, от примерно 6 до примерно 9 недель после начала терапии, или путем оценки физического или эмоционального состояния пациента, например, путем осуществления физикального обследования пациента или путем опроса пациента в отношении картины сна, побочных действий, дремоты в дневное время, общего самочувствия и т.д.
Может быть принято решение о краткосрочном прекращении лечения, например, если, пациенту следует давать другую дозу агониста мелатонина или применять другой агонист мелатонина, обладающий фармакологической активностью, т.е., связывающийся с MT1R и MT2R и обладающий относительными величинами аффинности связывания и величиной t1/2, присущими тазимелтеону.
Указанное выше пороговое значение вероятности может коррелировать с пороговой концентрацией мелатонина в биологическом образце из организма пациента. Например, уровни мелатонина можно измерять непосредственно в образцах крови, плазмы, мочи, слюны и т.д., и можно устанавливать концентрацию мелатонина, которая соответствует выбранному пороговому значению вероятности. Концентрацию мелатонина, которая соответствует выбранному пороговому значению вероятности, можно обозначать как пороговая концентрация.
Уровни мелатонина, как правило, определяют (1) путем измерения количества основного метаболита мелатонина, т.е. 6-сульфатоксимелатонина (aMT6s), в моче, собираемой каждые 2-8 ч в течение 24-48-часового периода, (2) путем измерения уровней мелатонина в образцах слюны, собираемых каждые 30-60 мин при слабом освещении, или (3) путем измерения уровней мелатонина в часто отбираемых образцах крови, например, отбираемых каждые 20-30 мин. Указанные методы обобщены, например, у Benloucif и др., J Clin Sleep Med, 4(1), 2008, cc. 66-69.
В данной области известно и, следовательно, подпадает под объем настоящего изобретения применение любого косвенного параметра концентраций мелатонина или скоростей его производства при определении продолжительности ритма мелатонина, т.е. величины tau. Например, как конкретно указано в настоящем описании, можно применять количество aMT6s в качестве косвенного параметра, характеризующего количество мелатонина, и можно применять циркадный ритм кортизола или циркадный ритм aMT6s в качестве косвенного параметра циркадного ритма мелатонина, т.е. продолжительность циркадного ритма кортизола может представлять собой косвенный параметр, характеризующий циркадный ритм aMT6s, который может представлять собой косвенный параметр, характеризующий продолжительность циркадного ритма мелатонина (т.е. tau). В альтернативном или дополнительном варианте можно применять кортизол в качестве указанного косвенного параметра мелатонина.
В приведенном с целью иллюстрации варианте осуществления изобретения количество мелатонина оценивают опосредованно, например, измеряя количество косвенного параметра мелатонина, в частности, aMT6s, в образцах мочи, и, используя указанные количества для определения акрофазы и средних пиковых количеств или концентраций эндогенного aMT6s в крови.
В приведенном с целью иллюстрации варианте осуществления изобретения косвенным параметром для мелатонина является скорость производства aMT6s, определенная путем измерения aMT6s в образцах мочи. В этом случае пороговая концентрация должна фактически представлять собой скорость экскреции, выраженной, например, в таких единицах как нг/ч. Указанную скорость можно определять путем измерения концентрации aMT6s в аликвоте мочи (нг/мл) и умножения ее на объем/время (мл/ч) общего выхода мочи, из которого получали аликвоты, что более подробно будет описано ниже. Указанный косвенный параметр применяют в указанном приведенном с целью иллюстрации варианте осуществления изобретения только для удобства и его можно легко пересчитывать в виде концентрации aMT6s в моче и выражать, например, в единицах нг/мл или в виде абсолютного количества aMT6s в моче и выражать, например, в таких единицах как нг или мг. Указанные количества, вне зависимости от того, выражены ли они в виде скорости экскреции, концентрации или массы, можно превращать в аналогично выраженные количества мелатонина
Например, пациент, имеющий пиковую скорость производства aMT6s, т.е. скорость экскреции, 1500 нг/ч в моче, вероятно, является респондером на лечение тазимелтеоном. При этом пороговая концентрация может быть установлена на уровне 1500 нг/ч aMT6s. Альтернативно этому, пороговая концентрация может быть установлена на уровне 2000 нг/ч aMT6s в моче (например, в образцах мочи, собранных с 4-часовыми интервалами и в течение периода сна в ночное время), или может иметь любое приемлемое значение между ними, например, 1550, 1600, 1650, 1700, 1750, 1800, 1850, 1900 или 1950 нг/ч. Альтернативно этому, пороговая концентрация может быть установлена также на уровне, превышающем 2000 нг/ч aMT6s в моче, например, 2100, 2200, 2300, 2400 или 2500 нг/ч.
Пороговая концентрация 1500 нг/ч aMT6s свидетельствует с вероятностью, превышающей 50%, что данный пациент будет отвечать на лечение, т.е. ожидается, что более 50% популяции пациентов, имеющих пиковую концентрацию aMT6s в моче (или концентрацию мелатонина, эквивалентную ей, в другом биологическом образце), должны отвечать на лечение. Основываясь на описанных выше результатах исследования, ожидается, что более примерно 75% или даже более примерно 80% или 90% пациентов должны давать ответ на лечение, если они имеют пиковые скорости производства aMT6s в моче (или соответствующие концентрации мелатонина в биологическом образце), составляющие 1500 или 2000 нг/ч.
Если эндогенные уровни мелатонина применяют для прогнозирования вероятности ответа пациента, а не для определения tau, то не является необходимым определять скорость экскреции aMT6s в разные моменты времени или отбирать в отдельные моменты времени в течение всего дня. Так, например, количество мелатонина, определенное по количеству aMT6s в моче, можно измерять в моче, собранной и объединенной в одну партию, за период времени, составляющий 24 ч, или даже в течение более короткого периода времени. Так, в приведенном с целью иллюстрации варианте осуществления изобретения уровни мелатонина, оцененные по количеству aMT6s в моче, или непосредственно уровни мелатонина, например, в крови или слюне, можно измерять в определенный момент времени один раз или несколько раз в течение дня.
Возможность предсказывать вероятность ответа на лекарственное средство является очень важной для поставщиков (провайдеров) медико-санитарной помощи, например, лечащих врачей, и пациентов, а также для компенсации поставщиков медико-санитарной помощи, например, провайдерами лекарственного страхования рецептурного лекарственного средства. Так, согласно одному из вариантов осуществления изобретения перед началом лечения синдрома «не-24» с помощью агониста мелатонина, например, тазимелтеона, тестируют пациента с целью определения у него или нее эндогенных уровней мелатонина, в частности пиковой концентрации мелатонина. Указанное тестирование можно осуществлять, используя биологический образец, например, мочи, крови, плазмы или слюны, используя описанные выше методологии или любую другую методологию. Поскольку способ, предлагаемый в настоящем изобретении, позволяет определять вероятность ответа, то не требуется высокая точность метода определения пиковой концентрации мелатонина. Достаточно, если он позволяет проводить оценку с точностью, например, 20%, в таком случае, если пороговая концентрация установлена на уровне 2000 нг/ч aMT6s в моче, то пациента можно рассматривать в качестве вероятного респондера, если установлено, что у пациента пиковая экскреция aMT6s с мочой составляет 1600 нг/ч или выше. Может допускаться еще более низкая точность, например, в пределах 25% или 30%. Как и в случае определения tau, можно применять также и другие косвенные параметры для оценки эндогенных уровней мелатонина.
Еще один объект настоящего изобретения вытекает из того факта, что известны некоторые терапевтические агенты, которые снижают эндогенные уровни мелатонина. Наиболее известными из указанных агентов являются антагонисты бета-адренергического рецептора, обычно обозначаемые как «бета-блокаторы», которые, как правило, предписывают для лечения сердечной аритмии, инфаркта миокарда, застойной сердечной недостаточности и гипертензии. К бета-блокаторам относятся среди прочего, например, альпренолол, атенолол, карведилол, метопролол и пропанолол.
Таким образом, одним из объектов изобретения является классификация пациентов с синдромом «не-24», которые подвергаются лечению с помощью бета-блокаторов, в качестве слабых респондеров на терапию с использованием агониста мелатонина. В указанном приведенном с целью иллюстрации варианте осуществления изобретения у таких пациентов можно не определять пиковую концентрацию мелатонина, но вместо этого, их можно лечить таким же методом, который применим в том случае, когда концентрации мелатонина ниже пороговой концентрации. Другими факторами, которые могут оказывать вредное воздействие на эффективность, являются НСПВС и свет.
В родственном приведенном с целью иллюстрации варианте осуществления изобретения пациента с синдромом «не-24» можно подвергать процедуре определения концентрации мелатонина по той причине, что его/ее лечат бета-блокатором, для того, чтобы установить, приводит или не приводит терапия бета-блокатором к падению пикового уровня мелатонина у пациента ниже пороговой концентрации.
В родственных объектах настоящего изобретения уровни мелатонина в плазме или лечение бета-блокатором или оба эта показателя применяют в качестве эффективных предикторов в сочетании с другими маркерами эффективности или нежелательных явлений. Так, например, приведенный с целью иллюстрации вариант осуществления настоящего изобретения относится к лечению пациента, страдающего синдромом «не-24», тазимелтеоном, если у пациента пиковые уровни мелатонина соответствуют 1500 нг/ч (или 2000 нг/ч) aMT6s в моче, собранной в течение 4-часовых периодов или во время периода ночного сна, и, если пациент является позитивным по данным, полученным с помощью одного или нескольких дополнительных маркеров эффективности. Включение указанных дополнительного(ых) маркера или маркеров эффективности может повышать возможность поставщика медико-санитарной помощи оценивать вероятность того, что на пациента, страдающего не-24-часовым циркадным ритмом, окажет благоприятное действие лечение агонистом мелатонина, таким как тазимелтеон.
В родственных вариантах осуществления изобретения компьютерная система получает информацию о предписании тазимелтеона и обрабатывает для объединения указанной информацией с информацией об эндогенных уровнях мелатонина у пациента с выдачей отчета, в котором указана вероятность эффективности, или выдачей отчета, из которого следует, что показано применение более высокой или более низкой дозы тазимелтеона, например, <20 мг/день или >20 мг/день.
Пациентов можно диагностировать, как страдающих синдромом «не-24», путем оценки у каждого пациента периода циркадного ритма (tau). Пациенты, у которых величина tau превышает 24 ч, диагностируют как имеющих синдром «не-24». Так, в целом, пациенты с синдром «не-24», на которых может оказывать благоприятное действие лечение тазимелтеоном, имеют величину tau, которую можно определять путем анализа циркадного ритма aMT6s или кортизола, превышающую 24 ч, например, превышающую 24 ч примерно на 0,1 ч, в некоторых случаях по меньшей мере примерно на 0,2, 0,3, 0,4 ч, и даже превышающую 24 ч примерно на 1,4 ч. Как обсуждалось выше, циркадный ритм кортизола можно использовать вместо или в дополнение к ритму aMT6s, хотя расчеты циркадного ритма кортизола могут быть несколько менее точными в том смысле, что указанные данные, полученные на основе анализов популяции пациентов, могут отличаться большим стандартным отклонением.
Для мониторинга циклов мелатонина в кровотоке индивидуума удобно анализировать уровни основного метаболита мелатонина, представляющего собой 6-сульфатоксимелатонин (aMT6s), в моче, поскольку картина его производства хорошо коррелирует с уровнями мелатонина в кровотоке. Однако в настоящем изобретении подразумевается измерение уровней aMT6s в других полученных из организма образцах, таких как кровь, плазма или слюна, а также подразумевается непосредственное имерение мелатонина или других косвенных параметров для уровней мелатонина. В данной области известно наличие корреляции между уровнями тазимелтеона или метаболитов тазимелтеона в других полученных из организма образцах (т.е. отличных от aMT6s в моче) с уровнями мелатонина в кровотоке. Например, количество кортизола в крови или моче можно применять также как и aMT6s для определения tau.
Пригодным протоколом определения tau для соединений-кандидатов при их тестировании в клинических условиях в качестве агентов для лечения синдрома «не-24», который можно применять для диагностирования синдрома «не-24» у данного пациента, является следующий метод:
У каждого индивидуума следует осуществлять 4 серии сбора 48-часовой мочи в номинальные дни 7, 14, 21 и 28. В течение каждой серии следует фиксировать время начала серии и время каждого опорожнения. Мочу, со