Иммунорегуляторная вакцина
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана иммунорегуляторная вакцина, содержащая первую часть, содержащую по меньшей мере направленную против CD32 молекулу, соединенную с лигандом TLR9 и первой пептидной альфа-спиралью, и вторую часть с по меньшей мере одним эпитопом и второй пептидной альфа-спиралью, скрученной с первой альфа-спиралью, в результате чего образуется суперспираль, при этом указанные первая и вторая части связаны между собой посредством образования указанной суперспирали, причем указанные первая и вторая альфа-спирали представляют собой две различные спирали и при этом указанная суперспираль представляет собой гетероспираль, образованную указанными двумя различными спиралями. Также описан способ иммунотерапии для лечения аллергических заболеваний у пациента, включающий введение указанному пациенту эффективного количества вакцины, при этом в указанной вакцине указанная направленная против CD32 молекула направлена против CD32a и CD32b. Кроме того, описан набор для получения вакцины. Представлен способ лечения субъекта, с целью вызвать направленный против иммуногена транзиторный иммунный ответ IgG, предпочтительно с определенным максимальным титром IgG, индуцированным после вакцинации, с последующим снижением титра на по меньшей мере 30%, предпочтительно на по меньшей мере 40%, или на по меньшей мере 50%, или на по меньшей мере 60%, или на по меньшей мере 70%, или на по меньшей мере 80%, или на по меньшей мере 90% или до 100% в течение 6 месяцев после вакцинации, включающий введение указанному субъекту эффективного количества вакцины, содержащей иммуногенную композицию, содержащую первую часть, содержащую по меньшей мере направленную против CD32 молекулу, соединенную с лигандом TLR9, и иммуноген, который связан с указанной первой частью предпочтительно путем присоединения или аффинного связывания. 4 н. и 15 з.п. ф-лы, 12 ил., 3 табл., 18 пр.
Реферат
Настоящее изобретение относится к иммунорегуляторной вакцине, содержащей иммуноген и соединенный с ним направленный адъювант, благодаря чему указанная вакцина модулирует иммунный ответ на иммуноген. Настоящее изобретение дополнительно относится к вакцине, содержащей иммуногенную композицию, содержащую
направленный адъювант, содержащий по меньшей мере направленную против CD32 молекулу, соединенную с лигандом TLR9, и
иммуноген, который связан с указанным направленным адъювантом;
для применения при лечении субъекта с целью вызвать транзиторный иммунный ответ IgG, направленный на указанный иммуноген.
УРОВЕНЬ ТЕХНИКИ
При иммунологических заболеваниях, включающих аллергию, рак и аутоиммунные заболевания, ключевую роль играет регулирование иммунного равновесия, опосредуемое Th1/Th2/Th17/Treg клетками, и его применение для разработки новых вариантов иммунотерапии.
Для Th1 клеток (клеток Т-хелперов 1-го типа) характерно продуцирование провоспалительных цитокинов, таких как IFN-гамма, IL-2 и TNF-бета. Th1 клетки участвуют в клеточном иммунитете. Цитокины, продуцируемые Th1 клетками, стимулируют фагоцитоз и разрушение микробных патогенов. Было описано, что некоторые хронические воспалительные заболевания представляют собой заболевания с преобладающим влиянием Th1, например, рассеянный склероз, диабет и ревматоидный артрит.
Th2 клетки (клетки Т-хелперы 2-го типа) характеризуются продукцированием IL-4, IL-5, IL-9, IL-10 и IL-13. Полагают, что Th2 клетки играют роль в аллергических реакциях. Цитокины, подобные IL-4, как правило, стимулируют продуцирование антител. IL-5 стимулирует реакции эозинофилов, также являющиеся частью иммунного ответа. Атопию и аллергию считают состояниями с преобладающим влиянием Th2.
Нарушение равновесия между Th1/Th2 или Th17/Treg типами иммунитета становится причиной различных иммунопатологий.
Аллергию считают реакцией гиперчувствительности на белки в окружающей среде. Аллергены представляют собой антигены, на которые страдающие атопией пациенты отвечают образованием IgE антител, что впоследствии приводит к аллергическим реакциям. Антигены в комплексах или гибридных белках могут представлять собой аллергены окружающей среды (например, аллергены клеща домашней пыли, пыльцу березы, пыльцу трав, антигены кошек, антигены тараканов) или пищевые аллергены (например, коровье молоко, арахис, креветку, сою), или комбинацию обоих типов аллергенов. Молекулы IgE важны благодаря их роли в активации эффекторных клеток (тучных клеток, базофилов и эозинофилов). Исследователи сходятся во мнениях, что IgE также играет важную роль в индукционной фазе аллергических заболеваний за счет повышения способности захватывать антиген у В-клеток и дендритных клеток (ДК), как посредством низкоаффинных (CD23), так и посредством высокоаффинных (FcεRI) рецепторов. Негативным функциям IgE-антител могут противодействовать аллерген-специфические IgG-антитела, например, так как они перенаправляют иммунный ответ от В-клеток к моноцитам и ДК и способны подавлять опосредованную рецептором IgE активацию эффекторных клеток посредством перекрестной сшивки FcεRI с FcγRIIb (CD32b) на данных клетках. Кроме того, они конкурируют с молекулами IgE за сайты связывания аллергена. Аллергии, следовательно, можно лечить, излечивать и предупреждать путем индукции аллерген-специфичных молекул IgG, в особенности IgG1.
Период полувыведения молекул IgG из сыворотки составляет приблизительно 3 недели, по сравнению с приблизительно 3 днями для молекул IgE. Взаимодействие между (наивными) В-клетками и Th2 клетками индуцирует молекулы IgE, что вызывает экспрессию IL-4 и IL-13, вместе с экспрессией CD40L, что необходимо для переключения класса антител на IgE в В-клетках памяти и плазматических клетках. Наоборот, Th1 клетки, которые продуцируют IFN-гамма и IL-2, вызывают переключение класса антител на IgG. Таким образом, индукция клеточных ответов на аллергены с задействованием Th1 клеток вместо Th2 клеток полезна для профилактики, лечения и выздоровления при аллергических заболеваниях.
На сегодняшний день используют несколько форм активной вакцинации с применением аллергенов. Наиболее распространена так называемая "иммунотерапия", которая основана на частых иммунизациях относительно высокими концентрациями аллергенов. Данная методика обладает лишь средней степенью эффективности при незначительном числе аллергических заболеваний, таких как аллергия на пчелиный яд, и в некоторых случаях ринита и конъюнктивита, и недавно в некоторых публикациях показали ее эффективность при легких формах астмы и атопического дерматита. Совсем недавно с несколько лучшими результатами стали применять интенсивную иммунотерапию, при которой возрастающие количества аллергена вводили путем инъекции в довольно короткий промежуток времени. Обычно для введения аллергенов применяют подкожную инъекцию, но недавно данный путь введения сравнили с пероральным применением или даже местным применением, и полученные результаты, как правило, были положительными, но не всегда согласующимися. Иной методикой иммунотерапии является методика, описанная у Saint-Remy (ЕР 0178085 и ЕР 0287361), согласно которой применяют аутологичные IgG-антитела, которые in vitro объединены в комплекс с соответствующими аллергенами. Данная методика позволяет применять гораздо меньшие количества аллергена с меньшими побочными эффектами.
Механизм, лежащий в основе данных методик лечения, неясен. При классической терапии, по-видимому, благоприятного результата добиваются, если терапия вызывает повышение количества специфических IgG-антител, хотя не каждый раз достоверное повышение количества специфических IgG коррелирует с успешной иммунотерапией. Возможным аргументом в пользу того, почему это происходит, является относительно низкая аффинность IgG-антител к CD32 на В-клетках, моноцитах и тучных клетках. В подходе Saint-Remy производят отбор специфических lgG-антител у пациента, которые впоследствии смешивают с соответствующими аллергенами in vitro. Таким образом, в рамках указанной методики, аллерген не может свободно реагировать с клетками или другими изотипами антител на клетках, такими как IgE на тучных клетках. Дополнительно утверждается, что индуцируется образование антиидиотипических антител против специфических молекул IgG, при этом указанные антиидиотипические антитела будут предотвращать развитие аллергии в будущем.
В WO 97/07218 раскрыты гибридные белки, представляющие собой объединение аллергена и направленной против CD32 молекулы. В данной публикации устранили проблемы, связанные с выделением специфических молекул IgG и низкой аффинностью таких IgG-антител к CD32, а также уменьшили факторы риска классической иммунотерапии, в которой применяют полные "связывающие IgE" аллергены. Тем не менее, заявленная индукция Th-опосредованных анамнестических реакций исключительно благодаря нацеливанию вакцины, содержащей направленную против CD32 молекулу, на дендритные клетки не подтверждена доказательствами.
В WO 2007098934 A1 раскрыты молекулы, способные связываться с TLR9 и с CD32, содержащие по меньшей мере один эпитоп по меньшей мере одного антигена, и получение и применение таких молекул в качестве лекарственного средства, особенно для лечения аллергических реакций.
Иммунорегуляция может иметь эффект не только в случае аллергических заболеваний, но также при целом ряде других заболеваний.
Целью профилактической или терапевтической противоинфекционной иммунотерапии является усиление иммунного ответа на инфекционные агенты, такие как микробные патогены.
При иммунотерапиях опухоли целью является также применение специфических к опухолевым антигенам клеток Т-хелперов 1-го типа (Th1), дополнительно к цитотоксическим Т-лимфоцитам (CTL).
Рак, известный в медицине как злокачественное новообразование, представляет собой широкую группу различных заболеваний, вызванных неконтролируемым ростом клеток. При раке клетки неконтролируемо делятся и растут, образуя злокачественные опухоли, и проникают в близлежащие части организма. Рак также может распространяться в более удаленные части организма через лимфатическую систему или кровоток. Не все опухоли являются раковыми. Доброкачественные опухоли не растут неконтролируемо, не проникают в соседние ткани и не распространяются по всему организму. Существует более 200 различных известных видов рака, которые поражают людей.
Сложно определить, что именно вызывает рак. Известно множество факторов, повышающих риск возникновения рака, включая употребление табака, некоторые инфекции, радиацию, отсутствие физической активности, ожирение и вещества, загрязняющие окружающую среду. Такие факторы могут непосредственно повреждать гены или совместно с существующими внутри клеток генетическими нарушениями вызывать заболевание. Приблизительно от пяти до десяти процентов раков полностью наследуемые.
Рак можно диагностировать множеством способов, в том числе основываясь на присутствии некоторых признаков и симптомов, скрининговых тестах или медицинской визуализации. После обнаружения потенциального рака проводят его диагностику с помощью исследования под микроскопом образца ткани. Рак обычно лечат химиотерапией, радиационной терапией и хирургическим вмешательством. Шансы выжить при раковом заболевании сильно варьируют в зависимости от типа и местонахождения рака и стадии заболевания на момент начала лечения. Несмотря на то, что рак может поражать людей всех возрастов и некоторые типы рака чаще встречаются у детей, риск развития рака, как правило, повышается с возрастом. В 2007 г. приблизительно 13% всех человеческих смертей по всему миру (7,9 миллионов) были вызваны раком. И этот показатель растет по мере того, как все больше людей доживают до пожилого возраста, и происходит изменение образа жизни людей в развивающемся мире.
Поскольку иммунная система реагирует на факторы окружающей среды, с которыми она встречается, на основе распознавания своего и чужого, многие виды опухолевых клеток, которые возникают в результате появления рака, в большей или меньшей степени игнорируются собственной иммунной системой пациента, поскольку опухолевые клетки по существу являются собственными клетками пациента, которые растут, делятся и распространяются без надлежащего регуляторного контроля.
Иммунная толерантность или иммунологическая толерантность представляет собой процесс, в результате которого иммунная система не атакует антиген. При естественной толерантности или аутотолерантности в организме не индуцируется иммунный ответ на собственные антигены (аутоантигены). Выделены три формы указанного процесса: центральная толерантность, периферическая толерантность и приобретенная толерантность.
Центральная толерантность1:
Центральная толерантность возникает в процессе развития лимфоцитов и действует в тимусе и костном мозге. Там Т- и В-лимфоциты, которые распознают собственные антигены, удаляются до того, как указанные клетки разовьются в полностью иммунокомпетентные клетки, что предотвращает аутоиммунитет. Данный процесс наиболее активно происходит в эмбриональном периоде, но продолжается на протяжении всей жизни по мере образования незрелых лимфоцитов.
Периферическая толерантность2:
Периферическая толерантность представляет собой иммунологическую толерантность, которая развивается после того, как Т- и В-клетки созревают и выходят на периферию. Т-клетки, которые покидают тимус, относительно безопасны, хотя и не полностью. На некоторых из них будут присутствовать рецепторы (TCR), которые могут отвечать на собственные антигены, присутствующие в таких высоких концентрациях, что они могут связываться со "слабыми" рецепторами, с которыми Т-клетка не встречалась в тимусе (такими как тканеспецифические молекулы, подобные таковым в островках Лангерганса, головном мозге или спинном мозге). Такие аутореактивные Т-клетки, которые избегают негативной селекции в тимусе, могут вызвать повреждение клетки, если их не удалить или эффективно не инактивировать в периферической ткани. Известно, что существует несколько механизмов обратной связи для подавления таких потенциально аутореактивных Т-клеток. Они включают следующие механизмы: анергия, вызванная активацией гибель клеток, периферическая супрессия.
Приобретенная или индуцированная толерантность3:
Под приобретенной или индуцированной толерантностью понимают адаптацию иммунной системы к внешним антигенам, отличительным признаком которой служит специфическая нечувствительность лимфоидных тканей к данному антигену, который при других обстоятельствах вполне вероятно вызвал бы клеточный или гуморальный иммунитет. Одним из наиболее важных естественных видов приобретенной толерантности является иммунная толерантность при беременности, когда необходима толерантность материнской иммунной системы к зародышу и плаценте.
Иммунотерапия, нацеленная на опухолевые специфические антигены.
Иммунотерапия рака представляет собой использование иммунной системы для отторжения рака. Основной предпосылкой является стимуляция иммунной системы пациента для атаки злокачественных опухолевых клеток, которые вызвали данное заболевание. Это можно осуществить либо посредством активной иммунизации пациента (например, путем введения клеточной вакцины от рака, такой как Провендж, Dendreon, Сиэтл, Вашингтон, США)4, при которой собственная иммунная система пациента обучается распознавать опухолевые клетки как мишени для уничтожения, или посредством введения терапевтических антител как лекарственных средств, при этом иммунная система пациента привлекается к уничтожению опухолевых клеток с помощью терапевтических антител. Другим подходом к активации иммунной системы пациента против опухоли является применение так называемых опухолевых специфических антигенов (Tumor Associated Antigens; ТАА), которые представляют собой собственные белки, которые в некотором количестве экспрессируются здоровыми нормальными клетками, но сверхэкспрессируются опухолевыми клетками, или они включают гормоны/факторы роста клеток, в ответ на которые опухолевые клетки пролиферируют5. Данные ТАА включают в состав лекарственной формы и представляют организму в качестве иммуногена таким образом, что иммунная система выработает ответ, несмотря на тот факт, что данные белки являются собственными. Очевидно, что данный подход будет полезен лишь для ТАА, против которых данный пациент развил периферическую или приобретенную толерантность. Если Т- и В-клетки, распознающие ТАА, были удалены из иммунологического репертуара, активная иммунотерапия рака не представляется возможной.
Гастрин.
Примером аутоантигена (гормона/фактора роста), который можно применять в качестве мишени для лечения таких видов рака желудочно-кишечного тракта, как рак поджелудочной железы, является малый гастрин (G17)6-9. Кроме того, нейтрализация G17 также может оказаться полезной при любом связанном с гастрином болезненном состоянии, включая язвы желудка, гастроэзофагеальную рефлюксную болезнь (ГЭРБ)10, поскольку pH желудка регулируется гастрином, и терминальную стадию почечной недостаточности (ТСПН)11, поскольку концентрации гастрина в кровотоке у пациентов с ТСПН выше, чем в норме.
В US 5023077 раскрыты иммуногенные композиции и способы лечения и предупреждения язвенной болезни желудка и двенадцатиперстной кишки, данные иммуногенные композиции составлены на основе пептидов гастрина, которые соединены с иммуногенным носителем, таким как дифтерийный анатоксин, столбнячный анатоксин, гемоцианин лимфы улитки или бычий сывороточный альбумин.
Гастрин выполняет несколько важных функций в желудочно-кишечном тракте, две наиболее важные из которых представляют собой стимуляцию секреции кислоты и стимуляцию роста клеток в желудочно-кишечном тракте. Данный гормон существует, по меньшей мере, в двух молекулярных формах: в форме гептадекагастрина, так называемого малого гастрина ("G17"), и в форме тетратриаконтагастрина ("G34"), - названных в соответствии с количеством аминокислотных остатков ("АА") в каждой молекуле, при этом G17 состоит из 17 аминоконцевых ("N-концевых") остатков G34.
В US 5609870 раскрыт способ получения иммуногена против G17, который вызывает образование антител у млекопитающего против собственного G17, которые не реагируют с G34. Указанный способ включает конъюгацию пептида, который состоит из последовательности, соответствующей фрагменту N-концевой последовательности аминокислот G17 до аминокислотного остатка номер 12 по С-концу со спейсерным пептидом, который конъюгирован с иммуногенным носителем, таким как дифтерийный анатоксин, столбнячный анатоксин, гемоцианин лимфы улитки и бычий сывороточный альбумин.
Иммунное равновесие.
Иммунное равновесие, которое регулируется Th1/Th2/Th17/Treg клетками, играет важную роль в разработке иммунологических способов лечения.
При аутоиммунных заболеваниях, т.е. при состояниях, при которых иммунная система атакует собственную ткань, существует потребность в регуляции нарушенного равновесия Th1/Th2/Th17/Treg.
Роль TLR9.
Toll-подобные рецепторы (TLR) представляют собой класс белков, которые играют ключевую роль в системе врожденного иммунитета. Они представляют собой некаталитические рецепторы, один раз пронизывающие мембрану, обычно экспрессируемые на поверхности клетки и в эндоцитозном компартменте «сторожевых» клеток, таких как макрофаги и дендритные клетки. TLR распознают патоген-ассоциированные молекулярные паттерны (ПАМП), структурно консервативные молекулы микробов, и запускают передачу сигналов, которые вызывают продукцию цитокинов, необходимых для врожденного иммунитета и, впоследствии, приобретенного иммунитета.
Различные TLR проявляют различные рисунки экспрессии. Данный ген преимущественно экспрессируется в богатых иммунными клетками тканях, например, в селезенке, лимфатическом узле, костном мозге и лейкоцитах периферической крови.
У людей и мышей в совокупности было обнаружено тринадцать TLR (названных просто TLR1-TLR13), и эквивалентные формы многих из них были обнаружены у других видов млекопитающих. Тем не менее, не каждый рецептор TLR, обнаруженный у мышей, также обнаруживают у людей, или наоборот. Кроме того, не для каждого рецептора TLR известен лиганд и функция, например, TLR10 представляет собой «сиротский» рецептор с неизвестной функцией.
Активацию рецепторов TLR применяют для лечения различных заболеваний, например, было показано, что активация TLR9 фармацевтическими композициями полезна для лечения аллергии и онкологии. Исследования у мышей и человека свидетельствуют о том, что природные лиганды TLR9 представляют собой неметилированные последовательности CpG в молекулах ДНК. Сайты CpG относительно редко встречаются (~1%) в геномах позвоночных по сравнению с геномами бактерий или вирусной ДНК. TLR9 экспрессируется множеством клеток иммунной системы, таких как дендритные клетки, В-лимфоциты, моноциты и натуральные клетки-киллеры (NK). Тем не менее, у здоровых людей экспрессия TLR9 ограничена плазмацитоидными дендритными клетками (пДК) и В-клетками. Его экспрессия происходит в эндосомальных компартментах внутри клетки и его функция состоит в том, чтобы предупредить иммунную систему о вирусных и бактериальных инфекциях путем связывания с ДНК, богатой мотивами CpG. Тем не менее, при патологических состояниях экспрессию TLR9 наблюдали также на поверхности клеток12-14.
Было описано множество различных синтетических молекул агонистов TLR9. Агонистические лиганды (активирующие TLR9) классифицировали на три группы.
Первая группа состоит из CpG класса А, в частности, из олигодезоксинуклеотидов (ОДН) CpG-A (D)15, также известных как ОДН "D''-типа. Такие агонисты TLR9 вызывают сильную индукцию IFN-альфа и минимальное созревание дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 1". Пример представляет собой ОДН221616: GGGGGACGATCGTCGGGGGG (SEQ ID NO: 48).
Вторая группа состоит из CpG класса В, в частности, из олигодезоксинуклеотидов (ОДН) CpG-B (K)17, также известных как ОДН "K"-типа. Такие агонисты TLR9 вызывают слабую индукцию IFN-альфа и созревание дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 2". Пример представляет собой ОДН200618;19: TCGTCGTTTTGTCGTTTTGTCGTT (SEQ ID NO: 49).
Третья группа состоит из CpG класса С, также известных как олигодезоксинуклеотиды (ОДН) CpG-C20. Такие агонисты TLR9 индуцируют IFN-альфа и созревание незрелых дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 3". Пример представляет собой ОДНМ36221: TCGTCGTCGTTCGAACGACGTTGAT (SEQ ID NO: 69).
Все описанные на сегодняшний день лиганды TLR9 имеют в основе нуклеотиды. Хотя антитела, специфичные к TLR9, были описаны и применялись, чтобы продемонстрировать присутствие и местонахождение рецептора, данные молекулы не были описаны в качестве лигандов TLR9, не было сообщений о какой-либо их активирующей или ингибирующей TLR9 активности.
Роль CD32.
CD32 экспрессируется на высоком уровне моноцитами/дендритными клетками и В-клетками и, следовательно, такие молекулы разрабатывают таким образом, чтобы они направляли иммунный ответ на данные важные иммунные клетки с целью предотвратить презентацию антигена В-клетками, при этом способствуя презентации антигена, главным образом, дендритными клетками (ДК), что при достаточной стимуляции приводит к индукции ТМ-ответов на антиген. Существует по меньшей мере два типа ДК: миелоидные дендритные клетки (мДК) и плазмацитоидные дендритные клетки (пДК), описание этих двух типов привело к формированию новой концепции ДК1 и ДК2 клеток. В данной концепции клетки ДК1 способствуют индукции развития Th1 клеток после антиген-специфической стимуляции, а клетки ДК2 поддерживают развитие Th2 клеток. ДК моноцитарного происхождения (или мДК), как правило, считают типом ДК1, тогда как пДК считают типом ДК2. Оба типа ДК экспрессируют CD32a и будут вызывать антиген-специфический ответ Т-клеток; тем не менее, нет гарантии, что в результате разовьется ответ Th1. В действительности, у страдающих аллергией доноров Th2-ответы более вероятны. Важно отметить, что пДК экспрессируют рецептор TLR9, который связывает CpG-ОДН (олигодезоксинуклеотиды (ОДН), содержащие неметилированные мотивы CpG). Активация данного рецептора в пДК приводит к очень высокой продукции IFN-альфа и IL-12, которые вызывают индукцию Th1 и, таким образом, превращают потенциальные клетки ДК2 в ДК1.
Таким образом, такие молекулы могут совмещать способность активаций рецептора TLR9 у пДК со специфической стимуляцией и индукцией антиген-специфических Th1 клеток.
При иммунотерапиях опухоли конкретной целью является применение специфических к опухолевым антигенам Т-хелперов 1-го типа (Th1) дополнительно к цитотоксическим Т-лимфоцитам (CTL).
Суперспирали.
Суперспирали состоят из структурных мотивов в белках, в которых 2-7 альфа-спиралей скручены вместе, как нити в веревке; наиболее распространенными типами являются димеры и тримеры. Суперскрученные спирали применяют для стабилизации Fv-фрагментов антител, что приводит к получению гетеродимерных суперспиральных доменов22.
Стабильность и свернутая структура сложных белковых молекул является решающей при разработке иммуногенов. Таким образом, цель настоящего изобретения состоит в получении вакцины с улучшенной стабильностью и структурой, для регуляции иммунного ответа на определенные иммуногены.
Дополнительно существует потребность в улучшенных способах иммунотерапии, нацеленной на гастрин и зависимые от гастрина болезненные состояния. Таким образом, цель настоящего изобретения состоит в получении вакцины с улучшенной иммуногенностью, стабильностью и структурой, для регуляции иммунного ответа на определенные эпитопы гастрина.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Указанная цель достигается заявленным объектом изобретения.
Согласно настоящему изобретению предложена иммунорегуляторная вакцина, содержащая
- направленный адъювант, содержащий по меньшей мере направленную против CD32 молекулу, соединенную с лигандом TLR9 и первой пептидной альфа-спиралью, и
- иммуноген, который имеет по меньшей мере один эпитоп и вторую пептидную альфа-спираль, скрученную с указанной первой альфа-спиралью.
В частности, указанный эпитоп представляет собой Т-клеточный и/или В-клеточный эпитоп.
Согласно конкретному аспекту настоящего изобретения каждая из указанных первой и второй альфа-спиралей содержит повторы аминокислотного мотива из 3-5 аминокислот, специфично связывающиеся друг с другом с Kd, меньшей чем 10-6 М, предпочтительно с Kd, меньшей чем 10-7 М, более предпочтительно, меньшей чем 10-8 М или 10-9 М.
Согласно дополнительному конкретному аспекту настоящего изобретения указанная направленная против CD32 молекула выбрана из группы, состоящей из антитела к CD32, фрагмента антитела и пептида, предпочтительно нацеленного на CD32a. Указанный фрагмент антитела, в частности, может представлять собой, например, фрагмент Fab, Fv, scFv, dAb, F(ab)2 или Fcab, или любую другую возможную связывающую единицу при условии, что она специфично связывается с рецептором и интернализуется после связывания.
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9 представляет собой агонист TLR9, выбранный из группы, состоящей из CpG класса А, в частности, из олигодезоксинуклеотидов (ОДН) CpG-A (D)23, также известных как ОДН "D"-типа. Такие агонисты TLR9 вызывают сильную индукцию IFN-альфа и минимальное созревание дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 1".
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9 представляет собой агонист TLR9, выбранный из группы, состоящей из CpG класса В, в частности, из олигодезоксинуклеотидов (ОДН) CpG-B (K)24, также известных как ОДН "K"-типа. Такие агонисты TLR9 вызывают слабую индукцию IFN-альфа и созревание дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 2".
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9, в частности, представляет собой агонист TLR9, выбранный из группы, состоящей из CpG класса С, также известных как олигодезоксинуклеотиды (ОДН) CpG-C25;26. Такие агонисты TLR9 индуцируют IFN-альфа и созревание незрелых дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 3".
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9, в частности, представляет собой иммуностимулирующий пептид, имитирующий любой из олигодезоксинуклеотидов CpG класса А, В или С, т.е. пептид, специфично связывающийся с TLR9, с активирующей, агонистической функцией.
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9 представляет собой антагонист TLR9, выбранный из группы, состоящей из ингибиторных олигодезоксинуклеотидов (ОДН)27;28 (иногда называемых ингибиторными CPG), например, из тех, которые содержат ингибиторный мотив, состоящий из CCx(не-C)(не-C)xxGGG (х - любое основание)29. Доказали, что определенные ингибиторные ОДН не индуцируют IFN-альфа и не индуцируют созревание дендритных клеток, также блокируя активацию посредством агониста TLR9.
Такого агониста или антагониста TLR9 можно определить с помощью подходящего анализа, основанного на клеточной системе, в котором измеряют стабильную экспрессию любого из IFN-альфа или по меньшей мере одного из маркеров CD80, CD83 и CD86, которые отражают созревание незрелых дендритных клеток (ДК). Для этой цели плазмацитоидные дендритные клетки (пДК) выделяют из крови здорового донора, как описано у Tel и др.30, и впоследствии инкубируют с подходящими концентрациями лиганда TLR9. Через 24 ч измеряют количество IFN-альфа в супернатанте, применяя стандартные протоколы твердофазного иммуноферментного анализа (ELISA). Для определения статуса созревания клеток, пДК окрашивают доступными для приобретения специфичными антителами до и после инкубации с лигандом TLR9, чтобы выявить экспрессию CD80, CD83 или CD86, применяя стандартные процедуры сортировки клеток с возбуждением флуоресценции (FACS).
Индукцию IFN-альфа можно определить по уровню экспрессии IFN-альфа и соответствующему его увеличению по сравнению с эталонным уровнем. Такое увеличение по сравнению с нестимулированными клетками можно сравнить с уровнями, индуцированными установленными эталонами для каждого типа CpG, который определяют по группе 1, 2 или 3 лигандов TLR9, и обычно оно составляет от 30% до 300% от соответствующего эталонного уровня, предпочтительно, по меньшей мере 100%, более предпочтительно по меньшей мере 120%, по меньшей мере 150%, по меньшей мере 200% или по меньшей мере 250%.
Созревание незрелых дендритных клеток можно определить по уровню экспрессии любого из маркеров CD80, CD83 и CD86. Соответствующее увеличение по сравнению с нестимулированными клетками можно сравнить с уровнями, индуцированными установленными эталонами для каждого типа CpG, который определяют по группе 1, 2 или 3 лиганда TLR9, и обычно оно составляет от 30% до 300% от соответствующего эталонного уровня, предпочтительно по меньшей мере 100%, более предпочтительно по меньшей мере 120%, по меньшей мере 150%, по меньшей мере 200% или по меньшей мере 250%.
В частности, агонист TLR9 из группы 1 и 3 будет приводить к повышенной экспрессии IFN-альфа и агонист TRL9 из группы 2 и 3 будет приводить к повышенной экспрессии любого из факторов созревания ДК CD80, CD83 и CD86. Антагонист TLR9 будет приводить к пониженной экспрессии IFN-альфа и к пониженной экспрессии любого из факторов созревания ДК CD80, CD83 и CD86, даже в присутствии агониста TLR9 из любой группы 1-3.
Согласно конкретному варианту реализации настоящего изобретения указанный иммуноген получен из любого из следующего:
- опухолевого специфичного антигена, для применения при иммунотерапии раковых заболеваний, или
- патогена, для применения при иммунотерапии инфекционных заболеваний, или
- аллергена, для применения при иммунотерапии аллергических заболеваний.
Такая вакцина обычно представляет собой иммуностимулирующую вакцину, например, стимулирующую гуморальный и Т-клеточный (Th1) иммунный ответ.
В данном варианте реализации иммуностимулирующей вакцины, в частности, используется лиганд TLR9, который представляет собой агонист TLR9. В данном случае указанная вакцина преимущественно индуцирует Th1-ответы против иммуногена.
В частности, указанная молекула, направленная против CD32, нацелена на CD32a, предпочтительно с высокой аффинностью с Kd≤10-6 М, более предпочтительно, меньшей чем 10-7 М или меньшей чем 10-8 М.
В частности, указанная молекула, направленная против CD32, специфично или избирательно связывает CD32a, т.е. не связывает CD32b или связывает CD32b с низкой аффинностью с Kd>10-6 М, предпочтительно выше, чем 10-5 М, более предпочтительно выше, чем 10-4 М. Различие в аффинности связывания с CD32a и CD32b предпочтительно составляет по меньшей мере 10 раз, более предпочтительно по меньшей мере 20 раз или по меньшей мере 30 раз, или различие значений Kd еще выше.
Особенно предпочтительна высокая аффинность или высокая разница в аффинности связывания CD32a вместо CD32b у молекулы, направленной против CD32, обычно применяемой в иммуностимулирующей вакцине, дополнительно использующей агонист TLR9. Дополнительно предпочтительным является применение в такой вакцине иммуногена, выбранного из целого ряда онкологических мишеней или патогенных мишеней, когда Thl-ответ и специфические IgG-антитела необходимы для эффективной борьбы с заболеваниями.
Согласно альтернативному варианту реализации указанная молекула, направленная против CD32, нацелена на оба маркера CD32a и CD32b, с высокой аффинностью с Kd≤10-6 М, предпочтительно с более высокой аффинностью, чем 10-7 М, более предпочтительно с более высокой аффинностью, чем 10-8 М. Особенно предпочтительную высокую аффинность связывания обоих CD32a и CD32b молекулой, направленной против CD32, обычно используют в вакцине, дополнительно содержащей агонист TLR9. Дополнительно предпочтительным является применение в такой вакцине иммуногена, выбранного из целого ряда аллергических мишеней, когда осуществляют переключение Th2-ответа на Th1-ответ.Обычно, предпочтительно отсутствие выработки антител против самой вакцины. Кроме того, предпочтительна определенная вакцина, которая связывается с CD32b приблизительно с такой же аффинностью, как и с CD32a.
Аффинность связывания молекулы, направленной против CD32, специфично нацеленной на любой из CD32a или CD32b, или сразу на оба CD32a и CD32b, можно определить с помощью подходящего анализа, такого как обычный ELISA, применяя доступные для приобретения меченые гистидиновой (HIS) меткой рекомбинантные формы CD32a и CD32b, которыми покрывают планшеты с Ni-NTA для ELISA, например, планшеты Ni-NTA HisSorb (Qiagen, Австрия). Молекулы, направленные против CD32, можно биотинилировать и после этого обнаружить, применяя стрептавидин-HRP (стрептавидин, конъюгированный с пероксидазой хрена) или стрептавидин-АР (стрептавидин, конъюгированный со щелочной фосфатазой) и подходящие субстраты. В качестве альтернативы указанные молекулы можно исследовать с помощью FACS анализа, применяя клетки U937 (например, номер в Американской коллекции типовых культур (АТСС): CRL 1593), экспрессирующие CD32a, но не CD32b, и трансформированные вирусом Эпштейна-Барр (EBV) В-клетки, например, CFB4:2, как описано у van Reijsen и др.31, экспрессирующие CD32b, но не CD32a.
Согласно дополнительному варианту реализации настоящего изобретения, указанный иммуноген получают из любого из следующего:
- аллергена, для применения при иммунотерапии аллергических заболеваний, или
- аутоантигена человека, для применения при иммунотерапии аутоиммунных заболеваний.
Такая вакцина для применения при аутоиммунном заболевании обычно представляет собой вакцину, вызывающую иммунотолерантность, например, вызывающую Т-клеточную толерантность к иммуногену регуляторных Т-клеток и снижающую гуморальный иммунный ответ.
В данном варианте реализации, относящемся к иммунотолерантности, в частности, применяют лиганд TLR9, который представляет собой агонист TLR9 из группы 1 или представляет собой антагонист TLR9. В данном случае указанная вакцина будет преимущественно снижать ответы Th1/2/17 клеток на иммуноген, но активировать клетки Treg.
Такая вакцина для применения при аллергии может представлять собой либо:
- вакцину, вызывающую иммунотолерантность, например, индуцирующую Т-клеточную толерантность к иммуногену регуляторных Т-клеток и снижающую гуморальный иммунный ответ, задействуя лиганд TLR9, который представляет собой агонист TLR9 из группы 1 или представляет собой антагонист TLR9. В данном случае указанная вакцина будет преимущественно снижать ответы Th1/2/17 клеток на иммуноген, но активировать клетки Treg;
либо
- иммуностимулирующую вакцину, индуцирующую Th1-ответы на иммуноген, при этом предотвращающую гуморальный иммунный ответ на вакцину, задействуя лиганд TLR9, который представляет собой агонист TLR9 из группы 3.
Согласно данному варианту реализации вакцины, вызывающей иммунотолерантность, указанная молекула, направленная против CD32, специфично нацелена на любой из CD32a или CD32b, или сразу на оба CD32a и CD32b с высокой аффинностью с Kd≤10-6 М, предпочтительно с более высокой аффинностью с Kd≤10-7 М, более предпочтительно с Kd≤10-8 М. Предпочтительно, чтобы молекула, направленная против CD32, была специфично нацелена на оба CD32a и CD32b.
Также для иммуностимулирующей вакцины для применения при аллергии указанная молекула, направленная против CD32, специфично нацелена на CD32a и CD32b с высокой аффинностью с Kd≤10-6 М, предпочтительно с более высокой аффинностью, например, с Kd≤10-7 М, более предпочтительно с Kd≤10-8 М. Предпочтительно, чтобы молекула, направленная против CD32, была специфично нацелена на оба CD32a и CD32b.
В частности, согласно настоящему изобретению предложена вакцина для применения для иммунотерапии аллергических заболеваний, в которой указанный иммуноген получен из аллергена и в которой указанная молекула, направленная против CD32, нацелена на CD32a и CD32b.
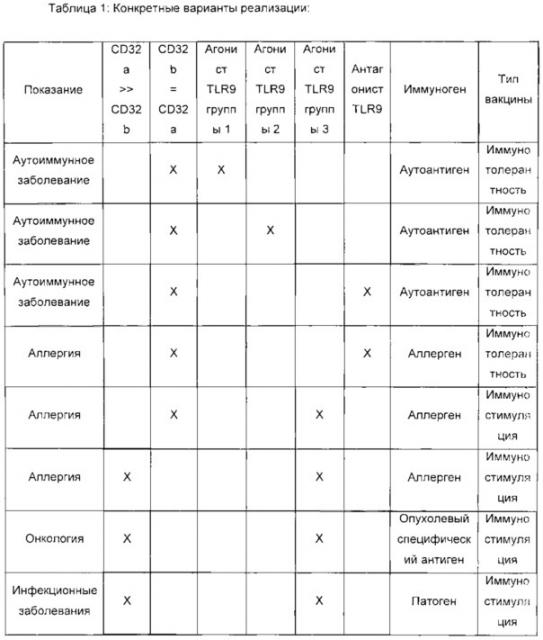
Конкретные варианты реализации настоящего изобретения можно представить в следующей таблице, в которой описан выбор молекулы, направленной против CD32, в соответствии с ее специфичностью и аффинностью связывания с CD32a и/или CD32b, типом лиганда TLR9 и типом иммуногена.