Способ получения микропобегов растений семейства betulaceae
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Изобретение представляет собой способ, включающий индукцию микропобегов непосредственно из апикальной недифференцированной ткани вегетативных почек экспланта на агаризованной среде, содержащей минеральную основу по Мурасиге-Скуга и дополнительно включающей 0,25-2,0 мг/л БАП, 20-30 г/л сахарозы, 6 г/л агара. Элонгацию и мультипликацию полученных микропобегов проводят с использованием жидкой питательной среды того же состава (за исключением агара) путем одновременного бессистемного размещения необходимого количества микропобегов в сосуде на поверхности перфорированной площадки, закрепленной выше уровня жидкой питательной среды. Затем в автоматическом режиме осуществляют циклическое чередование процессов экспозиции микропобегов в воздушной среде влажностью 80-90% и погружения их в жидкую питательную среду на 1-4 минуты 2-4 раза в сутки путем подъема ее уровня. При этом дополнительно проводят аэрацию воздуха внутри сосуда по 2-6 минут через равные промежутки времени от 10 до 16 раз в сутки в течение 16-часового фотопериода. Изобретение позволяет повысить количество микропобегов в одном сосуде более чем в 60 раз в течение 3-4 недель и увеличить в 5 раз общее их количество за год, снизить в 7 раз проявления хлороза, увеличить в 2,2 раза число боковых пазушных побегов. Получить до 90% жизнеспособных микропобегов. 3 табл.
Реферат
Изобретение относится к биотехнологии и воспроизводству лесных древесных растений на искусственных питательных средах в стерильных условиях in vitro и может быть использовано в лесном хозяйстве для массового получения посадочного материала экономически ценных и декоративных форм древесных растений сем. Betulaceae.
Известен способ клонального микроразмножения гибридов карельской березы, по которому в качестве исходных эксплантов используют верхушечные и пазушные почки. Рост каллуса и формирование микропобегов проводят на основной агаризованной питательной среде Мурасиге-Скуга, содержащей в качестве фитогормонов 80-120 мг/л лизина, 0,05-0,15 мг/л кинетина, 0,6-1,0 мг/л 6-бензиламинопурина (БАП) и 0,05-0,08 мг/л α-нафтилуксусной кислоты (НУК). В последующем удлинение побегов осуществляют на агаризованной питательной среде с уменьшенной вдвое концентрацией макросолей по Мурасиге-Скуга и с добавлением 0,6-1,0 мг/л БАП и 0,3-0,5 мг/л индолилуксусной кислоты (ИУК) (авторское свидетельство СССР №1752284, МПК А01Н 4/00, опубл. 07.08.1992 г.).
Однако в указанном способе индукцию микропобегов осуществляют из каллуса, что, с одной стороны, повышает коэффициент размножения, а с другой при прохождении клетками стадии дедифференцировки в условиях in vitro не исключает процесс их полиплоидизации и анеуплоидизации. Все это приводит к сомаклональной изменчивости, в результате чего увеличивается вероятность получения генетически измененного клонового потомства. Для получения каллусной ткани используют дорогостоящие реактивы, например фитогормоны (лизин, НУК, ИУК, БАП, кинетин), при этом само присутствие этапа каллусообразования удлиняет процесс в целом. Использование большого количества стеклянных сосудов малого объема повышает трудозатраты и требует увеличения площади стеллажей. Поэтому полный цикл получения микропобегов является трудоемким, дорогостоящим и продолжительным.
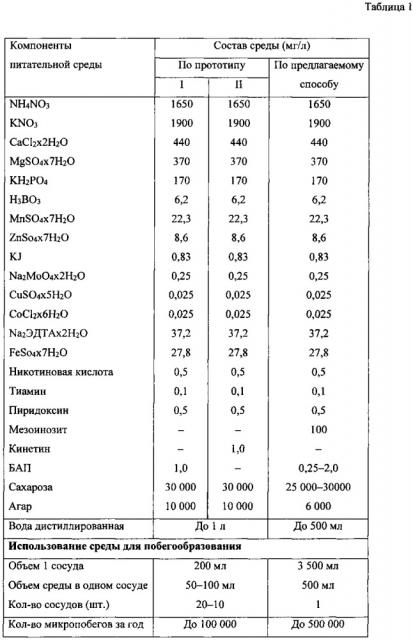
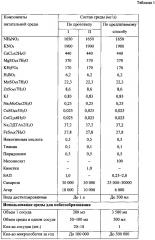
Наиболее близким заявленному является способ получения растительного материала для размножения растений, по которому размножение осуществляют путем высадки стерильных черенков побегов растений в сосуд с агаризованной питательной средой, содержащей в качестве регулятора роста цитокинин или кинетин (таблица 1). После этого сосуд заливают жидкой питательной средой того же состава до полного погружения черенков и культивируют при 16-часовом фотопериоде при освещенности 10000 лк до появления боковых побегов. Твердая питательная среда обеспечивает побегам вертикальное положение (Патент SU 1590029, МПК A3 А01Н 3/00, опубл. 30.08.1990 г.).
Данный способ разработан для травянистых многолетних растений, имеющих высокую скорость роста, которую сложно соотнести с довольно низкой скоростью роста древесных растений. Способ не обеспечивает микропобегам оптимальные условия на этапе побегообразования, поскольку при длительном нахождении в жидкой среде они могут испытывать затяжную гипоксию (недостаток кислорода), вследствие которой возможно угнетение процессов фотосинтеза и формирования боковых пазушных побегов. Кроме того, как указывают сами авторы, у самых сильных побегов, находящихся выше уровня поверхности жидкой среды, т.е. в воздушной среде, листовых почек в пазухах листа образовывалось мало или вовсе не образовывалось. Недостатком способа является использование высокой концентрации агара (10000 мг/л), приводящей к его удорожанию. Применение комбинированной по консистенции питательной среды (агаризованной полутвердой одновременно с жидкой) усложняет сам процесс приготовления, увеличивает его продолжительность и трудозатраты, предусматривает использование дорогостоящих реактивов и снижает уровень асептики культивируемой ткани. Трудозатраты также повышаются из-за повторного культивирования черенков, полученных из средней и нижней частей побегов и использования для разлива питательной среды индивидуальных стеклянных колб небольшого объема (200 мл), для установки которых, кроме того, требуются дополнительные площади. Поэтому полный цикл получения микропобегов является трудоемким, дорогостоящим, длительным и, кроме того, не обеспечивающим необходимого их качества.
Задачей настоящего изобретения является разработка экономичного способа клонального микроразмножения растений семейства Betulaceae, позволяющего получать одновременно большое количество высококачественных микропобегов in vitro, сохраняющих уникальные признаки исходных генотипов, и способствующего ускоренному выращиванию посадочного материала экономически ценных и декоративных трудноразмножаемых древесных растений.
Техническим результатом изобретения является повышение эффективности способа за счет стимуляции формирования множественного числа боковых пазушных побегов (de novo) при одновременном развитии на каждом из них нескольких микропобегов (от 2 до 10 шт.) in vitro и усиления скорости их роста (длины), увеличения фотосинтетической деятельности формирующихся листьев, а также повышение жизнеспособности микропобегов, удешевление и снижение трудозатрат процесса получения микропобегов в культуре тканей, соответствующих исходному фенотипу.
Заявленный технический результат достигается тем, что в способе получения микропобегов растений сем. Betulaceae, включающем индукцию микропобегов на агаризованной питательной среде Мурасиге-Скуга in vitro, последующую их элонгацию и мультипликацию, согласно изобретению, индукцию микропобегов осуществляют непосредственно из апикальной недифференцированной ткани вегетативных почек экспланта, а элонгацию и мультипликацию полученных микропобегов проводят путем одновременного в одном сосуде необходимого количества микропобегов на поверхности перфорированной площадки, закрепленной выше уровня жидкой питательной среды, содержащей минеральную основу по Мурасиге-Скуга, дополнительно включающей 0,25-2,0 мг/л БАП, 20000-30000 мг/л сахарозы, и осуществляют в автоматическом режиме циклическое чередование процессов экспозиции микропобегов в воздушной среде влажностью 80-90% и погружения их в жидкую питательную среду на 1-4 минуты 2-4 раза в сутки путем подъема ее уровня, с дополнительной аэрацией воздуха внутри сосуда по 2-6 минут через равные промежутки времени от 10 до 16 раз в сутки в течение 16-часового фотопериода.
Предлагаемый способ получения микропобегов растений сем. Betulaceae реализуется следующим образом.
Берут верхушечные и боковые вегетативные почки у растений сем. Betulaceae с ауксибластов (молодые побеги текущего года), достигших длины от 1 до 3 см, стерилизуют с помощью антисептических и дезинфицирующих средств. Использование ауксибластов для получения эксплантов значительно упрощает процесс стерилизации, поскольку они, как правило, менее заражены разными видами микрофлоры. В стерильных условиях из них вычленяют апикальную недифференцированную ткань и размещают в небольших стеклянных сосудах, объемом 125 мл, на агаризованной питательной среде (по 15 мл в один сосуд), содержащей минеральную основу по Мурасиге-Скуга, куда дополнительно вносят 0,25-2,0 мг/л БАП, 25000-30000 мг/л сахарозы, 6000 мг/л агара (таблица 1). На этой среде в течение 2-3 недель индуцируют пазушные побеги. Использование минимального набора фитогормонов (только БАП) в питательной среде в процессе побегообразования является не только экономически выгодным, но также препятствует формированию каллуса и способствует сохранению гарантированных признаков исходного генотипа. Затем осуществляют процесс элонгации и мультипликации путем черенкования полученных микропобегов на сегменты с размещением их в стерильном сосуде, объемом 3,5 л, содержащем 0,5 л жидкой питательной среды того же состава, за исключением агара, для последующей индукции на них микропобегов de novo (таблица 1). Микропобеги в сосуде размещают свободно на поверхности перфорированной площадки, которая закреплена выше уровня жидкой питательной среды. Размещение микропобегов без их индивидуальной фиксации в общем сосуде значительно сокращает временные затраты и экономит площади рабочей поверхности, предназначенной для культивирования. Мультипликацию микропобегов повторяют в зависимости от потребностей в их количестве. Исключение агара из среды на побегообразование значительно удешевляет процесс получения микропобегов. Культивирование микропобегов проводят на стеллажах при температуре 23-27°С, 16-часовом фотопериоде и освещенности общей интенсивности от 3000 до 4500 лк в течение 3-5 недель.
Побегообразование осуществляют при циклическом чередовании процессов экспозиции микропобегов в воздушной среде, влажностью 80%, и погружения их в жидкую питательную среду на 1-4 минуты. Процесс повторяют 2-4 раза в сутки автоматически в соответствии с заданным интервалом времени. Погружение микропобегов обеспечивается путем подъема жидкой питательной среды до уровня, обеспечивающего их покрытие. При этом дополнительно проводят аэрацию воздуха внутри сосуда по 2-6 мину в автоматическом режиме через равные промежутки времени от 10 до 16 раз в сутки в течение 16-часового фотопериода. Заявляемый режим создает оптимальные условия для побегообразования, обеспечивающие индукцию пазушных побегов de novo и развитие листовой массы. Кроме того, наблюдается замедление процесса старения листьев, благодаря чему усиливается их аттрагирующая способность, направленная на поглощение необходимых веществ из питательной среды, а также общая способность клеток к синтетической деятельности. Экспериментальным путем выявлено, что поднятие уровня жидкой питательной среды на 1-4 минуты 2-4 раза в сутки с погружением в нее микропобегов достаточно, поскольку в этом случае поглощение необходимого количества питательных веществ ими активно осуществляется всей поверхностью. При этом тургор тканей не снижается, а гипоксия практически исключается. Многократная аэрация внутри сосуда оптимизирует условия газообмена и способствует обновлению воздушной среды, препятствуя накоплению в ней этилена и других газов, которые оказывают в основном тормозящее влияние на процессы роста.
Применение предлагаемого способа получения микропобегов растений позволяет существенно сократить использование дорогостоящих реактивов, например агара, что значительно удешевляет культивирование растений in vitro. Создание оптимальных условий формирования микропобегов за счет особого режима кратковременного погружения эксплантов в жидкую питательную среду и последующего длительного их экспонирования в воздушной среде с высокой влажностью обеспечивают ускоренное формирование новых микропобегов (de novo). Стимулирование побегообразования дает возможность ускорить процесс формирования пазушных побегов, увеличить биомассу микропобегов, а также усилить процесс фотосинтеза и замедлить старение (хлороз) листьев, что способствует повышению жизнеспособности микропобегов в целом.
Предложенный способ обеспечивает повышение эффективности клонального микроразмножения также за счет ускоренного массового формирования побегов путем применения одного сосуда вместо нескольких небольшого объема. Используется упрощенный состав среды (без добавления агара) и фотопериод: 16-часовой при освещенности 4500 лк (в прототипе в примерах указан постоянный фотопериод при освещенности 8000 лк), которые позволяют удешевить технологию за счет экономии средств на приобретение дорогостоящих реактивов и электроэнергии. Ускоренное развитие микропобегов происходит за счет дополнительной аэрации воздуха внутри сосуда и усиления процесса фотосинтеза. В прототипе данные по фотосинтезу не представлены.
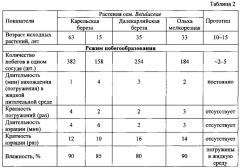
Апробация способа проводилась в течение 4-х лет (2012-2015 гг.) на следующих видах сем. Betulaceae: карельская береза Betula pendula Roth var. carelica (Merclin) , далекарлийская береза В. pendula Roth var. dalecarlica Schneid. (L.f.), ольха мелкорезная Alnus incana f. angustissima Holmberg ex Hylander и др., которые относятся к экономически ценным или декоративным, но трудноукореняемым растениям. В каждом варианте использовалось от 158 до 382 исходных микропобегов в один сосуд.
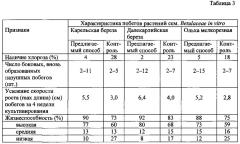
Контролем служил вариант опыта, где процесс мультипликации осуществляли на полутвердой агаризованной питательной среде. Режимы способа получения микропобегов представлены в таблице 2. По окончании эксперимента визуально определяли наличие или отсутствия хлороза, количество вновь образованных пазушных побегов в расчете на один исходный микропобег, их длину за 4 недели культивирования, на основании которых делали заключение об их жизнеспособности. Полученные данные представлены в таблице 3. В прототипе аналогичные морфофизиологические показатели не приводятся.
Анализ данных таблицы 1 показал, что заявляемый способ позволяет повысить количество микропобегов в одном сосуде более чем в 60 раз в течение 3-4 недель и в 5 раз увеличить общее их количество за год по сравнению с прототипом. Из таблицы 3 следует, что предлагаемый способ позволяет снизить в 7 раз проявление хлороза, увеличить в 2,2 раза число боковых пазушных побегов (de novo), при одновременном развитии на каждом из них нескольких микропобегов, усилить в 1,8 раза скорость роста (длину) микропобегов за 4 недели культивирования и получить до 90% жизнеспособных микропобегов, что в 1,2 раза выше по сравнению с контролем.
Важным преимуществом предлагаемого способа по сравнению с известными является возможность получать одновременно массовое количество высококачественных микропобегов при размножении и выращивании хозяйственно ценных и декоративных представителей семейства Betulaceae при экономии средств и снижении трудозатрат, что позволяет широко использовать его в практике лесного хозяйства для массового выращивания посадочного материала, а также в научных целях.
Способ получения микропобегов растений сем. Betulaceae, включающий индукцию микропобегов на агаризованной питательной среде Мурасиге-Скуга in vitro, последующую их элонгацию и мультипликацию, отличающийся тем, что индукцию микропобегов осуществляют непосредственно из апикальной недифференцированной ткани вегетативных почек экспланта, а элонгацию и мультипликацию полученных микропобегов проводят путем одновременного размещения в одном сосуде необходимого количества микропобегов на поверхности перфорированной площадки, закрепленной выше уровня жидкой питательной среды, содержащей минеральную основу по Мурасиге-Скуга, дополнительно включающей 0,25-2,0 мг/л БАП, 20000-30000 мг/л сахарозы, и осуществляют в автоматическом режиме циклическое чередование процессов экспозиции микропобегов в воздушной среде влажностью 80-90% и погружения их в жидкую питательную среду на 1-4 минуты 2-4 раза в сутки путем подъема ее уровня, с дополнительной аэрацией воздуха внутри сосуда по 2-6 минут через равные промежутки времени от 10 до 16 раз в сутки в течение 16-часового фотопериода.