Антитела к h7cr
Иллюстрации
Показать всеНастоящая группа объектов изобретения относится к области иммунологии. Предложено антитело, которое специфически связывает B7-H7CR человека, и его антигенсвязывающий фрагмент. Также рассмотрены: фармацевтическая композиция, способ лечения заболевания, связанного с экспрессией В7-H7CR, способ усиления иммунного ответа, связанного с взаимодействием В7 и B7-H7CR, способ профилактического лечения заболевания, связанного с экспрессией B7-H7CR, и способ диагностики заболевания, связанного с экспрессией B7-H7CR. Антитело по настоящему изобретению обеспечивает усиление иммунного ответа, в связи с чем может найти дальнейшее применение в терапии и диагностике различных заболеваний. 7 н. и 26 з.п. ф-лы, 23 ил., 11 табл., 8 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка представляет собой заявку PCT, по которой испрашивается приоритет предварительной заявки на патент США № 61/745296, поданной 21 декабря 2012 г., предварительной заявки на патент США 61/745312, поданной 21 декабря 2012 г., предварительной заявке на патент США № 61/827269, поданной 24 мая 2013 г., и предварительной заявки на патент США № 61/827279, поданной 24 мая 2013 г., и все заявки включены в настоящее описание в качестве ссылки в полном объеме.
ЗАЯВЛЕНИЕ ОТНОСИТЕЛЬНО ФИНАНСИРУЕМОГО ИЗ ГОСУДАРСТВЕННОГО БЮДЖЕТА ИССЛЕДОВАНИЯ ИЛИ РАЗРАБОТКИ
[0002] Настоящее изобретение было осуществлено отчасти при поддержке правительства Соединенных Штатов в виде грантов под номерами R01 CA097085-10 и ROl A172592 от Национальных институтов здравоохранения (NIH) и U19 CA113341 от Национального института рака (NCI). Правительство Соединенных Штатов может иметь определенные права на настоящее изобретение.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0003] Настоящая заявка включает один или несколько перечней последовательностей согласно пункту 1.821 статьи 37 C.F.R. и далее, которые раскрыты как бумажных и машиночитаемых носителях информации, и при этом раскрытия на данных бумажных и машиночитаемых носителях информации включены в данный документ по ссылке во всей своей полноте.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Область техники, к которой относится настоящее изобретение
[0004] Настоящее изобретение относится к антителам и их антигенсвязывающим фрагментам, а также к другим молекулам, которые способны иммуноспецифически связываться с контррецептором B7-H7, H7CR, и к их применению для лечения и диагностики злокачественных опухолей и других заболеваний.
Описание предшествующего уровня техники
[0005] Иммунная система людей и других млекопитающих отвечает за защиту против инфекции и заболевания. Такая защита обеспечивается гуморальным иммунным ответом и клеточно-опосредованным иммунным ответом. Гуморальный ответ приводит к индукции антител и других биомолекул, которые способны распознавать и нейтрализовать чужеродные мишени (антигены). В отличие от этого, клеточно-опосредованный иммунный ответ включает активацию макрофагов, природных киллеров (NK) и антиген-специфических цитотоксических T-лимфоцитов T-клетками, а также высвобождение различных цитокинов в ответ на распознавание антигена (Dong, C. et al. (2003) «Immune Regulation by Novel Costimulatory Molecules» Immunolog. Res. 28(1):39-48).
[0006] Способность T-клеток оптимально опосредовать иммунный ответ против антигена требует двух различных сигнальных взаимодействий (Viglietta, V. et al. (2007) «Modulating Co-Stimulation» Neurotherapeutics 4:666-675; Korman, A.J. et al. (2007) «Checkpoint Blockade in Cancer Immunotherapy» Adv. Immunol. 90:297-339). Во-первых, антиген, который был презентирован на поверхности антигенпрезентирующих клеток (APC) должен быть презентирован антиген-специфической наивной CD4+ T-клетке. Такая презентация доставляет сигнал с помощью Т-клеточного рецептора (TCR), который направляет T-клетку на инициацию иммунного ответа, который будет специфическим относительно презентированного антигена. Во-вторых, ряд костимулирующих и ингибирующих сигналов, опосредованных взаимодействиями между APC и отличающимися молекулами Т-клеточной поверхности, сначала запускает активацию и пролиферацию Т-клеток и в конечном итоге их ингибирование. Таким образом, первый сигнал придает специфичность в отношении иммунного ответа, в то время как второй сигнал служит для определения природы, величины и продолжительности ответа.
[0007] Иммунная система жестко контролируется костимулирующими и коингибирующими лигандами и рецепторами. Эти молекулы обеспечивают второй сигнал для активации Т-клеток и обеспечивают сбалансированную совокупность положительных и отрицательных сигналов для максимального увеличения ответов против инфекции при ограничении иммунитета организма в отношении самого себя (Wang, L. et al. (March 7, 2011) «VISTA, A Novel Mouse Ig Superfamily Ligand That Negatively Regulates T Cell Responses» J. Exp. Med. 10.1084/jem.20100619:1-16; Lepenies, B. et al. (2008) «The Role Of Negative Costimulators During Parasitic Infections» Endocrine, Metabolic & Immune Disorders - Drug Targets 8:279-288). Особенно важным является связывание между лигандами B7.1 (CD80) и B7.2 (CD86) антигенпрезентирующей клетки и рецепторами CD28 и CLTA-4 CD4+ T-лимфоцита (Sharpe, A.H. et al. (2002) «The B7-CD28 Superfamily» Nature Rev. Immunol. 2:116-126; Dong, C. et al. (2003) «Immune Regulation by Novel Costimulatory Molecules» Immunolog. Res. 28(1):39-48; Lindley, P.S. et al. (2009) «The Clinical Utility Of Inhibiting CD28-Mediated Costimulation» Immunol. Rev. 229:307-321). Связывание B7.1 или B7.2 с CD28 стимулирует активацию Т-клеток, а связывание B7.1 или B7.2 с CTLA4 ингибирует такую активацию (Dong, C. et al. (2003) «Immune Regulation by Novel Costimulatory Molecules» Immunolog. Res. 28(1):39-48; Lindley, P.S. et al. (2009) «The Clinical Utility Of Inhibiting CD28-Mediated Costimulation» Immunol. Rev. 229:307-321; Greenwald, R.J. et al. (2005) «The B7 Family Revisited» Ann. Rev. Immunol. 23:515-548). CD28 конститутивно экспрессируется на поверхности Т-клеток (Gross, J., et al. (1992) «Identification And Distribution Of The Costimulatory Receptor CD28 In The Mouse» J. Immunol. 149:380-388), в то время как экспрессия CTLA4 быстро активируется после активации Т-клеток (Linsley, P. et al. (1996) «Intracellular Trafficking Of CTLA4 And Focal Localization Towards Sites Of TCR Engagement» Immunity 4:535-543). Поскольку CTLA4 представляет собой рецептор с более высокой аффинностью (Sharpe, A.H. et al. (2002) «The B7-CD28 Superfamily» Nature Rev. Immunol. 2:116-126), то связывание сначала инициирует пролиферацию T-клеток (посредством CD28), а затем ингибирует ее (посредством начинающейся экспрессии CTLA4), таким образом ослабляя влияние в случае, когда пролиферация больше не требуется.
[0008] Дальнейшие исследования лигандов рецептора CD28 привели к идентификации и описанию характеристик ряда родственных молекул B7 («суперсемейство B7») (Coyle, A.J. et al. (2001) «The Expanding B7 Superfamily: Increasing Complexity In Costimulatory Signals Regulating T Cell Function» Nature Immunol. 2(3):203-209; Sharpe, A.H. et al. (2002) «The B7-CD28 Superfamily» Nature Rev. Immunol. 2:116-126; Greenwald, R.J. et al. (2005) «The B7 Family Revisited» Ann. Rev. Immunol. 23:515-548; Collins, M. et al. (2005) «The B7 Family Of Immune-Regulatory Ligands» Genome Biol. 6:223.1-223.7; Loke, P. et al. (2004) «Emerging Mechanisms Of Immune Regulation: The Extended B7 Family And Regulatory T Cells» Arthritis Res. Ther. 6:208-214; Korman, A.J. et al. (2007) «Checkpoint Blockade in Cancer Immunotherapy» Adv. Immunol. 90:297-339; Flies, D.B. et al. (2007) «The New B7s: Playing a Pivotal Role in Tumor Immunity» J. Immunother. 30(3):251-260; Agarwal, A. et al. (2008) «The Role Of Positive Costimulatory Molecules In Transplantation And Tolerance» Curr. Opin. Organ Transplant. 13:366-372; Lenschow, D.J. et al. (1996) «CD28/B7 System of T Cell Costimulation» Ann. Rev. Immunol. 14:233-258; Wang, S. et al. (2004) «Co-Signaling Molecules Of The B7-CD28 Family In Positive And Negative Regulation Of T Lymphocyte Responses» Microbes Infect. 6:759-766). В настоящее время известно восемь членов семейства: B7.1 (CD80), B7.2 (CD86), индуцибельный костимулирующий лиганд (ICOS-L), лиганд программируемой смерти 1 (PD-L1; B7-H1), лиганд программируемой смерти 2 (PD-L2; B7-DC), B7-H3, B7-H4 (также называемые B7x и B7S1; Sica, G.L. et al. (2003) «B7-4, A Molecule Of The B7 Family, Negatively Regulates T Cell Immunity» Immunity18:849-861; Zang, X. et al. (2003) «B7x: A Widely Expressed B7 Family Member That Inhibits T Cell Activation» Proc. Natl. Acad. Sci. (USA) 100:10388-10392; Prasad, D.V. et al. (2003) «B7S1, A Novel B7 Family Member That Negatively Regulates T Cell Activation» Immunity 18:863-873), B7-H6 (Collins, M. et al. (2005) «The B7 Family Of Immune-Regulatory Ligands» Genome Biol. 6:223.1-223.7) и B7-H7 (Flajnik, M.F. et al. (2012) «Evolution Of The B7 Family: Co-Evolution Of B7H6 And Nkp30, Identification Of A New B7 Family Member, B7H7, And Of B7's Historical Relationship With The MHC» Immunogenetics 64:571-590). Семейство генов B7 является основным в регуляции адаптивной иммунной системы. Большинство членов семейства B7 содержат домены вариабельного (V) и константного (C) типа суперсемейства иммуноглобулинов (IgSF).
[0009] Лиганды B7 экспрессируются на клеточной поверхности многих различных типов клеток, включая антигенпрезентирующие клетки (APC), и их взаимодействие с рецепторными молекулами на T-клетках обеспечивает активирующие и/или ингибирующие сигналы, которые регулируют активность и устойчивость Т-клеток (Collins, M. et al. (2005) «The B7 Family Of Immune-Regulatory Ligands» Genome Biol. 6:223,1-223,7). Некоторые ингибирующие лиганды B7 также экспрессируются на опухолевых клетках, приводя к подавлению иммунных ответов (Keir, M.E. et al. (2008) «PD-1 And Its Ligands In Tolerance And Immunity» Annu. Rev. Immunol. 26:677-704; Zou, W. et al. (2008) «Inhibitory B7-Family Molecules In The Tumour Microenvironment» Nat. Rev. Immunol. 8:467-477). Таким образом, стимулирование или ослабление взаимодействий лигандов B7 и их рецепторов имеет терапевтический потенциал для лечения аутоиммунных заболеваний и рака (WO 2011/020024; Flajnik, M.F. et al. (2012) «Evolution Of The B7 Family: Co-Evolution Of B7H6 And Nkp30, Identification Of A New B7 Family Member, B7H7, And Of B7's Historical Relationship With The MHC» Immunogenetics 64:571-590).
[0010] Несмотря на все предшествующие успехи в лечении воспаления или рака, сохраняется необходимость в композициях, способных обеспечить усиленную иммунотерапию для лечения таких состояний.
[0011] Целью настоящего изобретения являются композиции, способные обеспечить усиленную иммунотерапию для лечения рака, инфекционного заболевания, воспаления и других заболеваний и состояний.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0012] Изобретение относится к антителам и к их антигенсвязывающим фрагментам и другим молекулам, которые способны иммуноспецифически связываться с контррецептором B7-H7, H7CR. Контррецептор B7-H7 также известен как B7-H7CR и CD28H (Yhu, et al., Nature Communications, 4:1-12 (2013)). Также изобретение относится к способам их применения для лечения и диагностики злокачественных опухолей, инфекционного заболевания, воспаления и других заболеваний и состояний. H7CR-связывающие молекулы могут представлять собой моноклональное антитело, антитело человека, химерное антитело или гуманизированное антитело.
[0013] Один из вариантов осуществления относится к H7CR-связывающим молекулам, в которых антигенсвязывающий фрагмент включает шесть CDR, где CDR включают по меньшей мере один CDR из CDR антител к H7CR: 1.3, 4.5 и 7.8 или их консенсусный CDR, причем все остальные CDR, выбраны из:
(A) трех CDR легкой цепи и трех СDR тяжелой цепи антитела 1.3 против H7CR;
(A) трех CDR легкой цепи и трех СDR тяжелой цепи антитела 4.5 против H7CR или
(A) трех CDR легкой цепи и трех СDR тяжелой цепи антитела 7.8 против H7CR.
[0014] Другой вариант осуществления относится к H7CR-связывающим молекулам, в которых шесть CDR представляют собой:
(A) три СDR легкой цепи и три СDR тяжелой цепи антитела 1.3 против H7CR;
(A) три СDR легкой цепи и три СDR тяжелой цепи антитела 4.5 против H7CR или
(A) три СDR легкой цепи и три СDR тяжелой цепи антитела 7.8 к H7CR.
[0015] Еще один вариант осуществления относится к H7CR-связывающим молекулам, имеющим антигенсвязывающий фрагмент гуманизированного варианта антитела 1.3 или 4.5 против H7CR человека, где молекула иммуноспецифически связывается с H7CR человека, и где антигенсвязывающий фрагмент содержит:
(A) (1) вариабельный участок легкой цепи гуманизированного варианта антитела 1.3 против H7CR человека, где указанный вариабельный участок легкой цепи имеет аминокислотную последовательность с любой последовательностью SEQ ID NO:17-22; и
(2) вариабельный участок тяжелой цепи гуманизированного варианта антитела 1.3 против H7CR человека, где указанный вариабельный участок тяжелой цепи имеет аминокислотную последовательность с любой последовательностью SEQ ID NO:23-28;
или
(В) (1) вариабельный участок легкой цепи гуманизированного варианта антитела 4.5 против H7CR человека, где указанный вариабельный участок легкой цепи имеет аминокислотную последовательность с любой последовательностью SEQ ID NO:33-38; и
(2) вариабельный участок тяжелой цепи гуманизированного варианта антитела 4.5 против H7CR человека, где указанный вариабельный участок тяжелой цепи имеет аминокислотную последовательность с любой последовательностью SEQ ID NO:39-44.
[0016] Предпочтительный вариант осуществления относится к варианту осуществления, где указанная H7CR-связывающая молекула иммуноспецифически связывается с H7CR, который:
(A) расположен на поверхности живой клетки или
(B) экспрессируется в эндогенной концентрации.
[0017] В одном из вариантов осуществления живая клетка представляет собой Т-клетку, NK-клетку или плазмацитоидную дендритную клетку.
[0018] В еще одном варианте осуществления молекула практически неспособна блокировать взаимодействие H7CR с B7-H7.
[0019] В другом варианте осуществления молекула способна связываться с H7CR и выступать в роли агониста активности H7CR.
[0020] Любое антитело может быть биспецифическим, триспецифическим или мультиспецифическим антителом. Молекула может иметь детектируемую метку или может содержать конъюгированный токсин, лекарственное средство, рецептор, фермент, лиганд рецептора или их комбинацию.
[0021] Другой вариант осуществления предполагает фармацевтическую композицию, содержащую терапевтически эффективное количество любых из вышеупомянутых молекул и физиологически приемлемый носитель или вспомогательное вещество.
[0022] Раскрытые композиции могут использоваться для лечения заболевания у индивида, проявляющего симптом заболевания, путем введения индивиду терапевтически эффективного количества любой из вышеупомянутых фармацевтических композиций для активации пути B7-H7 и стимуляции иммунного ответа. Конкретные показания к лечению включают, но или не ограничиваются, рак, инфекционное заболевание, хроническое вирусное заболевание, воспалительное состояние или аутоиммунное заболевание.
[0023] Также изобретение относится к способу лечения заболевания, где фармацевтическая композиция выступает в роли агониста функции H7CR.
[0024] Способы профилактического лечения заболевания включают введение индивиду профилактически эффективного количества любой из вышеуказанных фармацевтических композиций до проявления симптома заболевания.
[0025] Способы диагностики заболевания (особенно рака или заболевания, влияющего на количество и эффективность T-клеток) у индивида включают анализ клеток индивида в отношении их способности связываться с любой указанной H7CR-связывающей молекулой, где способ включает цитологический анализ для диагностики иммунологической реактивности или наличия заболевания у индивида.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0026] На фигуре 1 представлена схема структуры, набор параметров экспрессии и взаимодействие между H7CR и B7-H7 на отдельных клетках.
[0027] На фигуре 2 представлена линейная диаграмма медианной интенсивности флуоресценции в зависимости от log [Ab] (нМ), показывающий соответствующие значения связывающей способности антител 1.3 к H7CR (Kd = 5,9 нМ) и 4,5 (Kd = 3,5 нМ) с трансфектантами H7CR CHO.
[0028] На фигурах 3A и 3B представлены линейные диаграммы медианной интенсивности флуоресценции в зависимости от log [Ab] (нМ), показывающие кривые связывания mAb к H7CR с наивными (CD45RA+) CD4 и CD8 T-клетками человека из PBMC (фигура 3B).
[0029] На фигурах 4(A)-4(C) представлены гистограммы данных проточной цитометрии, показывающие способность антител 1.3, 4.5 и 7.8 связываться с H7CR человека, экспрессируемыми на поверхности трансфектантов CHO. Данные представлены в виде количества импульсов от клеток в зависимости от логарифма флуоресценции Comp PE-A. Левый пик в каждой секции представляет антитело изотипического контроля, правый пик представляет антитело H7CR.
[0030] На фигурах 5A-5D представлены гистограммы данных проточной цитометрии, показывающие, что слитый белок B7-H7 Ig связывается с трансфектантом H7CR CHO. Данные представлены в виде количества импульсов от клеток в зависимости от логарифма флуоресценции Comp APC-A. Было обнаружено, что предварительная инкубация антител 1.3 (фигура 5B), 4.5 (фигура 5C) и 7.8 (фигура 5D) с трансфектантами H7CR в каждом случае была практически неспособна блокировать взаимодействие H7CR с B7-H7.
[0031] На фигуре 6 представлена микрофотография, показывающая способность антитела против H7CR человека (H7CR 4.5) связываться с H7CR, который эндогенно экспрессируется на поверхности ткани миндалин человека.
[0032] На фигуре 7 (секции A-C) представлены диаграммы рассеяния на основе данных проточной цитометрии, показывающие, что экспрессия H7CR в T- и NK-клетках была связана с фенотипом наивных Т-клеток. На секции A представлены диаграммы рассеяния от четырех доноров, показывающих экспрессию H7CR на CD3+ T-клетках относительно экспрессии у них CD45RO. На диаграммах рассеяния представлена флуоресценция антитела к H7-CR в зависимости от флуоресценции антитела к CD45RO. На секции B представлена диаграмма рассеяния, показывающая гейтирование T-клеток и NK-клеток на основе экспрессии маркеров CD3 и CD16. На диаграммах рассеяния представлена флуоресценция антитела к CD3 в зависимости от флуоресценции антитела к CD16. На секции С представлены диаграммы рассеяния от четырех доноров, показывающих экспрессию H7CR на CD16+ NK-клетках относительно экспрессии у них CD45RO. На диаграммах рассеяния представлена флуоресценция антитела к H7-CR в зависимости от флуоресценции антитела к CD45RO.
[0033] На фигурах 8A-8H представлены диаграммы рассеяния профилей экспрессии H7CR и B7-H7 в PMBC у четырех здоровых доноров (донор 1, фигуры 8A и 8B; донор 2, фигуры 8C и 8D; донор 3 (фигура 8E и фигура 8F) и донор 4 (фигура 8G и фигура 8H)). На фигурах 8A, 8C, 8E и 8G представлены диаграммы рассеяния логарифма флуоресценции с применением антитела 1.3 в зависимости от логарифма флуоресценции с применением антитела к CD3. На фигурах 8B, 8D, 8F и 8H представлены диаграммы рассеяния логарифма флуоресценции с применением антитела 2D3 к B7H7 в зависимости от антитела к CD14. У всех доноров показана экспрессия H7CR на CD3 T-клетке при минимальной экспрессии B7-H7 в PBMC.
[0034] На фигурах 9A-9H представлены диаграммы рассеяния профилей экспрессии H7CR и B7-H7 в PMBC у четырех здоровых доноров (донор 1, фигуры 9A и 9B; донор 2, фигуры 9C и 9D; донор 3, фигуры 9E и 9F, и донор 4, фигуры 9G и 9H). На фигурах 9A, 9C, 9E и 9G представлены диаграммы рассеяния флуоресценции с применением антитела 1.3 в зависимости от антитела к CD3. На фигурах 9B, 98D, 9F и 9H представлены диаграммы рассеяния флуоресценции с применением антитела 2D3 к B7H7 в зависимости от антитела к CD14. У доноров 2, 3, 4 показана экспрессия H7CR на CD3 T-клетках при минимальной экспрессии B7-H7 в PBMC. У донора 1 показан высокий уровень экспрессии B7-H7 на CD14+ моноцитах и низкий уровень экспрессии H7CR на CD3 T-клетках.
[0035] На фигурах 10A-10D представлены гистограммы на основе данных проточной цитометрии, показывающие экспрессию H7CR и B7-H7 моноцитами человека (10A, 10F, 10K, 10P, 10U и 10Z), CD8+ CD3+ лимфоцитами (10B, 10G, 10L, 10Q, 10V, 10AA), CD8- CD3+ лимфоцитами (10C, 10H, 10M, 10R, 10W и 10AB), CD16+ NK-клетками (10D, 10I, 10N, 10S, 10X и 10AC) и CD3- CD8- клетками. (10E, 10J, 10O, 10T, 10Y и 10AD). Антитела 18C3 (10A-10E) и 2D3 (10F-10J) представляют собой моноклональные антитела к B7-H7. На фигурах 10K-10O применяется антитело к PD-1. На фигурах 10P-T применяется антитело 1.3. На фигурах 10U-Y применяется антитело 4.5. На фигурах 10Z-AD применяется антитело 7.8.
[0036] На фигурах 11A-11D представлены гистограммы на основе данных проточной цитометрии, показывающие экспрессию H7CR и B7-H7 моноцитами яванского макака (11A, 11F, 11K, 11P, 11U и 11Z), CD8+ CD3+ лимфоцитами (11B, 11 G, 11L, 11Q, 11V, 11AA), CD8- CD3+ лимфоцитами (11C, 11H, 11M, 11R, 11W и 11AB), CD16+ NK-клетками (11D, 11I, 11N, 11S, 11X и 11AC) и CD3- CD8- клетками (11E, 11J, 11O, 11T, 11Y и 11AD). Антитела 18C3 (фигуры 10A-10E) и 2D3 (фигуры 10F-10J) представляют собой моноклональные антитела к B7-H7. На фигурах 10K-10O применяется антитело к PD-1. На фигурах 10P-T применяется антитело 1.3. На фигурах 10U-Y применяется антитело 4.5. На фигурах 10Z-AD применяется антитело 7.8.
[0037] На фигурах 12A-12K представлены гистограммы на основе данных проточной цитометрии для in vitro анализа экспрессии B7-H7 и других маркеров активации созревшими происходящими из моноцитов дендритными клетками. На фигуре 12A представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-FITC-A с применением антитела к HLA-ABC. На фигуре 12B представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-PE-A с применением антитела к B7-H1. На фигуре 12С представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-PerCP-Cy5-5-A с применением антитела к HLA-DR. На фигуре 12D представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-PE-Cy7-A с применением антитела к CD40. На фигуре 12Е представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-APC-A с применением антитела к CD86. На фигуре 12F представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-PacificBlue-A с применением антитела к CD83. На фигуре 12G представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-FITC-A с применением антитела к CD80. На фигуре 12H представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-PE-A с применением антитела к B7-DC. На фигуре 12I представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-PacificBlue-A с применением антитела к CD54. На фигуре 12J представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-PerCP-Cy5-5A с применением антитела к B7-H7. На фигуре 12K представлена гистограмма количества импульсов в зависимости от логарифма флуоресценции Comp-APC-A с применением антитела к CCR7. Сплошная серая линия представляет изотипический контроль. Пунктирная линия представляет незрелые дендритные клетки. Точечная линия представляет клетки, обработанные в течение одного дня TNFα и PGE2. Сплошная черная линия представляет клетки, обработанные в течение двух дней 1 нг/мл TNFa и 1 мкг/мл PGE2.
[0038] На фигуре 13 представлен линейный график процента поделившихся клеток (низкая интенсивность окрашивания CFSE) в зависимости от времени в днях для Ctl Ig (■), H7CR1.3 (•), H7CR4.5 (▲), H7CR7.8 (♦) и только T-клеток (—), и показано, что антитела к H7CR активируют специфические ответы Т-клеток на модельный антиген-столбнячный анатоксин.
[0039] На фигурах 14A-14L представлены столбиковые диаграммы, которые показывают природу и уровни цитокинов, экспрессируемых клетками, подвергнутыми стимуляции белком столбнячного анатоксина и обработке антителом H7CR или контрольным антителом. На фигуре 14A представлена столбиковая диаграмма экспрессирующих IFN-γ (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14B представлена столбиковая диаграмма экспрессирующих IL-5 (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14D представлена столбиковая диаграмма экспрессирующих IL-13 (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14Е представлена столбиковая диаграмма экспрессирующих GM-CSF (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14F представлена столбиковая диаграмма экспрессирующих IL-10 (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14G представлена столбиковая диаграмма экспрессирующих IL-6 (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14H представлена столбиковая диаграмма экспрессирующих IL-12p70 (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14I представлена столбиковая диаграмма экспрессирующих MCP-1 (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14J представлена столбиковая диаграмма экспрессирующих IL-17 (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14K представлена столбиковая диаграмма экспрессирующих MIP-1β (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток. На фигуре 14L представлена столбиковая диаграмма экспрессирующих IL-8 (пг/нл) клеток, обработанных CtlIg, H7CR1.3, H7CR4.5, H7CR7.8, или только T-клеток.
[0040] На фигурах 15A и 15B представлены диаграммы рассеяния на основе данных проточной цитометрии, которые показывают, что обработка антителами к H7CR усиливала пролиферацию и внутриклеточную экспрессию IFNγ в антиген-специфических T-клетках. На фигуре 15A представлена диаграмма рассеяния логарифма флуоресценции Comp-PerCP-Cy5-5-A::IFNg в зависимости от Comp-FITC::CFSE с применением CtlIg. На фигуре 15B представлена диаграмма рассеяния логарифма флуоресценции Comp-PerCP-Cy5-5-A::IFNg в зависимости от Comp-FITC::CFSE.
[0041] На фигурах 16A-16B представлены столбиковые диаграммы, которые показывают влияния антител к H7CR на ответы Т-клеток человека. На фигуре 16A представлена столбиковая диаграмма поделившихся CD4+ T-клеток (%), которая показывает, что антитела к CD28H (закрашенный прямоугольник) опосредуют сильно увеличенную пролиферацию T-клеток в отсутствие CTLA4-Ig. На фигуре 16B показано, что антитела к CD28H (закрашенный прямоугольник) опосредуют повышение экспрессии цитокинов. Фигура 16B включает секцию A, на которой представлена столбиковая диаграмма для IFN-γ в пг/мл из T-клеток, обработанных контролем (незакрашеный прямоугольник) или антителом к CD28H (закрашенный прямоугольник). На секции B представлена столбиковая диаграмма в пг/мл для следующих цитокинов (закрашенный прямоугольник) слева направо: IL-5, IL-10, TNF-α, IL-17, контроль (незакрашеный прямоугольник).
[0042] На фигурах 17A-17B представлены двухмерные изображения в виде бусин в бусах (2D Collier Perles) вариабельных доменов легкой цепи (фигура 17A) и тяжелой цепи (фигура 17B) антитела 1.3. Петли трех CDR представлены наверху схем. Заштрихованные кружки представляют собой пропущенные остатки для этого mAb. Представленные в квадратиках аминокислоты представляют собой консервативные аминокислоты в этом положении.
[0043] На фигурах 18A-18B представлены двухмерные изображения в виде бусин в бусах (2D Collier Perles) вариабельных доменов легкой цепи (фигура 18A) и тяжелой цепи (фигура 18B) антитела 4.5. Петли трех CDR представлены наверху схем. Заштрихованные кружки представляют собой пропущенные остатки для этого mAb. Представленные в квадратиках аминокислоты представляют собой консервативные аминокислоты в этом положении.
[0044] На фигурах 19A-D представлены гистограммы полученного с помощью проточной цитометрии количества клеток в зависимости от CFSE, показывающие, что антитело 1.3 приводит к наращиванию числа CD4+ и CD8+ клетки человека in vivo. На фигурах 19A и 19C представлены контроли, показывающие количество клеток в зависимости от логарифма флуоресценции контрольного антитела. На фигуре 19B представлено количество CD4+ клеток в зависимости от логарифма флуоресценции с применением антитела 1.3 к H7CR. На фигуре 19D представлено количество CD4+ клеток в зависимости от логарифма флуоресценции с применением антитела 1.3 к H7CR. В качестве контрольного антитела использовали изотипический контроль из IgG хомяка (Biolegend).
[0045] На фигурах 20A-H представлены диаграммы рассеяния на основе данных проточной цитометрии, показывающие увеличение числа клеток, экспрессирующих CD40L, IFNγ и CD107a у NGS мышей, которым вводили инъекцией антитело 1.3. На фигуре 20A показан логарифм флуоресценции антитела к CD40L в зависимости от логарифма флуоресценции антитела к CD3 у необработанных CD4+ клеток. На фигуре 20B показан логарифм флуоресценции антитела к CD40L в зависимости от логарифма флуоресценции антитела к CD3 у CD4+ клеток, обработанных антителом 1.3 к H7CR. На фигуре 20С показан логарифм флуоресценции антитела к IFNγ в зависимости от логарифма флуоресценции антитела к CD3 у необработанных CD4+ клеток. На фигуре 20D показан логарифм флуоресценции антитела к IFNγ в зависимости от логарифма флуоресценции H у CD4+ клеток, обработанных антителом к H7CR. На фигуре 20Е показан логарифм флуоресценции антитела к CD107a в зависимости от логарифма флуоресценции антитела к CD3 у необработанных CD8+ клеток. На фигуре 20F показан логарифм флуоресценции антитела к CD107a в зависимости от логарифма флуоресценции антитела к CD3 у CD8+ клеток, обработанных антителом 1.3 к H7CR. На фигуре 20G показан логарифм флуоресценции антитела к IFNγ в зависимости от логарифма флуоресценции антитела к CD3 у необработанных CD8+ клеток. На фигуре 20Н показан логарифм флуоресценции антитела к IFNγ в зависимости от логарифма флуоресценции H у CD8+ клеток, обработанных антителом к H7CR.
[0046] На фигуре 21A представлена точечная диаграмма количества IFN-γ (пг/мл) в покоящихся PMBC человека, стимулируемых (слева направо) химерным мышиным антителом к H7CR (1.3), отрицательным контролем (Ctl Ig), OKT3, OKT3 +CD28, иммобилизированным химерным мышиным антителом к H7CR (1.3), иммобилизированным отрицательным контролем и иммобилизированным OKT3. На фигуре 21B представлена точечная диаграмма количества IFN-γ в активированных PMBC, стимулируемых (слева направо) химерным мышиным антителом к H7CR (1.3), отрицательным контролем (Ctl Ig), OKT3, OKT3 +CD28, иммобилизированным химерным мышиным антителом к H7CR (1.3), иммобилизированным отрицательным контролем и иммобилизированным OKT3. На фигуре 21B представлена точечная диаграмма количества IFN-γ в активированных PMBC, стимулируемых (слева направо) химерным мышиным антителом к H7CR (1.3), отрицательным контролем (Ctl Ig), OKT3, OKT3 +CD28, иммобилизированным химерным мышиным антителом к H7CR мыши (1.3), иммобилизированным отрицательным контролем и иммобилизированным OKT3 в концентрации 10 мкг/мл в течение ночи.
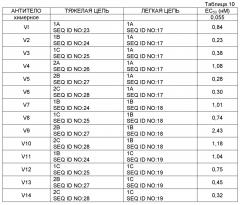
[0047] На фигуре 22 представлена столбиковая диаграмма процента разведенных в CFSE Т-клеток для происходящих из моноцитов дендритных клеток, созревающих под действием 1 нг/мл TNFα и 1 мкг/мл PGE2 в течение двух дней. Дендритные клетки инкубировали с мечеными CFSE аутологичными Т-клетками в течение двух недель в присутствии 100 нг/мл столбнячного анатоксина. Клетки обрабатывали (слева направо) 10 мкг/мл растворимого контрольного IgG4, химерным мышиным антителом к H7CR (1.3) и вариантами V1-V14 (см. таблицу 10).
[0048] На фигуре 23 представлен ряд диаграмм рассеяния на основе данных проточной цитометрии для тридцати шести гуманизированных H7CR4.5 с отмеченными тяжелыми и легкими цепями. Тридцать шесть вариантов инкубировали с трансфицированными слитым белком H7CR-GFP клетками CHO и окрашивали вторичным антителом к Ig человека. На оси X показана экспрессия H7CR-GFP, а на оси Y показано связывание вариантов с трансфектантами.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0049] Изобретение относится к антителам, гуманизированным вариантам антител и к их антигенсвязывающим фрагментам, а также к другим молекулам, которые способны иммуноспецифически связываться с контррецептором B7-H7, H7CR (также известным как B7-H7CR и CD28H), и их применения в лечении и диагностике рака и других заболеваний.
[0050] B7-H7 экспрессируется на антигенпрезентирующих клетках; он конститутивно экспрессируется на макрофагах и является индуцируемым на дендритных клетках. Для стимуляции иммунной системы и иммунных ответов B7-H7 взаимодействует с контррецептором (H7CR) (фигура 1). H7CR особенно экспрессируется на наивных T-клетках, NK-клетках и плазмацитоидных дендритных клетках (особенно в селезенке, лимфатических узлах и тимусе), а его экспрессия подвергается понижающей регуляции на созревших или активированных клетках. Такая понижающая регуляция экспрессии H7CR ослабляет выживаемость активированных Т-клеток/Т-клеток памяти in vivo и приводит к возврату иммунной системы к состоянию покоя у нормальных индивидов. Таким образом, взаимодействие между B7-H7 и H7CR является важным для примирования наивных Т-клеток и выживания активированных Т-клеток/Т-клеток памяти in vivo. Тем не менее, также было отмечено, что экспрессия H7CR подвергается понижающей регуляции в подверженных хроническому воздействию антигенов/истощенных Т-клетках. Молекулы, такие как B7-H7 Ig и антитела к H7CR, которые способны к связыванию с H7CR, способны служить в качестве агонистов для пролиферации Т-клеток и выработки цитокинов. Такие молекулы полезны при лечении рака, инфекционного заболевания и заболеваний, характеризующихся недостаточным Т-клеточным ответом. С другой стороны, молекулы, такие как антитела к B7-H7 и H7CR Ig, которые способны к блокированию взаимодействия между B7-H7 и H7C R, способны служить в качестве антагонистов пролиферации Т-клеток и выработки цитокинов. Такие молекулы полезны при лечении воспаления и, в частности, аутоиммунного заболевания.
A. B7-H7
[0051] B7-H7 был открыт в результате поиска в базах данных Xenopus как ген, который проявлял значительную гомологию с B7-H4 Xenopus. Белок B7-H4 имеет 282 аминокислотных остатка, которые были классифицированы как имеющие аминоконцевой внеклеточный домен, большой гидрофобный трансмембранный домен и очень короткий внутриклеточный домен (состоящий только из 2 аминокислотных остатков). Подобно другим членам семейства B7, B7-H4 имеет пару Ig-подобных участков в своем внеклеточном домене. Белок B7-H4 имеет общую структуру трансмембранного белка типа I.
[0052] Было обнаружено, что аминокислотная последовательность B7-H7 подобна ранее описанному гену человека, HHLA2 (связанный с длинными концевыми повторами белок 2 эндогенного ретровируса человека H (HHLA2); Mager, D.L. et al. (1999) «Endogenous Retroviruses Provide The Primary Polyadenylation Signal For Two New Human Genes (HHLA2 And HHLA3» Genomics 59:255-263), функция которого была неизвестна (Flajnik, M.F. et al. (2012) «Evolution Of The B7 Family: Co-Evolution Of B7H6 And Nkp30, Identification Of A New B7 Family Member, B7H7, And Of B7's Historical Relationship With The MHC» Immunogenetics 64:571-590).
[0053] Было обнаружено, что последовательность B7-H7 человека имеет гомологи у курицы, опоссума, копытных млекопитающих (например, лошади, свиньи), лосося и акулы. Тем не менее, у грызунов (мыши и крысы) к настоящему времени были идентифицированы только псевдогены. Аминокислотные последовательности таких генов проявляют подобные структуры доменов у всех видов с консервативностью канонических остатков доменов суперсемейства Ig.
[0054] Полипептид B7-H7 человека имеет длину 414 аминокислот, и было описано, что он содержит следующее: сигнальную последовательность, внеклеточный домен, 3 иммуноглобулин-подобных (Ig-подобных) домена, трансмембранный домен и цитоплазматический домен. В частности, было описано, что полипептид B7-H7 человека содержит Ig-подобный домен V-типа 1, Ig-подобный домен C-типа 1 и Ig-подобный домен V-типа 2. Существуют многочисленные встречающиеся в природе варианты B7-H7 (например, под номером доступа Q9UM44-1 (homo sapiens), NP_009003 (GI:5901964, homo sapiens) и AAD48396 (GI:15726285, homo sapiens); см. WO 2011/020024).
[0055] Выражение “нативный B7-H7” относится к любой встречающейся в природе аминокислотной последовательности B7-H7, включая незрелые формы или предшественники и зрелые формы. Зрелые формы B7-H7 включают белки B7-H7, которые подверглись посттрансляционной модификации, например, полипептиды B7-H7, которые имели отщепляемую сигнальную или лидерную аминокислотную последовательность. Аминокислотная последовательность иллюстративного B7-H7 человека под номером доступа Q9UM44-1 представляет собой (SEQ ID NO:1):
MKAQTALSFF LILITSLSGS QGIFPLAFFI YVPMNEQIVI GRLDEDIILP
SSFERGSEVV IHWKYQDSYK VHSYYKGSDH LESQDPRYAN RTSLFYNEIQ
NGNASLFFRR VSLLDEGIYT CYVGTAIQVI TNKVVLKVGV FLTPVMKYEK
RNTNSFLICS VLSVYPRPII TWKMDNTPIS ENNMEETGSL DSFSINSPLN
ITGSNSSYEC TIENSLLKQT WTGRWTMKDG LHKMQSEHVS LSCQPVNDYF
SPNQDFKVTW SRMKSGTFSV LAYYLSSSQN TIINESRFSW NKELINQSDF
SMNLMDLNLS DSGEYLCNIS SDEYTLLTIH TVHVEPSQET ASHNKGLWIL
VPSAILAAFL LIWSVKCCRA QLEARRSRHP ADGAQQERCC VPPGERCPSA
PDNGEENVPL SGKV
[0056] Описано, что по результатам анализа in silico B7-H7 человека содержит следующие предполагаемые домены: сигнальную последовательность в положениях аминокислотных остатков с 1 по 22 в SEQ ID NO:1, Ig-подобный домен V-типа 1 в положениях аминокислотных остатков с 61 по 131 в SEQ ID NO:1, Ig-подобный домен C-типа 1 в положениях аминокислотных остатков с 138 по 222 в SEQ ID NO:1, Ig-подобный домен V-типа 2 в положениях аминокислотных остатков с 235 по 328 в SEQ ID NO:1 и трансмембранный домен в положениях аминокислотных остатков с 345 по 365 в SEQ ID NO:1. Предполагаемая граница раздела в димере для полипептида B7-H7 человека представляет собой аминокислотные остатки 141-144, 156, 158, 160, 162, 193-196, 198, 200, 201, 224 и 225 в SEQ ID NO:1. Предполагаемые N-связанные сайты гликозилирования для полипептида B7-H7 человека расположены в положениях аминокислотных остатков 90, 103 и 318 в SEQ ID NO:1. Встречающиеся в природе варианты полипептида B7-H7 человека включают BOT, N344K и S346R (UniProt Q9UM44) (см. WO 2011/020024, упоминание которого включено в данный документ с помощью ссылки во всей своей полноте для объяснения структуры и последовательности B7-H7 человека).
[0057] Последовательность ДНК, кодирующая B7-H7 человека (SEQ ID NO:1) представляет собой (SEQ ID NO:2):
atgaaggcac agacagcact gtctttcttc ctcattctca taacatctct
gagtggatct caaggcatat tccctttggc tttcttcatt tatgttccta
tgaatgaaca aatcgtcatt ggaagacttg atgaagatat aattctccct
tcttcatttg agaggggatc cgaagtcgta atacactgga agtatcaaga
tagctataag gttcatagtt actacaaagg cagtgaccat ttggaaagcc
aagatcccag atatgcaaac aggacatccc ttttctataa tgagattcaa
aatgggaatg cgtcactatt tttcagaaga gtaagccttc tggacgaagg
aatttacacc tgctatgtag gaacagcaat tcaagtgatt acaaacaaag
tggtgctaaa ggtgggagtt tttctcacac ccgtgatgaa gtatgaaaag
aggaacacaa acagcttctt aatatgcagc gtgttaagtg tttatcctcg
tccaattatc acgtggaaaa tggacaacac acctatctct gaaaacaaca
tggaagaaac agggtctttg gattcttttt ctattaacag cccactgaat
attacaggat caaattcatc ttatgaatgt acaattgaaa attcactgct
gaagcaaaca tggacagggc gctggacgat gaaagatggc cttcataaaa
tgcaaagtga acacgtttca ctctcatgtc aacctgtaaa tgattatttt
tcaccaaacc aagacttcaa agttacttgg tccagaatga aaagtgggac
tttctctgtc ctggcttact atctgagctc ctcacaaaat acaattatca
atgaatcccg attctcatgg aacaaagagc tgataaacca gagtgacttc
tctatgaatt tgatggatct taatctttca gacagtgggg aatatttatg
caatatttct tcggatgaat atactttact taccatccac acagtgcatg
tagaaccgag ccaagaaaca gcttcccata acaaaggctt atggattttg
gtgccctctg cgattttggc agcttttctg ctgatttgga gcgtaaaatg
ttgcagagcc cagctagaag ccaggaggag cagacaccct gctgatggag
cccaacaaga aagatgttgt gtccctcctg gtgagcgctg tcccagtgca
cccgataatg gcgaagaaaa tgtgcctctt tcaggaaaag ta
[0058] В отличие от B7-H4 человека, который экспрессируется в различных местах, обнаружено, что B7-H7 человека проявляет более ограниченную экспрессию (например, экспрессируется в кишечнике, почках, легких, эпителиальных клетках и лимфоцитах). HHLA2 человека находится на хромосоме 3q13.33 возле B7.1 и B7.2. B7-H7 конститутивно экспрессируется на макрофагах и оказывает индуцирующее действие на дендритные клетки (DC).
B. H7CR
[0059] Применяемое в данном документе выражение «нативный H7CR» относится к любому встречающему в природе контррецептору B7-H7. H7CR также обозначается как B7-H7CR и CD28H. H7CR экспрессируется T-клетками, NK-клетками и плазмацитоидными дендритными клетками. В литературе/базах данных полипептид H7CR человека иначе обозначается как трансмембранный и содержащий домен 2 имм