Антиген-связывающий белок и его применение в качестве продукта для адресной доставки при лечении рака
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, в частности к способу скрининга in vitro антитела или его связывающего фрагмента, способного доставлять молекулу, представляющую интерес, или вызывать ее интернализацию в клетку млекопитающего, экспрессирующую на своей поверхности белок Axl. Для осуществления указанного способа сначала отбирают антитело, которое способно специфически связываться с белком Axl и лишено какой-либо значительной активности в отношении пролиферации опухолевых клеток. Затем проводят ковалентное связывание указанной молекулы с выбранным антителом с образованием комплекса. После чего указанный комплекс контактирует с клеткой млекопитающего, экспрессирующей на своей поверхности белок Axl. Далее определяют, был ли указанный комплекс внутриклеточно доставлен или интернализован в указанную клетку, и отбирают необходимое антитело. Настоящее изобретение также раскрывает способ получения in vitro цитотоксического или цитостатического комплекса и позволяет отбирать антитела к Axl, которые могут быть использованы для получения иммуноконъюгатов, более безопасных, но сохраняющих свою эффективность. 2 н. и 5 з.п. ф-лы, 11 ил., 8 табл., 13 пр.
Реферат
Настоящее изобретение относится к новому антиген-связывающему белку, в частности моноклональному антителу, способному специфически связываться с белком Axl, а также к аминокислотным и нуклеотидным последовательностям, кодирующим указанный белок. В одном аспекте, изобретение относится к новому антиген-связывающему белку или антиген-связывающим фрагментам, способным специфически связываться с Axl и, вызывая интернализацию Axl, интернализоваться в клетку. Изобретение также относится к применению в качестве продукта для адресной доставки указанного антиген-связывающего белка, конъюгированного с другими противораковыми соединениями, такими как токсины, радиоактивные элементы или лекарственные средства, и его применению для лечения некоторых видов рака.
«Axl» (также называемый как «Ufo», «Ark» или «Tyro7») был клонирован из пациентов с хронической миелоидной лейкемией как онкоген, запускающий трансформацию при сверхэкспрессии мышиными NIH3T3. Он принадлежит к семейству рецепторных тирозинкиназ (RTK), называемому семейство ТАМ (Tyro3, Axl, Mer), которое включает Tyro3 (Rse, Sky, Dtk, Etk, Brt, Tif), Axl и Mer (Eyk, Nyk, Tyro-12) [Lemke G. Nat. Rev. Immunol. (2008). 8, 327-336].
Белок Axl человека состоит из 894 аминокислот, последовательность которых представлена в перечне последовательностей как SEQ ID NO. 29. Аминокислоты 1-25 соответствуют сигнальному пептиду, белок Axl человека без указанного сигнального пептида представлен в перечне последовательностей как SEQ ID NO. 30.
Gas6, первоначально выделенный как ген блокировки роста, является общим лигандом для членов семейства ТАМ [Varnum B.C. et al. Nature (1995). 373, 623-626]. Gas6 демонстрирует самое высокое сродство к Axl, меньшее сродство к Tyro3 и, наконец, еще меньшее сродство к Mer [Nagata K. et al. J. Biol. Chem. (1996). 271, 30022-30027]. Gas6 состоит из домена, обогащенного γ-карбоксиглутаматом (Gla), который опосредует связывание с фосфолипидными мембранами, четырех доменов, подобных эпидермальному фактору роста, и двух доменов, подобных ламинину G (LG) [Manfioletti G., Brancolini.C, Avanzi.G. & Schneider, С. Mol. Cell Biol. (1993). 13, 4976-4985]. Как и у многих других RTK, связывание лиганда приводит к димеризации рецепторов и аутофосфорилированию остатков тирозина (остатки тирозина 779, 821 и 866 для рецептора Axl), которые служат участками стыковки для различных внутриклеточных сигнальных молекул [Linger R.M. Adv. Cancer Res. (2008). 100, 35-83]. Кроме того, рецептор Axl может быть активирован независимо от лиганда. Эта активация может произойти при сверхэкспрессии рецептора Axl.
Сигналы от Gas6/Axl, как было показано, регулируют различные клеточные процессы, включая клеточную пролиферацию, адгезию, миграцию и выживание, у целого ряда клеток in vitro [Hafizi S. & Dahlback.B. FEBS J. (2006).273, 5231-5244]. Кроме того, рецепторы ТАМ участвуют в контроле врожденного иммунитета; они замедляют воспалительные реакции на патогены в дендритных клетках (DC) и макрофагах. Они также запускают фагоцитоз апоптотических клеток этими иммунными клетками, и они необходимы для созревания и поражающей активности естественных клеток-киллеров (NK) [Lemke G. Nat. Rev. Immunol. (2008). 8, 327-336].
Слабо экспрессирующиеся в нормальных клетках, они, в основном, обнаруживаются в фибробластах, миелоидных клетках-предшественниках, макрофагах, нервной ткани, сердечной и скелетных мышцах, где они, главным образом, поддерживают выживание клеток. Система Gas6/Axl играет важную роль в биологии сосудов, регулируя гомеостаз гладкомышечных клеток сосудов [Korshunov V.A., Mohan, A.M., Georger, M.A. & Berk, B.C. Circ. Res. (2006). 98, 1446-1452; Korshunov V.A., Daul, M., Massett, MP. & Berk, B.C. Hypertension (2007). 50, 1057-1062].
В опухолевых клетках Axl играет важную роль в регулировании клеточной инвазии и миграции. Сверхэкспрессия Axl связана не только с плохим прогнозом, но и с повышенной инвазивностью различных злокачественных опухолей человека, как сообщалось для рака молочной железы, рака толстой кишки, рака пищевода, гепатоцеллюлярной карциномы, рака желудка, глиомы, рака легких, меланомы, остеосаркомы, рака яичников, рака простаты, рабдомиосаркомы, рака почки, рака щитовидной железы и рака эндометрия [Linger R.M. Adv. Cancer Res. (2008). 100, 35-83 и Verma A. Mol. Cancer Ther. (2011). 10, 1763-1773, для обзоров]. При раке молочной железы Axl, по-видимому, является сильным эффектором эпителиально-мезенхимального перехода (ЕМТ); программа ЕМТ активно способствует миграции и распространению раковых клеток в организме [Thiery J.P. Curr. Opin. Cell Biol. (2003). 15, 740-746].
Также было показано, что Axl регулирует ангиогенез. Действительно, нокдаун Axl в эндотелиальных клетках нарушал формирование трубки и миграцию [Holland S.J. et al. Cancer Res. (2005). 65, 9294-9303], а также повреждал специфичные ангиогенные сигнальные пути [Li Y. et al. Oncogene (2009). 28, 3442-3455].
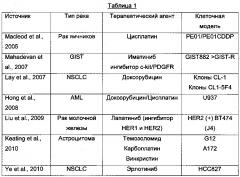
В нескольких исследованиях ряда клеточных моделей, проведенных в последнее время, описано участие сверхэкспрессии Axl в явлении лекарственной устойчивости. В нижеприведенной таблице 1 приведены сведения об этих исследованиях.
Полные данные об источниках, приведенных выше в таблице 1, следующие:
- Macleod, K. et al. Cancer Res. (2005). 65, 6789-6800
- Mahadevan D. et al. Oncogene (2007). 26, 3909-3919
- Lay J.D. et al. Cancer Res. (2007). 67, 3878-3887
- Hong C.C. etal. Cancer Lett. (2008). 268, 314-324
- Liu L. et al. Cancer Res. (2009). 69, 6871-6878
- Keating A.K. etal. Mol. CancerTher. (2010). 9, 1298-1307
- Ye X. et al. Oncogene (2010). 29, 5254-5264
В таком контексте RTK Axl рассматривается как интересная мишень в онкологии. Несколько групп уже разработали противоопухолевые стратегии, направленные на ось Gas6/Axl, либо использующие изолированные моноклональные антитела, либо направленные на малые молекулы [Verma A. Mol. Cancer Ther. (2011). 10, 1763-1773].
В первом варианте осуществления изобретение относится к антиген-связывающему белку или его антиген-связывающему фрагменту, который i) специфически связывается с белком Axl человека и ii) интернализуется после его связывания с указанным белком Axl человека.
В более общем смысле изобретение относится к применению белка Axl для отбора антиген-связывающего белка или его антиген-связывающего фрагмента, способного интернализоваться после его связывания с указанной мишенью Axl. В частности, указанной мишенью является внеклеточный домен Axl.
В этом частном аспекте настоящее изобретение относится к способу скрининга in vitro соединения или его связывающего фрагмента, способного доставлять молекулу, представляющую интерес, или вызывать ее интернализацию в клетку млекопитающего, где молекула, представляющая интерес, ковалентно связана с указанным соединением, при этом способ включает следующие стадии:
a) отбор соединения, которое способно специфически связываться с белком Axl, или его внеклеточным доменом (ECD), или его эпитопом;
b) необязательно, ковалентное связывание указанной молекулы, представляющей интерес, или контрольной молекулы с соединением, выбранным на стадии а), с образованием комплекса;
c) контактирование соединения, выбранного на стадии а), или комплекса, полученного на стадии b), с клеткой млекопитающего, предпочтительно, жизнеспособной клеткой, экспрессирующей на своей поверхности белок Axl или его функциональный фрагмент;
d) определение, были ли указанное соединение, или указанная молекула, представляющая интерес, или указанный комплекс внутриклеточно доставлены или интернализованы в клетку млекопитающего; и
e) отбор указанного соединения в качестве соединения, способного доставлять молекулу, представляющую интерес, или вызывать ее интернализацию в жизнеспособную клетку млекопитающего.
В предпочтительном варианте осуществления указанное соединение, способное доставлять молекулу, представляющую интерес, или вызывать ее интернализацию в жизнеспособную клетку млекопитающего, представляет собой белок (называемый в данном документе также как полипептид или пептид) или подобное белку соединение, содержащее пептидную структуру, в частности, аминокислотную последовательность из по меньшей мере 5, 10, 15 или более аминокислотных остатков, причем указанный(ые) аминокислотный(ые) остаток(остатки) может(могут) быть гликозилирован(ы).
Когда указанное соединение, способное доставлять молекулу, представляющую интерес, или вызывать ее интернализацию в жизнеспособную клетку млекопитающего, представляет собой белок или подобное белку соединение, указанное соединение также называется в данном документе «антиген-связывающий белок», при этом антиген-связывающий белок или его связывающий фрагмент может:
i) специфически связываться с белком Axl, предпочтительно, белком Axl человека, и
ii) интернализоваться в клетку млекопитающего после его связывания с указанным белком Axl, когда белок Axl экспрессируется на поверхности клетки млекопитающего.
В предпочтительном варианте осуществления изобретения указанная жизнеспособная клетка млекопитающего представляет собой клетку человека, предпочтительно, клетку, естественным образом экспрессирующую рецептор белка Axl.
В частном воплощении изобретения жизнеспособные клетки млекопитающих на стадии с) являются клетками млекопитающих, которые экспрессируют рекомбинантный(ые) белок(белки) Axl на их поверхности.
В предпочтительном варианте осуществления молекула, представляющая интерес, является цитотоксической молекулой (называемой в данном документе также как цитотоксический или цитостатический агент).
В предпочтительном варианте осуществления молекула, представляющая интерес, ковалентно связана с соединением, способным связываться с белком Axl с помощью линкера, более предпочтительно, пептидного линкера, более предпочтительно, расщепляемого пептидного линкера, более предпочтительно, линкера, который может расщепляться природными внутриклеточными соединениями, содержащимися в клетке млекопитающего, в частности, в цитозоле указанной клетки млекопитающего.
В предпочтительном варианте осуществления соединение, способное связываться с белком Axl, представляет собой антитело или его функциональный связывающий фрагмент, который специфически направлен на белок Axl или его эпитоп, расположенный в домене EDC Axl.
Стадия е) отбора может быть осуществлена любым способом, известным специалисту в данной области, для оценки внутриклеточной доставки или интернализации. Анализы или тесты, способные продемонстрировать или оценить присутствие, отсутствие или активность соединения, способного специфически связывать белок Axl, или комплекса, образованного указанным соединением и молекулой, представляющей интерес, или указанной молекулы, представляющей интерес, которая ковалентно связана с указанным соединением, хорошо известны специалисту в данной области (см. некоторые примеры таких тестов или анализов далее по тексту, однако эти тесты не ограничиваются приведенными здесь примерами).
В частности, эти тесты или анализы могут быть осуществлены методами FACS, иммунофлуоресценции, проточной цитометрии, вестерн-блоттинга, оценки цитотоксичности/цитостатичности и т.д.
В этом аспекте настоящее изобретение также относится к способу получения in vitro цитотоксического или цитостатического комплекса, способного доставлять цитотоксическое соединение в клетку млекопитающего, предпочтительно, жизнеспособную клетку, при этом способ включает стадию: - ковалентного связывания цитотоксического агента с соединением, которое:
i) способно специфически связываться с белком Axl, предпочтительно, белком Axl человека, и
ii) интернализуется в клетку млекопитающего после его связывания с белком Axl, когда указанный белок Axl экспрессируется на поверхности клетки млекопитающего.
Предпочтительно, указанное соединение представляет собой подобное белку соединение, более предпочтительно, антитело, которое специфически направлено на белок Axl или его эпитоп, расположенный в домене EDC Axl, или функциональный связывающий фрагмент указанного антитела.
В предпочтительном варианте осуществления указанный цитотоксический агент ковалентно связан с антителом к Axl или его функциональным фрагментом с помощью линкера, более предпочтительно, пептидного линкера, более предпочтительно, расщепляемого пептидного линкера, более предпочтительно, линкера, который может расщепляться, например, природными внутриклеточными соединениями, но не ограничиваясь ими.
Подобно другим членам семейства ТАМ, внеклеточный домен (ECD) Axl имеет строение, похожее на строение молекул клеточной адгезии. ECD Axl характеризуется сочетанием двух иммуноглобулин-подобных доменов, за которыми следуют два смежных фибронектин-Ш-подобных домена [O'Bryan J.P. et al. Mol. Cell Biol. (1991). 11, 5016-5031]. Эти два N-концевых иммуноглобулин-подобных домена являются достаточными для связывания лиганда Gas6 [Sasaki Т. et al. EMBO J. (2006).25, 80-87].
ECD белка Axl человека представляет собой фрагмент из 451 аминокислоты, соответствующий аминокислотам 1-451 последовательности SEQ ID NO. 29, которая представлена в перечне последовательностей как SEQ ID NO. 31. Аминокислоты 1-25 соответствуют сигнальному пептиду, ECD белка Axl человека без сигнального пептида соответствует аминокислотам 26-451 последовательности SEQ ID NO. 29, представленным последовательностью SEQ ID NO. 32.
На сегодняшний день установлены различные способы интернализации. Они определяют место появления интернализованных белков или белковых комплексов в клетке. После эндоцитоза большинство мембранных белков или липидов возвращается к клеточной поверхности (рециклизация), но некоторые компоненты мембраны доставляются к поздним эндосомам или Гольджи [Maxfield F.R. & McGraw, Т.Е. Nat. Rev. Mol. Cell Biol. (2004). 5, 121-132].
В предпочтительном варианте осуществления изобретение относится к антиген-связывающему белку или его антиген-связывающему фрагменту, который i) специфически связывается с белком Axl человека и ii) интернализуется после его связывания с указанным белком Axl человека, где указанный антиген-связывающий белок содержит по меньшей мере аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO. 1-14, или любую последовательность, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, идентичную последовательностям SEQ ID NO. 1-14.
В наиболее предпочтительном варианте осуществления изобретение относится к антиген-связывающему белку или его антиген-связывающему фрагменту, который
i) специфически связывается с белком Axl человека, предпочтительно имеющим последовательность SEQ ID NO. 29 или 30 или ее встречающийся в природе вариант, и
ii) интернализуется после его связывания с указанным белком Axl человека, где указанный антиген-связывающий белок содержит по меньшей мере аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO. 1-14.
«Связывающий белок» или «антиген-связывающий белок» представляет собой пептидную цепь, имеющую специфическое или общее сродство с другим белком или молекулой (обычно называемой антигеном). Белки входят в контакт и, если связывание возможно, образуют комплекс. Предпочтительно, антиген-связывающий белок согласно изобретению может представлять собой, без ограничения, антитело, фрагмент или производное антитела, белок или пептид.
Под «антиген-связывающим фрагментом» антиген-связывающего белка согласно изобретению следует понимать любой пептид, полипептид или белок, сохраняющий способность специфически связываться с мишенью (также обычно называемой антигеном) антиген-связывающего белка и включающий аминокислотную последовательность из по меньшей мере 5 смежных аминокислотных остатков, по меньшей мере 10 смежных аминокислотных остатков, по меньшей мере 15 смежных аминокислотных остатков, по меньшей мере 20 смежных аминокислотных остатков, по меньшей мере 25 смежных аминокислотных остатков, по меньшей мере 40 смежных аминокислотных остатков, по меньшей мере 50 смежных аминокислотных остатков, по меньшей мере 60 смежных аминокислотных остатков, по меньшей мере 70 смежных аминокислотных остатков, по меньшей мере 80 смежных аминокислотных остатков, по меньшей мере 90 смежных аминокислотных остатков, по меньшей мере 100 смежных аминокислотных остатков, по меньшей мере 125 смежных аминокислотных остатков, по меньшей мере 150 смежных аминокислотных остатков, по меньшей мере 175 смежных аминокислотных остатков, по меньшей мере 200 смежных аминокислотных остатков, или по меньшей мере 250 смежных аминокислотных остатков из аминокислотной последовательности антиген-связывающего белка.
В предпочтительном варианте осуществления, где антиген-связывающий белок представляет собой антитело, такие «антиген-связывающие фрагменты» выбирают из группы, состоящей из Fv, scFv (sc означает одноцепочечный), Fab, F(ab')2, Fab', scFv-Fc-фрагментов или диател, или любого фрагмента, время полужизни которого увеличено путем химической модификации, например, путем добавления поли(алкилен)гликоля, такого как поли(этилен)гликоль («ПЭГилирование») (пегилированные фрагменты называют Fv-PEG, scFv-PEG, Fab-PEG, F(ab')2-PEG или Fab'-PEG) («PEG» от поли(этилен)гликоль), либо путем включения в липосому, причем указанные фрагменты имеют по меньшей мере один из характерных CDR антитела согласно изобретению. Предпочтительно, указанные «антиген-связывающие фрагменты» будут представлять собой или содержать часть последовательности вариабельной области тяжелой или легкой цепи антитела, из которого они получены, причем указанная часть последовательности достаточна для того, чтобы сохранить ту же специфичность связывания, как и у антитела, из которого она произошла, и достаточное сродство, предпочтительно, по меньшей мере равное 1/100, в более предпочтительном варианте - по меньшей мере 1/10 сродства антитела, из которого она произошла, по отношению к мишени. Такой функциональный фрагмент будет содержать по меньшей мере 5 аминокислот, предпочтительно 10, 15, 25, 50 и 100 последовательных аминокислот из последовательности антитела, из которого он получен.
Термин «эпитоп» означает область антигена, которая связывается антиген-связывающим белком, в том числе антителами. Эпитопы могут быть определены как структурные или функциональные. Функциональные эпитопы, как правило, являются разновидностью структурных эпитопов и включают те остатки, которые непосредственно способствуют аффинности взаимодействия. Эпитопы также могут быть конформационными, то есть состоять из аминокислот, не являющихся линейной последовательностью в белке. В некоторых вариантах осуществления эпитопы могут включать детерминанты, которые являются химически активными поверхностными группировками молекул, такие как аминокислоты, боковые цепи Сахаров, фосфорильные группы или сульфонильные группы, и в некоторых вариантах осуществления могут иметь специфические характеристики трехмерной структуры и/или специфические характеристики заряда.
В настоящей заявке эпитоп локализован во внеклеточном домене белка Axl человека.
В соответствии с предпочтительным вариантом осуществления изобретения антиген-связывающий белок или его антиген-связывающий фрагмент специфически связывается с эпитопом, локализованным во внеклеточном домене белка Axl человека, предпочтительно имеющим последовательность SEQ ID NO. 31 или 32 или ее встречающийся в природе вариант.
Под выражениями «специфическое связывание», «специфически связывается» или тому подобными подразумевают, что антиген-связывающий белок или его антиген-связывающий фрагмент образует комплекс с антигеном, который относительно стабилен в физиологических условиях. Специфическое связывание можно охарактеризовать равновесной константой диссоциации по меньшей мере приблизительно 1×10-6 М или менее. Методы определения того, связываются ли две молекулы специфично, хорошо известны в данной области и включают, например, равновесный диализ, поверхностный плазмонный резонанс и тому подобное. Во избежание сомнений, данный термин не означает, что указанный антиген-связывающий фрагмент не мог бы связываться или взаимодействовать на низком уровне с другим антигеном. Тем не менее, в предпочтительном варианте осуществления указанный антиген-связывающий фрагмент связывается только с указанным антигеном.
В этом смысле «ЕС50» относится к 50% эффективной концентрации. Точнее, термин «полумаксимальная эффективная концентрация» (ЕС50) соответствует концентрации лекарственного средства, антитела или токсиканта, которая вызывает ответ посередине между исходной точкой и максимумом после некоторого заданного времени воздействия. Он обычно используется в качестве единицы измерения активности препарата. ЕС50 по градуированной кривой зависимости ответа от дозы, таким образом, представляет концентрацию соединения, при которой наблюдается 50% от максимального эффекта. ЕС50 по кривой зависимости ответа от дозы, полученной для данных в форме наличия или отсутствия ответа, представляет концентрацию соединения, при которой 50% популяции проявляет ответ после заданной продолжительности воздействия. Измерения концентрации обычно выстраиваются в сигмоидальную кривую, быстро возрастающую при относительно малом изменении концентрации. Она может быть определена математически путем построения наилучшей эмпирической кривой.
В предпочтительном варианте осуществления ЕС50, определенная в настоящем изобретении, характеризует эффективность связывания антитела с ECD Axl, экспонированным на опухолевых клетках человека. Параметр ЕС50 определяется с помощью анализа FACS. Параметр ЕС50 отражает концентрацию антитела, при которой достигается 50% от максимального связывания Axl человека, экспрессированного на опухолевых клетках человека. Каждое значение ЕС50 было рассчитано как средняя точка кривой зависимости ответа от дозы с использованием программы вычерчивания четырехпараметрической регрессионной кривой (Prism Software). Этот параметр был выбран в качестве репрезентативного для физиологических/патологических состояний.
В одном из вариантов осуществления изобретения антиген-связывающий белок или его антиген-связывающий фрагмент связывается со своим эпитопом с ЕС50 по меньшей мере 10-9 М, предпочтительно, между 10-9 и 10-12 М.
Еще один вариант осуществления изобретения представляет собой процесс или способ отбора антиген-связывающего белка или его антиген-связывающего фрагмента, способного внутриклеточно интернализоваться в клетку млекопитающего, предпочтительно, в клетку человека, предпочтительно, в жизнеспособную клетку, включающий стадии:
- i) отбор антиген-связывающего белка, который специфически связывается с Axl, предпочтительно, с его доменом EDC или с его эпитопом; и
- ii) отбор антиген-связывающего белка из предшествующей стадии i), который интернализуется в клетку млекопитающего после его связывания с белком Axl, экспрессируемым на поверхности клетки млекопитающего.
В частном воплощении указанная клетка млекопитающего естественным образом экспрессирует рецептор белка Axl на своей поверхности или является клеткой млекопитающего, предпочтительно, клеткой человека, которая экспрессирует рекомбинантный белок Axl на своей поверхности.
Такой способ или процесс может включать стадии i) отбора антиген-связывающего белка, который специфически связывается с Axl с ЕС50 по меньшей мере 10-9 М и ii) отбор антиген-связывающего белка из предшествующей стадии, который интернализуется после связывания с Axl. Стадия отбора ii) может быть осуществлена любым способом, известным специалисту в данной области для оценки интернализации. В частности, можно провести тесты с помощью FACS, иммунофлуоресценции, проточной цитометрии, вестерн-блоттинга, оценки цитотоксичности и т.д.
Еще одной характеристикой антиген-связывающего белка согласно изобретению является то, что он не имеет какой-либо значительной активности в отношении пролиферации опухолевых клеток. В частности, как показано в нижеприведенных примерах, антиген-связывающий белок согласно изобретению не имеет какой-либо существенной активности in vitro на модели пролиферации SN12C.
В онкологии существует несколько механизмов, посредством которых моноклональные антитела (mAbs) могут проявлять терапевтический эффект, но зачастую их активность недостаточна для получения долговременного положительного эффекта. Поэтому были использованы несколько стратегий для усиления их активности, в частности, комбинирование их с лекарственными средствами, такими как химиотерапевтические агенты. В качестве эффективной альтернативы таким комбинационным подходам, новым возможным терапевтическим средством для лечения рака могут стать иммунотоксины [Beck А. et al. Discov. Med. (2010). 10, 329-339; Alley S.C. et al. J. Pharmacol. Exp. Ther. (2009). 330, 932-938]. Конъюгаты антитело-лекарственное средство (ADC) представляют собой один из подходов, при которых возможность использовать специфичность mAbs и адресную доставку цитотоксического агента к опухоли может значительно повысить активность как mAbs, так и лекарственного средства. В идеале mAb будет специфически связываться с антигеном со значительной экспрессией на опухолевых клетках, но с ограниченной экспрессией на нормальных клетках.
Настоящее изобретение направлено на белок, специфически связывающий Axl, и, более конкретно, на специфичное антитело к Axl, которое обладает высокой способностью к интернализации после связывания с Axl. Такой антиген-связывающий белок представляет интерес как один из компонентов конъюгата антитело-лекарственное средство, чтобы обеспечивать адресную доставку присоединенного цитотоксического агента в раковые клетки-мишени. Сразу после интернализации цитотоксический агент вызывает гибель раковых клеток.
Важными моментами для успешной иммуноконъюгационной терапии считают специфичность к антигену-мишени и интернализацию раковыми клетками комплексов антиген-связывающих белков. Очевидно, неинтернализующиеся антигены являются менее эффективными для доставки цитотоксических агентов, чем интернализующиеся антигены. Процессы интернализации различаются среди антигенов и зависят от нескольких параметров, которые могут зависеть от связывающих белков. RTK клеточной поверхности представляют собой интересное семейство антигенов для исследования такого подхода.
В биомолекуле цитотоксический агент привносит цитотоксическую активность, а используемый антиген-связывающий белок вносит свою специфичность против раковых клеток, а также является переносчиком для проникновения внутрь клеток, чтобы правильно направить цитотоксический агент.
Таким образом, чтобы улучшить молекулу иммуноконъюгата, белок, связывающий носитель, должен проявлять высокую способность к интернализации в раковые клетки-мишени. Эффективность, с которой связывающие белки опосредовали интернализацию, существенно различается в зависимости от эпитопа-мишени. Отбор активно интернализующихся белков, связывающих Axl, требует разнообразных экспериментальных данных, показывающих не только снижение экспрессии Axl, но и последующее появление связывающих Axl белков в этих клетках.
В предпочтительном варианте осуществления интернализация антиген-связывающего белка согласно изобретению может быть оценена, предпочтительно, посредством иммунофлуоресценции (как показано в последующих примерах в настоящей заявке) или любого способа или процесса, известного специалисту в данной области техники, специфичного для данного механизма интернализации.
В другом предпочтительном варианте осуществления, так как после связывания связывающего белка согласно изобретению с ECD указанного Axl комплекс антиген-связывающего белка с Axl в соответствии с изобретением интернализуется, происходит уменьшение количества Axl на поверхности клеток. Это уменьшение может быть количественно измерено любым способом, известным специалисту в данной области (вестерн-блоттинг, FACS, иммунофлюоресценция и т.д.).
В одном варианте осуществления изобретения это снижение, отражающее интернализацию, предпочтительно, может быть измерено с помощью FACS и выражено как отличие или разность между средней интенсивностью флуоресценции (MFI), измеренной на необработанных клетках, и MFI, измеренной на клетках, обработанных антиген-связывающим белком согласно изобретению.
В качестве неограничивающего примера настоящего изобретения эта разность определяется на основе MFI, полученных для необработанных клеток и клеток, обработанных антиген-связывающим белком согласно настоящему изобретению, как описано в примере 9, с использованием i) клеток опухоли почки человека SN12C после 24-часового периода инкубации с антиген-связывающим белком согласно изобретению и ii) вторичного антитела, меченого Alexa 488. Этот параметр определяют путем вычислений по следующей формуле:
Эта разность между MFI отражает снижение количества Axl, так как MFI пропорциональны количеству Axl, экспрессированного на поверхности клетки.
В более предпочтительном и выгодном аспекте антиген-связывающий белок или его антиген-связывающий фрагмент согласно изобретению состоит из моноклонального антитела, предпочтительно, выделенного Mab, вызывающего Δ(MFI24ч необработанных клеток - MFI24ч обработанных клеток), равную по меньшей мере 200, предпочтительно, по меньшей мере 300.
Антиген-связывающий белок или его антиген-связывающий фрагмент в соответствии с изобретением вызывает снижение MFI, равное по меньшей мере 200.
Более подробно, вышеупомянутая разность может быть измерена в соответствии со следующим способом, который должен рассматриваться в качестве иллюстративного и неограничивающего примера:
a) обработка и инкубация представляющих интерес опухолевых клеток с антиген-связывающим белком согласно изобретению;
b) обработка клеток, обработанных на стадии а), и, параллельно, необработанных клеток антиген-связывающим белком согласно изобретению,
c) измерение MFI (отражающей количество Axl, присутствующего на поверхности) для обработанных и необработанных клеток с использованием вторичного меченого антитела, способного связываться с антиген-связывающим белком, и
d) расчет разности, получаемой вычитанием из значения MFI, полученного для обработанных клеток, значения MFI, полученного для необработанных клеток.
Термины «антитело», «антитела» или «иммуноглобулин» используются взаимозаменяемо в самом широком смысле и включают монокпональные антитела, предпочтительно, выделенные Mab (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела или мультиспецифические антитела (например, биспецифические антитела, если они проявляют желаемую биологическую активность).
В частности, такие молекулы состоят из гликопротеина, содержащего по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, связанные дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область (или домен) тяжелой цепи (сокращенно обозначаемую здесь как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи включает три домена, СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначаемую здесь как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи включает один домен, CL. Участки VH и VL могут быть разделены на участки гипервариабельности, называемые участками, определяющими комплементарность (CDR), чередующиеся с участками, которые являются более консервативными, называемыми каркасными участками (FR). Каждая VH и VL состоит из трех CDR и четырех FR, располагаемых от аминоконца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе различными клетками иммунной системы (например, эффекторными клетками) и первым компонентом (C1q) классической системы комплемента.
Антитела в контексте настоящего изобретения также означают некоторые фрагменты антител. Указанные фрагменты антител проявляют желаемую специфичность связывания и аффинность независимо от источника или типа иммуноглобулина (например, IgG, IgE, IgM, IgA и т.д.), то есть они способны специфически связываться с белком Axl с аффинностью, сравнимой с полноразмерными антителами согласно изобретению.
В общем, для получения моноклональных антител или их функциональных фрагментов, особенно мышиного происхождения, можно использовать методы, которые описаны, в частности, в руководстве «Антитела» (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp.726, 1988), или методы получения из гибридом, описанные в Kohler and Milstein (Nature, 256:495-497, 1975).
Термин «моноклональное антитело» или «Mab», используемый в данном документе, относится к молекуле антитела, которая направлена на конкретный антиген и которая может быть получена с помощью единственного клона В-клеток или гибридомы. Моноклональные антитела также могут быть рекомбинантными, т.е. производимыми с помощью белковой инженерии. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные на различные детерминанты или эпитопы, каждое моноклональное антитело направлено на один эпитоп антигена. Изобретение относится к антителам, выделенным или полученным путем очистки из природных источников или полученным с помощью генетической рекомбинации или химического синтеза.
Предпочтительный вариант осуществления изобретения представляет собой антиген-связывающий белок или его антиген-связывающий фрагмент, содержащий или состоящий из антитела, при этом указанное антитело содержит три CDR легкой цепи, содержащие последовательности SEQ ID NO. 1, 2 и 3 или любую последовательность, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, идентичную SEQ ID NO. 1, 2 и 3; и три CDR тяжелой цепи, содержащие последовательности SEQ ID NO. 4, 5 и 6 или любую последовательность, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, идентичную SEQ ID NO. 4, 5 и 6.
В более предпочтительном варианте осуществления изобретения антиген-связывающий белок или его антиген-связывающий фрагмент состоит из антитела, при этом указанное антитело содержит три CDR легкой цепи, содержащие последовательности SEQ ID NO. 1, 2 и 3; и три CDR тяжелой цепи, содержащие последовательности SEQ ID NO. 4, 5 и 6.
В предпочтительном аспекте под участками CDR, или CDR(s), понимают гипервариабельные участки тяжелой и легкой цепей иммуноглобулинов, как определено IMGT. Во избежание каких-либо противоречий CDRs будут определяться в настоящем описании в соответствии с системой нумерации IMGT.
Уникальная нумерация IMGT была введена, чтобы сравнивать вариабельные домены независимо от рецептора антигена, типа цепи или вида [Lefranc М.-Р., Immunology Today 18, 509 (1997)/Lefranc М.-Р., The Immunologist, 7, 132-136 (1999) / Lefranc, M.-P., Pommié, C, Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, Dev. Сотр. Immunol., 27, 55-77 (2003)]. В уникальной нумерации IMGT консервативные аминокислоты всегда имеют ту же самую позицию, например, цистеин 23 (1st-CYS), триптофан 41 (CONSERVED-TRP), гидрофобная аминокислота 89, цистеин 104 (2nd-CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). Уникальная нумерация IMGT обеспечивает стандартизированное разграничение каркасных областей (FR1-IMGT: позиции от 1 до 26, FR2-IMGT: от 39 до 55, FR3-IMGT: от 66 до 104, и FR4-IMGT: от 118 до 128) и участков, определяющих комплементарность: CDR1-IMGT: от 27 до 38, CDR2-IMGT: от 56 до 65, и CDR3-IMGT: от 105 до 117. Так как разрывы представляют собой незанятые позиции, длины CDR-IMGT (показаны в скобках и разделяются точками, например, [8.8.13]) становятся определяющей информацией. Уникальная нумерация IMGT используется в виде графических 2D структур, называемых «Жемчужные колье IMGT» (IMGT Colliers de Perles) [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002) / Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)], и в 3D структурах в IMGT/3Dstructure-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210(2004)].
Необходимо понимать, что для исключения противоречия в настоящем описании определяющие комплементарность участки или CDRs означают гипервариабельные области тяжелой и легкой цепей иммуноглобулинов, как они определены в соответствии с системой нумерации IMGT.
Тем не менее, CDRs также могут быть определены в соответствии с системой нумерации Kabat (Kabat et al., Sequences of proteins of immunological interest, 5th Ed., U.S. Department of Health and Human Services, NIH, 1991, и более поздние издания). Существуют три CDR тяжелых цепей и три CDR легких цепей. В данном документе термины «CDR» и «CDRs» (CDR в единственном числе или множественном числе соответственно) используются для обозначения, в зависимости от конкретно