Эффективные мишени рнк-интерференции в геноме вич-1 и субстраты дайсера, предназначенные для их поражения
Иллюстрации
Показать всеИзобретение относится к областям медицинской и молекулярной генетики, а также к генотерапии, и касается набора, включающего шесть субстратов Дайсера. Представленный набор включает шесть субстратов Дайсера, которые образуют в клетках человека шесть siРНК:
5'AAAAAGCAUCAGAAAGAACCUCCAUUU 3' - А1 (7)
5'AAAUGGAGGUUCUUUCUGAUGCUUUUU 3' - A1 (8)
5'AGACAUAGUUAUCUAUCAAUACAUGGA 3' - A2 (9)
5'UCCAUGUAUUGAUAGAUAACUAUGUCU 3' - A2 (10)
5'AGGAGUAGUGGAGUCUAUGAAUAAGGA 3' - A3 (11)
5'UCCUUAUUCAUAGACUCCACUACUCCU 3' - A3 (12)
5'GUGUGGACUAUAGUAGGUAUAGAAUAU 3' - A4 (13)
5'AUAUUCUAUACCUACUAUAGUCCACAC 3' - A4 (14)
5'ACCAGGACAGACAUGGUAUGGAACAGG 3' - A5 (15)
5'CCUGUUCCAUACCAUGUCUGUCCUGGU 3' - A5 (16)
5'GUGCGAGAGCGUCAGUAUUAAGUGGGG 3' - A6 (17)
5'CCCCACUUAAUACUGACGCUCUCGCAC 3' - A6 (18),
которые при введении в клетки человека способны поражать соответствующие консервативные мишени в мРНК ВИЧ-1 (А1-А6):
5'AAAAAGCATCAGAAAGAACCTCCATTT 3' - A1 (1)
5'AGACATAGTTATCTATCAATACATGGA 3' - А2 (2)
5'AGGAGTAGTGGAGTCTATGAATAAGGA 3' - A3 (3)
5'GTGTGGACTATAGTAGGTATAGAATAT 3' - А4 (4)
5'ACCAGGACAGACATGGTATGGAACAGG 3' - А5 (5)
5'GTGCGAGAGCGTCAGTATTAAGTGGGG 3' - А6 (6),
расположенные в доменах обратной транскриптазы (мишени А1 и А2) и интегразы (мишень A3) гена pol, в мРНК гена vpu (мишень А4), а также мРНК гена env в ее домене gp120 (мишень А5) и мРНК гена gag в домене р17 (мишень А6), и вызывать подавление продукции вируса в клетках человека. Изобретение может быть использовано в медицине и научных исследованиях. 2 ил., 4 табл., 1 пр.
Реферат
Изобретение относится к областям медицинской и молекулярной генетики, а также к генотерапии, и связано с выявлением шести эффективных мишеней для РНК-интерференции в вирусе иммунодефицита человека 1 типа (ВИЧ-1) субтипа А. Данные мишени выявлены на основе детального анализа последовательностей нуклеотидов в жизненно важных генах pol, vpu, env, и gag ВИЧ-1, кодирующих соответственно обратную транскриптазу (RT), интегразу (Int), белок vpu, белок gp120 и белок р17.
Они находятся в наиболее консервативных 27-нуклетидных областях указанных генов. Кроме того, предложены прототипы препаратов, субстраты Дайсера, которые являются 27-нуклеотидными двухцепочечными РНК и эффективно поражают эти мишени в транскриптах вируса с помощью РНК-интерференции. При этом транскрипты разрезаются, в результате чего соответствующие гены не экспрессируются. Это вызывает обрыв жизненного цикла ВИЧ-1 и блокирует его наработку в клетках человека.
Обратная транскриптаза (RT) ВИЧ-1 синтезирует копии ДНК на РНК-матрицах вируса, а интеграза (Int) обеспечивает встраивание вирусной ДНК в хромосому клетки хозяина. Эти продукты кодируются геном pol.
Белок vpu необходим для выделения дочерних вирионов из клетки. Кроме того, он взаимодействует с клеточными факторами, блокируя противовирусную защиту хозяина.
Матриксный белок р17, который кодируется геном gag, содержит домен мембранной локализации (М, membrane targeting). Данный структурный белок, окружающий капсид, играет важную роль на многих стадиях жизненного цикла вируса, включая репликацию, нацеливание РНК на плазматическую мембрану, сборку вирионов и некоторые другие [Fiorentini S, Marini Е, Caracciolo S, Caruso A. Functions of the HIV-1 matrix protein p17. New Microbiol. 2006 Jan; 29(1):1-10].
Белок gp120, который кодируется геном env, необходим для проникновения вируса в клетку.
В настоящее время основным подходом лечения СПИДа и ВИЧ-инфекции является назначение пациентам противовирусной химиотерапии, включающей препараты, действующие на ключевые ферменты ВИЧ-1 - обратную транскриптазу, интегразу, протеазу. Однако, несмотря на большое количество разработанных препаратов, существует проблема эффективности применяемой противовирусной терапии. Основная причина, объясняющая неэффективность лечения - адаптивный мутагенез вируса, приводящий к появлению вариантов вируса, обладающих устойчивостью к противовирусным препаратам. Серьезными проблемами являются также токсичность и высокая стоимость применяемых лекарственных средств.
Известно применение рибозимов и антисмысловых РНК для терапии ВИЧ-инфекции [Dorman N. And Lever A.M. (2001) RNA-based gene therapy for HIV infection. HIV Med., 2, 114-122; Michienzi A., Conti L., Varano В., Prislei S., Gessani S., and Bozzoni I. (1998) Inhibition of human immunodeficiency virus type 1 replication by nuclear chimeric anti-HIVribozymes in a human T lymphoblastoid cell line. Hum. Gene Ther., 9., 621-628; Veres G., Junker U., Baker J., Barske C., Kalfoglou C., Ilves H., Escaich S., Kaneshima H., and Bohnlein E. (1998) Comparative analysis of intracellularly expressed antisense RNAs as inhibitors of human immunodeficiency virus type 1 replication. J. Virol., 72, 1894-1901], которые блокируют несколько генов ВИЧ, что снижает его активность.
РНК-интерференция - мощный природный механизм регуляции экспрессии генов. Он запускается с помощью нарезания ферментом Дайсером, двухцепочечных РНК на 21-нуклеотидные фрагменты, которые имеют двух нуклеотидные выступы на 3' концах. Дайсер облегчает загрузку таких РНК (двухцепочечные siРНК) в сложные белковые комплексы - RISC - в которых остается только антисмысловая цепь РНК (одноцепочечная siРНК). Она служит гидом, с помощью которого RISC узнает комплементарные нуклеотидные последовательности в мРНК и разрезает их. Тем самым блокируется экспрессия соответствующего гена. Механизмы РНК-интерференции требуют полной комплементарности между мишенью в транскрипте вируса и соответствующей siРНК [Pusch et al., Nucl. Acids Res., 2003, 31, 6444-6449; Senserrich et al., Virology, 2008, 372, 421-429]. ВИЧ-1 отличает высокая вариабельность. Именно поэтому для создания технологии генотерапии ВИЧ/СПИДа требуется тщательное изучение мишеней РНК-интерференции и отбор только таких полностью комплементарных мишеней, которые одинаковы в 70-95% клинических вариантах вирусов [Kretova OV, Chechetkin VR, Fedoseeva DM, Kravatsky YV, Sosin DV, Alembekov IR, Gorbacheva MA, Gashnikova NM, Tchurikov NA. Analysis of variability in HIV-1 subtype A strains in Russia suggests a combination of deep sequencing and multi-target RNA interference for silencing of the virus. AIDS Res Hum Retroviruses. 2016 Jul 30. Epub ahead of print DOI:10.1089/AID.2016.0088 PMID:27476852].
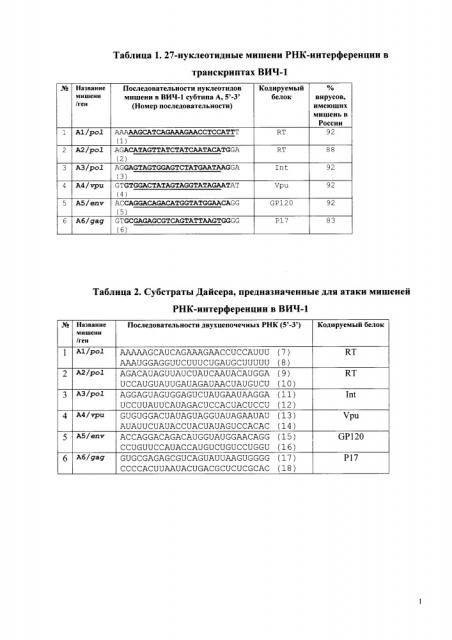
С помощью капиллярного и глубокого секвенирования генома ВИЧ-1 субтипа А в двух когортах больных в России была изучена вариабельность в шести выбранных мишенях РНК-интерференции. В результате был сделан вывод о том, что выбранные шесть мишеней являются высоко консервативными и вполне пригодными для использования в генотерапии (Таблица 1).
Предложены шесть субстратов Дайсера (Таблица 2), которые предназначены для эффективного подавления продукции данных клинических вариантов ВИЧ-1 в клетках человека. Они могут быть использованы в медицине для генотерапии СПИДа и ВИЧ-инфекции, а также в научных исследованиях для мощного подавления продукции ВИЧ-1 субтипа А.
Наиболее близким к данному изобретению является генетическая конструкция, обеспечивающая экспрессию двух анти-ВИЧ-1 siРНК, соответствующих мишеням А1 и A3 данной Заявки (патент РФ №2552486, опубликован 6 мая 2015 г.). Кроме того, такие же мишени А2, А4, А5 и А6 приведены в патенте РФ 2552607 (мишени А1 и А6), опубликованном 7 мая 2015 г.; в патенте РФ 2607381, опубликованном 10 января 2017 г. (мишени А1 и А2).
Настоящее изобретение отличается тем, что
1. предлагается использовать не две, а шесть указанных выше высоко консервативных мишеней РНК-интерференции в генах pol, vpu, env и gag ВИЧ-1, выявленных у больных в России;
2. использовать не генетические конструкции, экспрессирующие 27-30-нуклеотидные шпильки РНК, а 27-нуклеотидные двухцепочечные РНК, субстраты Дайсера.
Отличия в нуклеотидных последовательностях мишеней настоящей Заявки от мишеней в более ранних Заявках и Патентах представлены в Таблице 3.
Ранее было описано, что 27-нуклеотидные двухцепочечные РНК позволяют усиливать эффективность РНК-интерференции на два порядка [Kim DH, Behlke MA, Rose SD, Chang MS, Choi S, Rossi JJ. Synthetic dsRNA Dicer substrates enhance RNAi potency and efficacy. Nat Biotechnol. 2005; Grimm D, Streetz KL, Jopling CL, Storm ТА, Pandey K, Davis CR, Marion P, Salazar F, Kay MA. Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways. Nature. 2006 May 5; 441(7092):537-41]. Согласно другим данным эффективность РНК-интерференции, запускаемая субстратами Дайсера, возрастает для разных мишеней в 2-5 раз [Патент РФ №2385939, опуб. 10.04.2010; Алембеков И.Р., Кретова О.В., Чуриков Н.А.. Анализ генетических конструкций, экспрессирующих антивирусные siРНК, в невирусной тест-системе. Вопросы вирусологии, 2011, т. 56, №2, с. 32-35].
Данные о мишенях РНК-интерференции ВИЧ-1 субтипа А в клинических вариантах вируса, выделенных у больных в России, получены с помощью капиллярного и глубокого секвенирования шести мишеней РНК-интерференции и депонированы в GenBank (accession numbers: KC681847-KC681888) и NCBI (Biosamples: SAMN05823508 и SAMN05828325). Все выявленные мишени характерны для изолятов вируса в России и встречаются в 83-92% вирусов (Таблица 1). Кроме того, идентичные им мишени встречаются в изолятах ВИЧ-1 из разных стран, помимо России (Таблица 4). Поиск идентичных мишеней в текущих базах данных нуклеотидных последовательностей проводили с помощью программы BLAST (NCBI). Число изученных изолятов ВИЧ-1 в разных странах может значительно отличаться. Тем не менее данные поиска свидетельствуют о том, что выявленные мишени помимо России также часто встречаются в изолятах ВИЧ-1 11-20 субтипов разных стран на всех континентах. Кроме того, мишени, идентичные мишеням А1, A3 и А6 данной Заявки, имеются в рекомбинантных вирусах AG ВИЧ-1, которые были описаны ранее [Baryshev, P.B., Bogachev, V.V. and Gashnikova, N.M. Genetic characterization of an isolate of HIV type 1 AG recombinan form circulating in Siberia, Russia. J. Arch. Virol. 157 (12), 2335-2341 (2012)].
Техническим результатам предлагаемого изобретения являются выявленные с помощью капиллярного и глубокого секвенирования в изолятах ВИЧ-1 в России шесть консервативных мишеней РНК-интерференции (А1-А6), приведенные в Таблице 1, а также соответствующие им шесть субстратов Дайсера, которые при введении в клетки человека способны поражать транскрипты генов pol (домены обратной транскриптазы, RT, и интегразы, int), vpu, env (домен gp120) и gag (домен p17) ВИЧ-1 и вызывать подавления продукции вируса в клетках человека.
Представленный технический результат достигается путем доставки одного или нескольких субстратов Дайсера (Таблица 2) в клетки человека.
Указанные субстраты Дайсера тестировали с помощью невирусной системы. Данная система предназначена для количественной оценки биологической активности siРНК, которые образуются in vivo при экспрессии генетических конструкций или при введении двухцепочечных РНК. Система создана на базе вектора psiCHECK™-2 (Promega, номер последовательности в GenBank AY535007). Вектор содержит ген люциферазы светлячка (Photinus pyralis) и ген люциферазы коралла (Renilla). Указанные люциферазы вызывают свечение разной длины волны, и их экспрессию можно измерять с помощью люминометра. В 3' концевую некодирующую область гена Renilla порознь вставляли 27-нуклеотидные последовательности ДНК, содержащие мишени A1, А2, A3, А4, А5, А6, соответствующие выбранным мишеням РНК-интерференции в транскриптах вируса. Указанные ДНК получают с помощью химического синтеза олигонуклеотидов ДНК. В Таблице 1 представлены тексты мишеней. Фрагменты ДНК, содержащие мишени, клонируют в векторе psiCHECK™-2 по сайтам рестриктаз XhoI и NotI.
Тестирование биологической активности кассеты проводят в экспериментах по трансфекции культуральных клеток человека. При этом используют ДНК плазмиды, созданной на базе вектора psi-CHECK-2, в котором в составе 3' концевой некодирующей последовательности гена люциферазы Renilla клонирована последовательность ДНК, содержащая шесть мишеней РНК-интерференции, указанных в Таблице 1. В такие клетки человека, трансфецированые указанной плазмидой, вводят химически синтезированные препараты двухцепочечных РНК (субстраты Дайсера), указанные в Таблице 2. Они являются природным субстратом Дайсера, фермента, вырезающего 21 нуклеотидные дуплексы РНК из шпильки. Если Дайсер работает на дуплексе РНК длиной более 23 пар нуклеотидов (природный субстрат), то далее он, оставаясь связанным с двуспиральной siРНК, активно участвует также и в ее "загрузке" в белковый комплекс RISC. В данном комплексе происходит раскручивание цепей siРНК и освобождение его от одной из них (от так называемой "passenger"-цепи). Если в комплексе остается антисмысловая siРНК, то она используется как "наводчик", узнающий комплементарную мишень в транскриптах клетки. После связывания комплекса с соответствующей мРНК происходит ее разрезание одним из его белков, что приводит к выключению экспрессии соответствующего гена вируса и нарушает его размножение в клетке-хозяине. В трансфецированных клетках мРНК Renilla, содержащая в 3'-некодирующей области испытываемую мишень РНК-интерференции, разрезается, что приводит к резкому снижению голубого свечения, вызываемого данной люциферазой (478 nm). Желто-зеленое свечение, вызываемое люциферазой светлячка (557 nm), кодируемой той же ДНК psiCHECK-2, служит внутренним контролем и используется для нормализации данных.
Для отбора наиболее консервативных областей ВИЧ-1 проводили множественное выравнивание известных в 2001 году последовательностей вируса. Затем в наиболее консервативных областях проводили поиск мишеней, используя on-line сервисы, предназначенные для поиска siРНК. Использовали одиннадцать критериев для отбора последовательностей мишеней РНК-интерференции в мРНК генов ВИЧ-1. Большинство из них соответствует критериям отбора siРНК фирмы Dharmacon RNA Technologies, http://dharmacon.gelifesciences.com/design-center/.,skb. Так были отобраны мишени А2-А6. Мишень А1 была отобрана по критериям Тушла (Tom Tuschl's rules, http://www.protocol-online.org/prot/Protocols/Rules-of-siRNA-design-for-RNA-interference--RNAi--3210.html).
Указанные критерии важны для того, чтобы именно антисмысловая цепь siРНК оставалась в комплексе RISC. Каждый из приведенных в Таблице 2 субстратов Дайсера в генетических конструкциях соответствует, по крайней мере, десяти из одиннадцати ниже перечисленных критериев, которые использовались для отбора коровых 19-нуклеотидных последовательностей siРНК (соответствующие им области подчеркнуты в последовательностях мишеней, указанных в Таблице 1):
- состав G/C 30-52%
- не менее 3 A/U в позициях 15-19 смысловой цепи
- отсутствие внутренних повторов
- А в позиции 19 смысловой цепи
- А в позиции 3 смысловой цепи
- U в позиции 10 смысловой цепи
- отсутствие G/C в позиции 19 смысловой цепи
- отсутствие G в позиции 13 смысловой цепи
- отсутствие гомополимерных трактов (А)4-5 или (Т)4-5 в смысловой цепи
- локализация мишени в консервативном районе генома вируса
- отсутствие гомологии с известными транскриптами генома человека.
Часть вышеперечисленных критериев отбора биологически активных siРНК опубликована [Reynolds A., Leake D., Boese Q., Scaringe S., Marshall W.S., Khvorova A. (2004) Rational siRNA design for RNA interference. Nature Biotechnol. 22, 326-330].
Приведенные в Таблице 2 субстраты Дайсера обеспечивают целенаправленное воздействие на мРНК генов pol, vpu, env и gag ВИЧ-1. Терапевтическим результатом такого воздействия является подавление репродукции вариантов ВИЧ-1 субтипа А у больных в России.
Для вируса иммунодефицита человека первого типа характерно быстрое возникновение и отбор мутантных вариантов, обладающих резистентностью к различным противовирусным препаратам. Для решения проблемы вирусной изменчивости выявлены консервативные мишени и получены соответствующие им субстраты Дайсера, атакующие шесть разных мишеней в ВИЧ-1. Таким образом, вызывается значительное подавление продукции вируса в клетках человека, которое в значительной степени не зависит от изменчивости вируса.
Краткое описание таблиц и рисунков
В Таблице 1 указаны 27-bp последовательности, соответствующие выявленным мишеням РНК-интерференции в ВИЧ-1. Последовательности ДНК представлены в ориентации 5'-3'. В скобках указаны номера последовательностей. Подчеркнуты области, соответствующие коровым 19-нуклеотидным последовательностям siРНК. Указан процент вирусов, имеющих данную мишень в изолятах ВИЧ-1 в России. Указанные 27-нуклеотидные мишени РНК-интерференции клонировали в векторе psiCHECK-2. Искусственные сайты XhoI и NotI, которые использовали для клонирования, не указаны.
Таблица 2. Последовательности 27-нуклеотидных плюс- и минус-цепей РНК, которые после попарного отжига образуют субстраты Дайсера (в скобках указаны номера последовательностей).
Таблица 3. Отличия в нуклеотидных последовательностях мишеней РНК-интерференции и генетических конструкций из более ранних Патентов и Заявок от мишеней настоящей Заявки. Мишени A1-А6 - в настоящей Заявке короче на 1-3 нуклеотида (показаны зеленым в текстах предыдущих Патентов и Заявок). Кроме того, мишень А4 имеет отличие в одной позиции (показано желтым).
Таблица 4. Поиск гомологичных последовательностей ДНК мишеней в полных не избыточных нуклеотидных баз данных NCBI с помощью программы BLAST. Устанавливали показ 5000 последовательностей из баз данных [Nucleotide collection (nr/nt)]. В третьей колонке таблицы указано найденное число идентичных для данной мишени последовательностей. Мишень А5 обнаружена только в России.
Фиг. 1. Физическая карта вектора psiCHECK-2. Вектор использовался для создания невирусной системы количественной оценки эффективности РНК-интерференции, вызываемой созданной кассетной генетической конструкцией. Указаны ген устойчивости к ампициллину (Амп), сайт полиаденилирования и энхансер SV40.
Фиг. 2. Оценка эффективность РНК-интерференции в невирусной тест-системе. РНК-интерференцию вызывают введением субстратов Дайсера в клетки HEK293T, транфецированные плазмидами, созданными на основе вектора psiCHECK-2 и содержащего мишени РНК-интерференции (Таблица 1). Приведены данные свечения гена люциферазы Renilla при ко-трансфекции "рандомизированных" мишеней с субстратами Дайсера, мишенями без добавления препаратов Дайсера, а также мишеней вместе с соответствующими субстратами Дайсера. * - p<0.007. Эксперименты проводили в трех параллелях (n=3).
Осуществление изобретения
Пример 1. Оценка эффективности РНК-интерференции, вызываемой созданными субстратами Дайсера в невирусной системе
Накануне проведения трансфекции (за 18-20 часов) клетки HEK293 рассевают в лунки 24-луночного планшета Nunc - по 50 тыс. клеток в 500 мкл культуральной среды DMEM (ПанЭко), содержащей глютамин и сыворотку (полная среда), на лунку. В день эксперимента готовят пробы ДНК для трансфекции при комнатной температуре следующим образом (на одну экспериментальную точку). В 200 мкл среды DMEM, не содержащей сыворотки (SFM), добавляют 40 ng ДНК генетической конструкции в векторе psiCHECK-2, содержащую мишени РНК-интерференции (см. Таблицу 3). После перемешивания добавляют 1 мкл свежеразмороженного реагента TransFast (Promega), встряхивают смесь и инкубируют ее 15 мин. Затем отсасывают среду из лунок с "сидящими" клетками, встряхивают пробирку со смесью ДНК-TransFast и сразу добавляют смесь в лунки с клетками и инкубируют 1 час при 37°С в CO2-инкубаторе.
Для введения субстратов Дайсера в клетки сначала проводят отжиг пар комплементарных РНК в растворе, содержащем 10 mM tris-HCl, pH 7.4; 20 mM NaCl и по 40 pmol каждой из РНК (на одну точку) путем инкубации полученного раствора в водяной бане, охлаждающейся от 65°С до 25°С в течение 20 мин. Для трансфекции отожженной РНК (субстрат Дайсера) используют siTransfection Reagent (Santa Cruz). Сначала готовят две смеси - 1 мкл Субстрата Дайсера (40 pmol) в 50 мкл SFM, а также 2 μl siRNA Transfection Reagent в 50 μl SFM (на одну точку). Затем оба раствора смешивают, инкубируют 15-45 мин при комнатной температуре.
После чего среду над клетками отсасывают, проводят отмывку один раз 100 мкл SFM. Затем добавляют 400 мкл SFM в смесь, содержащую субстрат Дайсера и siRNA Transfection Reagent, смесь медленно пипетируют для перемешивания и добавляют в лунку. После инкубации в течение 7 часов в лунку добавляют полную среду - 500 мкл и продолжают инкубацию в течение 24 час.
Далее, около 1 мл среды над клетками отсасывают и добавляют подогретую до 37°С полную среду - 800 мкл. Инкубацию продолжают еще 48 час.
Для измерения экспрессии люцифераз среду над клетками в лунках планшета отсасывают, добавляют 100 мкл раствора трипсина-ЭДТА (ПанЭко) на лунку, после 10 мин инкубации при 37°С в СО2-инкубаторе добавляют по 100 мкл полной среды, переносят полностью суспензию клеток в пробирку эппендорф на 0.5 мл, осаждают центрифугированием при комнатной температуре в центрифуге Eppendorf (5 мин - 2000 rpm), надосадочную жидкость отсасывают, суспендируют клетки в 70 мкл 1×PBS и проводят измерение свечения люцифераз светлячка и Renilla согласно рекомендациям к набору Dual-Luciferase Reporter Assay System (Promega) на люминометре Reporter Microplate Luminometer (Turner BioSystems). На Фиг. 2 показаны результаты испытания генетических конструкций в невирусной системе. Видно, что субстраты Дайсера специфически подавляют экспрессию мишеней на 81-91%.
Эффективные мишени РНК-интерференции в геноме ВИЧ-1 и субстраты Дайсера, предназначенные для их поражения
Нуклеотидные последовательности ДНК:
5' AAAAAGCATCAGAAAGAACCTCCATTT 3' (1)
5' AGACATAGTTATCTATCAATACATGGA 3' (2)
5' AGGAGTAGTGGAGTCTATGAATAAGGA 3' (3)
5' GTGTGGACTATAGTAGGTATAGAATAT 3' (4)
5' ACCAGGACAGACATGGTATGGAACAGG 3' (5)
5' GTGCGAGAGCGTCAGTATTAAGTGGGG 3' (6),
Нуклеотидные последовательности РНК:
5' AAAAAGCAUCAGAAAGAACCUCCAUUU 3' (7)
5' AAAUGGAGGUUCUUUCUGAUGCUUUUU 3' (8)
5' AGACAUAGUUAUCUAUCAAUACAUGGA 3' (9)
5' UCCAUGUAUUGAUAGAUAACUAUGUCU 3' (10)
5' AGGAGUAGUGGAGUCUAUGAAUAAGGA 3' (11)
5' UCCUUAUUCAUAGACUCCACUACUCCU 3' (12)
5' GUGUGGACUAUAGUAGGUAUAGAAUAU 3' (13)
5' AUAUUCUAUACCUACUAUAGUCCACAC 3' (14)
5' ACCAGGACAGACAUGGUAUGGAACAGG 3' (15)
5' CCUGUUCCAUACCAUGUCUGUCCUGGU 3' (16)
5' GUGCGAGAGCGUCAGUAUUAAGUGGGG 3' (17)
5' CCCCACUUAAUACUGACGCUCUCGCAC 3' (18)
Набор, включающий шесть субстратов Дайсера, которые получают путем попарного отжига комплементарных последовательностей РНК:
5'AAAAAGCAUCAGAAAGAACCUCCAUUU 3' - А1 (7)
5'AAAUGGAGGUUCUUUCUGAUGCUUUUU 3' - A1 (8)
5'AGACAUAGUUAUCUAUCAAUACAUGGA 3' - A2 (9)
5'UCCAUGUAUUGAUAGAUAACUAUGUCU 3' - A2 (10)
5'AGGAGUAGUGGAGUCUAUGAAUAAGGA 3' - A3 (11)
5'UCCUUAUUCAUAGACUCCACUACUCCU 3' - A3 (12)
5'GUGUGGACUAUAGUAGGUAUAGAAUAU 3' - A4 (13)
5'AUAUUCUAUACCUACUAUAGUCCACAC 3' - A4 (14)
5'ACCAGGACAGACAUGGUAUGGAACAGG 3' - A5 (15)
5'CCUGUUCCAUACCAUGUCUGUCCUGGU 3' - A5 (16)
5'GUGCGAGAGCGUCAGUAUUAAGUGGGG 3' - A6 (17)
5'CCCCACUUAAUACUGACGCUCUCGCAC 3' - A6 (18),
которые при введении в клетки человека способны поражать соответствующие консервативные мишени в мРНК ВИЧ-1 (А1-А6):
5'AAAAAGCATCAGAAAGAACCTCCATTT 3' - A1 (1)
5'AGACATAGTTATCTATCAATACATGGA 3' - А2 (2)
5'AGGAGTAGTGGAGTCTATGAATAAGGA 3' - A3 (3)
5'GTGTGGACTATAGTAGGTATAGAATAT 3' - А4 (4)
5'ACCAGGACAGACATGGTATGGAACAGG 3' - А5 (5)
5'GTGCGAGAGCGTCAGTATTAAGTGGGG 3' - А6 (6),
расположенные в доменах обратной транскриптазы (мишени А1 и А2) и интегразы (мишень A3) гена pol, в мРНК гена vpu (мишень А4), а также мРНК гена env в ее домене gp120 (мишень А5) и мРНК гена gag в домене р17 (мишень А6), и вызывать подавление продукции вируса в клетках человека.