Биспецифические антигенсвязывающие молекулы
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии. Предложен способ получения биспецифической антигенсвязывающей молекулы, включающей Fc домен и Fab фрагменты, специфично связывающиеся с первым и вторым антигенами, причем биспецифическая антигенсвязывающая молекула обеспечивает моновалентное связывание с первым и/или вторым антигенами. Один из Fab в составе указанной молекулы слит на С-конце своей тяжелой цепи с N-концом тяжелой цепи другого Fab фрагмента, который, в свою очередь, слит на С-конце своей тяжелой цепи с N-концом субъединицы домена Fc. При этом по меньшей мере в одном из Fab производят одну из следующих замен: (i) вариабельные домены легкой цепи (VL) и тяжелой цепи (VH) заменяют друг другом, или (ii) константный домен легкой цепи (CL) и первый константный домен тяжелой цепи (СН) СН1 заменяют друг другом, при условии, что в первом и втором Fab фрагментах производят не одну и ту же замену. Кроме того, домен Fc в составе указанной молекулы включает модификацию, стимулирующую ассоциацию субъединиц домена Fc. Данное изобретение позволяет получать биспецифические антигенсвязывающие молекулы с улучшенной активностью и может найти применение в получении терапевтических конструкций на основе антител. 24 з.п. ф-лы, 27 ил., 2 табл., 5 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к биспецифическим антигенсвязывающим молекулам. Кроме того, настоящее изобретение относится к полинуклеотидам, кодирующим такие биспецифические антигенсвязывающие молекулы, а также к векторам и клеткам-хозяевам, содержащим такие полинуклеотиды. Изобретение, кроме того, относится к способам получения биспецифических антигенсвязывающих молекул по изобретению и к способам применения этих биспецифических антигенсвязывающих молекул при лечении заболевания.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Би- или мультиспецифические антитела, способные к связыванию двух или более антигенов, известны в данной области техники. Такие мультиспецифические связывающие белки могут быть образованы путем слияния клеток гибридомы, химической конъюгации или методов рекомбинантных ДНК.
Биспецифические антитела представляют большой интерес для терапевтических применений, поскольку они дают возможность одновременного связывания и инактивации двух или более антигенов-мишеней, что, таким образом, устраняет необходимость в комбинированных терапиях. Другим перспективным применением биспецифических антител является применение в качестве молекул, привлекающих иммунные эффекторные клетки, например, для клеточной иммунотерапии рака. Для этой цели конструируют биспецифические антитела, связывающиеся с поверхностным антигеном на клетках-мишенях, и, например, с активирующим компонентом Т-клеточного рецепторного комплекса (TCR; от англ. "Т cell receptor"). Одновременное связывание такого антитела с обеими его мишенями усилит преходящее взаимодействие между клеткой-мишенью и Т-клеткой, вызывающее активацию любого цитотоксического Т лимфоцита (CTL; от англ. "cytotoxic T lymphocyte") и последующий лизис клетки-мишени. Следовательно, иммунный ответ перенаправляется на клетки-мишени независимо от презентирования пептидного антигена клеткой-мишенью или специфичности Т-клетки, необходимой для нормальной, ограниченной главным комплексом гистосовместимости (ГКГ) активации CTL. В данном контексте важно, чтобы CTL активировались только тогда, когда клетка-мишень презентирует им биспецифическое антитело, то есть, при имитации иммунологической конъюгации, а не просто при связывании антитела с T-клеточным антигеном.
В недавнем прошлом разработан ряд форматов рекомбинантного мультиспецифического антитела, включающих, например, слияния тетравалентного IgG с одноцепочечным вариабельным фрагментом (scFv) (см., например, Coloma & Morrison, Nat Biotechnol 15, 159-163 (1997)), антитела, подобные двойному вариабельному домену тетравалентного IgG (Wu et al., Nat Biotechnol 25, 1290-1297 (2007)) или бивалентные гибридные биспецифические IgG крысы/мыши (см., например, Lindhofer et al., J Immunol 155, 219-225 (1995)).
Также получено несколько биспецифических форматов, в которых основная структура антитела (IgA, IgD, IgE, IgG или IgM) больше не сохраняется. Примеры включают диатела (см., например, Holliger et al., Proc Natl Acad Sci USA 90, 6444-6448 (1995)), тандемные молекулы scFv (см., например, Bargou et al., Science 321, 974-977 (2008)) и различные их производные.
Множество форматов, находящихся в разработке, проявляет огромный потенциал, присущий биспецифическим антителам. Задача создания биспецифических антител, подходящих для конкретной цели, однако, никоим образом не является тривиальной и требует ряда разработок. Например, необходимо соответствующим образом выбрать валентность и геометрию антитела в зависимости от характеристик антигенов-мишеней и предназначенного эффекта. Как для всех терапевтических антител, необходимо сбалансировать эффективность и токсичность, что требует среди прочего минимизации иммуногенности и оптимизации фармакокинетических свойств антитела. Также необходимо учитывать желательность Fc-опосредованных эффектов. Кроме того, получение конструкций биспецифического антитела, имеющих клинически достаточное количество и чистоту, создает значительную проблему, поскольку гомодимеризация тяжелых цепей антитела и/или ошибочное спаривание тяжелых и легких цепей антитела различных специфичностей при совместной экспрессии снижает выход правильно собранной конструкции и приводит в результате к ряду нефункциональных побочных продуктов, от которых может быть трудно отделить желаемое биспецифическое антитело.
С учетом возрастающего числа возможных применений биспецифических антител, а также трудностей и недостатков, связанных с доступными в настоящее время биспецифическими антителами, остается необходимость в новых, усовершенствованных форматах таких молекул.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте в изобретении предложена биспецифическая антигенсвязывающая молекула, включающая первый Fab фрагмент, специфично связывающийся с первым антигеном, второй Fab фрагмент, специфично связывающийся со вторым антигеном, и домен Fc, состоящий из первой и второй субъединиц, способных к стабильной ассоциации; причем,
a) биспецифическая антигенсвязывающая молекула обеспечивает моновалентное связывание с первым и/или вторым антигеном,
b) первый Fab фрагмент, второй Fab фрагмент и первая субъединица домена Fc слиты друг с другом, и
c) в первом и/или втором Fab фрагменте произведена одна из следующих замен: (i) вариабельные домены легкой цепи (VL; от англ. "variable light") и тяжелой цепи (VH; от англ. "variable heavy") заменены друг другом, (ii) константный домен легкой цепи (CL; от англ. "constant light") и первый константный домен тяжелой цепи (СН; от англ. "constant heavy") CH1 заменены друг другом, или (iii) как вариабельные, так и константные домены VL-CL и VH-СН1 заменены друг другом,
при условии, что в первом и втором Fab фрагменте произведена не одна и та же замена.
В конкретных формах осуществления первый Fab фрагмент слит на его С-конце с N-концом второго Fab фрагмента, который, в свою очередь, слит на его С-конце с N-концом первой субъединицы домена Fc. В более конкретной форме осуществления первый Fab фрагмент слит на С-конце его тяжелой цепи с N-концом тяжелой цепи второго Fab фрагмента, который, в свою очередь, слит на С-конце его тяжелой цепи с N-концом первой субъединицы домена Fc. В других формах осуществления второй Fab фрагмент слит на его С-конце с N-концом первого Fab фрагмента, который, в свою очередь, слит на его С-конце с N-концом первой субъединицы домена Fc. В более конкретной форме осуществления второй Fab фрагмент слит на С-конце его тяжелой цепи с N-концом тяжелой цепи первого Fab фрагмента, который, в свою очередь, слит на С-конце его тяжелой цепи с N-концом первой субъединицы домена Fc. В других формах осуществления второй Fab фрагмент слит на его С-конце с N-концом первой субъединицы домена Fc, которая, в свою очередь, слита на ее С-конце с N-концом первого Fab фрагмента. В более конкретной форме осуществления второй Fab фрагмент слит на С-конце его тяжелой цепи с N-концом первой субъединицы домена Fc, которая, в свою очередь, слита на ее С-конце с N-концом тяжелой цепи первого Fab фрагмента.
В формах осуществления, в которых либо первый Fab фрагмент слит на С-конце его тяжелой цепи с N-концом тяжелой цепи второго Fab фрагмента, который, в свою очередь, слит на С-конце его тяжелой цепи с N-концом первой субъединицы домена Fc, либо второй Fab фрагмент слит на С-конце его тяжелой цепи с N-концом тяжелой цепи первого Fab фрагмента, который, в свою очередь, слит на С-конце его тяжелой цепи с N-концом первой субъединицы домена Fc, дополнительно легкая цепь Fab первого Fab фрагмента и легкая цепь Fab второго Fab фрагмента могут быть слиты друг с другом, необязательно посредством пептидного линкера.
В одной форме осуществления замена произведена в первом Fab фрагменте. В некоторых формах осуществления замена представляет собой замену вариабельных доменов VL и VH друг другом. В других формах осуществления замена представляет собой замену константных доменов CL и СН1 друг другом.
В одной форме осуществления биспецифическая антигенсвязывающая молекула по существу состоит из первого Fab фрагмента, второго Fab фрагмента, домена Fc и необязательно одного или более пептидных линкеров.
В конкретных формах осуществления биспецифическая антигенсвязывающая молекула включает третий Fab фрагмент, специфично связывающийся с первым или вторым антигеном. В одной форме осуществления третий Fab фрагмент слит со второй субъединицей домена Fc. В более конкретной форме осуществления третий Fab фрагмент слит на его С-конце с N-концом второй субъединицы домена Fc. В еще более конкретной форме осуществления третий Fab фрагмент слит на С-конце его тяжелой цепи с N-концом второй субъединицы домена Fc. В одной форме осуществления третий Fab фрагмент специфично связывается со вторым антигеном. В некоторых формах осуществления второй Fab фрагмент, третий Fab фрагмент и домен Fc являются частью молекулы иммуноглобулина. В такой конкретной форме осуществления молекула иммуноглобулина представляет собой молекулу иммуноглобулина класса IgG, более конкретно молекулу иммуноглобулина подкласса IgG1 или IgG4. В одной форме осуществления молекула иммуноглобулина представляет собой молекулу иммуноглобулина человека. В одной форме осуществления биспецифическая антигенсвязывающая молекула по существу состоит из первого Fab фрагмента, специфично связывающегося с первым антигеном, молекулы иммуноглобулина, специфично связывающейся со вторым антигеном, и необязательно одного или более пептидных линкеров.
В одной форме осуществления в Fab фрагментах, специфично связывающихся с одним и тем же антигеном, произведена одна и та же замена. В следующей форме осуществления замена произведена только в первом Fab фрагменте. В одной форме осуществления биспецифическая антигенсвязывающая молекула обеспечивает моновалентное связывание с первым антигеном. В одной форме осуществления биспецифическая антигенсвязывающая молекула не включает одноцепочечный Fab фрагмент.
В некоторых формах осуществления домен Fc включает модификацию, стимулирующую ассоциацию первой и второй субъединицы домена Fc. В такой конкретной форме осуществления аминокислотный остаток домена CH3 первой субъединицы домена Fc заменен аминокислотным остатком, имеющим больший объем боковой цепи, создавая посредством этого выпячивание внутри домена CH3 первой субъединицы, которое может быть расположено в углублении домена CH3 второй субъединицы, и аминокислотный остаток в домене CH3 второй субъединицы домена Fc заменен аминокислотным остатком, имеющим меньший объем боковой цепи, создавая посредством этого углубление внутри домена CH3 второй субъединицы, в котором может быть расположено выпячивание внутри домена CH3 первой субъединицы. В одной форме осуществления домен Fc представляет собой домен Fc IgG, в частности, домен Fc IgG1 или IgG4. В одной форме осуществления домен Fc представляет собой домен Fc человека. В некоторых формах осуществления домен Fc сконструирован таким образом, что он обладает измененным связывающим сродством с рецептором Fc и/или измененной эффекторной функцией по сравнению с не сконструированным доменом Fc.
Согласно другому аспекту изобретения предложен изолированный полинуклеотид, кодирующий биспецифическую антигенсвязывающую молекулу по изобретению или ее фрагмент. Объем изобретения также включает полипептиды, кодируемые полинуклеотидами по изобретению. Кроме того, в изобретении предложен экспрессионный вектор, содержащий изолированный полинуклеотид по изобретению, и клетка-хозяин, содержащая изолированный полинуклеотид или экспрессионный вектор по изобретению. В некоторых формах осуществления клетка-хозяин представляет собой эукариотическую клетку, в частности, клетку млекопитающего.
В другом аспекте предложен способ получения биспецифической антигенсвязывающей молекулы по изобретению, включающий следующие стадии: а) культивирование клетки-хозяина по изобретению в условиях, подходящих для экспрессии биспецифической антигенсвязывающей молекулы, и b) выделение биспецифической антигенсвязывающей молекулы. Объем изобретения также включает биспецифическую антигенсвязывающую молекулу, полученную способом по изобретению.
Далее в изобретении предложена фармацевтическая композиция, содержащая биспецифическую антигенсвязывающую молекулу по изобретению и фармацевтически приемлемый носитель.
Объем изобретения также включает способы применения биспецифической антигенсвязывающей молекулы и фармацевтической композиции по изобретению. В одном аспекте в изобретении предложена биспецифическая антигенсвязывающая молекула или фармацевтическая композиция по изобретению, применяемая в качестве лекарственного средства. В одном аспекте предложена биспецифическая антигенсвязывающая молекула или фармацевтическая композиция по изобретению, применяемая при лечении заболевания у индивидуума, нуждающегося в этом. В конкретной форме осуществления заболевание представляет собой рак.
Также предложено применение биспецифической антигенсвязывающей молекулы согласно изобретению для получения лекарственного средства для лечения заболевания у индивидуума, нуждающегося в этом; а также способ лечения заболевания у индивидуума, включающий введение индивидууму терапевтически эффективного количества композиции, содержащей биспецифическую антигенсвязывающую молекулу согласно изобретению в фармацевтически приемлемой форме. В конкретной форме осуществления заболевание представляет собой рак. В любой из вышеописанных форм осуществления индивидуум предпочтительно представляет собой млекопитающее, в частности, человека.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
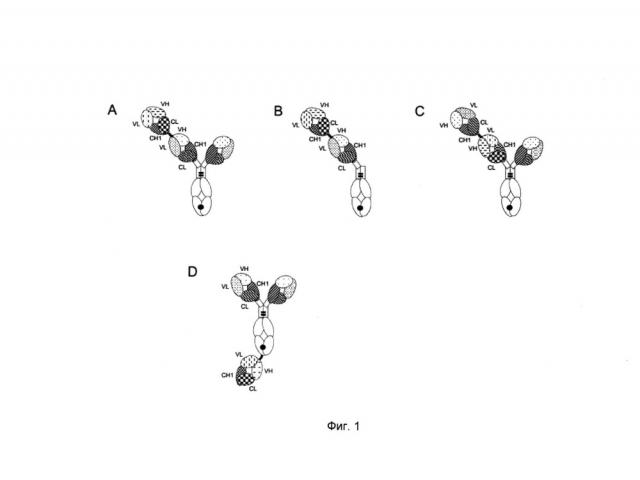
ФИГ.1. Иллюстрация иллюстративных форматов биспецифических антигенсвязывающих молекул по изобретению. (А) формат "2+1", в котором фрагмент Crossfab отличающейся специфичности слит с N-концом Fab фрагмента, содержащегося в антителе ("2+1 IgG Crossfab (N-концевой)"). (В) формат "1+1", в котором фрагмент Crossfab отличающейся специфичности слит с N-концом Fab фрагмента, содержащегося в антителе, в котором отсутствует второй Fab фрагмент ("1+1 IgG Crossfab (N-концевой)"). (С) формат "2+1", такой как в (А), в котором порядок фрагмента Crossfab, и Fab фрагмент, с которым слит фрагмент Crossfab, инвертирован ("2+1" IgG Crossfab (N-концевой), инвертированный"). (D) формат "2+1", в котором фрагмент Crossfab отличающейся специфичности слит с С-концом субъединицы домена Fc, содержащейся в антителе ("2+1 IgG Crossfab (C-концевой)"). Черная точка: необязательная модификация в домене Fc, стимулирующая гетеродимеризацию.
ФИГ.2. (А, В) Электрофорез в ДСН-ПААГ (4-12% Трис-ацетат (А) или 4-12% Бис/Трис (В), NuPage Invitrogen, окрашивание Кумасси) "1+1 IgG Crossfab (N-концевой), Fc(впадина) P329G LALA/Fc(выступ), дикий тип" (анти-MCSP/анти-huCD3) (см. SEQ ID NO:1, 2, 3 и 4), не восстановленный (А) и восстановленный (В). (С) Аналитическая эксклюзионная хроматография (Superdex 200 10/300 GL GE Healthcare; 2 мМ 3-(N-морфолино)пропансульфоновая кислота (MOPS) pH 7,3, 150 мМ NaCl, 0,02% (масс/об) NaCl; нанесение 50 мкг образца) "1+1 IgG Crossfab (N-концевой), Fc(впадина) P329G 1-А1-А/Fc(выступ) дикий тип" (анти-MCSP/анти-huCD3).
ФИГ.3. (А, В) Электрофорез в ДСН-ПААГ (4-12% Бис/Трис, NuPage Invitrogen, окрашивание Кумасси) "2+1 IgG Crossfab (N-концевой)" (анти-MCSP/анти-huCD3) (см. SEQ ID NO:1, 3, 4 и 5), не восстановленный (А) и восстановленный (В). (С) Аналитическая эксклюзионная хроматография (Superdex 200 10/300 GL GE Healthcare; 2 мМ MOPS pH 7,3, 150 мМ NaCl, 0,02% (масс/об) NaCl; нанесение 50 мкг образца) "2+1 IgG Crossfab (N-концевой)" (анти-MCSP/анти-huCD3).
ФИГ.4. (А, В) Электрофорез в ДСН-ПААГ (4-12% Бис/Трис, NuPage Invitrogen, окрашивание Кумасси) "2+1 IgG Crossfab (N-концевой), инвертированный" (анти-СЕА/анти-huCD3) (см. SEQ ID NO:3, 8, 9 и 10), не восстановленный (А) и восстановленный (В). (С) Аналитическая эксклюзионная хроматография (Superdex 200 10/300 GL GE Healthcare; 2 мМ MOPS pH 7,3, 150 мМ NaCl, 0,02% (масс/об) NaCl; нанесение 50 мкг образца) "2+1 IgG Crossfab (N-концевой), инвертированный" (анти-СЕА/анти-huCD3).
ФИГ.5. (А, В) Анализ "2+1 IgG Crossfab (С-концевой)" (анти-с-Met/анти-Her3) (см. SEQ ID NO:11, 12, 13, 14), не восстановленный (А) и восстановленный (В) в капиллярном электрофорезе (КЭ) - геле с додецилсульфатом натрия (ДСН).
ФИГ.6. Одновременное связывание биспецифических конструкций с доменом D3 MCSP человека и CD3γ(G4S)5CD3ε-AcTev-Fc(выступ)-Avi/Fc(впадина) человека. (А) Постановка анализа Biacore; (В) измерение "2+1 IgG Crossfab (N-концевой)".
ФИГ.7. Уровни различных цитокинов, измеренные в супернатанте цельной крови после обработки 1 нМ различных биспецифических конструкций CD3-MCSP ("2+1 IgG Crossfab (N-концевой)", "(scFv)2") или соответствующих контрольных IgG в присутствии (А, В) ли в отсутствие (С, D) опухолевых клеток Colo-38 в течение 24 часов.
ФИГ.8. Уровень поверхностной экспрессии позднего активационного маркера CD25 Т клеток CD8+ яванского макака от двух различных животных (яванский макак Нестор, яванский макак Нобу) после 43 часов инкубации с указанными концентрациями биспецифической конструкции "2+1 IgG Crossfab (N-концевой)" (направленной на CD3 яванского макака и MCSP человека), в присутствии или в отсутствие опухолевых клеток-мишеней MV-3, экспрессирующих MCSP человека (отношение эффекторных клеток к клеткам-мишеням Е:Т (от англ. "Effector: Target)=3:1). В качестве контролей использовали референсные IgG (IgG против CD3 яванского макака, IgG против MCSP человека) или нефизиологический стимул фитогемагглютинин (ФГА)-М.
ФИГ.9. Цитолиз (измеренный на основании высвобождения лактатдегидрогеназы (ЛДГ)) опухолевых клеток MDA-MB-435 при совместном культивировании с общими Т-клетками человека (отношение Е:Т=5:1) и активации в течение 20 часов различными концентрациями биспецифических молекул "2+1 IgG Crossfab (N-концевой)" и "(scFv)2" и соответствующих IgG.
ФИГ.10. Цитолиз (измеренный на основании высвобождения ЛДГ) опухолевых клеток MDA-MB-435 при совместном культивировании с общими Т-клетками человека (отношение Е:Т=5:1) и активации в течение 21 часа различными концентрациями биспецифических конструкций и соответствующими IgG. Сравнивали биспецифические конструкции CD3-MCSP "2+1 IgG Crossfab (N-концевой)" и "1+1 IgG Crossfab (N-концевой)", молекулу "(scFv)2" и соответствующие IgG.
ФИГ.11. Цитолиз (измеренный на основании высвобождения ЛДГ) huMCSP-положительных клеток меланомы MV-3 при совместном культивировании с мононуклеарными клетками периферической крови (МКПК) человека (отношение Е:Т=10:1), обработанными различными биспецифическими конструкциями CD3-MCSP ("2+1 IgG Crossfab (N-концевой)" и "(scFv)2") в течение приблизительно 26 часов.
ФИГ.12. Иллюстративные конфигурации биспецифических антигенсвязывающих молекул по изобретению, имеющих сшитую легкую цепь. (A) Иллюстрация молекулы "2+1 IgG Crossfab (N-концевой), сшитая легкая цепь". (B) Иллюстрация молекулы "1+1 IgG Crossfab (N-концевой), сшитая легкая цепь". (C) Иллюстрация молекулы "2+1 IgG Crossfab (N-концевой), инвертированный, сшитая легкая цепь". (D) Иллюстрация молекулы "1+1 IgG Crossfab (N-концевой), инвертированный, сшитая легкая цепь".
ФИГ.13. Анализы КЭ-ДСН. Электрофореграмма, показанная в виде электрофореза в ДСН-ПААГ "2+1 IgG Crossfab (N-концевой), сшитая легкая цепь" (дорожка 1: восстановленный, дорожка 2: не восстановленный).
ФИГ.14. Аналитическая эксклюзионная хроматография "2+1 IgG Crossfab (N-концевой), сшитая легкая цепь" (конечный продукт). Нанесение 20 мкг образца "2+1 IgG Crossfab (N-концевой), сшитая легкая цепь".
ФИГ.15. Цитолиз (измеренный на основании высвобождения ЛДГ) MCSP-положительных опухолевых клеток MV-3 при совместном культивировании с МКПК человека (отношение Е:Т=10:1), обработанных различными биспецифическими конструкциями CD3-MCSP в течение приблизительно 44 часов. МКПК человека выделяли из свежей крови здоровых волонтеров.
ФИГ.16. Цитолиз (измеренный на основании высвобождения ЛДГ) MCSP-положительных опухолевых клеток Colo-38 при совместном культивировании с МКПК человека (отношение Е:Т=10:1), обработанных различными биспецифическими конструкциями CD3-MCSP в течение приблизительно 22 часов. МКПК человека выделяли из свежей крови здоровых волонтеров.
ФИГ.17. Цитолиз (измеренный на основании высвобождения ЛДГ) MCSP-положительных опухолевых клеток Colo-38 при совместном культивировании с МКПК человека (отношение Е:Т=10:1), обработанных различными биспецифическими конструкциями CD3-MCSP в течение приблизительно 22 часов. МКПК человека выделяли из свежей крови здоровых волонтеров.
ФИГ.18. Цитолиз (измеренный на основании высвобождения ЛДГ) MCSP-положительных клеток WM266-4 при совместном культивировании с МКПК человека (отношение Е:Т=10:1), обработанных различными биспецифическими конструкциями CD3-MCSP в течение приблизительно 22 часов. МКПК человека выделяли из свежей крови здоровых волонтеров.
ФИГ.19. Уровень поверхностной экспрессии раннего активационного маркера CD69 (А) и позднего активационного маркера CD25 (В) на Т-клетках CD8+ человека после 22 часов инкубации с 10 наномоль (нМ), 80 пикомоль (пМ) или 3 пМ различных биспецифических конструкций CD3-MCSP в присутствии или в отсутствие MCSP-экспрессирующих опухолевых клеток-мишеней Colo-38 человека (отношение Е:Т=10:1).
ФИГ.20. Анализы КЭ-ДСН. (А) Электрофореграмма, показанная в виде электрофореза в ДСН-ПААГ 1+1 IgG Crossfab (N-концевой); обмен VL/VH (LC007/V9): а) не восстановленный, b) восстановленный. (В) Электрофореграмма, показанная в виде электрофореза в ДСН-ПААГ 1+1 CrossMab; обмен CL/CH1 (LC007/V9): а) восстановленный, b) не восстановленный. (С) Электрофореграмма, показанная в виде электрофореза в ДСН-ПААГ 2+1 IgG Crossfab (N-концевой), инвертированный; обмен CL/CH1 (LC007/V9): а) восстановленный, b) не восстановленный. (D) Электрофореграмма, показанная в виде электрофореза в ДСН-ПААГ 2+1 IgG Crossfab (N-концевой); обмен VL/VH (M4-3 ML2/V9): а) восстановленный, b) не восстановленный. (Е) Электрофореграмма, показанная в виде электрофореза в ДСН-ПААГ 2+1 IgG Crossfab (N-концевой); обмен CL/CH1 (M4-3 ML2/V9): а) восстановленный, b) не восстановленный. (F) Электрофореграмма, показанная в виде электрофореза в ДСН-ПААГ 2+1 IgG Crossfab (N-концевой), инвертированный; обмен CL/CH1 (CH1A1A/V9): а) восстановленный, b) не восстановленный.
ФИГ.21. Уровень поверхностной экспрессии раннего активационного маркера CD69 (А) и позднего активационного маркера CD25 (В) на Т-клетках CD4+ или CD8+ человека после 24 часов инкубации с указанными концентрациями конструкций CD3/MCSP "1+1 CrossMab", "1+1 IgG Crossfab (N-концевой)" и "2+1 IgG Crossfab (N-концевой)". Анализ был проведен в присутствии или в отсутствие клеток-мишеней MV-3, как указано.
ФИГ.22. Цитолиз (измеренный на основании высвобождения ЛДГ) опухолевых клеток MKN-45 (А) или LS-174T (В) при совместном культивировании с МКПК человека (отношение Е:Т=10:1) и активации в течение 28 часов различными концентрациями конструкции "2+1 IgG Crossfab (N-концевой), инвертированный (VL/VH)" по сравнению с конструкцией "2+1 IgG Crossfab (N-концевой), инвертированный (CL/CH1)".
ФИГ.23. Цитолиз (измеренный на основании высвобождения ЛДГ) опухолевых клеток WM266-4 при совместном культивировании с МКПК человека (отношение Е:Т=10:1) и активации в течение 26 часов различными концентрациями конструкции "2+1 IgG Crossfab (N-концевой) (VL/VH)" по сравнению с конструкцией "2+1 IgG Crossfab (N-концевой) (CL/CH1)".
ФИГ.24. Цитолиз (измеренный на основании высвобождения ЛДГ) опухолевых клеток MV-3 при совместном культивировании с МКПК человека (отношение Е:Т=10:1) и активации в течение 27 часов различными концентрациями конструкции "2+1 IgG Crossfab (N-концевой) (VH/VL)" по сравнению с конструкцией "2+1 IgG Crossfab (N-концевой) (CL/CH1)".
ФИГ.25. Цитолиз (измеренный на основании высвобождения ЛДГ) MCSP-положительных опухолевых клеток WM266-4 человека (А) или опухолевых клеток MV-3 (В) при совместном культивировании с МКПК человека (отношение Е:Т=10:1) и активации в течение 21 часа различными концентрациями конструкции "2+1 IgG Crossfab (N-концевой)", "1+1 CrossMab" и "1+1 IgG Crossfab (N-концевой)", как указано.
ФИГ.26. Связывание биспецифических конструкций с CD3 человека, экспрессируемым клетками Jurkat (А), или с СЕА человека, экспрессируемым клетками LS-174T (В), определенное с помощью флуоресцентно-активируемого клеточного сортинга (FACS; от англ. "Fluorescence Activated Cell Sorting"). В качестве контроля также оценивали эквивалентную максимальную концентрацию референсных IgG и фоновое окрашивание за счет меченого второго антитела (ФИТЦ (флуоресцеинизотиоцианат)-конъюгированного F(ab')2 фрагмента коза против человека AffiniPure, специфичного к фрагменту Fcγ, Jackson Immuno Research Lab # 109-096-098).
ФИГ.27. Связывание биспецифических конструкций с CD3 человека, экспрессируемым клетками Jurkat, или с MCSP человека, экспрессируемым опухолевыми клетками WM266-4 (В), определенное с помощью FACS.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Определения
В данной работе использованы термины, обычно используемые в данной области техники, если ниже не определено иное.
Как используют в данной работе, термин "антигенсвязывающая молекула" относится в его самом широком смысле к молекуле, специфично связывающей антигенную детерминанту. Примерами антигенсвязывающих молекул являются иммуноглобулины и их производные, например, фрагменты.
Термин "биспецифическая" означает, что антигенсвязывающая молекула способна к специфичному связыванию с двумя отдельными антигенными детерминантами. В характерном случае биспецифическая антигенсвязывающая молекула содержит два антигенсвязывающих сайта, каждый из которых специфичен к различным антигенным детерминантам. В некоторых формах осуществления биспецифическая антигенсвязывающая молекула способна к одновременному связыванию двух антигенных детерминант, в частности, двух антигенных детерминант, экспрессирующихся на двух отдельных клетках.
Как используют в данной работе, термин "антигенная детерминанта" является синонимом "антигена" и "эпитопа" и относится к сайту (например, к непрерывному отрезку из аминокислот или к конформационной конфигурации, состоящей из различных участков несмежных аминокислот) на полипептидной макромолекуле, с которым связывается антигенсвязывающий фрагмент, образуя комплекс антигенсвязывающего фрагмента с антигеном. Полезные антигенные детерминанты могут быть обнаружены, например, на поверхностях опухолевых клеток, на поверхностях клеток, инфицированных вирусами, на поверхностях других пораженных клеток, на поверхности иммунных клеток, в свободном виде в сыворотке крови и/или во внеклеточном матриксе (ВКМ). Белки, относящиеся в данной работе к антигенам (например, ассоциированный с меланомой протеогликановый хондроитинсульфат (MCSP; от англ. "melanoma-associated chondroitin sulphate proteoglycan"), белок, активирующий фибробласты (FAP; от англ. "Fibroblast Activation Protein"), карцино-эмбриональный антиген (СЕА; от англ. "carcino-embryonic antigen"), рецептор эпидермального фактора роста (EGFR; от англ. "epidermal growth factor receptor"), CD33, CDS, c-Met, Her3) может представлять собой любую нативную форму белков из любого источника позвоночных, включая млекопитающих, таких как приматы (например, людей), и грызуны (например, мыши и крысы), если не указано иное. В конкретной форме осуществления антиген представляет собой белок человека. Если в данной работе сделана ссылка на конкретный белок, этот термин включает как "полноразмерный", непроцессированный белок, так и любую форму белка, являющуюся результатом процессинга в клетке. Этот термин также включает встречающиеся в природе варианты белка, например, варианты сплайсинга или аллельные варианты. Иллюстративные белки человека, полезные в качестве антигенов, включают, но не ограничены ими, следующие белки: ассоциированный с меланомой протеогликановый хондроитинсульфат (MCSP), также известный как протеогликановый хондроитинсульфат 4 (UniProt no. Q6UVK1, Национальный центр биотехнологической информации (NCBI; от англ. "National Center for Biotechnology Information"), № доступа NP_001888); белок, активирующий фибробласты (FAP), также известный как сепраза (Seprase; от англ. "Surface Expressing Protease" Uni Prot №№ Q12884, Q86Z29, Q99998, № доступа NCBI NP_004451); карцино-эмбриональный антиген (СЕА), также известный как молекула клеточной адгезии 5, родственная карцино-эмбриональному антигену (UniProt № Р06731, № доступа NCBI NP_004354); CD33, также известный как gp67 или Siglec-3 (UniProt № Р20138, №№ доступа NCBI NP_001076087, NP_001171079); рецептор эпидермального фактора роста (EGFR), также известный как ErbB-1 или Her1 (UniProt № Р0053, №№ доступа NCBI NP_958439, NP_958440), CD3, в частности, эпсилон-субъединица CD3 (UniProt № Р07766, № доступа NCBI NP_000724); c-Met, также известный как рецептор фактора роста гепатоцитов (UniProt № Р08581, №№ доступа NCBI NP_000236, NP_001120972) и Her3, также известный как ErbB-3 (UniProt № Р21860, №№ доступа NCBI NP_001973, NP_001005915). В некоторых формах осуществления биспецифическая антигенсвязывающая молекула по изобретению связывается с эпитопом первого антигена или второго антигена, являющимся консервативным среди первого антигена или второго антигена от различных видов.
Под "специфичным связыванием" подразумевают, что связывание является селективным для антигена, и его можно отличить от нежелательных или неспецифичных взаимодействий. Способность антитела к связыванию со специфичной антигенной детерминантой можно измерить либо посредством твердофазного иммуноферментного анализа (ELISA; от англ. "enzyme-linked immunosorbent assay"), либо другими методами, знакомыми специалистам в данной области техники, например, методом поверхностного плазменного резонанса (SPR; от англ. "surface plasmon resonance") (анализируемого на приборе BIAcore) (Liljeblad et al., Glyco J 17, 323-329 (2000)), и традиционными анализами связывания (Heeley, Endocr Res 28, 217-229 (2002)). В одной форме осуществления степень связывания антитела с посторонним белком составляет менее чем приблизительно 10% связывания антитела с антигеном, измеренного, например, с помощью SPR. В некоторых формах осуществления антитело или его фрагмент, связывающийся с антигеном, имеет константу диссоциации (KD), составляющую не более 1 мкМ, не более 100 нМ, не более 10 нМ, не более 1 нМ, не более 0,1 нМ, не более 0,01 нМ или не более 0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 M, например, от 10-9 М до 10-13 М).
"Сродство" относится к силе общей суммы нековалентных взаимодействий между отдельным связывающим сайтом молекулы (например, рецептора) и его партнером связывания (например, лигандом). Если не указано иное, как используют в данной работе, "связывающее сродство" относится к собственному связывающему сродству, отражающему взаимодействие 1:1 между членами связывающей пары (например, антигенсвязывающего фрагмента и антигена или рецептора и его лиганда). Сродство молекулы Х к ее партнеру Y может быть, как правило, представлено константой диссоциации (KD), представляющей собой отношение констант скоростей диссоциации и ассоциации (koff и kon, соответственно). Таким образом, эквивалентные значения сродства могут включать различные константы скоростей, если отношение констант скоростей остается тем же. Сродство можно измерить хорошо разработанными методами, известными в данной области техники, включающими методы, раскрытые в данной работе. Конкретным способом измерения сродства является поверхностный плазменный резонанс (SPR).
Термин "валентный", как используют в данной работе, обозначает наличие определенного числа антигенсвязывающих сайтов в антигенсвязывающей молекуле. Как таковой, термин "моновалентное связывание с антигеном" обозначает наличие одного (и не более чем одного) антигенсвязывающего сайта, специфичного к антигену антигенсвязывающей молекулы.
"Антигенсвязывающий сайт" относится к сайту, то есть к одному или более аминокислотных остатков антигенсвязывающей молекуле, обеспечивающему взаимодействие с антигеном. Например, антигенсвязывающий сайт антитела включает аминокислотные остатки из участков, определяющих комплементарность (CDR; от англ. "complementarity determining regions"). Нативная молекула иммуноглобулина в характерном случае имеет два антигенсвязывающих сайта, Fab фрагмент в характерном случае имеет единственный антигенсвязывающий сайт.
Как используют в данной работе, термин "антигенсвязывающий фрагмент" относится к молекуле полипептида, специфично связывающейся с антигенной детерминантой. Антигенсвязывающие фрагменты включают антитела и их фрагменты, как дополнительно определено в данной работе. Конкретные антигенсвязывающие фрагменты включают антигенсвязывающий домен антитела, содержащий вариабельную область тяжелой цепи антитела и вариабельную область легкой цепи антитела. В некоторых формах осуществления антигенсвязывающие фрагменты могут включать константные области антитела, как дополнительно определено в данной работе и известно в данной области техники. Полезные константные области тяжелой цепи включают любой из пяти изотипов: α, δ, ε, γ или μ. Полезные константные области легкой цепи включают любой из двух изотипов: κ и λ.
Как используют в данной работе, термины "первый" и "второй" по отношению к Fab фрагментам и т.д. используют для удобства различения, когда имеется более чем один тип фрагмента. Использование этих терминов не предназначено для определения конкретного порядка или ориентации биспецифической антигенсвязывающей молекулы, если явным образом не указано иное.
Как используют в данной работе, термин "одноцепочечный" относится к молекуле, включающей мономеры аминокислот, линейно связанные пептидными связями. Под одноцепочечным Fab фрагментом подразумевают молекулу Fab, в которой легкая цепь Fab и тяжелая цепь Fab соединены пептидным линкером с образованием одной пептидной цепи.
Термин "молекула иммуноглобулина" относится к белку, имеющему структуру встречающегося в природе антитела. Например, иммуноглобулины класса IgG представляют собой гетеротетрамерные гликопротеины, имеющие массу приблизительно 150000 Дальтон, состоящие из двух легких цепей и двух тяжелых цепей, связанных дисульфидными связями. От N-конца к С-концу каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следует шарнирная область (HR; от англ. "hinge region") и три константных домена (СН1, СН2 и CH3), также называемых константной областью тяжелой цепи. В случае иммуноглобулина класса IgE тяжелая цепь дополнительно имеет домен СН4. Следовательно, тяжелая цепь иммуноглобулина представляет собой полипептид, состоящий в направлении от N-конца к С-концу из следующих доменов: VH-CH1-HR-CH2-CH3-(CH4). Аналогично от N- к С-концу каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, за которым следует константный легкий домен (CL), также называемый константной областью легкой цепи. Следовательно, легкая цепь иммуноглобулина представляет собой полипептид, состоящий в направлении от N-конца к С-концу из следующих доменов: VL-CL. Тяжелая цепь иммуноглобулина может быть отнесена к одному из пяти типов, называемых α (IgA), δ (IgD), ε (IgE), γ (IqG) или μ (IgM), причем, некоторые из могут быть дополнительно разделены на подтипы, например, γ1 (IgG1), γ2 (IgG2), γ3 (IgG3), γ4 (IgG4), α1 (IgA1) и α2 (IgA2). Легкая цепь иммуноглобулина может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена. Иммуноглобулин по существу состоит из двух Fab фрагментов и домена Fc, связанных посредством шарнирной области иммуноглобулина.
Термин "антитело" в данной работе используют в самом широком смысле, и он включает различные структуры антитела, включающие, но не ограниченные ими, моноклональные антитела, поликлональные антитела и фрагменты антител, если они проявляют желаемую антигенсвязывающую активность.
"Фрагмент антитела" относится к молекуле, отличающейся от интактного антитела, включающей участок интактного антитела, связывающий антиген, с которым связывается интактное антитело. Примеры фрагментов антитела включают, но не ограничены ими, Fv, Fab, Fab', Fab'-SH, F(ab')2, диатела, линейные антитела, одноцепочечные молекулы антител (например, scFv) и однодоменные антитела. Обзор некоторых фрагментов антител см. в статье Hudson et al., Nat Med 9, 129-134 (2003). Обзор фрагментов scFv см., например, в статье Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp.269-315 (1994); см. также документ WO 93/16185; и патенты US №№5571894 и 5587458. Обсуждение Fab и F(ab')2 фрагментов, включающих остатки эпитопа связывания рецептора реутилизации, и имеющих увеличенный период полувыведения in vivo, см. в патенте US №5869046. Диатела представляют собой фрагменты антител, имеющие два антигенсвязывающих сайта, которые могут быть бивалентными или биспецифическими. См., например, следующие документы: ЕР 404097; WO 1993/01161; Hudson et al., Nat Med 9, 129-134 (2003); и Hollinger et al., Proc Natl Acad Sci USA 90, 6444-6448 (1993). Триатела и тетратела также раскрыты в статье Hudson et al., Nat Med 9, 129-134 (2003). Однодоменные антитела представляют собой фрагменты антител, содержащие полноразмерный вариабельный домен тяжелой цепи антитела или его участок, либо полноразмерный вариабельный домен легкой цепи антитела или его участок. В некоторых формах осуществления однодоменное антитело представляет с