Способ обработки несеменного зерна, пораженного микроскопическими грибами и микотоксинами
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано в сельском хозяйстве. Предложен способ обработки зерна, предназначенного для скармливания сельскохозяйственным животным, предусматривающий обеззараживание зерна перед высушиванием и закладкой на хранение суспензией штамма Bacillus subtilis-93-ДЕП в концентрации 1×1010 КОЕ/мл из расчета 5л на тонну зерна. Изобретение обеспечивает снижение загрязнения зерна микроскопическими грибами и их токсинами. 10 табл., 11 пр.
Реферат
Способ обработки зерна, пораженного микроскопическими грибами и микотоксинами, предназначенного для скармливания сельскохозяйственным животным.
Изобретение относится к сельскому хозяйству и биотехнологии, а именно к защите не семенного зерна при хранении в зернохранилищах от поражения микроскопическими плесневыми грибами и их токсинами с использованием бактериального штамма.
Наиболее часто в кормах обнаруживаются микроскопические плесневые грибы, они способствуют снижению пищевой ценности кормов, контаминируют их продуктами своего метаболизма (микотоксины), которые даже в малых количествах оказывают серьезное неблагоприятное влияние на здоровье сельскохозяйственных животных. Развитие микромицетов и накапливание микотоксинов происходит в период вегетации растений, после уборки урожая до обмолота, при нарушении условий хранения. Обсемененные токсигенными плесневыми грибами растительные субстраты не могут быть использованы в корм без соответствующей санитарной обработки, их необходимо обезвредить от мицелия и ядовитых метаболитов.
Известен способ обезвреживания не семенного зерна от фузариоза путем промывки его в течение нескольких часов в горячей воде, обработки водным раствором щелока, нагретым до 40-45°С в течение двух часов, последующей промывкой чистой водой и высушиванием (патент СССР №77576, опуб. 30.11.1949 г.). Недостатком метода является трудоемкость исполнения, расход большого количества воды, необходимость ее нагрева, наличия емкостей для промывки и последующее высушивание зерна.
Несмотря на широкий ассортимент биопрепаратов, используемых для защиты от грибковых заболеваний посевного материала, зеленой массы растений (патент РФ №2099947, опуб. 25.12.1997 г., патент РФ №2129375, опуб. 27.04.1999 г., авторское свидетельство СССР №256150, авторское свидетельство СССР №262504 и т.д.), нет эффективных мер для обработки не семенного зерна.
Наиболее близкими техническими решениями являются штамм бактерий Bacillus subtilis ВНИИСХМ 131, используемый для получения препарата против возбудителей гнилей яблок и винограда при хранении (авторское свидетельство СССР №1706504) и штамм бактерий Bacillus subtilis ВКПМ В-7036 - против грибковых заболеваний картофеля, клевера и других кормовых трав, роз разных сортов и огурцов, вызываемых Phytophthore infestans, Microsporium solani, Fusarium solani (патент РФ №2086128, опуб. 10.08.1997 г.). Упомянутые штаммы также как и в предлагаемом решении, рекомендованы для обработки кормов и продуктов для употребления в пищу, однако их не применяют для обработки не семенного зерна, нет данных об их активности в отношении возбудителей грибковых заболеваний зерна и эффективности разложения микотоксинов.
Высокую антагонистическую активность в отношении фитопатогенных грибов рода Fusarium, Aspergillus, Penicillium, Mucor проявляет штамм Bacillus subtilis-93 (патент РФ №2491942, опуб. 10.03.2013 г.). Штамм депонирован 11.04.2001 г. во Всероссийском государственном научно-исследовательском институте контроля, стандартизации и сертификации ветеринарных препаратов (ВГНКИ) - штамм Bacillus subtilis-93-ДЕП. Местом хранения штамма определена коллекция микроорганизмов ФГБНУ «ФЦТРБ-ВНИВИ» (г. Казань). Штамм В. subtilis-93 активно размножается в питательных средах, принятых в производстве пробиотических препаратов. Устойчив к высушиванию и хранению. Бактерии Bacillus subtilis-93 безопасны для животных. Штамм в целях обработки не семенного зерна и продуктов его переработки против загрязнения микроскопическими грибами и их токсинами не использовался.
Задачей изобретения является разработка способа применения штамма Bacillus subtilis-93, позволяющего повысить качество обеззараживания зерна, пораженного микроскопическими грибами и микотоксинами.
Для достижения поставленной задачи в предлагаемом способе обработки зерна, пораженного микроскопическими грибами и микотоксинами, предназначенного для сельскохозяйственных животных перед высушиванием и закладкой зерна на хранение его обрабатывают суспензией штамма Bacillus subtilis-93-ДЕП в концентрации 1×1010 КОЕ/мл из расчета 5 л на тонну зерна при помощи опрыскивателей (ручных, ранцевых моторных, с приводом ДВС, установок типа ДУК, ВДМ, АДА, ЛСД и т.д.) однократно с последующим тщательным перемешиванием.
Внесение штамма В. subtilis-93 по рекомендуемой схеме в зерно, пораженное микроскопическими грибами, приводит к снижению площади роста микроскопических грибов и снижению содержания токсинов. Не доброкачественный корм, обеззараженный по данному способу, не представляет опасности для животных и пригоден к скармливанию.
Для осуществления предлагаемого способа обеззараживания не семенного зерна культуру Bacillus subtilis-93 высевают в пробирку на скошенный мясо-пептонный агар (МПА), культивируют в термостате при 37°С в течение 24 часов, затем готовят смыв 5 мл мясо-пептонного бульона, переносят в культуральный матрац емкостью 1,5 л, добавляют мясо-пептонный бульон до 100 мл и культивируют в условиях термостата при 37°С. Спустя 48 часов проводят контроль титра, концентрация бактерий должна быть не менее 1013 КОЕ/мл, затем содержимое матраца разливают во флаконы и разбавляют стерильным 0,9% раствором натрия хлорида в соотношении 1:1000, проверяют бактериальную чистоту. Флаконы закрывают резиновыми пробками, закатывают алюминиевыми колпачками и хранят в темном месте при температуре 4±2°С.
Контроль титра клеток проводят по следующей схеме. Готовят ряд последовательных десятикратных разведений содержимого культурального матраца. Для этого 1 мл культуральной жидкости стерильной пипеткой переносят в пробирку с 9 мл стерильного 0,9% раствора натрия хлорида, получая разведение 10-1, затем 1 мл из разведения 10-1 переносят в следующую пробирку с 9 мл стерильного раствора хлорида натрия, получая разведение 10-2 и т.д. до разведения 10-13. Для получения каждого последующего разведения используют отдельную стерильную пипетку. По 1 мл из разведений 10-11 и 10-13 стерильной пипеткой переносят в чашку Петри с МПА (по 3 чашки для каждого разведения). Стерильным шпателем растирают суспензию по поверхности агара, чашки помещают в термостат на 24 часа при температуре 37°С. После подсчитывают количество выросших колоний.
Определение бактериальной чистоты проводят по следующей схеме. По 1 мл из разведений 10-3 и 10-4, приготовленных по схеме приведенной выше, переносят в чашку Петри с МПА (по 3 чашки для каждого разведения). Стерильным шпателем растирают суспензию по поверхности агара, чашки помещают в термостат на 24 часа при температуре 37°С. После проводят микроскопию, посторонняя микрофлора должна отсутствовать.
Ниже приведены примеры, иллюстрирующие изобретение.
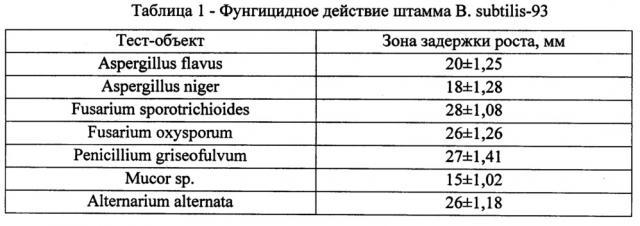
Пример 1. Оценка фунгицидного действия испытуемого штамма с помощью метода блоков. Для этого суспензию культуры В. subtilis-93 в объеме 0,1 мл при помощи шпателя равномерно засеяли на поверхность мясо-пептонного агара в чашке Петри, инкубировали в термостате при 37°С в течение 24 часов до образования «сплошного газона», затем стерильным пробочным сверлом вырезали с него блоки и перенесли их на предварительно засеянную тест-грибами поверхность среды (Aspergillus flavus, Aspergillus niger, Fusarium sporotrichioides, Fusarium oxysporum, Penicillium griseofulvum, Mucor sp.и Alternarium alternata: по 2 чашки на каждый из грибов - опыт и контроль). Грибы засеяли шпателем, агаровые блоки наложили ростом вверх на равном расстоянии один от другого и от краев чашки. Чашки с тест-грибами и агаровыми блоками инкубировали в термостате в течение 7 суток при температуре 26°С. Полученные данные в результате испытаний представлены в таблице 1.
Как видно из таблицы, предлагаемый штамм обладает фунгицидным потенциалом в отношении исследуемых патогенных грибов.
Пример 2. Оценка фунгицидного действия испытуемого штамма с помощью метода штриха. В четырнадцать стерильных чашек Петри разлили расплавленный мясо-пептонный агар, после застывания агара стерильным скальпелем по диаметру чашки вырезали полоску шириной 1 см. В образовавшийся желобок залили расплавленную и остуженную до 45-50°С агаризованную среду, содержащую суспензию культуры гриба Aspergillus flavus (чашка 1 и 2), Aspergillus niger (чашка 3 и 4), Fusarium sporotrichioides (чашка 5 и 6), Fusarium oxysporum (чашка 7 и 8), Penicillium griseofulvum (чашка 9 и 10), Mucor sp. (чашка 11 и 12), Alternarium alternata (чашка 13 и 14). После застудневания среды в чашки 2, 4, 6, 8, 10, 12 и 14 отдельным штрихом по диаметру чашки нанесли культуру В. subtilis-93 пересекая в перпендикулярном направлении желобок. Чашки поместили в термостат при 28°С. Результат учитывали на 2-е, 4-е и 7-е сутки по развитию бактериального штамма. Контролем роста тест-грибов служило параллельное выращивание их на чашках 1, 3, 5, 7, 9, 11 и 13 без культуры-антагониста.
Полученные данные представлены в таблице 2.
Как видно из таблицы, предлагаемый штамм обладает фунгицидным потенциалом в отношении исследуемых патогенных грибов.
Пример 3. Определение антифунгальной активности проводили методом двойных (встречных) культур на картофельно-глюкозном агаре. В чашки Петри высеяли агаровый блок с мицелием гриба (Aspergillus flavus (чашка 1), Aspergillus niger (чашка 2), Fusarium sporotrichioides (чашка 3), Fusarium oxysporum (чашка 4), Penicillium griseofulvum (чашка 5), Mucor sp. (чашка 6), Altemarium alternata (чашка 7)), бактериальный штамм Bacillus subtilis-93 (1×1010 КОЕ/мл) при этом нанесли на расстоянии 6 см от блока патогена. Культуры инкубировали в течение 20 дней при температуре 28°С. Контрольные варианты - чашки Петри с чистыми культурами грибов (7 чашек) и бактериями (1 чашка). Учеты провели на 5-е, 10-е, 15-е и 20-е сутки опыта. Отмечали характер взаимоотношений гриба и бактерии: наличие или отсутствие зон роста мицелия, их размер, изменение цвета, плотности, толщины и направления. Степень ингибирования роста мицелия патогена определили по формуле:
И=(1-(А/В))×100,
где И - % ингибирования;
А - рост гриба в опыте;
В - рост гриба в контроле.
Результаты исследования ингибирующей способности роста мицелия грибов бактериальным штаммом Bacillus subtilis-93 отражены в таблице 3.
Отмечены изменения в морфологии патогенных грибов под воздействием бактериального штамма Bacillus subtilis-93: отсутствие воздушного мицелия, лизис и израстание уже сформировавшегося мицелия, ингибирование роста и потемнение мицелия грибов.
Пример 4. Отработка оптимальных доз внесения микроорганизмов.
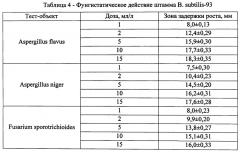
Исследовали антагонистическую активность штамма В. subtilis-93 в различных концентрациях в отношении микроскопических грибов методом оценки фунгистатического действия. Для этого суспензию штамма В. subtilis-93 в разведении 1×1010 микробных клеток на 1 мл нанесли на мясо-пептонный агар в чашки Петри в дозах 1; 2; 5; 10; 15 мл/л (по семь чашек на каждую из доз), чашки поместили в термостат и культивировали при 37°С в течение 48 часов. Затем бактерии стерилизовали в парах хлороформа (30 минут) и залили тонким слоем сусло-агара с предварительно внесенной культурой гриба (Aspergillus flavus, Aspergillus niger, Fusarium sporotrichioides, Fusarium oxysporum, Penicillium griseofulvum, Mucor sp. и Alternarium alternata) в соотношении 1:10. Контролем служили чашки с грибом без бактериальной культуры. Все чашки поместили в термостат и культивировали при 26°С в течение 7 суток. При появлении видимых колоний оценивали ежедневно их линейный рост. Степень антагонистической активности характеризовали размером зон задержки роста гриба. Полученные данные представлены в таблице 4.
Как видно из представленных в таблице данных, оптимальное количество внесения микробных клеток В. Subtilis-93 в разведении 1×1010 составило 5 мл/л. Дальнейшее увеличение количества микробных клеток существенным образом не изменяет специфическую активность штамма в отношении тест-культур грибов.
Пример 5. Лабораторные опыты провели с учетом динамики развития грибов в зерне в период хранения. Для этого навески зерна по 100 г обработали 10 мл суспензии, содержащей гриб и 0,5 мл культуральной жидкости микроба с титром клеток 1×1010 КОЕ/мл: Aspergillus flavus (проба 1), Aspergillus flavus и Bacillus subtilis-93 (проба 2), Aspergillus niger (проба 3), Aspergillus niger и Bacillus subtilis-93 (проба 4), Fusarium sporotrichioides (проба 5), Fusarium sporotrichioides и Bacillus subtilis-93 (проба 6), Fusarium oxysporum (проба 7), Fusarium oxysporum и Bacillus subtilis-93 (проба 8), Penicillium griseofulvum (проба 9), Penicillium griseofulvum и Bacillus subtilis-93 (проба 10), Mucor sp. (проба 11), Mucor sp. и Bacillus subtilis-93 (проба 12), Alternarium alternata (проба 13), Alternarium alternata и Bacillus subtilis-93 (проба 14). Пробы заложили во влажные камеры. По истечении 7 дней провели учет опыта.
В пробах, обработанных бактериальной суспензией, рост грибов был существенно меньше. Таким образом, бактериальный штамм Bacillus subtilis-93 обладает антагонизмом к грибам Aspergillus flavus, Aspergillus niger, Fusarium sporotrichioides, Fusarium oxysporum, Penicillium griseofulvum, Mucor sp. и Alternarium alternate. Дальнейшее наблюдение в течение месяца показало, что развитие и распространение гриба в обработанных пробах прекратилось, мицелий гриба угнетен.
Пример 6, демонстрирующий эффективность разложения микотоксинов.
Опыты провели на искусственно и естественно загрязненном афлатоксином В1 и Т-2 токсином зерне.
Первую серию опытов провели на искусственно загрязненном зерне. Для этого 100 г зерна поместили во флакон емкостью 500 мл, автоклавировали при давлении 1 атм 45 минут. После остывания зерна во флаконы внесли микотоксины в концентрации 400 мкг/кг (в 1-15 - афлатоксин В1, во флаконы 16-30 - Т-2 токсин). Затем во флаконы 1, 6, 11, 16, 21 и 26 внесли, соответственно, по 1 мл суспензии штамма В. subtilis-93 в разведении 1×109, во флаконы 2, 7, 12, 17, 22 и 27 - в разведении 2×109, во флаконы 3, 8, 13, 18, 23 и 28 - 5×109, во флаконы 4, 9, 14, 19, 24 и 29 - 10×109 с последующим тщательным перемешиванием, флаконы 5, 10, 15, 20, 25 и 30 служили контролем без микробного штамма. Каждые 24 часа проводили исследование зерна на содержание микотоксинов.
Вторую серию опытов провели в лабораторных условиях на экспериментально зараженном микроскопическими грибами зерне. Для этого 100 г зерна поместили во флакон емкостью 500 мл, автоклавировали при давлении 1 атм 45 минут. После остывания зерна во флаконы внесли по 15 мл фильтрата недельной культуры гриба, выращенного на жидкой картофельной среде (флаконы 1-5 - Aspergillus flavus, флаконы 6-10 - Fusarium sporotrichioides). Во флаконы 1-4 и 6-9 внесли, соответственно, по 1 мл суспензии штамма В. subtilis-93 в разведениях 1×109, 2×109, 5×109, 10×109 с последующим тщательным перемешиванием, флаконы 5 и 10 служили контролем без микробного штамма. Все флаконы инкубировали в термостате при 26°С в течение 7 суток. Затем содержимое флаконов автоклавировали при давлении 1 атм 30 минут, просушили при 45°С и размололи на лабораторной мельнице. Содержание афлатоксина В1 определили методом ТСХ и ВЭЖХ, Т-2 токсина - биоавтографии (проявление хроматограммы осуществили с использованием тест-культуры Candida pseudotropicalis, штамм 44 пк), с подтверждением результатов хроматомасс-спектрометрическим анализом.
В зерне флаконов 3, 4, 8 и 9 токсинов обнаружено не было, 1, 2, 6 и 7 - в следовых количествах, в контрольных флаконах 5-280 мкг/кг (афлатоксин В1) и 10-330 мкг/кг (Т-2 токсин).
Как видно из представленных данных, оптимальное количество внесения микробных клеток В. Subtilis-93 в разведении 1×109 составило 5 мл/100 г зерна (50 мл/кг), или 5 мл/кг в разведении 1×1010. Дальнейшее увеличение количества микробных клеток существенным образом не изменяло специфическую активность штамма в отношении деградации микотоксинов.
Пример 7. Исследование безвредности, вирулентности, токсичности и токсигенности штамма Bacillus subtilis-93.
Для определения безвредности суспензию суточной культуры Bacillus subtilis-93 в физиологическом растворе (разведением 1×1010 КОЕ/мл) в объеме 0,5 мл перорально ввели 10 белым мышам. Все мыши оставались живы.
Для исследования вирулентности суспензию суточной культуры Bacillus subtilis-93 в физиологическом растворе с концентрацией клеток 109-1011 КОЕ/мл ввели 30 белым мышам однократно внутрибрюшинно в объеме 1 мл и пятикратно перорально в объеме 0,5 мл.
Схема постановки опытов исследования токсичности идентична исследованию вирулентности, отличие состояло в инактивации микробной суспензии (прогревание в течение 1,5 ч при 100°С). Каждую концентрацию испытывали на 10 белых мышах, вводили внутрибрюшинно.
Результаты исследования отражены в таблице 6.
Установили отсутствие вирулентных и токсичных свойств, однократное внутрибрюшинное и многократное пероральное введение микробной суспензии Bacillus subtilis-93 не привело к гибели подопытных животных. На протяжении всего периода наблюдения (10 сут) после окончания инъекций или перорального введения видимых изменений в клиническом состоянии не отмечали.
Токсигенность суспензии Bacillus subtilis-93 в разведении 1010 изучили при внутрибрюшинном введении центрифугата, полученном центрифугированием культуральной жидкости в течение 30 мин при 3000 об/мин. Гибели мышей не отметили, в период наблюдения все животные оставались активными, хорошо поедали корм.
Пример 8. Исследование токсичности зерна, пораженного микроскопическими грибами после обработки суспензией штамма Bacillus subtilis-93. Для этого сформировали 7 групп белых крыс по 5 голов в каждой. Животным первой группы скармливали зерно, контаминированное афлатоксином В1 в дозе 400 мкг/кг корма, второй группы - Т-2 токсином в дозе 400 мкг/кг, третьей - сочетанно афлатоксином В1 и Т-2 токсином в тех же дозах, у крыс четвертой - шестой групп корм контаминировали токсинами и обработали суспензией Bacillus subtilis-93 в разведении 1×1010 в дозе 5 мл/кг. Животные седьмой группы служили контролем и получали чистое зерно. Продолжительность опыта составила 45 суток, ежедневно оценивали общее состояние животных, потребление корма и воды, на 15, 30 и 45 сутки опыта проводили взвешивание крыс и взятие крови.
В группах, где крысы потребляли корм, контаминированный микотоксинами, клинические признаки отравления начали проявляться на 4 сутки опыта в виде угнетения, шаткости походки, тремора, взъерошенности шерстного покрова, диареи. В группах, где корм обработали суспензией штамма, клиника интоксикации проявилась в более поздние сроки и с менее выраженной симптоматикой, диареи не отмечали. Прирост массы тела за опыт у крыс первой - третьей групп был ниже контроля на 19,3; 22,0 и 34,2%, соответственно, в четвертой - шестой группах - на 6,3; 8,1 и 10,5%. При исследовании крови у животных первой - третьей групп на протяжении всего опыта наблюдалась эритроцитопения, лейкопения, снижение уровня гемоглобина, общего белка, глюкозы, изменение соотношения белковых фракций, повышение СОЭ, продуктов перекисного окисления липидов (МДА). Исследуемые показатели в крови крыс, потреблявших корм, обработанный микробной суспензией, не имели достоверных отличий с контролем.
Пример 9. Исследование токсичности корма пораженного микроскопическими грибами после обработки суспензией штамма Bacillus subtilis-93 на стилонихиях. Для этого взяли 7 проб зерна по 10 г, подготовленного для опыта на крысах, поместили его в конические колбы объемом 100 мл, залили ацетоном, размешали в течение 5 мин, отстаивали 10 мин, отобрали 0,5 мл надосадочной жидкости экстракта и перенесли в стакан с 100 мл водного раствора Лозина-Лозинского. Затем на предметные стекла нанесли по 20 мкл среды со стилонихиями и 20 мкл водно-ацетонового экстракта зерна. Через 1 час экспозиции подсчитали численность простейших.
В экстракте проб зерна первой - третьей групп выживаемость стилонихий составила 20, 15 и 5%, четвертой - шестой групп - 90, 85 и 75%, соответственно, в контроле - 100%.
Таким образом, обработка суспензией штамма Bacillus subtilis-93 корма, контаминированного микотоксинами, способствует снижению его токсичности.
Пример 10. Исследование влияния скармливания сельскохозяйственным животным корма пораженного микроскопическими грибами и микотоксинами после обработки суспензией штамма Bacillus subtilis-93.
Опыты провели на 24 поросятах крупно-белой породы 8 - недельного возраста, живой массой 14-17 кг, разделенных по принципу аналогов на две группы по 8 голов. Животным первой и второй групп задавали не доброкачественный комбикорм, контаминированный микроскопическими грибами рода Aspergillus, и Fusarium, микотоксинами: Т-2 и афлатоксином В1 в дозах 400 мкг/кг, однако корм поросят второй группы предварительно с помощью ручного опрыскивателя обработали суспензией штамма Bacillus subtilis-93 в разведении 1×1010 из расчета 5 мл/кг с последующим тщательным перемешиванием. Животные третьей группы служили контролем и получали доброкачественный комбикорм. Продолжительность опыта составила 45 суток.
У поросят, потреблявших токсичный корм, на 14-16 сут исследования наблюдали понижение аппетита и активности, животные имели вялый вид, бока становились запавшими, появилось расстройство со стороны желудочно-кишечного тракта. Наблюдали отставание в росте и развитии. Прирост массы тела (табл. 7) составил 2,1 кг на 15 сут, 2,39 кг - на 30 сут и 3,29 кг - на 45 сут. У поросят при потреблении токсичного корма, обработанного микробной суспензией, клинических признаков отравления отмечено не было. Прирост массы тела на 15 сут составил 3,07 кг, 30 сут - 3,50 кг, 45 сут - 5,10 кг, разница прироста за опыт по сравнению с приростом массы животных второй группы - 48,3%, среднесуточный прирост был выше на 84,4 г, отличия с контрольными показателями были не достоверные.
Примечание: * - различия с контролем достоверны, р≤0,05
Результаты гематологических исследований крови поросят третьей группы (табл. 8) показали повышение количества эритроцитов в исследуемые сроки на 4,8; 7,5 и 16,7%, лейкоцитов - на 5,5; 21,6 и 24,3%, гемоглобина - 3,3; 4,1 и 6,9%, понижение гематокрита - на 5,7; 6,4 и 7,9%, соответственно, по сравнению с показателями животных получавших токсичный корм. С контрольными показателями различия были не достоверными.
У поросят третьей группы на 15; 30 и 45 сут эксперимента отмечали повышение содержания общего белка на 10,1; 10,6 и 14,2%, альбуминов - на 7,4; 12,4 и 13,8%, понижение концентрации β-глобулинов на 9,5; 11,7 и 18,7%,
γ-глобулинов - 7,1; 7,3 и 11,8%, соответственно в сравнении с показателями животных второй группы (табл. 9), с контролем отличия были не достоверны.
Примечание: * - различия с контролем достоверны, р≤0,05
Активность аланин- и аспартатаминотрансферазы (АЛТ и ACT) в крови поросят третьей группы была на уровне контроля и ниже, чем у животных второй группы на 15 сут на 48,1 и 14,1%, 30-е - на 32,9 и 18,6%, 45-е - 20,1 и 34,4%, соответственно. Содержание щелочной фосфатазы (ЩФ) в сыворотке крови в исследуемые сроки было ниже значений поросят второй группы на 10,1; 17,9 и 23,0%, уровень холестерина был ниже на 11,9; 18,3 и 21,5%, концентрация билирубина общего - на 23,7; 17,7 и 30,8%, содержание мочевины - на 21,6; 25,8 и 26,5%, креатинина - 5,9; 6,6 и 9,0%, амилазы - 11,2; 20,0 и 30,4%, концентрация глюкозы была выше на 3,9; 9,0 и 16,7%.
Примечание: * - различия с контролем достоверны, р≤0,05
Выявили угнетение показателей иммунной системы у поросят, потреблявших токсичный корм. У животных, комбикорм которых был обработан микробной суспензией, исследуемые показатели не имели достоверных отличий с контролем. Так, у поросят второй группы в сравнении с животными третьей группы понижение фагоцитарной активности нейтрофилов на 15; 30; 45 сут исследования составило, соответственно, 6,3; 12,7; 17,9%, активность лизоцима сыворотки была ниже на 7,6; 12,7; 18,9%, содержание Т-лимфоцитов - на 3,4; 12,1; 13,7%, В - лимфоцитов - на 3,3; 6,1; 8,7% (табл. 10).
Примечание: * - различия с контролем достоверны, р≤0,05
Патологоанатомическая картина вскрытия умерщвленных поросят, потреблявших не доброкачественный комбикорм, обработанный суспензией штамма Bacillus subtilis-93, не имела отличий с контрольными животными. При вскрытии поросят второй группы, потреблявших токсичный корм без обеззараживания, отмечали незначительную инъекцию сосудов брыжейки и кишечника, гиперемию слизистой оболочки тонкого отдела кишечника, коричнево-красную окраску печени, слабую выраженность границы между корковым и мозговым веществом почек, отечность вещества головного мозга, кровенаполненность сосудов. Легкие, сердце, селезенка не имели видимых патологических изменений. При гистологическом исследовании отмечали внутриклеточный и периваскулярный отек в сердце, дистрофические изменения гепатоцитов и эпителия извитых канальцев почек (в виде белковой дистрофии) с очаговыми некробиозами и десквамацией.
Таким образом, у поросят, потребляющих токсичный корм, содержащий микромицеты и микотоксины, отмечались внешние признаки отравления, изменения гематологических, биохимических, иммунологических показателей крови и выявлялись патологические изменения внутренних органов. У животных, потреблявших токсичный корм обработанный суспензией штамма Bacillus subtilis-93, клиника отравления не проявилась, отмечено благоприятное воздействие на морфологические, биохимические и иммунологические показатели крови, установлено отсутствие патологических изменений в органах.
Пример 11. Провели отбор проб кормов, почвы, воды, крови у крупного рогатого скота в хозяйствах Апастовского района РТ с целью мониторинга содержания микотоксинов и анализа микобиоты. Исследования провели согласно существующим ГОСТ и МУ. В ходе анализа результатов опытов на кроликах и белых мышах 55% проб признаны слаботоксичными, 45% - токсичными. Микологические исследования показали одновременную контаминацию проб патогенными грибами родов Aspergillus (28,6%), Fusarium (22,2%), Mucor (26,1%), Penicillium (12,4%), Althernarium (7,0%), Risopus (3,7%). Выявили содержание микотоксинов Т-2, зеараленон, афлатоксин В1, охратоксин А, ДОН в концентрациях превышающих МДУ. Таким образом, отобранные пробы имеют высокую степень контаминации микромицетами и микотоксинами и могут быть источниками кормовых микотоксикозов.
С целью снижения контаминированности проб микромицетами, содержания микотоксинов и общей токсичности провели микробиологическую обработку суспензией на основе штамма Bacillus subtilis-93 по рекомендуемому способу. В результате отмечены изменения в морфологии патогенных грибов под воздействием бактериального штамма Bacillus subtilis-93: отсутствие воздушного мицелия, лизис и израстание уже сформировавшегося мицелия, ингибирование роста и потемнение мицелия грибов, что свидетельствует о наличии антагонистической активности. Содержание микотоксинов после обработки отмечали лишь в следовых количествах. В опытах на токсичность проб после обработки установили, что они являются не токсичными.
Затем в условиях хозяйств, из которых был произведен отбор проб, провели обеззараживание кормов по рекомендуемому способу. Через 30 дней повторно провели отбор проб кормов и забор крови у взрослого и молодняка крупного рогатого скота. В результате исследований установили существенное снижение контаминации проб микромицетами и микотоксинами, нормализацию гематологических и биохимических показателей крови у животных.
Способ обработки зерна, пораженного микроскопическими грибами и микотоксинами, предназначенного для скармливания сельскохозяйственным животным, характеризующийся тем, что перед высушиванием и закладкой зерна на хранение его обеззараживают суспензией штамма Bacillus subtilis-93-ДЕП в концентрации 1×1010 КОЕ/мл из расчета 5 л на тонну зерна при помощи опрыскивателей однократно с последующим тщательным перемешиванием.