Нуклеиновая кислота, содержащая или кодирующая гистоновую структуру типа"стебель-петля" и поли(а)-последовательность или сигнал полиаденилирования, для увеличения экспрессии кодируемого опухолевого антигена
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к молекуле мРНК, содержащей кодирующую область, кодирующую содержащий опухолевый антиген белок, по меньшей мере, одну гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования, и может быть использовано в медицине. Изобретение позволяет получить нуклеиновую кислоту для увеличения экспрессии указанного кодируемого пептида или белка. Объединение в структуре нуклеиновой кислоты сигнала полиаденилирования и гистоновой структуры типа «стебель-петля» за счет синергетического эффекта позволяет в несколько раз повысить уровень экспрессии по сравнению с таким уровнем каждого из таких элементов, используемых в отдельности. 8 н. и 17 з.п. ф-лы, 27 ил., 15 табл., 3 пр.
Реферат
Настоящее изобретение относится к последовательности нуклеиновых кислот, содержащей или кодирующей кодирующую область, кодирующую по меньшей мере один пептид или белок, содержащий опухолевый антиген или его фрагмент, вариант или производные по меньшей мере одну гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования. Кроме того, настоящее изобретение предоставляет применение нуклеиновой кислоты для увеличения экспрессии указанного кодируемого пептида или белка. Оно также раскрывает ее использование для подготовки фармацевтической композиции, особенно вакцины, например, для применения при лечении онкологических или опухолевых заболеваний. Настоящее изобретение далее описывает способ увеличения экспрессии пептида или белка, содержащего опухолевый антиген или его фрагмент, вариант или производное, с использованием нуклеиновой кислоты, содержащей или кодирующей гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования.
Помимо сердечно-сосудистых заболеваний и инфекционных заболеваний, возникновение опухолевых и онкологических заболеваний является одной из наиболее частых причин смерти в современном обществе и в большинстве случаев связано с большими затратами с точки зрения терапии и последующих реабилитационных мероприятий. Лечение опухолей и онкологических заболеваний в значительной степени зависит, например, от типа опухоли, которая имеет место, возраста, распространения раковых клеток у пациента, проходящего лечение, и др. Лечение рака в настоящее время обычно осуществляется путем применения лучевой терапии или химиотерапии, в дополнение к инвазивным операциям. Однако такие традиционные способы лечения, как правило, оказывают чрезвычайный стресс на иммунную систему и могут применяться в некоторых случаях лишь в ограниченной степени. Кроме того, большинство этих традиционных способов лечения требует длительных интервалов между отдельными процедурами лечения для обеспечения восстановления иммунной системы.
По этой причине, в дополнение к «традиционным способам лечения» в последние годы были исследованы дополнительные стратегии для того, чтобы избежать или хотя бы уменьшить воздействие таких способов лечения на иммунную систему. Один из таких дополнительных способов лечения, в частности, включает генно-терапевтические подходы или генетическую вакцинацию, которые уже оказались весьма перспективными для лечения или поддержки таких традиционных способов лечения.
Генная терапия и генетическая вакцинация представляют собой способы молекулярной медицины, которые уже доказали свою эффективность в терапии и профилактике заболеваний и, как правило, демонстрируют существенное влияние на повседневную медицинскую практику, в частности на лечение заболеваний, как упоминалось выше. Оба способа, генная терапия и генетическая вакцинация, основываются на введении нуклеиновых кислот в клетки или ткань пациента и последующей обработке информации, кодируемой нуклеиновой кислотой, которая была введена в клетки или ткань, то есть (белковой) экспрессии желательных полипептидов.
В подходах генной терапии, как правило, используется ДНК, хотя также известно об использовании РНК в последних разработках. Важно, что во всех этих подходах генной терапии мРНК функционирует в качестве мессенджера информации о последовательности кодируемого белка, независимо от того, используется ли ДНК, вирусная РНК или мРНК.
Вообще говоря, РНК считается нестабильной молекулой: РНКазы встречаются повсеместно, и их очень сложно инактивировать. Кроме того, РНК также является химически более лабильной, чем ДНК. Поэтому, наверное, является удивительным, что «состояние по умолчанию» мРНК в эукариотических клеток характеризуется относительной стабильностью и для ускорения распада отдельных мРНК требуются специальные сигналы. Основной причиной этого обнаружения, по-видимому, является то, что распад мРНК внутри клеток катализируется почти исключительно экзонуклеазами. При этом, концы эукариотических мРНК защищены от этих ферментов определенными концевыми структурами и ассоциированными с ними белками: m7GpppN CAP на 5ʹ-конце и, как правило, поли(A)-последовательностью на 3ʹ-конце. Удаление этих двух концевых модификаций, таким образом, рассматривается ограничивающим скорость распада мРНК. Несмотря на то, что стабилизирующий элемент был охарактеризован в 3ʹ UTR мРНК альфа-глобина, последовательности РНК, влияющие на оборот эукариотических мРНК, обычно действуют в качестве катализатора распада, как правило, за счет ускорения деаденилирования (в качестве обзора, Meyer, S., C. Temme, et al. (2004), Crit Rev Biochem Mol Biol 39(4): 197-216).
Как упоминалось выше, 5ʹ-концы эукариотических мРНК, как правило, модифицируются посттранскрипционно, чтобы нести метилированную CAP-структуру, например, m7GpppN. Помимо ролей в сплайсинге, стабилизации и транспорте РНК, CAP-структура значительно увеличивает привлечение 40S-рибосомных субъединиц к 5ʹ-концу мРНК во время инициации трансляции. Для последней функции требуется распознавание CAP-структуры комплексом эукариотического фактора инициации eIF4F. Поли(A)-последовательность дополнительно стимулирует трансляцию через усиление привлечения 40S-субъединиц к мРНК, эффект, который требует вмешательства поли(A)-связывающего белка (PABP). PABP, в свою очередь, как недавно был продемонстрировано, физически взаимодействует с eIF4G, который является частью CAP-связывающего eIF4F-комплекса. Соответственно, была постулирована модель замкнутой петли инициации трансляции на кэпированной, полиаденилированной мРНК (Michel, Y.M., D. Poncet, et al. (2000), J Biol Chem 275(41): 32268-76).
Почти все эукариотические мРНК заканчиваются такой поли(A)-последовательностью, которая добавляется к 3ʹ-концу вездесущим аппаратом расщепления/полиаденилирования. Присутствие поли(A)-последовательности на 3ʹ-конце является одной из самых узнаваемых особенностей эукариотических мРНК. После расщепления большинство пре-мРНК, за исключением зависящих от репликации транскриптов гистонов, приобретают полиаденилированный хвост. В этом контексте, 3ʹ-концевой процессинг представляет собой ядерный котранскрипционный процесс, который способствует транспорту мРНК из ядра в цитоплазму и влияет на стабильность и трансляцию мРНК. Формирование этого 3ʹ-конца происходит за две стадии реакции, направляемой аппаратом расщепления/полиаденилирования, и зависит от наличия двух элементов последовательности в предшественниках мРНК (пре-мРНК): высококонсервативного гексануклеотида AAUAAA (сигнал полиаденилирования) и расположенной ниже по течению C/U-богатой последовательности. На первой стадии, пре-мРНК расщепляется между этими двумя элементами. На второй стадии, тесно связанной с первой стадией, вновь образованной 3ʹ-конец удлиняется путем добавления поли(A)-последовательности, состоящей из 200-250 аденилатов, что впоследствии оказывает влияние на все аспекты метаболизма мРНК, включая экспорт, стабильность и трансляцию мРНК (Dominski, Z. and W.F. Marzluff (2007), Gene 396(2): 373-90).
Единственным известным исключением из этого правила являются репликацие-зависимые гистоновые мРНК, которые заканчиваются гистоновыми структурами типа «стержень-петля», а не поли(A)-последовательностью. Типичные последовательности гистоновых структур типа «стебель-петля» описаны в Lopez et al. (Davila Lopez, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308).
Структуры типа «стебель-петля» в пре-мРНК гистонов, как правило, следуют за пурин-богатой последовательностью, известной как гистоновый расположенный вниз по течению элемент (HDE). Эти пре-мРНК процессируются в ядре при помощи одного эндонуклеотического расщепления примерно 5 нуклеотидами ниже по течению структуры типа «стебель-петля», катализируемого U7 snRNP через спаривание оснований U7 snRNA с HDE. Последовательность 3'-UTR, включающую гистоновую структуру типа «стебель-петля», и расположенный вниз по течению элемент гистонов (HDE) (сайт связывания U7 snRNP) обычно называют гистоновым сигналом 3'-процессинга (см., например, Chodchoy, N., N.B. Pandey, et al. (1991). Mol Cell Biol 11(1): 497-509).
Из-за необходимости упаковки вновь синтезированной ДНК в хроматин синтез гистонов регулируется согласовано с клеточным циклом. Увеличенный синтез гистоновых белков в процессе S-фазы достигается за счет активации транскрипции гистоновых генов, а также посттранскрипционной регуляции уровней гистоновых мРНК. Можно показать, что гистоновая структура типа «стебель-петля» имеет важное значение для всех посттранскрипционных стадий регуляции экспрессии гистонов. Это необходимо для эффективного процессинга, экспорта мРНК в цитоплазму, посадки на полирибосомы и регулирования стабильности мРНК.
В контексте вышесказанного, был идентифицирован 32 кДа белок, который ассоциирован с гистоновой структурой типа «стебель-петля» на 3ʹ-конце гистоновых информационных РНК как в ядре, так и цитоплазме. Уровень экспрессии этого связывающегося со структурой типа «стебель-петля» белка (SLBP) регулируется клеточным циклом и является наибольшим в S-фазе, когда уровни гистоновых мРНК повышаются. SLBP необходим для эффективного 3'-концевого процессинга гистоновых пре-мРНК при помощи U7 snRNP. После завершения процессинга SLBP остается связанным со структурой типа «стебель-петля» на конце зрелых гистоновых мРНК и стимулирует их трансляцию в гистоновые белки в цитоплазме (Dominski, Z. and W.F. Marzluff (2007), Gene 396(2): 373-90). Интересно, что РНК-связывающий домен SLBP является консервативным у метазоа и простейших (Davila Lopez, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308), и может быть продемонстрировано, что его связывание с последовательностью гистоновой структуры типа «стебель-петля» зависит от устройства структуры типа «стебель-петля» и минимальный сайт связывания содержит по меньшей мере 3 нуклеотида с 5ʹ- и 2 нуклеотида 3ʹ-стороны структуры типа «стебель-петля» (Pandey, N.B., et al. (1994), Molecular and Cellular Biology, 14(3), 1709-1720 и Williams, A.S., & Marzluff, W.F., (1995), Nucleic Acids Research, 23(4), 654-662).
Хотя гены гистонов, как правило, классифицируются как «репликацие-зависимые», дающие начало мРНК, которая заканчивается гистоновой структурой типа «стебель-петля», или «замещенного типа», дающие начало мРНК, несущей вместо этого поли-(A)-хвост, в некоторых очень редких случаях были идентифицированы природные мРНК, содержащие как гистоновую структуру типа «стебель-петля», так и поли(A) или олиго(A) на своем 3ʹ-конце. Sanchez et al. исследовали влияние природных олиго(A)-хвостов, добавленных к 3ʹ-концу гистоновый структуры типа «стебель-петля» гистоновой мРНК во время оогенеза Xenopus, с использованием люциферазы в качестве репортерного белка и обнаружили, что олиго(A)-хвост представляет собой активную часть механизма репрессии трансляции, который сайленсирует гистоновую мРНК во время оогенеза, и его удаление является частью механизма, который активирует трансляцию гистоновых мРНК (Sanchez, R. and W.F. Marzluff (2004), Mol Cell Biol 24(6): 2513-25).
Кроме того, требования регулирования репликацие-зависимых гистонов на уровне процессинга пре-мРНК и стабильности мРНК были исследованы при помощи искусственных конструкций, кодирующих маркерный белок альфа-глобин, пользуясь тем, что ген глобина содержит интроны, в отличие от интрон-несодержащих генов гистонов. Для этой цели были созданы конструкции, в которых за последовательностью, кодирующей альфа-глобин, следовал сигнал гистоновой структуры типа «стебель-петля» (гистоновая структура типа «стебель-петля» с последующим гистоновым расположенным вниз по течению элементом) и сигналом полиаденилирования (Whitelaw, E., et al. (1986). Nucleic Acids Research, 14(17), 7059-7070; Pandey, N.B., & Marzluff, W.F. (1987). Molecular and Cellular Biology, 7(12), 4557-4559; Pandey, N.B., et al. (1990). Nucleic Acids Research, 18(11), 3161-3170).
В другом подходе Lüscher et al. исследовали зависимую от клеточного типа регуляцию рекомбинантного гена гистона H4. Были созданы конструкции, в которых за кодирующей последовательностью H4 следовал сигнал гистоновой структуры типа «стебель-петля» и сигнал полиаденилирования, два сигналами процессинга, случайно разделенных кодирующей последовательностью галактокиназы (Lüscher, B. et al., (1985). Proc. Natl. Acad. Sci. USA, 82(13), 4389-4393).
Кроме того, Stauber et al. определили минимальную последовательность, необходимую для осуществления регуляции клеточного цикла на уровне мРНК гистона H4. Для этих исследований были использованы конструкции, включающие кодирующую последовательность для селективного маркера ксантин:гуанинфосфорибозилтрансферазы (GPT), предшествующую сигналу гистоновой структуры типа «стебель-петля», с последующим сигналом полиаденилирования (Stauber, C. et al., (1986). EMBO J, 5(12), 3297-3303).
При исследовании процессинга гистоновой пре-мРНК Wagner et al. выявили факторы, необходимые для расщепления гистоновых пре-мРНК, с помощью репортерной конструкции, в которой EGFP помещен между сигналом гистоновой структуры типа «стебель-петля» и сигналом полиаденилирования, так, что EGFP экспрессировался лишь в случае нарушения процессинга гистоновой пре-мРНК (Wagner, E. J. et al., (2007). Mol Cell 28(4), 692-9).
Следует отметить, что для трансляции полиаденилированной мРНК, как правило, требуется сближение 3' поли(A)- последовательности с 5ʹ CAP. Это опосредуется через белок-белковое взаимодействие между поли(A)-связывающим белком и эукариотическим фактором инициации eIF4G. В отношении репликацие-зависимых гистоновых мРНК, аналогичный механизм не был раскрыт. В этом контексте, Gallie et al. показывают, что гистоновая структура типа «стебель-петля» функционально аналогична поли-(A)-последовательности в том, что она повышает эффективность трансляции и является со-зависимой от 5ʹ-CAP для установления эффективного уровня трансляции. Они показали, что гистоновая структура типа «стебель-петля» является достаточной и необходимой для увеличения трансляции репортерной мРНК в трансфицированных клетках яичника китайского хомячка, но должна располагаться на 3ʹ-конце, чтобы оптимально функционировать. Поэтому, аналогично поли(А)-хвосту в других мРНК, 3ʹ-конец этих гистоновых мРНК, по-видимому, необходимым для трансляции in vivo и функционально аналогичен поли(А)-хвосту (Gallie, D.R., Lewis, N.J., & Marzluff, W.F. (1 996), Nucleic Acids Research, 24(10), 1954-1962).
Кроме того, можно показать, что SLBP связан с цитоплазматической гистоновой мРНК и необходим для ее трансляции. Хотя SLBP не взаимодействует непосредственно с eIF4G, домен, необходимый для трансляции гистоновой мРНК, взаимодействует с недавно идентифицированным белком SLIP1. На следующей стадии, SLIP1 взаимодействует с eIF4G и обеспечивает циклизацию гистоновой мРНК и поддерживает эффективную трансляцию гистоновой мРНК с помощью механизма, аналогичного трансляции полиаденилированных мРНК.
Как упоминалось выше, в подходах генной терапии, как правило, используется ДНК для передачи закодированной информации в клетку, которая затем транскрибируется в мРНК, несущую естественные элементы мРНК, в частности, структуру 5ʹ-CAP и 3ʹ поли(A)-последовательность для обеспечения экспрессии кодируемого терапевтического или антигенного белка.
Однако во многих случаях система экспрессии, основанная на введении таких нуклеиновых кислот в клетки или ткань пациента и последующей экспрессии нужных полипептидов, кодируемых этими нуклеиновыми кислотами, не проявляет желаемого или даже необходимого уровня экспрессии, который может обеспечить эффективную терапию, независимо от того, используется ли ДНК или РНК.
В предшествующем уровне техники до сих пор предпринимались различные попытки увеличения уровня экспрессии кодируемого белка, в частности, путем применения улучшенных систем экспрессии, как in vitro, так и/или in vivo. Способы увеличения экспрессии, как правило, описываемые в предшествующем уровне техники, традиционно основываются на применении экспрессионных векторов или кассет, содержащих определенные промоторы и соответствующие регуляторные клетки. Поскольку эти экспрессионные векторы или кассеты обычно ограничиваются конкретными клеточными системами, эти системы экспрессии должны быть адаптированы для применения в различных клеточных системах. Такие адаптированные экспрессионные векторы или кассеты затем, как правило, трансфицируют в клетки и обычно обрабатывают в зависимости от конкретной клеточной линии. Таким образом, предпочтение отдается в первую очередь тем молекулам нуклеиновых кислот, которые способны экспрессировать кодируемые белки в клетке-мишени при помощи систем, внутренне присущих клетке, независимых от промоторов и регуляторных элементов, которые специфичны для отдельных типов клеток. В этом контексте можно проводить различие между стабилизирующими элементами мРНК и элементами, которые увеличивают эффективность трансляции мРНК.
мРНК, которые оптимизированы по своей кодирующей последовательности и которые, в основном, подходят для таких целей, описаны в заявке WO 02/098443 (CureVac GmbH). Например, WO 02/098443 описывает мРНК, которые стабилизируются в общем виде и оптимизированы для трансляции своих кодирующих областей. WO 02/098443 далее раскрывает способ определения модификаций последовательностей. WO 02/098443 дополнительно описывают возможности для замены нуклеотидов аденина и урацила в последовательностях мРНК в целях увеличения содержания гуанина/цитозина (G/C) последовательностей. В соответствии с WO 02/098443, такие замены и адаптации для увеличения G/C-содержания могут использоваться для генно-терапевтических применений, а также для генных вакцин при лечении онкологических или инфекционных заболеваний. В этом контексте, WO 02/098443, как правило, упоминает последовательности в качестве базовой последовательности для таких модификаций, в которой модифицированная мРНК кодирует по меньшей мере один биологически активный пептид или полипептид, который транслируется в проходящем лечение пациенте, например, либо не всех, либо неадекватно, либо с дефектами. Кроме того, WO 02/098443 предлагает мРНК, кодирующие антигены, например, опухолевые антигены или вирусных антигены в качестве базовых последовательностей для таких модификаций.
В другом подходе, для увеличения экспрессии кодируемого белка приложение WO 2007/036366 описывает положительный эффект длинных поли(A)-последовательностей (в частности, длиной более 120 п.н.) и комбинации по меньшей мере двух 3ʹ-нетранслируемых областей бета-глобина на стабильность и трансляционную активность мРНК.
Однако, несмотря на то, что все эти недавние документы рассматриваемой области техники уже пытаются обеспечить достаточно эффективные инструменты для подходов генной терапии и дополнительно улучшают стабильность и трансляционную активность мРНК, по-прежнему остается проблема пониженной стабильности приложений на основе РНК против ДНК-вакцин и генно-терапевтических подходов на основе ДНК. Соответственно, в рассматриваемой области по-прежнему существует потребность в предоставлении улучшенных инструментов для подходов генной терапии и генной вакцинации, или таковых в качестве дополнительной терапии для традиционных способов лечения, как описано выше, которые позволяют лучше обеспечивать кодируемыми белками in vivo, например, путем дополнительного увеличения стабильности и/или трансляционной активности мРНК, предпочтительно для генной терапии и генной вакцинации.
Более того, несмотря на все успехи в рассматриваемой области, эффективная экспрессия кодируемого пептида или белка в бесклеточных системах, клетках или организмах (рекомбинантная экспрессия) до сих пор остается сложной проблемой.
Задача, лежащая в основе настоящего изобретения, представляет собой, следовательно, предоставление дополнительных и/или альтернативных способов увеличения экспрессии кодируемого белка, предпочтительно путем дополнительной стабилизации мРНК и/или увеличения эффективности трансляции такой мРНК по отношению к таким нуклеиновым кислотам, известным из предшествующего уровня техники, для применения в генной вакцинации при лечебном или профилактическом лечении онкологических или опухолевых заболеваний.
Эта задача решается содержанием прилагаемых пунктов формулы изобретения. В частности, задача, лежащая в основе настоящего изобретения, решается в соответствии с первым аспектом при помощи последовательности нуклеиновых кислот по изобретению, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит опухолевый антиген или его фрагмент, вариант или производное;
b) по меньшей мере, одну гистоновую структуру типа «стебель-петля» и
c) поли-(A)-последовательность или сигнал полиаденилирования,
предпочтительно для увеличения экспрессии указанного кодируемого пептида или белка.
Кроме того, любая соответствующая последовательность типа «стебель-петля», отличная от гистоновой последовательности типа «стебель-петля» (полученная из генов гистонов, в частности генов гистонов семейств H1, H2A, H2B, H3 и H4)), может быть использована в настоящем изобретении во всех его аспектах и вариантах осуществления.
В этом контексте особенно предпочтительно, что нуклеиновую кислоту по изобретению в соответствии с первым аспектом изобретения продуцируют по меньшей мере частично путем синтеза ДНК или РНК, предпочтительно, как описано в настоящем документе, или она представляет собой выделенную нуклеиновую кислоту.
Настоящее изобретение основано на удивительном открытии авторов настоящего изобретения, что комбинация поли(A)-последовательности или сигнала полиаденилирования и по меньшей мере одной гистоновой структуры типа «стебель-петля», несмотря на то, что каждое из этого представляет альтернативные природные механизмы, действует синергически, поскольку эта комбинация увеличивает белковую экспрессию, многократно превышающую уровень, наблюдаемый с каждым из элементов по отдельности. Синергетический эффект комбинации поли(A) и по меньшей мере одной гистоновой структуры типа «стебель-петля» наблюдается независимым от порядка поли(A) и гистоновой структуры типа «стебель-петля» и независимым от длины поли(A)-последовательности.
Поэтому особенно предпочтительно, что последовательность нуклеиновых кислот по изобретению включает или кодирует а) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит опухолевый антиген или его фрагмент, вариант или производное; b) по меньшей мере, одну гистоновую структуру типа «стебель-петля» и c) поли(A)-последовательность или последовательность полиаденилирования; предпочтительно для увеличения уровня экспрессии указанного кодируемого пептида или белка. В некоторых вариантах осуществления может быть предпочтительно, если кодируемый белок не является гистоновым белком, в частности, отличным от гистонового белка из семейства гистонов H4, H3, Н2А и/или H2B или его фрагмента, производного или варианта, сохраняющего функцию гистона (гистоно-подобную), а именно формирование нуклеосомы. Кроме того, кодируемый белок, как правило, не соответствует гистоновому линкерному белку семейства H1-гистона. Молекула нуклеиновой кислоты по изобретению, как правило, не содержат каких-либо регуляторных сигналов (5ʹ- и/или, в частности, 3'- из гистонового гена мыши, в частности, не содержит гена гистона Н2А мыши и, далее, наиболее предпочтительно, не содержит гена гистона H2A614 мыши. В частности, она не содержит гистоновой структуры типа «стебель-петля» и/или сигнала процессинга гистоновой структуры типа «стебель-петля» гена гистона мыши, в частности, гена гистона Н2А мыши и, наиболее предпочтительно, гена гистона H2A614 мыши.
Также, нуклеиновая кислота по изобретению, как правило, не предоставляет репортерный белок (например, люциферазу, GFP, EGFP, бета-гактозидазу, особенно EGFP) галактокиназу (galK) и/или маркерный или селективный белок (например, альфа-глобин, галактокиназу и ксантин-гуанинфосфорибозилтрансферазу (GPT)) или бактериальной репортерный белок, например, хлорамфениколацетил-трансферазу (CAT) или другие бактериальные белки устойчивости к антибиотикам, например, полученные с бактериальным геном neo в своем элементе(a).
Не подразумевается, что репортерный, маркерный или селективный белок, как правило, является опухолевым антигеном, в соответствии с изобретением. Репортерный, маркерный или селективный белок или лежащих в его основе ген обычно используется как инструмент для исследования микроорганизмов, клеточных культур, животных или растений. Они придают экспрессирующим их организмам (предпочтительно гетерологичным) легко идентифицируемую особенность, которая может определяться или которая позволяет осуществить селекцию. В частности, маркерный или селективный белок проявляет селектируемые функции. Как правило, такие селективные, маркерные или репортерные белки природно не встречаются в организме человека или других млекопитающих, но происходят из других организмов, в частности, бактерий и растений. Соответственно, белки с селективной, маркерной или репортерной функцией, происходящих из видов, отличных от видов млекопитающих, в частности, отличных от человека, предпочтительно исключают из рассмотрения в качестве белка, обладающего свойством действовать в качестве «опухолевого антигена», в соответствии с настоящим изобретением. В частности, селективный, маркерный или репортерный белок позволяет идентифицировать трансформированные клетки при помощи тестов in vitro, основанных, например, на флуоресцентных или других спектроскопических способах и устойчивости к антибиотикам. Селективные, маркерные или репортерные гены, придающие такие свойства трансформированным клеткам, поэтому обычно не рассматриваются в качестве белка, действующего в качестве опухолевого антигена, в соответствии с изобретением, in vivo.
В любом случае, репортерные, маркерные или селективные белки, как правило, не проявляют каких-либо опухолевых антигенных свойств и, следовательно, не оказывают иммунологического эффекта, который терапевтически позволяет лечить опухолевые заболевания. Если какой-либо отдельный репортерный, маркерный или селективный белок, тем не менее, будет так действовать (в дополнение к его репортерной, маркерной или селективной функции), такой репортерный, маркерный или селективный белок предпочтительно не рассматривается в качестве «опухолевого антигена» по смыслу настоящего изобретения.
В отличие от этого, белок или пептид, действующий в качестве опухолевого антигена (в частности, за исключением генов гистоновых семейств H1 (H2A, H2B, H3 и H4)) в соответствии с настоящим изобретением, как правило, не проявляет селективную, маркерную или репортерную функцию. Если какой-либо отдельный «опухолевый антиген», тем не менее, будет так действовать (в дополнение к его функции опухолевого антигена), то такой опухолевый антиген предпочтительно не рассматривается в качестве «селективного, маркерного или репортерного белка» по смыслу настоящего изобретения.
Наиболее предпочтительно рассматривается, что белок, действующий как опухолевый антиген в соответствии с изобретением, получен из млекопитающих, в частности людей, в частности, из опухолей млекопитающих, и не квалифицируется в качестве селективного, маркерного или репортерного белка. В частности, такие опухолевые антигены получают из опухолей млекопитающих, в частности, из опухолей человека. Эти опухолевые антигенные белки понимаются как антигенные, поскольку они предназначены для лечения индивидуума путем инициирования иммунный ответ у индивидуума так, что иммунная система индивидуума получает возможность бороться с опухолевыми клетками индивидуума при помощи иммунных реакций TH1 и/или TH2. Соответственно, такие антигенные опухолевые белки обычно представляют собой белки млекопитающих, в частности, белки человека, характеризующиеся типом рака индивидуума.
Соответственно, предпочтительно, что кодирующая область, а) кодирующая по меньшей мере один пептид или белок, гетерологична по меньшей мере (b) по меньшей мере, одной гистоновой структуре типа «стебель-петля», или в более широком смысле, любой соответствующей структуре типа «стебель-петля». Иными словами, «гетерологичный» в контексте настоящего изобретения означает, что по меньшей мере одна последовательность типа «стебель-петля» не встречается в природе как (регуляторная) последовательность (например, в 3'UTR) определенного гена, который кодирует (опухолевый антигенный) белок или пептид элемента (а) нуклеиновой кислоты по изобретению. Соответственно, (гистоновая) структура типа «стебель-петля» нуклеиновой кислоты по изобретению получена предпочтительно из 3ʹ UTR гена, отличного от гена, включающего кодирующую область элемента (a) нуклеиновой кислоты по изобретению. Например, кодирующая область элемента (a) не должна кодировать гистоновый белок или его фрагмент, вариант или производное (при сохранении функции гистонового белка), если нуклеиновая кислота по изобретению является гетерологичной, но должна кодировать любой другой пептид или последовательность (того же или другого вида), который проявляет биологическую функцию, предпочтительно функцию опухолевого антигена, отличную от гистоново(-подобной) функции, например, должна кодировать белок (проявляющий функцию опухолевого антигена, например, в плане вакцинации против опухолей млекопитающих, в частности, опухолей человека), инициируя тем самым иммунологическую реакцию в отношении опухолевых клеток индивидуума, которые предпочтительно экспрессируют опухолевый антиген, кодируемый нуклеиновой кислотой по изобретению.
В этом контексте особенно предпочтительно, чтобы нуклеиновая кислота по изобретению включала или кодировала в направлении от 5ʹ к 3ʹ:
a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит опухолевый антиген или его фрагмент, вариант или производное;
b) по меньшей мере, одну гистоновую структуру типа «стебель-петля», необязательно без гистонового расположенного ниже по течению элемента (HDE), 3ʹ к «гистоновой структуре типа «стебель-петля»
c) поли(A)-последовательность или сигнал полиаденилирования.
Термин «гистоновый расположенный ниже по течению элемент (HDE)» относится к пурин-богатому полинуклеотидному участку примерно от 15 до 20 нуклеотидов, 3ʹ к природным гистоновым структурам типа «стебель-петля», который представляет сайт связывания с U7 snRNA, вовлеченную в процессирование гистоновой пре-мРНК в зрелую гистоновую мРНК. Например, у морских ежей HDE представляет собой CAAGAAAGA (Dominski, Z. and W.F. Marzluff (2007), Gene 396(2): 373-90).
Кроме того, предпочтительно, чтобы нуклеиновая кислота по изобретению в соответствии с первым аспектом настоящего изобретения не содержала интрон.
В другом, особенно предпочтительном варианте осуществления, последовательность нуклеиновых кислот по изобретению в соответствии с первым аспектом настоящего изобретения содержит или кодирует в направлении от 5ʹ к 3ʹ:
a) кодирующую область, предпочтительно кодирующую по меньшей мере один пептид или белок, который содержит опухолевый антиген или его фрагмент, вариант или производное;
c) поли(A)-последовательность; и
b) по меньшей мере, одну гистоновую структуру типа «стебель-петля».
Последовательность нуклеиновых кислот по изобретению, в соответствии с первым вариантом осуществления по настоящему изобретению, включает любую подходящую нуклеиновую кислоту, выбранную, например, из любой (одноцепочечной или двуцепочечной) ДНК, предпочтительно, без ограничения этим, например, геномной ДНК, плазмидной ДНК, молекул одноцепочечной ДНК, молекул двухцепочечной ДНК, или она может быть выбрана, например, из любой PNA (пептид-нуклеиновой кислоты), или она может быть выбрана, например, из любой (одноцепочечной или двуцепочечной) РНК, предпочтительно матричной РНК (мРНК); и др. Последовательность нуклеиновых кислот по изобретению может также включать вирусную РНК (вРНК). При этом последовательность нуклеиновых кислот по изобретению может не быть вирусной РНК или может не содержать вирусной РНК. Конкретнее, последовательность нуклеиновых кислот по изобретению может не содержать элементов вирусной последовательности, например, вирусных энхансеров или вирусных промоторов (например, отсутствие инактивированных вирусных промоторных элементов или элементов последовательности, конкретнее, не инактивированных при помощи стратегий замещения), или других элементов вирусной последовательности, или вирусных или ретровирусных последовательностей нуклеиновых кислот. Точнее говоря, последовательность нуклеиновых кислот по изобретению может не являться антиретровирусным или вирусным вектором, или модифицированным антиретровирусным или вирусным вектором.
В любом случае, последовательность нуклеиновых кислот по изобретению может содержать или может не содержать энхансерную и/или промоторную последовательность, которая может быть или может не быть модифицирована или которая может быть или может не быть активирована. Энхансер или промотор может экспрессироваться или может не экспрессироваться в растении, и/или может экспрессироваться или может не экспрессироваться в эукариотах, или может экспрессироваться или может не экспрессироваться в прокариотах. Последовательность нуклеиновых кислот по изобретению может содержать или может не содержать последовательность, кодирующую (самосплайсирующийся) рибозим.
В конкретных вариантах осуществления последовательность нуклеиновых кислот по изобретению может содержать или может не содержать самореплицирующуюся РНК (репликон).
Предпочтительно, последовательность нуклеиновых кислот по изобретению представляет собой плазмидную ДНК или РНК, в частности мРНК.
В конкретном варианте осуществления первого аспекта по настоящему изобретению, нуклеиновая кислота по изобретению представляет собой последовательность нуклеиновых кислот, содержащую нуклеиновую кислоту, подходящую для транскрипции in vitro, особенно в соответствующем векторе для транскрипции in vitro (например, плазмиде или линейной последовательности нуклеиновых кислот, содержащей специфические промоторы для транскрипции in vitro, например, промоторы T3, Т7 или Sp6).
В дополнительных конкретных предпочтительных вариантах осуществления первого аспекта настоящего изобретения, нуклеиновая кислота по изобретению включена в нуклеиновую кислоту, подходящую для транскрипции и/или трансляции в экспрессионной системе (например, в экспрессионном векторе или плазмиде), в частности, в прокариотической (например, бактерии наподобие E.coli) или эукариотической (например, клетки млекопитающих, наподобие клеток СНО, дрожжевых клеток или клеток насекомых или целых организмов, наподобие растений или животных) экспрессионной системе.
Термин «экспрессионная система» означает систему (культуру клеток или целые организмы), которая подходит для продуцирования пептидов, белков и РНК, особенно мРНК (рекомбинантная экспрессия).
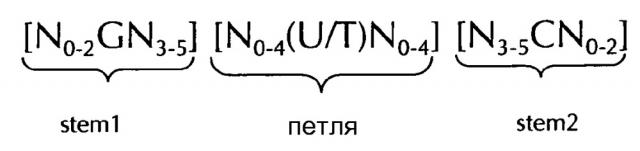
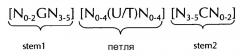
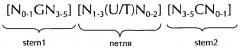
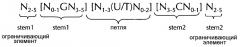
Последовательность нуклеиновых кислот по изобретению в соответствии с первым аспектом настоящего изобретения содержит или кодирует по меньшей мере одну гистоновую структуру типа «стебель-петля». В контексте настоящего изобретения, такая гистоновая структура типа «стебель-петля», в целом (независимо от того, является ли она гистоновой структурой типа «стебель-петля» или нет), как правило, получена из генов гистонов и включает внутримолекулярное спаривание оснований двух соседних полностью или частично обратно комплементарных последовательностей, образующих таким образом структуру типа «стебель-петля». Структура типа «стебель-петля» может иметь место в одноцепочечной ДНК, или, чаще, в РНК. Структура также известна как шпилька или шпилька-петля и, как правило, состоит из стебля и (терминальной) петли в пределах идущих подряд последовательностей, разделенных короткой последовательностью в виде спейсера, который образует петлю структуры типа «стебель-петля». Две соседние полностью или частично обратно комплементарные последовательности могут быть определены как, например, элементы структуры типа «стебель-петля» stem 1 и stem 2. Структура типа «стебель-петля» образуется, когда эти две соседние полностью или частично обратно комплементарные последовательности, например, элементы структуры типа «стебель-петля» stem 1 и stem 2, образуют пары оснований друг с другом, приводя к образованию участка двуцепочечной последовательности нукл