Химерные антигенные рецепторы, нацеленные на антиген созревания в-клеток
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии, в частности к выделенной молекуле нуклеиновой кислоты, кодирующей химерный рецептор антигена (CAR), направленный против антигена созревания В-клеток (ВСМА). Настоящее изобретение также раскрывает клетки-хозяева, такие как Т-клетки или натуральные киллеры (NK-клетки), экспрессирующие CAR, и относится к способам разрушения клеток множественной миеломы с использованием указанных клеток. Настоящее изобретение позволяет расширить арсенал средств для лечения множественной миеломы. 12 н. и 10 з.п. ф-лы, 9 ил., 4 табл., 6 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная патентная заявка претендует на приоритет предварительной патентной заявки США №61/622600, поданной 11 апреля 2012, которая включена в данный документ во всей ее полноте посредством ссылки. Настоящее изобретение было создано при поддержке Правительства с № проекта ZIA ВС 011417 Национальным институтом здоровья, Национальным институтом онкологии. Правительство имеет определенные права на данное изобретение.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ МАТЕРИАЛА, ПРЕДСТАВЛЕННОГО В ЭЛЕКТРОННОМ ВИДЕ
[0002] Включенный в данный документ в полном объеме посредством ссылки читаемый на компьютере список нуклеотидных/аминокислотных последовательностей, представленный одновременно с данной заявкой и определенный следующим образом: один файл размером 42589 байт ASCII (Text) с названием "712361_ST25.TXT", созданный 14 марта 2013 г.
УРОВЕНЬ ТЕХНИКИ
[0003] Множественная миелома (ММ) представляет собой злокачественное заболевание, которое характеризуется накоплением клональных плазматических клеток (см., например, Palumbo et al., New England J. Med., 364(11): 1046-1060 (2011), и Lonial et al., Clinical Cancer Res., 17(6): 1264-1277 (2011)). Современные подходы к лечению ММ часто вызывают ремиссию, но почти все пациенты в конечном итоге страдают от рецидива и умирают (см., например, Lonial et al., выше, и Rajkumar, Nature Rev. Clinical Oncol., 8(8): 479-491 (2011)). Было показано, что аллогенная трансплантация гемопоэтических стволовых клеток вызывает иммуно-опосредованное удаление клеток миеломы; тем не менее, токсичность этого подхода является высокой, и некоторые пациенты излечиваются (см., например, Lonial et al., выше, и Salit et al., Clin. Lymphoma, Myeloma, and Leukemia, 11(3): 247-252 (2011)). В настоящее время не существует клинически эффективных FDA-утвержденных способов лечения ММ моноклональными антителами или аутологичными Т-клетками (см., например, Richardson et al., British J. Haematology, 154(6): 745-754 (2011), и Yi, Cancer Journal, 15(6): 502-510 (2009)).
[0004] Адоптивный перенос Т-клеток, генетически модифицированных для распознавания связанных со злокачественностью антигенов, выглядит обещающим в качестве нового подхода к лечению рака (см., например, Morgan et al., Science, 314(5796): 126-129 (2006); Brenner et al., Current Opinion in Immunology, 22(2): 251-257 (2010); Rosenberg et al., Nature Reviews Cancer, 8(4): 299-308 (2008), Kershaw et al., Nature Reviews Immunology, 5(12): 928-940 (2005); и Pule et al., Nature Medicine, 14(11): 1264-1270 (2008)). Т-клетки могут быть генетически модифицированы для экспрессии химерных антигенных рецепторов (CAR, chimeric antigen receptor), которые являются гибридными белками, состоящими из фрагмента распознавания антигена и доменов Т-клеточной активации (см., например, Kershaw et al., выше, Eshhar et al., Proc. Natl. Acad. Sci. USA, 90(2): 720-724 (1993), и Sadelain et al., Curr. Opin. Immunol., 21(2): 215-223 (2009)).
[0005] Для злокачественных образований В-клеточных линий был достигнут значительный прогресс в разработке адоптивных Т-клеточных подходов, которые используют анти-CD19-CAR (см., например, Jensen et al., Biology of Blood and Marrow Transplantation, 16: 1245-1256 (2010); Kochenderfer et al., Blood, 116(20): 4099-4102 (2010); Porter et al., The New England Journal of Medicine, 365(8): 725-733 (2011); Savoldo et al., Journal of Clinical Investigation, 121(5): 1822-1826 (2011), Cooper et al., Blood, 101(4): 1637-1644 (2003); Brentjens et al., Nature Medicine, 9(3): 279-286 (2003); и Kalos et al., Science Translational Medicine, 3(95): 95ra73 (2011)). Адоптивно перенесенные Т-клетки, трансдуцированные анти-CD19-CAR, вылечили лейкемию и лимфому у мышей (см., например, Cheadle et al., Journal of Immunology, 184(4): 1885-1896 (2010); Brentjens et al., Clinical Cancer Research, 13(18 Pt 1): 5426-5435 (2007); и Kochenderfer et al., Blood, 116(19): 3875-3886 (2010)). В ранних клинических испытаниях адоптивно перенесенные Т-клетки, трансдуцированные анти-CD19-CAR, удаляли нормальные и злокачественные В-клетки у пациентов с лейкемией и лимфомой (см, например, Kochenderfer et I., Blood, 116(20): 4099-4102 (2010); Porter et al., supra, Brentjens et al., Blood, 118(18): 4817-4828 (2011); и Kochenderfer et al., Blood, December 8, 2011 (электронная публикация перед печатью (2012).). Тем не менее, CD19 только в редких случаях экспрессируется на злокачественных плазматических клетках множественной миеломы (см., например, Gupta et al., Amer. J. Clin. Pathology, 132(5): 728-732 (2009); и Lin et al., Amer. J. Clin. Pathology, 121(4): 482-488 (2004)).
[0006] Таким образом, существует потребность в композициях, которые могут быть использованы в способах лечения множественной миеломы. Это изобретение предусматривает такие композиции и способы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Данное изобретение относится к выделенной или очищенной нуклеиновокислотной последовательности, кодирующей химерный рецептор антигена (CAR), где CAR включает фрагмент распознавания антигена и фрагмент Т-клеточной активации, и где фрагмент распознавания антигена направлен против антигена созревания В-клеток (ВСМА).
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0008] Фиг. 1А и 1В представляют собой графики, на которых изображены экспериментальные данные, иллюстрирующие характер экспрессии ВСМА в различных типах человеческих клеток, определенный с помощью количественной ПЦР. Результаты выражены как число копий кДНК ВСМА на 105 копий кДНК актина.
[0009] Фиг. 2A-2L представляют собой графики, на которых изображены экспериментальные данные, иллюстрирующие, что экспрессия ВСМА на клеточной поверхности была обнаружена на нескольких клеточных линиях миеломы, но не на других типах клеток, как описано в примере 1. Во всех графиках сплошная линия представляет окрашивание анти-ВСМА-антителами, а пунктирная линия представляет окрашивание контрольными антителами, подходящими по изотипу. На всех графиках клетки гейтировали по живым клеткам.
[0010] Фиг. 3А представляет собой схему, на которой изображена нуклеиновокислотная конструкция, кодирующая анти-BCMA-CAR. В направлении с N-конца к С-концу анти-BCMA-CAR включает анти-ВСМА scFv, шарнирную и трансмембранную области молекулы CD8α, цитоплазматическую часть молекулы CD28 и цитоплазматическую часть молекулы CD3ζ.
[0011] Фиг. 3B-3D представляют собой графики, на которых изображены экспериментальные данные, иллюстрирующие, что анти-bcma1-CAR, анти-bcma2-CAR и SP6-CAR (описаны в примере 2) экспрессируются на поверхности Т-клеток. Минимальное анти-Fab-окрашивание произошло на нетрансдуцированных (UT, untransduced) клетках. На всех графиках клетки гейтировали по CD3+-лимфоцитам. Цифры на графиках являются процентами клеток в каждом квадранте.
[0012] Фиг. 4А-4С представляют собой графики, на которых изображены экспериментальные данные, иллюстрирующие, что Т-клетки, экспрессирующие анти-BCMA-CAR, вызывают дегрануляцию Т-клеток ВСМА-специфическим образом, как описано в примере 3. На графиках клетки гейтировали по живым CD3+-лимфоцитам. Цифры на графиках являются процентами клеток в каждом квадранте.
[0013] Фиг. 5A-5D представляют собой графики, на которых изображены экспериментальные данные, иллюстрирующие, что Т-клетки, экспрессирующие анти-BCMA-CAR, вызывают дегрануляцию Т-клеток ВСМА-специфическим образом, как описано в примере 3. На графиках клетки гейтировали по живым CD3+-лимфоцитам. Цифры на графиках являются процентами клеток в каждом квадранте.
[0014] Фиг. 6А-6С представляют собой графики, на которых изображены экспериментальные данные, иллюстрирующие, что Т-клетки, экспрессирующие анти-BCMA-CAR, продуцируют цитокины IFNγ, IL-2 и TNF ВСМА-специфическим образом, как описано в примере 3. На графиках клетки гейтировали по живым CD3+-лимфоцитам. Цифры на графиках являются процентами клеток в каждом квадранте.
[0015] Фиг. 7А представляет собой график, который изображает экспериментальные данные, иллюстрирующие, что Т-клетки, экспрессирующие анти-bcma2-CAR, специфически пролиферируют в ответ на ВСМА. Фиг. 6В представляет собой график, который изображает экспериментальные данные, иллюстрирующие, что Т-клетки, экспрессирующие SP6-CAR, не пролиферируют специфически в ответ на ВСМА.
[0016] Фиг. 7С и 7D представляют собой графики, на которых изображены экспериментальные данные, иллюстрирующие, что Т-клетки от донора А, экспрессирующие анти-bcma2-CAR, специфически убивают клеточные линии множественной миеломы Н929 (фиг. 6С) и RPMI8226 (фиг. 6D) в четырехчасовом анализе цитотоксичности при различных соотношениях эффектор: клетка-мишень. Т-клетки, трансдуцированные отрицательным контролем SP6-CAR, индуцируют гораздо более низкие уровни цитотоксичности во всех соотношениях эффектор: мишень. Для всех соотношений эффектор: мишень была определена цитотоксичность в двух повторах, и результаты представлены в виде среднего +/-стандартная ошибка среднего.
[0017] Фиг. 8А представляет собой график, который изображает экспериментальные данные, иллюстрирующие, что ВСМА экспрессируется на поверхности первичных клеток множественной миеломы костного мозга от пациента с миеломой 3, как описано в примере 5. На графике клетки гейтировали по CD38высокий CD56+-плазматическим клеткам, которые составляют до 40% клеток костного мозга.
[0018] Фиг. 8В представляет собой график, на котором изображены экспериментальные данные, иллюстрирующие, что аллогенные Т-клетки от донора С, трансдуцированные анти-bcma2-CAR, продуцируют IFNγ после совместного культивирования с необработанными клетками костного мозга от пациента с миеломой 3, как описано в примере 5. Фиг. 7В также иллюстрирует, что Т-клетки от одного и того же аллогенного донора, экспрессирующие анти-bcma2-CAR, продуцируют гораздо меньше IFNγ, когда они культивированы с мононуклеарными клетками периферической крови (РВМС) от пациента с миеломой 3. Кроме того, Т-клетки от донора С, экспрессирующие SP6-CAR, специфически не распознают костный мозг от пациента с миеломой 3.
[0019] Фиг. 8С представляет собой график, который изображает экспериментальные данные, иллюстрирующие, что плазмоцитома, резецированная у пациента с миеломой 1, состоит на 93% из плазматических клеток, и эти первичные плазматические клетки экспрессируют ВСМА, что показано с помощью проточной цитометрии на ВСМА (сплошная линия) и путем окрашивания изотипическим контролем (пунктирная линия). На всех графиках клетки гейтировали по плазматическим клеткам.
[0020] Фиг. 8D представляет собой график, который изображает экспериментальные данные, иллюстрирующие, что Т-клетки от пациента с миеломой 1, экспрессирующие анти-bcma2-CAR, продуцируют IFNγ специфически в ответ на аутологичные клетки плазмоцитомы.
[0021] Фиг. 8Е представляет собой график, показывающий экспериментальные данные, иллюстрирующие, что Т-клетки от пациента с миеломой 1, экспрессирующие анти-bcma2-CAR, специфически убивают аутологичные клетки плазмоцитомы при низком соотношении эффектор: мишень. Напротив, Т-клетки от пациента с миеломой 1, экспрессирующие SP6-CAR, демонстрируют низкие уровни цитотоксичности против аутологичных клеток плазмоцитомы. Для всех соотношений эффектор: мишень была определена цитотоксичность в двух повторах, и результаты представлены в виде среднего +/- стандартная ошибка среднего.
[0022] Фиг. 9А представляет собой график, который изображает экспериментальные данные, иллюстрирующие, что Т-клетки, трансдуцированные анти-bcma2-CAR, могут разрушать верифицированные опухоли множественной миеломы у мышей. Фиг. 9В представляет собой график, который изображает выживание мышей с опухолями, получавших Т-клетки, экспрессирующие анти-bcma2-CAR, по сравнению с контрольной группой.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0023] Данное изобретение относится к выделенной или очищенной нуклеиновокислотной последовательности, кодирующей химерный рецептор антигена (CAR), где CAR содержит фрагмент распознавания антигена и фрагмент Т-клеточной активации. Химерный рецептор антигена (CAR) является искусственно созданным гибридным белком или полипептидом, содержащим антигенсвязывающий домен антитела (например, одноцепочечный вариабельный фрагмент (scFv)), связанный с Т-клеточным сигналингом или доменами Т-клеточной активации. CAR имеют возможность перенаправлять Т-клеточную специфичность и реактивность на выбранную мишень МНС-неограниченным образом, используя антигенсвязывающие свойства моноклональных антител. МНС-неограниченное распознавание антигена дает Т-клеткам, экспрессирующим CAR, способность распознавать антиген независимо от процессинга антигена, таким образом минуя главный механизм избегания опухоли. Более того, при экспрессии в Т-клетках CAR преимущественно не димеризуются с альфа- и бета-цепями эндогенного Т-клеточного рецептора (TCR).
[0024] Понятие "нуклеиновокислотной последовательности" охватывает полимеры ДНК или РНК, т.е. полинуклеотиды, которые могут быть одноцепочечными или двуцепочечными, и которые могут содержать неприродные или измененные нуклеотиды. Термины "нуклеиновая кислота" и "полинуклеотид", используемые в данном описании, относятся к полимерной форме нуклеотидов любой длины, рибонуклеотидов (РНК) или дезоксирибонуклеотидов (ДНК). Эти термины относятся к первичной структуре молекулы, и, таким образом, включают дву- и одноцепочечную ДНК, а также дву- и одноцепочечную РНК. Термины включают, в качестве эквивалентов, аналоги РНК или ДНК, изготовленные из нуклеотидных аналогов и модифицированных полинуклеотидов, таких как, но не ограничиваясь ими, метилированные и/или кэппированные полинуклеотиды.
[0025] Под "выделенной" подразумевается удаление нуклеиновой кислоты из ее природной среды. Под "очищенной" подразумевается, что данная нуклеиновая кислота, была ли она выделена из природной среды (в том числе геномная ДНК и мРНК) или синтезирована (в том числе кДНК) и/или амплифицирована в лабораторных условиях, имеет повышенную чистоту, где "чистота" является относительным термином, а не "абсолютной чистотой". Тем не менее, следует понимать, что нуклеиновые кислоты и белки могут быть собраны в состав с разбавителями или адъювантами и по-прежнему для практических целей быть выделены. Например, нуклеиновые кислоты, как правило, смешивают с приемлемым носителем или разбавителем, когда используют их для введения в клетки.
[0026] Нуклеиновокислотная последовательность согласно изобретению кодирует CAR, который содержит фрагмент распознавания антигена, направленный против антигена созревания В-клеток (ВСМА, также известного как CD269). ВСМА является членом суперсемейства рецептора фактора некроза опухоли (см., например, Thompson et al., J. Exp.Medicine, 192(1): 129-135 (2000), и Mackay et al., Annu. Rev. Immunol., 21: 231-264 (2003)). ВСМА связывает фактор В-клеточной активации (BAFF) и лиганд, индуцирующий пролиферацию (APRIL) (см., например, Mackay et al., см. выше, и Kalled et al., Immunological Reviews, 204: 43-54 (2005)). Сообщалось, что среди доброкачественных клеток ВСМА экспрессируется в основном в плазматических клетках и субпопуляции зрелых В-клеток (см., например, Laabi et al., EMBO J., 11(11): 3897-3904 (1992); Laabi et al., Nucleic Acids Res., 22(7): 1147-1154 (1994); Kalled et al., выше; O'Connor et al., J. Exp. Medicine, 199(1): 91-97 (2004); и Ng et al., J. Immunol., 173(2): 807-817 (2004)). Мыши, дефицитные по ВСМА, здоровы и имеют нормальное число В-клеток, но выживание долгоживущих плазматических клеток нарушается (см., например, O'Connor et al, выше; Xu et al., Mol. Cell. Biol., 21(12): 4067-4074 (2001); и Schiemann et al., Science, 293(5537): 2111-2114 (2001)). РНК ВСМА была обнаружена повсеместно в клетках множественной миеломы, а белок ВСМА был обнаружен на поверхности плазматических клеток от пациентов с множественной миеломой несколькими исследователями (см., например, Novak et al., Blood, 103(2): 689-694 (2004); Neri et al., Clinical Cancer Research, 13(19): 5903-5909 (2007); Bellucci et al., Blood, 105(10): 3945-3950 (2005); и Moreaux et al., Blood, 103(8): 3148-3157 (2004)).
[0027] Нуклеиновокислотная последовательность согласно изобретению кодирует CAR, который содержит фрагмент распознавания антигена, содержащий моноклональное антитело, направленное против ВСМА, или его антигенсвязывающую часть. Термин "моноклональные антитела", используемый в данном документе, относится к антителам, которые продуцируются одним клоном В-клеток и связываются с одним и тем же эпитопом. Напротив, "поликлональные антитела" относятся к популяции антител, которые продуцируются различными В-клетками и связываются с различными эпитопами одного и того же антигена. Фрагмент распознавания антигена в CAR, кодируемого нуклеиновокислотной последовательностью согласно изобретению, может быть целым антителом или фрагментом антитела. Целое антитело, как правило, состоит из четырех полипептидов: двух идентичных копий полипептида тяжелой (Н) цепи и двух идентичных копий полипептида легкой (L) цепи. Каждая из тяжелых цепей содержит одну N-концевую вариабельную (VH) область и три C-концевых константных (СН1, СН2 и СН3) области, а каждая легкая цепь содержит одну N-концевую вариабельную (VL) область и одну C-концевую константную (CL) область. Вариабельные области каждой пары легкой и тяжелой цепей образуют сайт связывания антигена с антителом. Области VH и VL имеют одинаковую общую структуру, при этом каждая область содержит четыре каркасные области, последовательности которых относительно консервативны. Каркасные области соединены тремя определяющими комплементарность областями (CDR). Три CDR, известные как CDR1, CDR2 и CDR3, образуют "гипервариабельную область" антитела, которая отвечает за связывание антигена.
[0028] Термины "фрагмент антитела", "функциональный фрагмент антитела" и "антигенсвязывающий фрагмент" используются в данном документе взаимозаменяемо для обозначения одного или более чем одного фрагмента или части антитела, которые сохраняют способность специфически связываться с антигеном (см., в целом, Holliger et al., Nat. Biotech., 23(9): 1126-1129 (2005)). Фрагмент распознавания антигена в CAR, кодируемый нуклеиновокислотной последовательностью согласно изобретению, может содержать любой фрагмент ВСМА-связывающего антитела. Желательно, чтобы фрагмент антитела содержал, например, одну или более чем одну CDR, вариабельную область (или ее части), константную область (или ее части) или их комбинации. Примеры фрагментов антител включают, но не ограничиваясь ими, (i) Fab-фрагмент, который представляет собой моновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1; (и) Р(ab')2-фрагмент, который представляет собой бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fv-фрагмент, состоящий из VL- и VH-доменов одного плеча антитела; (iv) одноцепочечный Fv (scFv), который представляет собой одновалентную молекулу, состоящую из двух доменов Fv-фрагмента (т.е. VL и VH), соединенных синтетическим линкером, который позволяет синтезировать два домена в виде одной полипептидной цепи (см., например, Bird et al., Science, 242: 423-426 (1988); Huston et al., Proc. Natl. Acad. Sci. USA, 85: 5879-5883 (1988); и Osbourn et al., Nat. Biotechnol., 16: 778 (1998)); и (v) двойное антитело, представляющее собой димер полипептидных цепей, где каждая полипептидная цепь содержит VH, соединенный с VL пептидным линкером, который является слишком коротким, чтобы позволить спаривание VH и VL на одной и той же полипептидной цепи, тем самым обеспечивая спаривание комплементарных доменов различных VH-VL полипептидных цепей для образования димерной молекулы, имеющей два функциональных антигенсвязывающих участка. Фрагменты антител известны в данной области и описаны более подробно, например, в публикации патентной заявки США 2009/0093024 А1. В предпочтительном воплощении фрагмент распознавания антигена в CAR, кодируемый нуклеиновокислотной последовательностью согласно изобретению, содержит одноцепочечный анти-BCMA-Fv (scFv).
[0029] Антигенсвязывающая часть или фрагмент моноклонального антитела может иметь любой размер при условии, что эта часть связывается с ВСМА. В этом отношении антигенсвязывающая часть или фрагмент моноклонального антитела, направленного против ВСМА (также называемого здесь "моноклональным анти-ВСМА-антителом"), желательно, содержит от примерно 5 до 18 аминокислот (например, примерно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, или в диапазоне, определенном любыми двумя из указанных выше значений).
[0030] В одном воплощении нуклеиновокислотная последовательность согласно изобретению кодирует фрагмент распознавания антигена, который содержит вариабельную область моноклонального анти-ВСМА-антитела. В этом отношении фрагмент распознавания антигена содержит вариабельную область легкой цепи, вариабельную область тяжелой цепи, или и вариабельную область легкой цепи, и вариабельную область тяжелой цепи моноклонального анти-ВСМА-антитела. Предпочтительно, фрагмент распознавание антигена в CAR, кодируемый нуклеиновокислотной последовательностью согласно изобретению, включает вариабельную область легкой цепи и вариабельную область тяжелой цепи моноклонального анти-ВСМА-антитела. Аминокислотные последовательности тяжелой и легкой цепей моноклонального антитела, которое связывается с ВСМА, раскрыты, например, в публикации международной патентной заявки WO 2010/104949.
[0031] В другом воплощении нуклеиновокислотная последовательность согласно изобретению кодирует CAR, который включает сигнальную последовательность. Сигнальная последовательность может быть расположена на амино-конце фрагмента распознавания антигена (например, вариабельная область анти-ВСМА-антитела). Сигнальная последовательность может содержать любую подходящую сигнальную последовательность. В одном воплощении сигнальная последовательность представляет собой последовательность рецептора человеческого гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) или сигнальную последовательность CD8a.
[0032] В другом воплощении CAR содержит шарнирную последовательность. Специалисту в данной области будет понятно, что шарнирная последовательность является короткой последовательностью аминокислот, которая облегчает гибкость антитела (см., например, Woof et al., Nat. Rev. Immunol., 4(2): 89-99 (2004)). Шарнирная последовательность может быть расположена между фрагментом распознавания антигена (например, анти-BCMA-scFv) и фрагментом Т-клеточной активации. Шарнирная последовательность может быть любой подходящей последовательностью, полученной из любой подходящей молекулы. В одном воплощении, например, шарнирная последовательность получена из молекулы человеческого CD8α или молекулы CD28.
[0033] Нуклеиновокислотная последовательность согласно изобретению кодирует CAR, содержащий фрагмент Т-клеточной активации. Фрагмент Т-клеточной активации может быть любым подходящим фрагментом, полученным из любой подходящей молекулы. В одном воплощении, например, фрагмент Т-клеточной активации содержит трансмембранный домен. Трансмембранный домен может быть любым трансмембранным доменом, полученным из любой молекулы, известной в данной области. Например, трансмембранный домен может быть получен из молекулы CD8a или из молекулы CD28. CD8 является трансмембранным гликопротеином, который выступает в качестве корецептора Т-клеточного рецептора (TCR) и экспрессируется в основном на поверхности цитотоксических Т-клеток. Наиболее распространенная форма CD8 существует в виде димера, состоящего из цепей CD8α и CD8β. CD28 экспрессируется на Т-клетках и обеспечивает костимулирующие сигналы, необходимые для активации Т-клеток. CD28 является рецептором для CD80 (В7.1) и CD86 (В7.2). В предпочтительном воплощении CD8α и CD28 являются человеческими.
[0034] В дополнение к трансмембранному домену фрагмент Т-клеточной активации также содержит внутриклеточный (т.е. цитоплазматический) домен сигналинга Т-клеток. Домен межклеточного сигналинга Т-клеток может быть получен из молекулы CD28, молекулы CD3 дзета (ζ) или их модифицированных версий, из человеческой гамма-цепи Fc-рецептора (FcRγ), молекулы CD27, молекулы ОХ40, молекулы 4-1ВВ или других молекул внутриклеточного сигналинга, известных в данной области. Как обсуждалось выше, CD28 представляет собой Т-клеточный маркер, важный для костимуляции Т-клеток. CD3ζ ассоциирует с TCR, чтобы сформировать сигнал, и содержит иммунорецепторные активирующие тирозинсодержащие повторы (ITAM). 4-1ВВ, также известный как CD137, передает мощный костимулирующий сигнал на Т-клетки, усиливая дифференцировку и повышая долгосрочное выживание Т-лимфоцитов. В предпочтительном воплощении CD28, CD3 дзета, 4-1ВВ, ОХ40 и CD27 являются человеческими.
[0035] Домен Т-клеточной активации CAR, кодируемый нуклеиновокислотной последовательностью согласно изобретению, может содержать любой из вышеупомянутых трансмембранных доменов и любой один или более чем один из вышеупомянутых доменов межклеточного сигналинга Т-клеток в любой комбинации. Например, нуклеиновокислотная последовательность согласно изобретению может кодировать CAR, содержащий трансмембранный домен CD28 и внутриклеточные домены T-клеточного сигналинга CD28 и CD3 дзета. Альтернативно, например, нуклеиновокислотная последовательность согласно изобретению может кодировать CAR, содержащий трансмембранный домен CD8α и внутриклеточные домены T-клеточного сигналинга CD28, CD3 дзета, гамма-цепи Fc-рецептора (FcRγ) и/или 4-1ВВ.
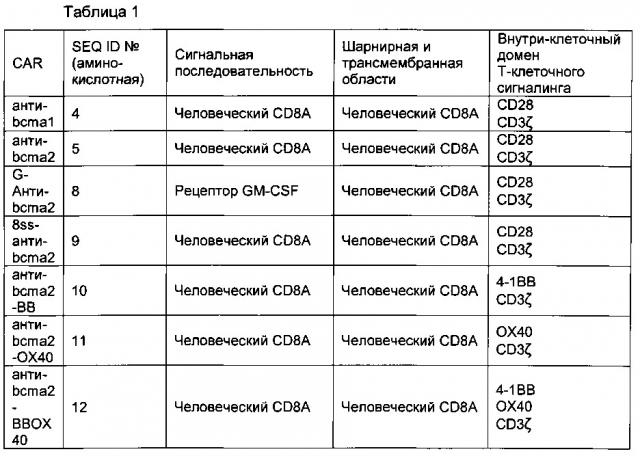
[0036] В одном воплощении нуклеиновокислотная последовательность согласно изобретению кодирует CAR, который содержит в направлении от 5' к 3' сигнальную последовательность рецептора гранулоцитарно-макрофагального колониестимулирующего фактора (рецептора GM-CSF), анти-BCMA-scFv, шарнирную и трансмембранную области молекулы человеческого CD8α, цитоплазматический домен T-клеточного сигналинга молекулы человеческого CD28 и домен T-клеточного сигналинга молекулы человеческого CD3ζ. В другом воплощении нуклеиновокислотная последовательность согласно изобретению кодирует CAR, который содержит в направлении от 5' к 3' сигнальную последовательность человеческого CD8α, анти-BCMA-scFv, шарнирную и трансмембранную области молекулы человеческого CD8α, цитоплазматический домен T-клеточного сигналинга молекулы человеческого CD28 и домен T-клеточного сигналинга молекулы человеческого CD3ζ. В другом воплощении нуклеиновокислотная последовательность согласно изобретению кодирует CAR, который содержит в направлении от 5' к 3' сигнальную последовательность человеческого CD8α, анти-BCMA-scFv, шарнирную и трансмембранную области молекулы человеческого CD8α, цитоплазматическую область T-клеточного сигналинга человеческой молекулы 4-1ВВ и/или цитоплазматическую область T-клеточного сигналинга молекулы человеческого ОХ40, и домен T-клеточного сигналинга молекулы человеческого CD3ζ. Например, нуклеиновокислотная последовательность согласно изобретению содержит или состоит из нуклеиновокислотной последовательности SEQ ID №1, SEQ ID №2 или SEQ ID №3.
[0037] Изобретение также относится к выделенному или очищенному химерному рецептору антигена (CAR), кодируемому нуклеиновокислотной последовательностью согласно изобретению.
[0038] Нуклеиновокислотная последовательность согласно изобретению может кодировать CAR любой длины, т.е. CAR может содержать любое число аминокислот, при условии, что CAR сохраняет свою биологическую активность, например, способность специфически связываться с антигеном, обнаруживать больные клетки у млекопитающих или лечить или предотвращать заболевание у млекопитающего и т.д. Например, CAR может содержать 50 или более (например, 60 или более, 100 или более, или 500 или более аминокислот), но меньше 1000 (например, 900 или менее, 800 или менее, 700 или менее, или 600 или менее) аминокислот. Предпочтительно, CAR имеет от примерно 50 до примерно 700 аминокислот (например, примерно 70, примерно 80, примерно 90, примерно 150, примерно 200, примерно 300, примерно 400, примерно 550, или примерно 650 аминокислот), от примерно 100 до примерно 500 аминокислот (например, примерно 125, примерно 175, примерно 225, примерно 250, примерно 275, примерно 325, примерно 350, примерно 375, примерно 425, примерно 450, или примерно 475 аминокислот), или в диапазоне, определяемом любыми двумя из указанных выше значений.
[0039] В объем данного изобретения включены нуклеиновокислотные последовательности, которые кодируют функциональные части CAR, описанные в данном документе. Термин "функциональная часть", используемый в отношении к CAR, относится к любой части или фрагменту CAR согласно изобретению, где часть или фрагмент сохраняет биологическую активность того CAR, частью которого он является (родительского CAR). Функциональные части охватывают, например, те части CAR, которые сохраняют способность распознавать клетки-мишени или обнаруживать, излечивать или предотвращать заболевание в подобной степени, в той же степени или в большей степени, чем родительский CAR. В отношении нуклеиновокислотной последовательности, кодирующей родительский CAR, нуклеиновокислотная последовательность, кодирующая функциональную часть CAR, может кодировать белок, содержащий, например, примерно 10%, 25%, 30%, 50%, 68%, 80%, 90%, 95% или более родительского CAR.
[0040] Нуклеиновокислотная последовательность согласно изобретению может кодировать функциональную часть CAR, которая содержит дополнительные аминокислоты на амино- или карбокси-конце этой части или на обоих концах, где дополнительные аминокислоты не найдены в аминокислотной последовательности родительского CAR. Желательно, чтобы дополнительные аминокислоты не мешали биологической функции функциональной части, например, распознаванию клетки-мишени, обнаружению рака, лечению или профилактике рака и т.д. Более предпочтительно, чтобы дополнительные аминокислоты повышали биологическую активность CAR по сравнению с биологической активностью родительского CAR.
[0041] Данное изобретение также относится к нуклеиновокислотным последовательностям, кодирующим функциональные варианты вышеупомянутого CAR. Термин "функциональный вариант", используемый в данном документе, относится к CAR, полипептиду или белку, имеющему существенную или значительную идентичность или сходство последовательности с CAR, закодированным нуклеиновокислотной последовательностью согласно изобретению, при этом функциональный вариант сохраняет биологическую активность CAR, вариантом которого она является. Функциональные варианты охватывают, например, те варианты CAR, описанные в данном документе (родительский CAR), которые сохраняют способность распознавать клетки-мишени в подобной степени, в той же степени или в большей степени, чем родительский CAR. В отношении нуклеиновокислотной последовательности, кодирующей родительский CAR, нуклеиновокислотная последовательность, кодирующая функциональный вариант CAR, может быть, например, примерно на 10% идентична, примерно на 25% идентична, примерно на 30% идентична, примерно на 50% идентична, примерно на 65% идентична, примерно на 80% идентична, примерно на 90% идентична, примерно на 95% идентична или примерно на 99% идентична нуклеиновокислотной последовательности, кодирующей родительский CAR.
[0042] Функциональный вариант может, например, включать аминокислотную последовательность CAR, закодированную нуклеиновокислотной последовательностью согласно изобретению, по меньшей мере с одной консервативной аминокислотной заменой. Фраза "консервативная аминокислотная замена" или "консервативная мутация" относится к замене одной аминокислоты другой аминокислотой с общими свойствами. Функциональным способом определить общие свойства у отдельных аминокислот является анализ нормированных частот аминокислотных замен в соответствующих белках гомологичных организмов (Schulz, G.Е. and Schirmer, R.Н., Principles of Protein Structure, Springer-Verlag, New York (1979)). Согласно таким анализам могут быть определены группы аминокислот, где аминокислоты в пределах группы заменяются преимущественно друг на друга, и поэтому наиболее похожи друг на друга по их влиянию на общую структуру белка (Schulz, G.Е. and Schirmer, R.Н., см. выше). Примеры консервативных мутаций включают аминокислотные замены аминокислот внутри подгрупп, описанных выше, например, лизина на аргинин и наоборот таким образом, чтобы положительный заряд мог быть сохранен; глутаминовой кислоты на аспарагиновую кислоту и наоборот таким образом, чтобы отрицательный заряд мог быть сохранен; серина на треонин таким образом, чтобы свободный -ОН мог быть сохранен; и глутамина на аспарагин таким образом, чтобы свободный -NH2 мог быть сохранен.
[0043] Альтернативно или дополнительно, функциональные варианты могут включать аминокислотную последовательность родительского CAR по меньшей мере с одной неконсервативной аминокислотной заменой. "Неконсервативные мутации" включают замены аминокислот из различных групп, например, лизина на триптофан или фенилаланина на серии и т.д. В этом случае для неконсервативной аминокислотной замены предпочтительно, чтобы она не мешала или не ингибировала биологическую активность функционального варианта. Неконсервативная аминокислотная замена может повысить биологическую активность функционального варианта, так что биологическая активность функционального варианта увеличивается по сравнению с родительским CAR.
[0044] Нуклеиновокислотная последовательность согласно изобретению может кодировать CAR (в том числе его функциональные части и функциональные варианты), который включает синтетические аминокислоты вместо одной или более чем одной природной аминокислоты. Такие синтетические аминокислоты известны в данной области и включают, например, аминоциклогексанкарбоновую кислоту, норлейцин, α-амино-n-декановую кислоту, гомосерин, S-ацетиламинометилцистеин, транс-3- и транс-4-гидроксипролин, 4-аминофенилаланин, 4-нитрофенилаланин, 4-хлорофенилаланин, 4-карбоксифенилаланин, β-фенилсерингидроксифенилаланин, β-фенилглицин, α-нафтилаланин, циклогексилаланин, циклогексилглицин, индолин-2-карбоновую кислоту, 1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту, аминомалоновую кислоту, моноамид аминомалоновой кислоты, N'-бензил-N'-метиллизин, N',N'-дибензиллизин, 6-гидроксилизин, орнитин, α-аминоциклопентанкарбоновую кислоту, α-аминоциклогексанкарбоновую кислоту, α-аминоциклогептанкарбоновую кислоту, α-(2-амино-2-норборнан)карбоновую кислоту, α,γ-диаминомасляную кислоту, α,β-диаминопропионовую кислоту, гомофенилаланин и α-трет-бутилглицин.
[0045] Нуклеиновокислотная последовательность согласно изобретению может кодировать CAR (в том числе его функциональные части и функциональные варианты), который гликозилирован, амидирован, карбоксилирован, фосфорилирован, этерифицирован, N-ацилирован, циклизован, например, через дисульфидный мостик, или превращен в кислотно-аддитивную соль и/или, возможно, димеризован, полимеризован или конъюгирован.
[0046] В предпочтительном воплощении нуклеиновокислотная последовательность согласно изобретению кодирует CAR, который содержит или состоит из аминокислотной последовательности SEQ ID №4, SEQ ID №5, SEQ ID №6, SEQ ID №8, SEQ ID №9, SEQ ID №10, SEQ ID №11 или SEQ ID №12.
[0047] Нуклеиновокислотная последовательность согласно изобретению может быть получена с использованием способов, известных в данной области. Например, нуклеиновокислотные последовательности, полипептиды и белки могут быть получены рекомбинантным путем с использованием стандартных методик рекомбинантной ДНК (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Press, Cold Spring Harbor, NY 2001; и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, NY, 1994). Кроме того, синтетически полученная нуклеиновокислотная последовательность, кодирующая CAR, может быть выделена и/или очищена из источника, такого как растение, бактерия, насекомое или млекопитающее, например, крыса, человек и т.д. Способы выделения и очистки хорошо известны в данной области. Альтернативно, нуклеиновокислотные последовательности, описанные в данном документе, могут быть синтезированы коммерческим образом. В этом отношении нуклеиновокислотная последовательность согласно изобретению может быть синтетической, рекомбинантной, выделенной и/или очищенной.
[0048] Данное изобретение также относится к вектору, содержащему нуклеиновокислотную последовательность, кодирующую CAR согласно изобретению. Вектор может быть, например, плазмидой, космидой, вирусным вектором (например, ретровирусным или аденовирусным) или фагом. Подходящие векторы и способы получения векторов хорошо известны в данной области (например, Sambrook et al., см. выше, и Ausubel et al., см. выше).
[0049] В дополнение к нуклеиновокислотной последовательности согласно изобретению, кодирующей CAR, вектор предпочтительно содержит последовательности, контролирующие экспрессию, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы транскрипции, внутренние сайты посадки рибосомы (IRES) и т.п., которые обеспечивают экспрессию нуклеиновокислотной последовательности в клетке-хозяине. Иллюстративные последовательности, контролирующие экспрессию, известны в данной области и описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology, Vol. 185, Academic Press, San Diego, Calif. (1990).
[0050] Большое число промоторов из множества различных источников, включая конститутивные, индуцибельные и репрессируемые промоторы, хорошо известны в данной области. Типичными источниками промоторов являются, например, вирусы, млекопитающие, насекомые, растения, дрожжи и бактерии, и подходящие промоторы из этих источников легко доступны или могут быть получены синтетическим путем на основании общедоступных последовательностей, например, из депозитариев, таких как АТСС, а также из других коммерческих или личных исто