Способы и композиции для опосредованной нуклеазой направленной интеграции трансгенов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложены кольцевой двухцепочечный полинуклеотид для интеграции экзогенной нуклеиновой кислоты в геном клетки и способ интеграции экзогенной последовательности нуклеиновой кислоты в эндогенный локус клетки. Предложенный кольцевой двухцепочечный полинуклеотид содержит экзогенную последовательность нуклеиновой кислоты и две последовательности, фланкирующие указанную экзогенную последовательность. При этом фланкирующие последовательности содержат два или более участков-мишеней для двух или более не встречающихся в природе нуклеаз. Указанные сайты-мишени фланкируют спейсерную последовательность длиной 4-20 нуклеотидов, не встречающуюся в геноме указанной клетки. Предложенный двухцепочечный полинуклеотид не содержит плеч гомологии. Предложенные полинуклеотид и способ могут быть использованы в биотехнологии для независимой от гомологии направленной вставки донорных молекул в геном клетки. 2 н. и 14 з.п. ф-лы, 61 ил., 33 табл., 10 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 61/643812, поданной 7 мая 2012 г., полное содержание которой таким образом приведено в качестве ссылки.
ЗАЯВЛЕНИЕ ПРАВ НА ИЗОБРЕТЕНИЯ, ВЫПОЛНЕННЫЕ В ФИНАНСИРУЕМЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИЯХ
[0002] Не предусмотрено.
ОБЛАСТЬ ТЕХНИКИ
[0003] Настоящее описание относится к области генной инженерии, в частности, направленной модификации генома клетки.
ПРЕДПОСЫЛКИ
[0004] Интеграция чужеродной ДНК в геном организмов и линий клеток представляет собой широко используемый способ для исследования биологических систем и манипуляций с ними. Традиционно, вставку трансгена направляют в специфический локус посредством предоставления плазмиды, несущей трансген, и имеющей существенную идентичность последовательности ДНК, фланкирующей желательный участок интеграции. Спонтанный разрыв хромосомы с последующей репарацией с использованием гомологичной области плазмидной ДНК в качестве матрицы приводит к переносу трансгена в геном. См., например, Roller et al. (1989) Proc. Nat’l. Acad. Sci. USA 86(22):8927-8931; Thomas et al. (1986) Cell 44(3): 419-428. Частоту этого типа управляемой гомологией направленной интеграции можно увеличивать вплоть до кратности 105 посредством преднамеренного создания двухцепочечного разрыва в окрестности намеченной области (Hockemeyer et al. (2009) Nature Biotech. 27(9):851-857; Lombardo et al. (2007) Nature Biotech. 25(11): 1298-1306; Moehle et al. (2007) Proc. Nat’l Acad. Sci. USA 104(9):3055-3060; Rouet et al. (1994) Proc. Nat’l Acad. Sci. USA 91(13):6064-6068.
[0005] Двухцепочечный разрыв (DSB) или пропуск можно получать посредством сайт-специфической нуклеазы, такой как нуклеаза с цинковыми пальцами (ZFN) или нуклеаза с эффекторным доменом TAL (TALEN), или с использованием системы CRISPR/Cas9 со сконструированной crРНК/tractРНК (одиночной руководящей РНК) для управления специфическим расщеплением. См., например, Burgess (2013) Nature Reviews Genetics 14:80-81, Urnov et al. (2010) Nature 435(7042):646-51; Публикации Патентов США 20030232410; 20050208489; 20050026157; 20050064474; 20060188987; 20090263900; 20090117617; 20100047805; 20110207221; 20110301073 и Международная публикация WO 2007/014275, полное содержание которых приведено в качестве ссылки для всех целей. Во многих организмах, вставку трансгена можно осуществлять посредством процесса направляемой гомологией репарации (HDR), требующего, чтобы вставленный трансген включал области гомологии с участком вставки (расщепления). Однако в некоторых организмах и линиях клеток отсутствует традиционный процесс HDR и направленная интеграция происходит в первую очередь посредством аппарата репарации ДНК независимым от гомологии соединением негомологичных концов (NHEJ). По существу, до настоящего времени в организмах и линиях клеток (например, клеток CHO), не подлежащих процессам HDR, только относительно короткие (<100 п.о.) олигонуклеотиды вставляли посредством независимых от гомологии путей после опосредованного нуклеазой расщепления локуса-мишени. См., например, Orlando et al. (2010) Nucleic Acids Res. 38(15):e152 и Публикацию Патента США № 20110207221.
[0006] Таким образом, остается необходимость композиций и способов независимой от гомологии направленной интеграции трансгенов, включая более крупные трансгены, непосредственно в участок расщепления, например, в организмы и линии клеток с отсутствием или дефицитом общепринятых зависимых от гомологии способов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0007] В настоящем документе описаны способы и композиции для независимой от гомологии направленной интеграции трансгена.
[0008] В одном аспекте в настоящем документе описаны двухцепочечные донорные полинуклеотиды для интеграции в выбранный эндогенный локус после расщеплением in vivo донора с использованием по меньшей мере одной нуклеазы. Донорные полинуклеотиды включают экзогенную последовательность (трансген), подлежащие интеграции в эндогенный локус, и содержат по меньшей мере один участок-мишень для нуклеазы, например, два парных участка связывания нуклеазы, разделенные «спейсерной» последовательностью, разделяющей ближние концы участков связывания. Спейсер может иметь любой размер, например, между 4 и 20 парами оснований (или любое значение между ними). Доноры, имеющие множество участков-мишеней нуклеазы, могут иметь одинаковые или различные участки-мишени, например, два одинаковых парных участка, фланкирующих трансген, или два различных парных участка, фланкирующих трансген. Донорные нуклеотиды не обязательно требуют присутствия гомологичных плеч, фланкирующих последовательность трансгена. Единственной гомологией с хромосомой, которая может присутствовать в донорной последовательности является(являются) участок(участки) связывания нуклеазы. В вариантах осуществления, в которых участки-мишени нуклеазы обладают гомологией с геномом, гомология с геномом составляет в длину менее 50-100 (или любое количество пар оснований между 50 и 100) непрерывных пар оснований. В конкретных вариантах осуществления, где нуклеаза, используемая для расщепления донора не является такой же, как нуклеаза, используемая для расщепления хромосомы, может не присутствовать гомологии между хромосомным локусом, расщепляемым нуклеазой(нуклеазами), и донорной последовательностью. Кроме того, участок(участки)-мишень для нуклеазы не находится внутри трансгена и, как таковое, расщепление донорного полинуклеотида нуклеазой(нуклеазами), связывающейся(связывающимися) с участком(участками)-мишенью, не модифицирует трансген. В конкретных вариантах осуществления донорная нуклеиновая кислота содержит два участка-мишени, и спейсерная последовательность между двумя участками-мишенями не встречается в природе, например, когда спейсерная последовательность не встречается в геномной последовательности между двумя участками-мишенями, присутствующими в геноме. В конкретных вариантах осуществления, донорные молекулы интегрируют в эндогенный локус посредством независимых от гомологии механизмов (например, NHEJ). В других вариантах осуществления двухцепочечный донор содержит трансген длиной по меньшей мере 1 т.п.о. и участок(участки)-мишень для нуклеазы на 3’- и/или 5’-трансгена для расщепления in vivo. В конкретных вариантах осуществления, участок(участки)-мишень для нуклеазы, используемый для расщепления донора, не восстанавливается после интеграции трансгена, например, когда спейсер между парными участками-мишенями не присутствует в эндогенном локусе и/или не обладает гомологией с эндогенным локусом. Донорная молекула может представлять собой, например, плазмиду. В конкретных вариантах осуществления, донор интегрируют после опосредованного нуклеазой расщепления эндогенного локуса. В любой опосредованной нуклеазой интеграции донорной молекулы одна или более нуклеаз, использованных для расщепления донора, могут являться такими же, как одна или более нуклеаз, используемых для расщепления эндогенного локуса. Альтернативно, одна или более нуклеаз, использованных для расщепления донора, могут отличаться от одной или более нуклеаз, используемых для расщепления эндогенного локуса.
[0009] В некоторых вариантах осуществления донор содержится на плазмиде. Донор может быть интегрирован после опосредованного нуклеазой расщепления, где последовательность, подлежащая интеграции (донор или трансген), фланкирована в плазмиде по меньшей мере двумя участками расщепления нуклеазой. В других вариантах осуществления донор содержится на плазмиде, где донор может быть интегрирован после опосредованного нуклеазой расщепления, где последовательность, подлежащая интеграции (донор или трансген), представляет собой плазмиду, содержащую одиночный 5’-участок расщепления нуклеазой. В конкретных вариантах осуществления последовательность участков расщепления нуклеазой в донорной плазмиде является такой же, как последовательность участка расщепления нуклеазой в хромосомном локусе, предназначенном в качестве мишени. В вариантах осуществления, в которых участки расщепления являются одинаковыми в доноре и геноме, последовательности, разделяющие участки расщепления, могут являться одинаковыми или различными. В конкретных вариантах осуществления, последовательности, разделяющие участки расщепления (спейсеры), являются отличными в доноре по сравнению с геномом, так что после расщепления донора участки-мишени повторно не образуются, и донор невозможно расщепить снова той же самой нуклеазой(нуклеазами).
[0010] Представляющая интерес последовательность молекулы-донора может содержать одну или более последовательностей, кодирующих функциональный полипептид (например, кДНК), с промотором или без. В конкретных вариантах осуществления последовательность нуклеиновой кислоты содержит последовательность, кодирующую антитело, антиген, фермент, фактор роста, рецептор (поверхности клеток или ядерный), гормон, лимфокин, цитокин, репортер, ген устойчивости к насекомым, ген устойчивости к гербицидам, фактор транскрипции, белок секвестрации или функциональные фрагменты любого из вышеуказанных и комбинации вышеуказанных. Представляющая интерес последовательность вставки молекулы-донора может содержать одну или более последовательностей, кодирующих молекулу РНК, кодирующую функциональную или структурную РНК, например, РНКи, мРНКи, и/или мкРНКи. В вариантах осуществления, в которых последовательности, кодирующие функциональный полипептид, не имеют промоторов, экспрессию интегрированной последовательности затем обеспечивают посредством транскрипции, управляемой эндогенным промотором или другим контрольным элементом в представляющей интерес области. В других вариантах осуществления «тандемную» кассету интегрируют в выбранный участок таким образом, где первый компонент кассеты содержит не имеющую промотора последовательность, как описано выше, с последующей последовательностью терминации транскрипции, и вторую последовательность, кодирующую автономную экспрессирующую кассету. В донорную молекулу можно включать дополнительные последовательности (кодирующие или некодирующие последовательности), включая, но без ограничения, последовательности, кодирующие пептид 2A, участок SA, IRES и т.д. В конкретных вариантах осуществления донорная нуклеиновая кислота (трансген) содержит последовательности, кодирующие функциональные РНК, например, мкРНК или кшРНК.
[0011] Другой аспект, описанный в настоящем документе, относится к способам интеграции донорной нуклеиновой кислоты (например, донорной молекулы, как описано в настоящем документе) в геном клетки посредством независимых от гомологии механизмов. Способы включают создание двухцепочечного разрыва (DSB) в геноме клетки и расщепления молекулы-донора с использованием одной или более нуклеаз, так что донорную нуклеиновую кислоту интегрируют в участок DSB. В конкретных вариантах осуществления донорную нуклеиновую кислоту интегрируют посредством не зависимых от гомологии способов (например, NHEJ). Как отмечено выше, при расщеплении in vivo донорные последовательности можно интегрировать направленным способом в геном клетки в расположении DSB. Донорная последовательность может включать один или более одинаковых участков-мишеней для одной или более нуклеаз, использованных для получения DSB. Таким образом, донорную последовательность можно расщеплять одной или несколькими из одинаковых нуклеаз, использованных для расщепления эндогенного гена, в который желательна интеграция. В конкретных вариантах осуществления донорная последовательность включает участки-мишени для нуклеазы, отличной от нуклеаз, использованных для индукции DSB. DSB в геноме клетки-мишени можно получать посредством любого механизма. В конкретных вариантах осуществления DSB получают посредством одного или более (например, димеризующейся пары) нуклеаз с цинковыми пальцами (ZFN), слитых белков, содержащих связывающий домен с цинковыми пальцами, сконструированный для связывания последовательности внутри интересующей области, и расщепляющий домен или расщепляющий полудомен расщепления. В других вариантах осуществления DSB получают посредством одного или более ДНК-связывающих доменов TALE (природных или неприродных), слитых с доменом нуклеазы (TALEN). В следующих вариантах осуществления расщепление осуществляют с использованием системы нуклеаз, такой как CRISPR/Cas со сконструированной crРНК/tracrРНК.
[0012] Более того, в любом из способов, описанных в настоящем документе, первый и второй полудомены расщепления могут происходить из рестрикционной эндонуклеазы типа IIS, например, FokI или StsI. Более того, в любом из способов, описанных в настоящем документе, по меньшей мере один из слитых белков может содержать изменение в аминокислотной последовательности поверхности димеризации полудомена расщепления, например, такое, что формируются облигатные гетеродимеры полудоменов расщепления. Альтернативно, в любом из способов, описанных в настоящем документе, домен расщепления может представлять собой природную или неприродную (сконструированную) мегануклеазу.
[0013] В любом из способов, описанных в настоящем документе, клетка может представлять собой любую эукариотическую клетку, например, клетку растения или клетку млекопитающего, или линию клеток, включая клетки COS, CHO (например, CHO-S, CHO-K1, CHO-DG44, CHO-DUXB11, CHO-DUKX, CHOK1SV), VERO, MDCK, WI38, V79, B14AF28-G3, BHK, HaK, NSO, SP2/0-Agl4, HeLa, HEK293 (например, HEK293-F, HEK293-H, HEK293-T) и perC6, также как клетки насекомых, таких как Spodoptera fugiperda (Sf), или клетки грибов, таких как Saccharomyces, Pichia и Schizosaccharomyces. В конкретных вариантах осуществления линия клеток представляет собой линию клеток CHO, MDCK или HEK293. Пригодные клетки включают также стволовые клетки, например, такие как эмбриональные стволовые клетки, индуцированные плюрипотентные стволовые клетки, гематопоэтические стволовые клетки, нейрональные стволовые клетки и мезенхимальные стволовые клетки. Более того, клетки могут являться арестованными в фазе G2 клеточного цикла. В некоторых вариантах осуществления способов, описанных в настоящем документе, клетка может представлять собой клетку с отсутствием эффективной основанной на гомологии репарации ДНК, например, клетку CHO. В конкретных вариантах осуществления клетки могут являться первичными или не делящимися клетками, предпочтительно использующими путь репарации ДНК NHEJ. В некоторых вариантах осуществления клетка может представлять собой клетку растения или гриба. В других вариантах осуществления способы, описанные в настоящем документе, можно использовать в клетках с несеквенированными геномами. Эти клетки можно использовать для создания линий клеток и/или трансгенных организмов (например, животных или растений), несущих трансген(ы).
[0014] Другой аспект относится к трансгенным организмам (например, растениям или животным), содержащим трансген, интегрированный любым из способов, описанных в настоящем документе. В одном варианте осуществления конструируют клетку, линию клеток или трансгенный организм, несущий гетерозиготный генотип для выбранного гена, в то время как в другом варианте осуществления получают гомозиготную клетку, линию клеток или трансгенный организм, несущий две мутантные копии в обоих аллелях желаемого локуса.
[0015] Представлен также набор, включающий способы и композиции по изобретению. Набор может содержать нуклеазы, (например, гены, кодирующие молекулы РНК или ZFN, TALEN или систему CRISPR/Cas, содержащиеся в подходящем экспрессирующем векторе), или аликвоты белков нуклеаз, донорные молекулы, подходящие линии клеток-хозяев, инструкции для осуществления способов по изобретению и т.п. Набор может также содержать представляющие интерес донорные молекулы (например, репортерные гены, специфические трансгены и т.п.).
[0016] Эти и другие аспекты ясно очевидны специалисту в данной области в свете описания в целом.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
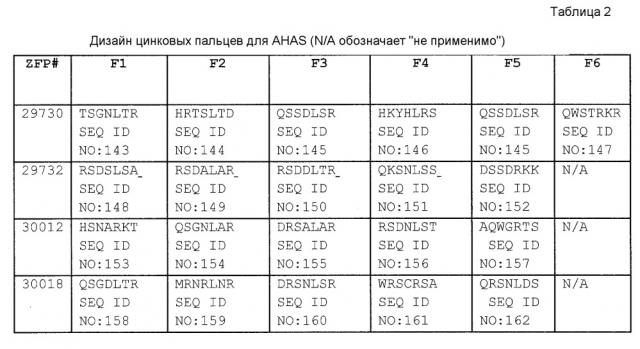
[0017] На фигуре 1, панели A-F, показан захват трансгена, расщепленного in vivo, в локусе AAVS1 в клетках K562. Фигура 1A представляет собой схематическое изображение иллюстративной донорной молекулы, имеющей два спаренных участка связывания (всего 4 участка связывания), где каждая пара отделена спейсерами), где сайты фланкируют трансген, подлежащий интеграции в геном. Участки-мишени могут являться одинаковыми или различными. Фигура 1B представляет собой схему, изображающую различные способы расщепления донора in vivo. В первом варианте осуществления, когда хромосома и донорная плазмида обе содержат участок расщепления ZFN (темно-серая область), расщепление донора и хромосомы является синхронизированным, позволяя эффективную интеграцию донора в хромосому. Интеграция может происходить как в прямой, так и в обратной ориентациях, названных «AB» и «BA», соответственно. Во втором варианте осуществления донор содержит более одного участка расщепления нуклеазой. Действие нуклеазы высвобождает линейный фрагмент ДНК, который интегрируют в хромосому. В третьем варианте осуществления хромосому расщепляют более, чем одной нуклеазой, и донор одной нуклеазой, что приводит к интеграции донора в делецию в хромосоме. В четвертом варианте осуществления как донорную ДНК, так и хромосомную ДНК расщепляют более чем одной нуклеазой, что приводит к интеграции линейного фрагмента в делецию в хромосоме. На фигуре 1C показано сравнение доноров, благоприятствующих прямой (AB) интеграции трансгена и воссозданию того же самого участка-мишени нуклеазы (верхние панели) с донорами, благоприятствующими обратной (BA) интеграции трансгена и не воссоздающими тот же самый участок-мишень нуклеазы (нижние панели). Последовательность между участками связывания (спейсерами) подчеркнута, и выступающие концы спейсеров дикого типа (верхние панели) и обратно комплементарных спейсеров (нижние панели), полученных после расщепления, показана справа верхних и нижних панелей. Последовательности, показанные вверху слева, представляют собой SEQ ID NO: 107 и 108. Последовательности, показанные вверху справа, представляют собой SEQ ID NO: 109 и 110. Последовательности, показанные внизу слева, представляют собой SEQ ID NO: 111 и 112, и последовательности, показанные внизу справа, представляют собой SEQ ID NO: 113 и 114. Фигура 1D представляет собой гель, показывающий детекцию направленной интеграции из доноров с последовательностями (или спейсерами) дикого типа («w.t.») между участками связывания ZFN (такими же последовательностями спейсеров, как в геноме), и обратно комплементарными («r.c.») последовательностями между участками связывания ZFN. Как показано, больший сигнал наблюдают в ориентации BA с выступающими обратно комплементарными нуклеотидами. Фигура 1E представляет собой гель, показывающий интеграцию донорной плазмиды в AAVS1 после расщепления in vivo специфическими для AAVS ZFN. Донорную плазмиду либо с содержанием, либо с отсутствием участка AAVS1 ZFN, совместно трансфицировали со специфическими для AAVS1 ZFN в клетки K562. Интеграцию как в AB, так и в BA ориентациях мониторировали посредством ПЦР участков стыковки хромосома-донор. При вставке в ориентации AB получают продукты ПЦР 391 и 423 п.о. для левого и правого участков стыковки, соответственно; при вставке в ориентации BA получают продукты ПЦР 369 и 471 п.о. для левого и правого участков стыковки, соответственно. «A1» относится к реакции ПЦР, разработанной для амплификации участка ZFN в AAVS1, и «NT» относится к реакциям с отсутствием ДНК-матрицы. На фигуре 1F изображены как схема триплоидного локуса AAVS1, так и результаты проверки направленной интеграции, как анализировали Саузерн-блоттингом. Три клона анализировали в двух повторах. Геномную ДНК из трех клонов либо расщепляли BglI и анализировали с помощью специфического для AAVS1 зонда (верхний гель), либо расщепляли AccI и анализировали с помощью специфического для трансгена зонда (bla).
[0018] На фигуре 2, панели A и B, показано, что расщепление донора in vivo способствует захвату трансгена в нескольких локусах двух различных типов клеток. На фигуре 2A показано, что направленная интеграция посредством NHEJ в участки в локусах IL2Rγ, CCR5 и глутаминсинтетазы (GS) является более эффективной, когда донорную плазмиду расщепляют совместно с хромосомой, вместо расщепления до трансфекции. Одну ПЦР участков стыковки для каждой ориентации проводили для всех трех локусов, левого участка стыковки для ориентации BA и правого участка стыковки для ориентации AB. Использованные условия эксперимента отмечены следующим образом «N» относится к трансфекциям, где у донора отсутствует участок ZFN; «ERV» относится к образцу, в котором донор предварительно расщепляли EcoRV до введения в клетку; «Y» относится к трансфекции, где донор и ген-мишень оба содержат участок ZFN; и «NT» относится к реакциям ПЦР без ДНК-матрицы. Размер ампликона, ожидаемый при амплификации ПЦР успешно интегрированных доноров, показан ниже каждой дорожки в парах оснований («Ожидаемый размер, п.о.»). Показанный рисунок представляет собой изображение с инвертированными цветами окрашенного бромидом этидия геля. На фигуре 2B изображено, что расщепление донора не обязательно должно быть выполнено с помощью таких же ZFN, как использованные для расщепления участка-мишени в хромосоме. Анализы специфической для участков стыковки ПЦР использовали для детекции интеграции трансгена в хромосомную мишень и для детекции ориентации интегрированных трансгенов. Эти анализы показали, что трансген можно интегрировать в любой ориентации после расщепления ZFN. Условия эксперимента отмечены следующим образом: GS, специфические для GS ZFN или донорная плазмида с участком расщепления ZFN GS; A1, специфические для AAVS1 ZFN или донор с участком расщепления ZFN AAVS1.
[0019] На фигуре 3, панели A-C, изображена направленная интеграция трансгена с высокой частотой в локус GS в клетках CHO-K1. Фигура 3А представляет собой схему локуса GS, показывающую трансген, интегрированный в ориентации BA. На фигуре 3B показан анализ Саузерн-блоттингом клонов клеток для направленной интеграции донора в локус GS. Экзонный зонд GS детектирует также два псевдогена GS. Ту же самую панель клонов анализировали по общей интеграции трансгена посредством анализа с зондом для гена bla E. coli (фигура 3C). Интеграцию трансгена в локус GS наблюдали вместе с интеграцией трансгена где-либо еще в геноме в трех из восьми анализированных клонов.
[0020] На фигуре 4, панели A и C, показано повреждение альфа-(1,6)-фукозилтрансферазы (FUT8) в клетках CHO-K1 посредством опосредованной ZFN и TALEN направленной вставки трансгена моноклонального антитела. На фигуре 4A изображены диаграммы Венна с пропорциональной площадью, показывающие соответствие между клонами, прошедшими скрининг по вставке трансгена посредством специфической для участков стыковки ПЦР и по экспрессии IgG. Фигура 4B представляет собой схему локуса FUT8, содержащего вставленный трансген (изображенный светло-серым), с отмеченной ориентацией трансгена в номенклатуре либо «AB» или «BA», и на фигуре 4C показано подтверждение Саузерн-блоттингом интеграции в FUT8. Отмечены интегранты, содержащие трансгены, вставленные в ориентациях BA и AB.
[0021] На фигуре 5, панели A-C, показана активность ZFN для экспериментов, описанных в примерах. На фигуре 5A показано расщепление ZFN в локусе AAVS1 (вверху) и в донорной плазмиде (внизу). Соответствующие дорожки на фигуре 5A из фигуры 1D указаны над гелем (например: «1,12»), как присутствие («Y») или отсутствие («N») фермента нуклеазы Surveyor™. Процент модифицированных молекул показан под дорожками с сигналом. На фигуре 5B показано расщепление ZFN в IL2Rγ, CCR5 и GS с использованием специфических для соответствующего гена ZFN. Как описано выше для 5A, соответствующие дорожки в 5B из фигуры 2A указаны над гелем, как присутствие («Y») или отсутствие («N») фермента нуклеазы Surveyor™. В то время как на гелях вверху фигуры 5B изображены результаты интеграции в локусы генов, на гелях внизу фигуры изображены результаты расщепления в донорах. На фигуре 5C показано расщепление ZFN в GS, где на геле слева изображены результаты для локуса гена в клетках CHO, в то время как на геле справа изображены результаты расщепления ZFN донора. Как выше, соответствующие дорожки на фигуре 5C из фигуры 2B указаны над гелем, как присутствие («Y») или отсутствие («N») фермента нуклеазы Surveyor™. Стрелками указаны ожидаемые продукты расщепления.
[0022] Фигура 6 представляет собой график, изображающий зависимую от гомологии направленную интеграцию кодирующего GFP трансгена в клетки HEK 293 и CHO-K1. Процент клеток, являющихся положительными по GFP, показан светло-серым (клетки HEK 293) или темно-серым (клетки CHO-K1). Количество использованного донора указано под каждой группой.
[0023] На фигуре 7 показана частичная последовательность ДНК продуктов ПЦР участков стыковки из клонов CHO K1, в которых расщепленные in vivo доноры были интегрированы в локус AAVS1. Хромосомная последовательность показана обычным текстом, и донорная последовательность показана курсивом. Участки связывания ZFN подчеркнуты и показаны жирным шрифтом. Микрогомология выделена серым. Ожидаемые последовательности аллелей в ориентации AB показаны сверху группы AB и определены как точное лигирование 5’-выступающих концов; ожидаемые последовательности аллелей в ориентации BA показаны сверху группы BA и определены как удаление 5’-выступающих концов с последующим лигированием. Идентификаторы последовательностей указаны на фигуре.
[0024] На фигуре 8, панели A-C, показаны последовательности ДНК из анализов продуктов ПЦР участков стыковки из пулов клеток CHO K1 с интеграцией трансгенов в AAVS1 (фигура 8A), CCR5 (фигура 8B), GS (фигура 8C), и IL2Rγ (фигура 8C). Хромосомная последовательность показана обычным текстом, донорная последовательность показана курсивом. Участки связывания ZFN подчеркнуты и выделены жирным шрифтом. Ожидаемые последовательности аллелей показаны, как выше, а также, как определено выше для фигуры 7. Идентичные последовательности, выделенные более одного раза, отмечены, и идентификаторы последовательности указаны на фигуре.
[0025] На фигуре 9 показаны последовательности ДНК после ПЦР участков стыковки из происходящих из отдельных клеток клонов GS. Хромосомная последовательность показана обычным текстом, донорная последовательность показана курсивом. Участки связывания ZFN подчеркнуты и выделены жирным шрифтом. Ожидаемые аллели в ориентации AB определены как точное лигирование 5’-выступающих концов; ожидаемые аллели в ориентации BA определены как удаление 5’-выступающих концов с последующим лигированием. Идентификаторы последовательности указаны на фигуре.
[0026] На фигуре 10, панели A и B, показаны последовательности ДНК после ПЦР участков стыковки происходящих из отдельных клеток клонов с интеграцией в FUT8. Хромосомная последовательность показана обычным текстом, донорная последовательность показана курсивом. На фигуре 10A показана интеграция после расщепления нацеленными на FUT8 ZFN (участки связывания ZFN подчеркнуты и выделены жирным шрифтом). На фигуре 10B показана интеграция после расщепления нацеленными на FUT8 TALEN (участки связывания TALEN подчеркнуты и выделены жирным шрифтом). Идентификаторы последовательности указаны на фигуре.
[0027] На фигуре 11 показана карта плазмиды pDAB109350.
[0028] На фигуре 12 показана карта плазмиды pDAB109360.
[0029] На фигуре 13 показана карта плазмиды pDAS000153.
[0030] На фигуре 14 показана карта плазмиды pDAS000150
[0031] На фигуре 15 показана карта плазмиды pDAS000143.
[0032] На фигуре 16 показана карта плазмиды pDAS000164.
[0033] На фигуре 17 показана карта плазмиды pDAS000433.
[0034] На фигуре 18 показана карта плазмиды pDAS000434.
[0035] На фигуре 19, панели A и B, изображено свободное от экзогенных маркеров, последовательное пакетирование трансгенов в эндогенном локусе AHAS в геноме пшеницы Triticum aestivum с использованием опосредованной ZFN, направленной NHEJ репарации ДНК. На фигуре 19A изображен первый пакет трансгенов; на фигуре 19B изображен второй пакет трансгенов.
[0036] На фигуре 20, панели A и B, изображено свободное от экзогенных маркеров, последовательное пакетирование трансгенов в эндогенном локусе AHAS в геноме пшеницы Triticum aestivum с использованием опосредованной ZFN, направляемой HDR репарации ДНК. На фигуре 20A изображен первый пакет трансгенов; на фигуре 20B изображен второй пакет трансгенов.
[0037] На фигуре 21 показана карта плазмиды pDAS000435.
[0038] На фигуре 22 показана карта плазмиды pDAB107827.
[0039] На фигуре 23 показана карта плазмиды pDAB107828.
[0040] На фигуре 24 показана карта плазмиды pDAS000340.
[0041] На фигуре 25 показана карта плазмиды pDAS000341.
[0042] На фигуре 26 показана карта плазмиды pDAS000342.
[0043] На фигуре 27 показана карта плазмиды pDAS000343.
[0044] На фигуре 28, панели A и B, показано расположение праймеров и их положение относительно стартового и стоп-кодона Fad3C. На фигуре 28A показано расположение участков праймеров для локуса Fad3C дикого типа. На фигуре 28B показано расположение участков праймеров для подтверждения интеграции донора и возможных ориентаций, посредством которых донор может интегрировать внутри локуса Fad3C.
[0045] На фигуре 29, панели A и B, показаны выравнивания последовательностей для различных направленных интеграций. На фигуре 29A показано выравнивание последовательностей, амплифицированных с участка стыковки кассеты tGFP из pDAS000341 с Fad3C в двухцепочечном разрыве после узнавания ZFN 28051-2A-28052. Показанные последовательности представляют собой SEQ ID NO:480-493 сверху вниз. «·» обозначает делеции, локализованные в участках разрезания. На фигуре 29B показано выравнивание последовательностей, амплифицированных с участка стыковки кассеты tGFP из pDAS000343 с Fad3C в двухцепочечном разрыве после узнавания ZFN 28051-2A-28052 и ZFN 28053-2A-28054. «·» обозначает делеции, локализованные в участках разрезания. Показанные последовательности представляют собой SEQ ID NO:494-507 сверху вниз.
[0046] На фигуре 30, панели A и B, показано выравнивание последовательностей, амплифицированных с участка стыковки кассеты hph из pDAS000340 с FAD3C в двухцепочечном разрыве после узнавания ZFN 28051-2A-28052. «·» обозначает делеции, локализованные в участках разрезания. Показанные последовательности представляют собой SEQ ID NO:508-523 сверху вниз. На фигуре 30A показаны последовательности для 5'-участка стыковки, и последовательности, показанные на фигуре 30B - для 3'-участка стыковки.
[0047] На фигуре 31, панели A и B, показано выравнивание последовательностей, амплифицированных с участка стыковки кассеты hph из pDAS00034 с FAD3C в двухцепочечном разрыве после узнавания ZFN 28051-2A-28052 и 28053-2A-28054. «·» обозначает делеции, локализованные в участках разрезания. Показанные последовательности представляют собой SEQ ID NO:524-532 сверху вниз. Последовательности, показанные на фигуре 31A - для 5'-участка стыковки, и последовательности, показанные на фигуре 31B - для 3'-участка стыковки.
[0048] На фигуре 32 показано отношение ZFN, сконструированных для связывания геномного локуса трансгенного события кукурузы DAS-59132. Шесть ZFN (E32ZFN1-6) идентифицированы из анализа в дрожжах, и четыре ZFN являлись преимущественными для оценки в растениях.
[0049] На фигуре 33 показана карта плазмиды pDAB105906.
[0050] На фигуре 34 показана карта плазмиды pDAB111809.
[0051] На фигуре 35 показана карта плазмиды pDAB100655.
[0052] На фигуре 36 изображен график, показывающий оценку временно экспрессированных ZFN в растениях. Четыре ZFN оценивали в каллюсе маиса по временно экспрессирующимся ZFN и внутреннему контролю - ZFN, нацеленной на ген IPPK2. После секвенирования нового поколения амплифицированных фрагментов ПЦР из области, окружающей участки расщепления ZFN, секвенированные амплифицированные фрагменты ПЦР оценивали в баллах по присутствию вариантов последовательности, возникающих в результате инделов. Показана относительная частота инделов для каждой из четырех пар E32 ZFN по сравнению с активностью IPPK2 ZFN. При трансгенном событии 32 ZFN6, содержащем связывающие домены с цинковыми пальцами 25716 (’716) и 25717 (’717), расщепление геномного локуса трансгенного события кукурузы DAS-59132 происходило в 380 раз эффективнее, чем для контрольной нуклеазы с цинковыми пальцами IPPK2.
[0053] На фигуре 37 изображен график повреждения ZFN локуса трансгенного события кукурузы DAS-59132.
[0054] Фигура 38 представляет собой схематическое изображение экспериментальной системы для интеграции донора в ELP генома маиса.
[0055] Фигура 39 представляет собой график, иллюстрирующий расщепление геномной ДНК-мишени посредством eZFN. ДНК выделена из каждой группы обработки (6 повторов для каждой), как указано. Анализы TAQMAN™ использовали для измерения расщепления ДНК-мишени. Активность расщепления eZFN представлена относительно обработок только донорной ДНК. Уровни eZFN (eZFN1 и eZFN3) составляли соотношения 1:1 или 1:10 относительно донорной ДНК. Статистические группы указаны строчными буквами.
[0056] Фигура 40 иллюстрирует участки связывания праймеров внутри локусов ELP генома кукурузы.
[0057] Фигура 41 иллюстрирует участки связывания праймеров фрагмента pDAB100651 для оценки количества копий.
[0058] На фигуре 42 показана активность расщепления eZFN относительно обработок только донорной ДНК. Уровни расщепления eZFN (eZFNl и eZFN3) составляли соотношения 1:1 или 1:10 относительно донорной ДНК. Статистические группы указаны строчными буквами.
[0059] На фигуре 43, панели A и B, показана последовательность участков стыковки из реакций внутренней-внешней ПЦР. Левая и правая последовательности представляют собой частичные последовательности AAD1 и ELP, соответственно. Последовательность, ожидаемая после инсерционного восстановления участка связывания eZFN, показана синим шрифтом. Участок связывания eZFN выделен зеленым, и делеции представлены черными штрихами. Показаны последовательности для прямой ориентации (фигура 43A) и обратной ориентации (фигура 43B). Последовательности находятся в блоках в соответствии с реакцией ПЦР, после которой они клонированы.
ПОДРОБНОЕ ОПИСАНИЕ
[0060] В настоящем документе описаны композиции и способы для опосредованной нуклеазой независимой от гомологии (например, захват NHEJ) направленной интеграции трансгена. В то время как вставку олигонуклеотидов можно проводить посредством простой совместной трансфекции ДНК с совместимыми 5’-выступающими концами, в настоящее время показано, что захват NHEJ фрагментов размера трансгена (например, >0,5 т.п.о.) сильно облегчается посредством опосредованного нуклеазой расщепления in vivo донорной плазмиды в дополнение к расщеплению хромосомы. Этим способом трансгены большего размера (например, длиной между 1 и 14 т.п.о. или длиннее) можно интегрировать направленным образом в организмы и линии клеток, такие как клетки яичника китайского хомяка (CHO), не поддающиеся основанной на HDR интеграции. Например, расщепление донора in vivo позволяло направленную интеграцию с высокой частотой (6%) в не подвергавшиеся селекции клетки CHO, тип клеток, в ином случае не поддающийся направленной вставке больших последовательностей ДНК.
[0061] Совместное расщепление хромосомы и содержащего трансген двухцепочечного донора, как описано в настоящем документе, приводит к успешной интеграции в любой эндогенный локус-мишень в выбранной клетке-хозяине. Способы и композиции, описанные в настоящем документе, позволяют эффективную независимую от гомологии направленную интеграцию, которая, как правило, недостижима простой совместной трансфекцией предварительно разрезанных доноров.
[0062] Таким образом, композиции и способы, описанные в настоящем документе, позволяют независимую от гомологии направленную интеграцию больших трансгенов в участки расщепления нуклеазой, включая делеции, образованные сконструированными нуклеазами, такими как ZFN и/или TALEN. Альтернативно, можно использовать донорную плазмиду с участками для нуклеазы, фланкирующими трансген, подлежащий интеграции, так что часть трансгена высвобож