Способ ферментативного получения l-метионина из о-фосфо-l-гомосерина и метантиола
Иллюстрации
Показать всеПредложен способ получения L-метионина, в котором О-фосфо-L-гомосерин (OPHS) и метантиол ферментативно превращают в L-метионин и Н3РО4 согласно схеме реакции: О-фосфо-L-гомосерин + CH3-SH <=> L-метионин + H3PO4. Указанное ферментативное превращение достигают путем использования OPHS-зависимой метионинсинтазы, представляющей собой белок, полученный из цистатионин-гамма-синтазы (КФ 2.5.1.48) в результате мутации. При этом OPHS-зависимая метионинсинтаза представляет собой белок, выбранный из группы, состоящей из (a) белка, содержащего любую из аминокислотных последовательностей SEQ ID NO: от 6 до 29; (b) белка, имеющего последовательность, идентичную по меньшей мере на 90% любой из SEQ ID NO: от 6 до 29, и обладающего ферментативной активностью превращения OPHS и метантиола в L-метионин и Н3РО4. Предложено также применение белка, обладающего ферментативной активностью превращения OPHS и метантиола в L-метионин и Н3РО4, для превращения OPHS и метантиола в L-метионин и Н3РО4. С использованием способа получения L-метионина осуществляют получение S-аденозилметионина, получение цистеина, получение глутатиона, а также получение 2-оксо-4-метилтиобутаноата. Группа изобретений позволяет эффективно превращать OPHS + CH7-SH в L-метионин. 6 н. и 2 з.п. ф-лы, 7 ил., 3 табл., 6 пр.
Реферат
Настоящее изобретение относится к способу получения L-метионина, в котором O-фосфо-L-гомосерин и метантиол ферментативно превращают в L-метионин и Н3РО4. Такого превращения достигают путем воздействия фермента O-фосфо-L-гомосерин (OHPS)-зависимой метионинсинтазы. Настоящее изобретение также относится к O-фосфо-L-гомосерин-зависимым метионинсинтазам, т.е. белкам, которые способны ферментативно превращать O-фосфо-L-гомосерин и метантиол в L-метионин и Н3РО4. Настоящее изобретение также относится к микроорганизмам, генетически модифицированным таким образом, чтобы производить L-метионин из О-фосфо-L-гомосерина и метантиола.
Описанные ферменты и процессы также могут быть с успехом использованы для синтеза производных метионина, таких как S-аденозилметионин, глутатион, цистеин, S-аденозилгомоцистеин и метилтиоаденозин. Настоящее изобретение также относится к методам скрининга ферментов, катализирующих превращение O-фосфо-L-гомосерина и метантиола в L-метионин и H3PO4.
L-метионин является незаменимой аминокислотой, образующейся в ходе метаболизма, при превращении L-аспартата, путем активации, в L-аспартил фосфат с последующим восстановлением до полуальдегида L-аспартата и L-гомосерина. У бактерий, также как и у грибов, L-гомосерин подвергается О-ацетилированию с образованием или сукцинила, или ацетильного эфира, который, сам по себе, подвергается конденсации серы, или непосредственно с сульфидом (SH2) с образованием L-гомоцистеина, или опосредованно с L-цистеином с образованием L-цистатионина и его дальнейшей конверсией в гомоцистеин. Метилирование гомоцистеина происходит с помощью метилтетрагидрофолата, с образованием L-метионина.
В растениях, L-гомосериновый эфир, используемый в качестве предшественника цистатионина, представляет собой О-фосфо-L-roMocepHH. Цистатионин затем превращается в гомоцистеин под действием цистатионин бета-лиазы. Метилирование гомоцистеина затем приводит к образованию метионина. O-фосфо-L-гомосерин также образуется в ходе метаболизма в клетках бактерий, растений, грибов и млекопитающих, как прямой предшественник L-треонина, при участии пиридоксальфосфата треонин-синтазы (КФ (код фермента) 4.2.3.1). У растений существует жесткое регулирование потока углерода в метионин и треонин в O-фосфо-L-гомосерин точке перехода (Amir et al., TRENDS Plant Science 7 (2002), 153). В литературе (смотри, например, Kreft et al., Plant. Physiol. 104 (1994), 1215; Ravanel et al., Arch. Biochem. Biophys. 316 (1995), 572) имеются сведения о том, что и L-цистеин, и сульфид (SH2) могут быть конденсированы растительной цистатионин-гамма-синтазой с O-фосфо-L-гомосерином в L-цистатионин и L-гомоцистеин, с одновременным высвобождением фосфата. Сообщалось также, что выбор субстрата тиола очень ограничен, помимо L-цистеина, лишь немногие субстраты являются приемлемыми.
Хотя метионин является незаменимой аминокислотой, он не синтезируется de novo у животных, которые должны получать извне метионин или метионин-содержащие белки, или относящиеся к ним серосодержащие соединения. В частности, метионин имеет важное значение для кормления в птицеводстве и животноводстве, он не содержится в достаточном количестве в используемых растительных кормах. Таким образом, для эффективного фермерства необходим дополнительный источник метионина. На сегодняшний день, большинство, если не весь метионин, используемый для кормления животных, поступает из нефтехимии. Одним из ограничений производства метионина является стоимость энергии, затрачиваемой на восстановление серы. Таким образом, существует потребность в альтернативных способах получения этой аминокислоты, предпочтительно, использующих возобновляемые ресурсы, которые позволили бы использовать микроорганизмы, синтез метионина в которых сопоставим с производством метионина в промышленном масштабе.
Настоящее изобретение направлено на удовлетворение этой потребности путем создания способа получения L-метионина, в котором О-фосфо-L-гомосерин и метантиол ферментативно превращают в Ьнметионин и Н3РО4. В таком способе источником серы является метантиол. В этом соединении сера представлена в виде сульфида, уже восстановленная. Кроме того, использование O-фосфо-L-гомосерина в качестве предшественника, экономит, по меньшей мере, два атома углерода на молекулу синтезированного метионина по сравнению со стандартным метаболическим путем, который основан на использовании ацетилированных или сукцинилированных производных гомосерина. В целом этот путь дает гораздо лучшие результаты в синтезе метионина и его производных.
Таким образом, настоящее изобретение относится к способу производства L-метионина, в котором L-метионин ферментативно получают в согласно следующей схеме реакции:
O-фосфо-L-гомосерин + CH3-SH <=> L-метионин + Н3РО4
В настоящее время отсутствуют данные о существовании в природе белка, обладающего способностью превращать O-фосфо-L-гомосерин и метантиол в L-метионин. Авторы настоящего изобретения рассмотрели возможность получения L-метионина экономически эффективным способом из О-фосфо-L-гомосерина и метантиола, и, с этой целью, разработали белки, которые не встречаются в природе, и которые способны превращать О-фосфо-L-гомосерин и метантиол в L-метионин. Как видно из приведенных примеров, авторы настоящего изобретения разработали систему, которая позволяет создавать ферменты, обладающие способностью превращать О-фосфо-L-гомосерин и метантиол в L-метионин и Н3РО4. Кроме того, авторы изобретения успешно применили эту систему для создания новых вариантов ферментов, полученных из существующих ферментов, обладающих способностью превращать О-фосфо-L-гомосерин и метантиол в L-метионин и H3PO4. Для этой цели они отталкивались от существующих ферментов, не обладающих способностью превращать О-фосфо-L-гомосерин и метантиол в L-метионин и Н3РО4, получали мутанты из таких существующих ферментов, и отбирали ферменты, демонстрирующие способность превращать О-фосфо-L-гомосерин и метантиол в L-метионин и Н3РО4. Таким образом, авторы изобретения выявили новую ферментативную активность, не описанную ранее, и предложили надежные и воспроизводимые способы получения соответствующих ферментов. Соответствующие ферменты в контексте настоящего изобретения называют O-фосфо-L-гомосерин-зависимыми метионинсинтазами.
Таким образом, настоящее изобретение, в частности, относится к способу производства L-метионина, в котором O-фосфо-L-гомосерин и метантиол ферментативно превращают в L-метионин и H3PO4 согласно следующей схеме реакции:
O-фосфо-L-гомосерин + CH3-SH <=> L-метионин + H3PO4
где ферментативное превращение осуществляют путем использования O-фосфо-L-гомосерин-зависимой метионинсинтазы.
В принципе, любая O-фосфо-L-гомосерин-зависимая метионинсинтаза, т.е. любой белок, обладающий способностью превращать О-фосфо-L-гомосерин и метантиол в L-метионин и H3PO4) может быть использован в способе по изобретению. Настоящее изобретение впервые описывает белки, обладающие этой способностью, и предлагает способы получения дополнительных белков, обладающих этой способностью. В частности, настоящее изобретение показывает, что, взяв за основу, растительную цистатионин-гамма-синтазу (КФ 2.5.1.48), которая в природе не обладает способностью превращать О-фосфо-L-гомосерин и метантиол в L-метионин, можно получить, в результате мутации и отбора, ее варианты, обладающие этой способностью.
О-фосфо-L-гомосерин-зависимые метионинсинтазы будут описаны ниже, в контексте белка по изобретению, и любая описанная О-фосфо-L-гомосерин-зависимая метионинсинтаза, может быть использована в способе по изобретению.
Как видно из приведенных примеров, авторы изобретения успешно создали несколько различных белков, которые демонстрируют способность превращать О-фосфо-L-гомосерин и метантиол в L-метионин и H3PO4. Последовательности этих белков показаны в SEQ ID NO: от 6 до 29. Эти белки получены, путем мутации и отбора в скрининговой системе, как описано в примерах, из растительной цистатионин гамма-синтазы (КФ 2.5.1.48), которая, в природе, не способна превращать О-фосфо-L-гомосерин и метантиол в L-метионин.
Кроме того, отталкиваясь от последовательностей, представленных в SEQ ID NO: от 6 до 29, возможно предложить дополнительные белки, обладающие активностью по превращению О-фосфо-L-гомосерина и метантиола в L-метионин и Н3РО4. То есть, например, возможно дальнейшее увеличение аффинности белков к субстрату О-фосфо-L-гомосерина и/или к субстрату метантиола, или улучшение других свойств белка, как описано ниже. Таким образом, в предпочтительном варианте осуществления способа по изобретению, ферментативного превращения О-фосфо-L-гомосерина и метантиола в L-метионин и H3PO4 достигают путем использования белка, выбранного из группы, состоящей из:
(a) белка, содержащего любую из аминокислотных последовательностей SEQ ID NO: от 6 до 29;
(b) белка, имеющего последовательность, идентичную по меньшей мере на 60% любой из SEQ ID NO: от 6 до 29, и обладающего ферментативной активностью превращения О-фосфо-L-гомосерина и метантиола в L-метионин и Н3РО4.
Ферментативная активность по превращению О-фосфо-L-гомосерина и метантиола в L-метионин и Н3РО4 может, например, быть оценена с помощью анализа, как описано в приведенных примерах. Для этой цели можно, например, использовать штамм S. cerevisiae, который имеет ауксотрофный фенотип по метионину. Примерами такого штамма являются штаммы, в которых ферменты гомосерин трансацетилаза и гомоцистеинсинтаза удалены или инактивированы. Предпочтительно, оба фермента удалены или инактивированы. Как показано на Фигуре 1, S. cerevisiae, зависит от обязательного использования О-ацетилгомосерина для синтеза гомоцистеина, который затем превращается в метионин. Фермент гомосерин трансацетилаза, ответственный за синтез О-ацетилгомосерина, кодируется геном МЕТ2. После инактивации МЕТ2, гомосерин не может больше превращаться в О-ацетилгомосерин, и весь поток гомосерина перенаправляется в сторону фосфогомосерина. Поскольку реакция, катализируемая МЕТ2, является единственным источником О-ацетилгомосерина в дрожжах, инактивация гена МЕТ2 приводит к появлению дрожжевых штаммов, имеющих строгий ауксотрофный фенотип по метионину. Тем не менее, гомоцистеин (последний предшественник метионина) может быть получен или из цистеина (через транссульфурационный путь), или из переработки S-аденозилметионина. Для того чтобы быть уверенными, что метионин не может быть синтезирован вообще, ген МЕТ6, кодирующий гомоцистеин метилтрансферазу, отвечающую за синтез метионина из гомоцистеина и метилтетрагидрофолата, также удаляют.
Таким образом, в анализе для проверки способности белка превращать О-фосфо-L-гомосерин и метантиол в L-метионин и H3PO4, может быть, предпочтительно, использован штамм S. cerevisiae, в котором гены МЕТ2 и/или МЕТ6, предпочтительно оба гена, удалены или инактивированы. Штамм с одновременно инактивированными met2Δ met6Δ (двойной мутант), не может расти в отсутствие метионина и, в частности, не может расти в присутствии метантиола в качестве источника серы. Такой штамм уже не в состоянии синтезировать О-ацетил-гомосерин, но производит О-фосфо-гомосерин. Такой штамм дрожжей затем может быть трансформирован молекулой нуклеиновой кислоты, кодирующей белок, который будет протестирован на способность превращать О-фосфо-L-гомосерин и метантиол в L-метионин и Н3РО4. Штамм выращивали в/на среде, содержащей метантиол в качестве единственного источника серы; способность расти на такой среде свидетельствует о том, что экспрессированный белок в состоянии превращать O-фосфо-L-гомосерин (OHPS) и метантиол в L-метионин; еще более предпочтительным является использование штамма, в котором ген, кодирующий треонинсинтазу, также инактивирован, например, путем делетирования или разрушения. В met2Δ met6Δ мутантных штаммах, OPHS синтезируется в реакции, катализируемой гомосерин-киназой, кодируемой геном THR1, но он не может эффективно накапливаться из-за его активного превращения в треонин с помощью треонин-синтазы, кодируемой геном THR4. Такие тройные met2Δ met6Δ thr4Δ мутантные штаммы, таким образом, позволяют детектировать очень низкую активность OPHS-зависимой метионинсинтазы, и были использованы для первого скрининга клеток с целью выделения новых белков, обладающих OPHS-зависимой метионинсинтазной активностью.
Эта ферментативная активность в дальнейшем может быть подтверждена с помощью in vitro анализа, в котором О-фосфо-L-гомосерин и метантиол инкубируют in vitro в подходящих условиях с бесклеточным экстрактом из штамма дрожжей, экспрессирующего белок, который будет протестирован, или с (частично) очищенным белком, который будет протестирован, и в котором производство метионина детектируется с помощью жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ/МС/МС) с использованием С3 метионина в качестве внутреннего контроля (Ravanel et al. Archives of Biochemistry and Biophysics 316 (1995), 572-584).
О-фосфо-L-гомосерин, используемый в таком in vitro анализе в качестве субстрата, может быть получен, например, способом, показанным на Фигуре 2 (Barclay et al., J. Chem. Soc, Chem. Com (1994) 815-816).
Как упоминалось выше, примерами белков, обладающих ферментативной активностью по превращению O-фосфо-L-гомосерина и метантиола в L-метионин и Н3РО4, являются белки, имеющие аминокислотную последовательность, в соответствии с любой из последовательностей SEQ ID NO: от 6 до 29. Таким образом, в одном предпочтительном варианте осуществления способа по изобретению используют белок, содержащий аминокислотную последовательность, в соответствии с любой из последовательностей SEQ ID NO: от 6 до 29. Тем не менее, конечно, также можно использовать варианты этих белков, то есть белки с аминокислотной последовательностью, имеющей высокую степень идентичности аминокислотной последовательности, в соответствии с любой из SEQ ID NO: от 6 до 29, и обладающие ферментативной активностью по превращению О-фосфо-L-гомосерина и метантиола в L-метионин и Н3РО4. Идентичность последовательности составляет по меньшей мере 60%, предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или, по меньшей мере 95%, и наиболее предпочтительно по меньшей мере 96%, 97%, 98% или 99% любой из последовательностей, в соответствии с SEQ ID NO: от 6 до 29. Предпочтительно, степень идентичности определяют путем сравнения соответствующей последовательности с аминокислотной последовательностью, в соответствии с любой из последовательностей SEQ ID NO: от 6 до 29. Когда сравниваемые последовательности не имеют одной и той же длины, степень идентичности, предпочтительно, относится или к проценту аминокислотных остатков в более короткой последовательности, идентичных аминокислотным остаткам в более длинной последовательности, или к проценту аминокислотных остатков в более длинной последовательности, идентичных аминокислотным остаткам в более короткой последовательности. Степень идентичности последовательностей может быть определена методами, хорошо известными в данной области техники, с использованием подходящих, предпочтительно, компьютерных алгоритмов, таких как CLUSTAL. При использовании Clustal-анализа для того, чтобы определить, является ли конкретная последовательность идентичной, например, на 80% эталонной последовательности, могут быть использованы настройки по умолчанию, или, предпочтительно, следующие настройки: Matrix: blosum 30; Open gap penalty: 10.0; Extend gap penalty: 0.05; Delay divergent: 40; Gap separation distance: 8 для сравнения аминокислотных последовательностей. Для сравнений нуклеотидных последовательностей, значение "Extend gap penalty" устанавливают предпочтительно равным 5,0.
Предпочтительно, степень идентичности рассчитывают по всей длине последовательности. Кроме того, если в контексте настоящего изобретения используют термин "гомология", этот термин, предпочтительно, означает "идентичность последовательности".
Способ по изобретению также позволяет получать другие серосодержащие соединения, являющиеся производными L-метионина. Примерами таких соединений являются S-аденозилметионин, глутатион, цистеин, S-аденозилгомоцистеин, метилтиоаденозин и 2-оксо-4-метилтиобутаноат.
Таким образом, настоящее изобретение также относится к способу получения S-аденозилметионина, который включает в себя способ получения L-метионина по изобретению, описанный выше, и, в котором L-метионин дополнительно преобразуют в S-аденозилметионин в соответствии со следующей реакцией:
Метионин + АТФ => S-аденозилметионин + РР + Ρ
Эта ферментативная реакция известна в данной области техники, и ферменты, катализирующие эту реакцию, известны в данной области техники.
Эти ферменты называются S-аденозилметионин синтазы (КФ 2.5.1.6). Примерами соответствующих ферментов являются SAM1 и SAM2 в дрожжах. Таким образом, в случае, когда такой способ осуществляется в организме, такой организм, предпочтительно, сверхэкспрессирует соответствующий фермент (ы), который (е) способен превращать L-метионин в S-аденозилметионин.
Также, может быть полезной дальнейшая модификация такого организма, чтобы предотвратить поток S-аденозилметионина в другие метаболические пути. В дрожжах, может, например, быть полезной, инактивация активности аденозин-киназы (КФ 2.7.1.20, кодируемой геном дрожжей AD01) для того, чтобы уменьшить поток S-аденозилметионина в S-аденозилгомоцистеин.
Кроме того, настоящее изобретение также относится к способу получения цистеина, который включает способ получения L-метионина по изобретению, описанный выше, и в котором L-метионин далее превращают в цистеин. Превращение L-метионина в цистеин известно из предшествующего уровня техники, и может быть достигнуто за счет средств и методов, известных специалистам в данной области. Например, L-метионин может быть сначала превращен в S-аденозилметионин, который затем превращают в S-аденозилгомоцистеин в соответствии со следующей реакцией:
S-аденозилметионин + метил-акцептор => S-аденозилгомоцистеин + метилированный акцептор
Эта реакция катализируется S-аденозилметионин-зависимой метилтрансферазой.
S-аденозилгомоцистеин может быть далее превращен в L-гомоцистеин в соответствии со следующей реакцией:
S-аденозилгомоцистеин <=> L-гомоцистеин + аденозин
Эта реакция катализируется S-аденозилгомоцистеин гидролазой, КФ 3.3.1.1. Впоследствии L-гомоцистеин может быть превращен в L-цистатионин в соответствии со следующей реакцией:
L-гомоцистеин + L-серин <=> L-цистатионин + H2O
Эта реакция катализируется цистатионин-бета-синтазой (КФ 4.2.1.22). И, наконец, L-цистатионин превращают в цистеин в соответствии со следующей реакцией:
L-цистатионин + Н2О <=> L-цистеин + NH3 + оксобутаноат
Эта реакция катализируется цистатионин-гамма-лиазой (КФ 4.4.1 0.1).
Если такой способ осуществляется в дрожжах, предпочтительно, сверхэкспрессированы следующие гены: SAM1, SAM2, SAH1, STR4 и STR1. Кроме того, ген STR2, кодирующий у дрожжей цистатионин гамма-синтазу, должен быть делетирован для того чтобы снизить обратный синтез, из цистеина в гомоцистеин. Кроме того, такие дрожжи, преимущественно, также содержат мутацию МЕТ6, ликвидирующую метилтетрагидрофолат-зависимую метионинсинтазу, а также делецию гена DUG2, который участвует в основном пути деградации глутатиона.
Кроме того, настоящее изобретение также относится к способу получения глутатиона, который включает способ получения L-метионина по изобретению, описанный выше, и в котором L-метионин дополнительно превращают в глутатион. Превращение L-метионина в глутатион известно в данной области техники и может быть осуществлено с помощью средств и методов, известных специалистам в данной области. Например, L-метионин может быть сначала превращен в S-аденозилметионин, который дополнительно превращают в цистеин, как описано выше, и полученный таким образом цистеин, дополнительно превращают в Glu-Cys (гамма-L-глутамил-L-цистеин) в соответствии со следующей реакцией:
АТФ + L-глутамат + L-цистеин <=> гамма-L-глутамил-L-цистеин + АДФ + Pi
Эта реакция катализируется глутамат-цистеинлигазой (КФ 6.3.2.2).
Полученный таким образом Glu-Cys затем превращают в глутатион в соответствии со следующей реакцией:
АТФ + гамма-L-глутамил-L-цистеин + глицин = глутатион + АДФ + Pi
Эта реакция катализируется глутатионсинтазой (КФ 6.3.2.3). Если такой способ осуществляют в дрожжах, предпочтительно, чтобы дрожжи были сконструированы так, как это описано выше в связи со способом производства цистеина, и такие дрожжи также должны сверхэкспрессировать гены GSH1 и GSH2, участвующие в превращении цистеина в глутатион. В наиболее предпочтительном варианте ген GSH1 экспрессирует устойчивый фермент по типу обратной связи.
Кроме того, настоящее изобретение также относится к способу получения 2-оксо-4-метилтиобутаноата, который включает способ получения L-метионина по изобретению, описанный выше, и в котором L-метионин дополнительно превращают в 2-оксо-4-метилтиобутаноат в соответствии со следующей реакцией:
Метионин + 2-оксо кислота => 2-оксо-4-метилтиобутаноат + L-аминокислота
Эта ферментативная реакция известна в данной области техники, и ферменты, катализирующие эту реакцию, известны в данной области техники. Эти ферменты называются метионинтрансаминазы (КФ 2.6.1.88). Примерами соответствующих ферментов являются AR08, ВАТ1, ВАТ2 в дрожжах. Таким образом, в случае, когда такой способ осуществляется в организме, такой организм, предпочтительно, сверхэкспрессирует соответствующий фермент (ы), который (ые) способен превращать L-метионин в 2-оксо-4-метилтиобутаноат.
Также может быть полезной дальнейшая модификация такого организма, чтобы предотвратить поток 2-оксо-4-метилтиобутаноата в другие метаболические пути. В дрожжах, например, может быть полезной, инактивация активности фенилпируват декарбоксилазы (КФ 4.1.1.43, кодируемой геном ARO10 в дрожжах) или активности пируватдекарбоксилазы (КФ 4.1.1.1 кодируемой генами PDC1, PDC5 и PDC6 в дрожжах) для того, чтобы уменьшить поток 2-оксо-4-метилтиобутаноата в 3-(метилтио)пропионовый альдегид.
Способ по настоящему изобретению может быть осуществлен in vitro или in vivo. Под реакцией in vitro понимают реакцию, в которой используют не клетки, а бесклеточную систему. Таким образом, термин "in vitro", преимущественно, означает в бесклеточной системе. Термин "in vitro", в одном варианте осуществления, означает в присутствии изолированного фермента. В одном варианте осуществления фермент, используемый в способе, используют в очищенном виде.
Для проведения процесса in vitro субстраты для реакции и фермента инкубируют в условиях (буфер, температура и т.д.), позволяющих ферменту быть активным, и иметь место ферментативному превращению. Реакцию проводят в течение времени, достаточного для получения L-метионина. Продукция L-метионина может быть измерена способами, известными в данной области техники.
Фермент может быть в любой подходящей форме, позволяющей ферментативной реакции иметь место. Он может быть очищенным, частично очищенным, в виде сырых клеточных экстрактов или в виде частично очищенных клеточных экстрактов. Также возможно, что фермент иммобилизован на подходящем носителе.
В другом варианте осуществления, способ по изобретению осуществляют в культуре, в присутствии организма, предпочтительно, микроорганизма, производящего белок, обладающий способностью превращать О-фосфо-L-гомосерин и метантиол в L-метионин и H3PO4. Белок представляет собой белок, описанный здесь.
Организм, используемый в таком способе, предпочтительно, представляет собой клетку-хозяина в соответствии с настоящим изобретением, как описано здесь.
Настоящее изобретение также относится к белку, обладающему способностью ферментативно превращать О-фосфо-L-гомосерин и метантиол в L-метионин. В контексте настоящего изобретения, такие ферменты называют OHPS-зависимыми метионинсинтазами. Как упоминалось выше, до настоящего времени нет никаких сведений о существовании в природе белков, обладающих способностью превращать О-фосфо-L-гомосерин и метантиол в L-метионин, и, настоящее изобретение впервые предлагает белки, позволяющие получать L-метионин в соответствии со способом по изобретению, как описано выше.
В предпочтительном варианте осуществления, белок по изобретению, способный ферментативно превращать О-фосфо-L-гомосерин и метантиол в L-метионин, получают из цистатионин-гамма-синтазы (КФ 2.5.1.48) в результате мутации. Такой мутацией может быть замена одного или нескольких аминокислотных остатков и/или удаление одного или нескольких аминокислотных остатков и/или добавление одного или нескольких аминокислотных остатков в аминокислотной последовательности цистатионин гамма-синтазы (КФ 2.5.1.48).
Цистатионин-гамма-синтазы известны и описаны в различных организмах. Например, для растений известны более чем 350 последовательностей цистатионин-гамма-синтазы, в частности, для A. thaliana, Nicotiana tabacum, Triticum aestivum, Solanum lycopersicum, Lemna paucicostata, Solanum tuberosum, Spinacia olerácea, Astragalus racemosus, Astragalus bisulcatus, Astragalus sinicus and Neptunia amplexicaulis.
Цистатионин-гамма-синтазы также известны для бактерий и грибов. Для бактерий описаны более 22,000 последовательностей; примерами последовательностей бактерий и грибов являются последовательности из Saccharomyces cerevisiae, Neurospora crassa, Salmonella erterica, Escherichia coli, Agrobacterium tumefaciens, Alcaligenes faecalis, Aneurinibacillus aneurinilyticus, Bacillus pumius, Bacillus subtilis, Corynebacterium glutamicum, Helicobacter pylori, Lysinibacillus sphaericus, Mycobacterium tuberculosis, Pectobacterium carotovorum, Pseudomonas dacunhae, Pseudomonas putida, Streptomyces phaeochromogenes.
Способы получения белков, обладающих активностью по превращению О-фосфо-L-гомосерина и метантиола в L-метионин и Н3РО4 описаны в приведенных примерах и более подробно будут описаны ниже. В принципе, любая цистатионин-гамма-синтаза (КФ 2.5.1.48) может быть использована в качестве исходного материала для получения белка, обладающего активностью по превращению O-фосфо-L-гомосерина и метантиола в L-метионин и Н3РО4. Предпочтительно, белок, обладающий активностью по превращению O-фосфо-L-гомосерина и метантиола в L-метионин и H3PO4, полученный из цистатионин-гамма-синтазы, (КФ 2.5.1.48) имеет последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, еще более предпочтительно по меньшей мере на 90%, и наиболее предпочтительно по меньшей мере на 95%, аминокислотной последовательности природной цистатионин-гамма-синтазы.
В одном предпочтительном варианте осуществления, цистатионин-гамма-синтаза (КФ 2.5.1.48), из которой происходит OHPS-зависимая метионинсинтаза, представляет собой растительную цистатионин-гамма-синтазу (КФ 2.5.1.48), предпочтительно цистатионин-гамма-синтазу (КФ 2.5.1.48) CGS1 из Arabidopsis thaliana, наиболее предпочтительно, цистатионин гамма-синтазу (КФ 2.5.1.48), имеющую аминокислотную последовательность SEQ ID NO: 1. В еще более предпочтительном варианте OHPS-зависимую метионинсинтазу, используемую в способе по изобретению, получают из последовательности SEQ ID NO: 2. Эта последовательность соответствует последовательности SEQ ID NO: 1, за исключением того, что остаток глицина в положении 84 заменен на остаток серина. Эта замена, то есть mto мутация, снимает репрессию трансляции, оказываемую S-аденозилметионином на CGS1 (Onoue et al., Journal of Biological Chemistry 286 (2011), 14903-14911). В наиболее предпочтительном варианте осуществления, OHPS-зависимую метионинсинтазу, используемую в способе по изобретению, получают из последовательности SEQ ID NO: 3. Эта последовательность соответствует последовательности SEQ ID NO: 2 за исключением того, N-концевая хлоропластная сигнальная последовательность (аминокислотные остатки от 1 до 57) была удалена, и остаток метионина добавлен на N-конце.
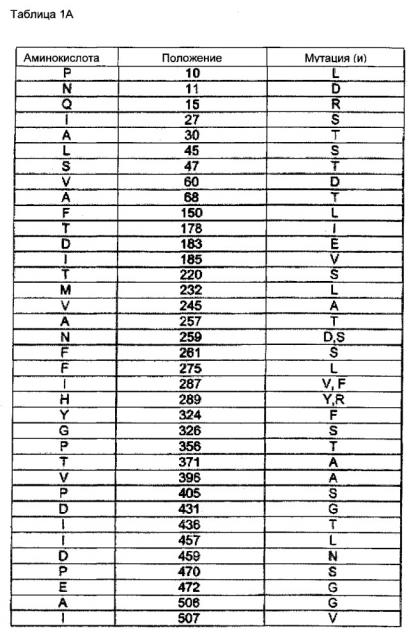
Примерами OHPS-зависимых метионинсинтаз, которые могут быть использованы в способе по настоящему изобретению, являются
(i) OHPS-зависимые метионинсинтазы, полученные из цистатионин-гамма-синтазы, имеющей аминокислотную последовательность SEQ ID NO: 3, путем замены или делеции по меньшей мере одного аминокислотного остатка в SEQ ID NO: 3, выбранного из группы, состоящей из:
(a) пролина 10;
(b) аспарагина 11;
(c) глутамина 15;
(d) изолейцина 27;
(e) аланина 30;
(f) лейцина 45;
(g) серина 47;
(h) валина 60;
(i) аланина 68;
(j) фенилаланина 150;
(k) треонина 178;
(l) аспартата 183;
(m) изолейцина 185;
(n) треонина 220;
(о) метионина 232;
(p) валина 245;
(q) аланина 257;
(r) аспарагина 259;
(s) фенилаланина 261;
(t) фенилаланина 275;
(u) изолейцина 287;
(v) гистидина 289;
(w) тирозина 324;
(х) глицина 326;
(у) пролина 356;
(2) треонина 371;
(аа) валина 396;
(bb) пролина 405;
(сс) аспартата 431;
(dd) изолейцина 436;
(ее) изолейцина 457;
(ff) аспартата 459;
(gg) пролина 470;
(hh) глутамата 472;
(ii) аланина 506;
(jj) изолейцина 507;
или
(ii) OHPS-зависимые метионинсинтазы, полученные из цистатионин-гамма-синтазы, аминокислотная последовательность которой, по меньшей мере, на 60% идентична аминокислотной последовательности SEQ ID NO: 3, путем замены или делеции по меньшей мере одной аминокислоты, соответствующей любой из перечисленных выше, от (а) до (jj), в SEQ ID NO: 3.
Предпочтительно, последовательность идентичнна по меньшей мере на 70%, еще более предпочтительно по меньшей мере на 80% и, наиболее предпочтительно по меньшей мере на 90%.
Термин "замена" означает, что аминокислоту, находящуюся в указанном положении, замещают другим аминокислотным остатком. В контексте настоящего изобретения, фраза "замещенный другим аминокислотным остатком" означает, что соответствующие аминокислотные остатки в указанном положении могут быть замещены любыми другими возможными аминокислотными остатками, предпочтительно, аминокислотными остатками, выбранными из группы, состоящей из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина. Предпочтительные замены для определенных положений указаны ниже. Аминокислотные остатки, расположенные в позиции, соответствующей позиции, выбранной из группы, включающей позиции от (а) до (jj), перечисленные выше, в аминокислотной последовательности SEQ ID NO: 3, могут быть идентифицированы специалистом способами, известными в данной области техники. Например, такие аминокислотные остатки могут быть идентифицированы путем сравнения изучаемой последовательности с последовательностью SEQ ID NO: 3, и путем идентификации позиций, соответствующих указанным выше позициям в SEQ ID NO: 3. Сравнение может быть проведено методами и способами, известными специалисту в данной области, например, с использованием такого известного компьютерного алгоритма, как алгоритм Липмана-Пирсона (Science 227 (1985), 1435) или алгоритма CLUSTAL. Предпочтительно, чтобы в таком сравнении, максимальная гомология приходилась на консервативные аминокислотные остатки, присутствующие в аминокислотных последовательностях.
При сравнении аминокислотных последовательностей таким способом, независимо от того, есть ли в аминокислотных последовательностях вставки или делеции, позиции соответствующих аминокислотных остатков могут быть определены в заданной последовательности.
По одному из вариантов осуществления, OHPS-зависимые метионинсинтазы по настоящему изобретению имеют аминокислотную последовательность, в которой
(i) аминокислотный остаток в положении 10 в аминокислотной последовательности SEQ ID NO: 3 или в положении, соответствующем этой позиции, замещен на лейцин; и/или
(ii) аминокислотный остаток в положении 11 в аминокислотной последовательности SEQ ID NO: 3 или в положении, соответствующем этой позиции, замещен на аспартат; и/или
(iii) аминокислотный остаток в положении позиции 15 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на аргинин; и/или
(iv) аминокислотный остаток в положении 27 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на серии; и/или
(v) аминокислотный остаток в положении 30 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на треонин; и/или
(vi) аминокислотный остаток в положении 45 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на серии; и/или
(vii) аминокислотный остаток в положении 47 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на треонин; и/или
(viii) аминокислотный остаток в положении 60 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на аспартат; и или
(ix) аминокислотный остаток в положении 68 в аминокислотной последовательности SEQ ID NO: 3, в положении, соответствующем этой позиции, замещен на треонин; и/или
(х) аминокислотный остаток в положении 150 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на лейцин; и/или
(xi) аминокислотный остаток в положении 178 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на изолейцин; и/или
(xii) аминокислотный остаток в положении 183 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на глутамат; и/или
(xiii) аминокислотный остаток в положении 185 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на валин; и/или
(xiv) аминокислотный остаток в положении 220 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на серии; и/или
(xv) аминокислотный остаток в положении 232 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на лейцин; и/или
(xvi) аминокислотный остаток в положении 245 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на аланин; и/или
(xvii) аминокислотный остаток в положении 257 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на треонин; и/или
(xviii) аминокислотный остаток в положении 259 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на аспартат или серии; и/или
(xiх) аминокислотный остаток в положении 261 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на серии; и/или
(xx) аминокислотный остаток в положении 275 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на лейцин; и/или
(xxi) аминокислотный остаток в положении 287 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на валин или фенилаланин; и/или
(xxii) аминокислотный остаток в положении 289 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на тирозин или аргинин; и/или
(xxiii) аминокислотный остаток в положении 324 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен фенилаланином; и/или
(xxiv) аминокислотный остаток в положении 326 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на серии; и/или
(xxv) аминокислотный остаток в положении 356 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на треонин; и/или
(xxvi) аминокислотный остаток в положении 371 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на аланин; и/или
(xxvii) аминокислотный остаток в положении 396 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на аланин; и/или
(xxviii) аминокислотный остаток в положении 405 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на серин; и/или
(xxix) аминокислотный остаток в положении 431 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на глицин; и/или
(xxx) аминокислотный остаток в положении 436 в аминокислотной последовательности SEQ ID NO: 3, или в положении, соответствующем этой позиции, замещен на треонин; и/или