Векторы для экспрессии простатоассоциированных антигенов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению вектора экспрессии, содержащего (а) нуклеотидную последовательность С68 и (б) мультиантигенную конструкцию ДНК, кодирующую иммуногенные полипептиды простатоассоциированных антигенов (РАА), что может быть использовано в медицине. Рекомбинантным путем получают вектор экспрессии С68, который используют в составе фармацевтической композиции для вызова иммунного ответа на РАА. Изобретение позволяет повысить эффективность лечения рака предстательной железы у человека. 5 н. и 19 з.п. ф-лы, 13 ил., 15 табл., 11 пр.
Реферат
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В данной заявке заявлен приоритет предварительной заявки США №61/898966, поданной 1 ноября 2013 г., включенной в данное описание посредством ссылки во всей своей полноте.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Эта заявка подается вместе с перечнем последовательностей в электронном формате. Перечень последовательностей приведен в виде файла в формате .txt с названием "PC72055A_FF_SEQ_LISTING_ST25.txt", созданного 6 октября 2014 года и имеющего размер 429 килобайт. Перечень последовательностей, содержащийся в этом .txt файле, является частью описания и включен в данное описание посредством ссылки во всей своей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к иммунотерапии и в частности к вакцинам и способам лечения или предупреждения опухолевых заболеваний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рак предстательной железы является вторым чаще всего диагностируемым раковым заболеванием и четвертой главной причиной смерти от рака у мужчин в развитых странах во всем мире. Было показано, что различные простатоассоциированные антигены (РАА), такие как простатоспецифический антиген (PSA), простатоспецифический мембранный антиген (PSMA) и антиген стволовых клеток простаты (PSCA), сверхэкспрессируются раковыми клетками предстательной железы по сравнению с нормальными аналогами. Таким образом, эти антигены представляют собой возможные мишени для вызова специфических иммунных ответов на раковые опухоли, экспрессирующие данные антигены, в результате применения иммунотерапевтического лечения вакцинами (см., например, Marrari, A., M. lero, et al. (2007). "Vaccination therapy in prostate cancer". Cancer Immunol. Immunother., 56(4): 429-45).
PSCA представляет собой состоящий из 123 аминокислот мембранный белок. Нативный полноразмерный PSCA человека состоит из аминокислоты 1 и аминокислот 4-125 в SEQ ID NO: 21 (без остатков аланина и серина во втором и третьем положении, соответственно). PSCA характеризуется высокой тканеспецифичностью и экспрессируется в более чем 85% видов рака предстательной железы, при этом уровни экспрессии повышены при более высоких индексах Глиссона и при андрогенной независимости. Он экспрессируется в 80-100% случаев костного метастаза у пациентов с раком предстательной железы.
PSA представляет собой калликреин-подобную сериновую протеазу, которая продуцируется исключительно клетками цилиндрического эпителия, выстилающими ацинусы и протоки предстательной железы. мРНК PSA транслируется в виде неактивного состоящего из 261 аминокислоты предшественника - preproPSA. PreproPSA имеет 24 дополнительных остатка, которые составляют пре-регион (сигнальный пептид) и пропептид. В результате высвобождения препропептида образуется состоящая из 237 аминокислот зрелая внеклеточная форма, которая является ферментативно активной. Полноразмерная последовательность нативного PSA человека состоит из аминокислот 4-263 с SEQ ID NO: 15. PSA является органоспецифическим антигеном и, таким образом, продуцируется эпителиальными клетками доброкачественной гиперплазированной ткани предстательной железы (ВРН), ткани первичного рака предстательной железы и ткани метастатического рака предстательной железы.
PSMA, также известный как фолатгидролаза 1 (FOLH1), состоит из 750 аминокислот. Аминокислотная последовательность полноразмерного PSMA человека приведена в SEQ ID NO: 1. PSMA включает цитоплазматический домен (аминокислоты 1-19), трансмембранный домен (аминокислоты 20-43) и внеклеточный домен (аминокислоты 44-750). Было обнаружено, что PSMA экспрессируется в раковых клетках предстательной железы с уровнями, в 1000 раз превышающими его уровни в нормальных тканях. Он в изобилии экспрессируется на новообразованных сосудах ряда других солидных опухолей, таких как рак толстой кишки, молочной железы, печени, мочевого пузыря, поджелудочной железы, легкого, почек, а также меланомы и сарком. Таким образом, PSMA рассматривается как мишень, специфичная не только для раковых клеток предстательной железы, а также как универсальная мишень раковых заболеваний (pan-carcinoma target) для других типов рака.
Несмотря на идентификацию большого числа опухолеассоциированных антигенов и то, что многие из этих антигенов исследованы в составе вакцин на основе белков или ДНК для лечения или предупреждения раковых заболеваний, большинство клинических испытаний к настоящему времени завершились неудачно с точки зрения получения терапевтического продукта. Одна из проблем при разработке вакцин против рака заключается в том, что раковые антигены обычно являются аутогенными и вследствие этого слабо иммуногенными, поскольку саморегуляция иммунной системы заключается в том, что она не распознает собственные белки. Соответственно, существует потребность в способе усиления иммуногенности или терапевтического эффекта вакцин против рака.
Изучали многочисленные подходы для усиления иммуногенности или усиления противоопухолевой эффективности вакцин против рака. Один из таких подходов включает применение различных иммуномодуляторов, таких как агонисты TLR (Toll-подобные рецепторы), агонисты TNFR (рецепторов фактора некроза опухоли), ингибиторы CTLA-4 (цитотоксический T-лимфоцитарный антиген 4) и ингибиторы протеинкиназ.
Toll-подобные рецепторы (TLR) представляют собой мембранные рецепторы типа 1, которые экспрессируются на гематопоэтических и не-гематопоэтических клетках. В семействе TLR идентифицировано по меньшей мере 11 членов. Эти рецепторы характеризуются своей способностью распознавать патогенассоциированные молекулярные паттерны (РАМР), экспрессируемые патогенными микроорганизмами. Эти рецепторы в системах врожденного иммунитета осуществляют контроль в отношении направленности последующего приобретенного иммунного ответа. Среди всех TLR интенсивно исследовали TLR9 в отношении его участия в иммунных ответах. Стимуляция рецептора TLR9 направляет антигенпрезентирующие клетки (АРС) в сторону примирования сильных T-клеточных ответов с доминированием TH1 (T-хелперов 1 типа) посредством усиления продуцирования провоспалительных цитокинов и презентирования костимулирующих молекул T-клеткам. Было обнаружено, что CpG-олигонуклеотиды, лиганды к TLR9, представляют собой класс сильнодействующих иммуностимулирующих факторов. CpG-терапия была протестирована в отношении широкого круга опухолевых моделей у мышей, и всякий раз была продемонстрирована стимуляция ингибирования или регрессии опухолей.
Цитотоксический T-лимфоцитарный антиген 4 (CTLA-4) является членом суперсемейства иммунолгобулинов и экспрессируется на поверхности T-хелперов. CTLA-4 представляет собой отрицательный регулятор зависимой от CD28 (cluster of differentiation - кластер дифференцировки) активации T-клеток и действует в качестве контрольной точки ингибирования в отношении адаптивного иммунного ответа. Аналогично костимулирующему T-клетки белку CD28, CTLA-4 связывается с CD80 и CD86 на антигенпрезентирующих клетках. CTLA-4 передает ингибирующий сигнал T-клеткам, в то время как CD28 передает стимулирующий сигнал. Человеческие антитела к CTLA-4 человека описаны в качестве иммуностимулирующих модуляторов в случае разнообразных болезненных состояний, например, для лечения или предупреждения вирусной и бактериальной инфекции и для лечения рака (WO 01/14424 и WO 00/37504). В различных доклинических исследованиях показано, что блокирование CTLA-4 моноклональными антителами усиливает иммунный ответ хозяина на иммуногенные опухоли и даже может приводить к отторжению диагностированных опухолей. Два полностью человеческих моноклональных антитела (mAb) к CTLA-4 человека, ипилимумаб (MDX-010) и тремелимумаб (также известный как СР-675206), были исследованы в клинических испытаниях в отношении лечения солидных опухолей различных типов.
Суперсемейство фактора некроза опухоли (TNF) представляет собой группу цитокинов, которые взаимодействуют со специфическими когнатными рецепторами клеточной поверхности, с суперсемейством рецепторов TNF (TNFR). Члены суперсемейства фактора некроза опухоли действуют посредством лиганд-опосредуемой тримеризации, приводящей к задействованию нескольких внутриклеточных адаптеров, с целью активации многочисленных путей передачи сигнала, таких как апоптоз, путь нуклеарного фактора-кВ (NF-kB; nuclear factor kappa В), путь c-Jun-N-концевой киназы (JNK; c-Jun N-terminal kinase), а также иммунных и воспалительных ответов. Примеры суперсемейства TNF включают лиганды CD40, лиганды ОХ40, лиганды 4-1ВВ, лиганд CD27, лиганд CD30 (CD153), TNF-альфа, TNF-бета, лиганды рецепторов-активаторов NF-kB (RANK; receptor activator of NF-kB), LT-альфа (лимфотоксин-альфа), LT-бета, GITR (лиганды индуцированных клюкокортикоидами TNFR) и LIGHT. Суперсемейство TNFR включает, например, CD40, ОХ40, 4-1ВВ, CD70 (лиганд CD27), CD30, TNFR2, RANK, LT-бета R, HVEM (медиатор проникновения вируса герпеса), GITR, TROY (член 19 суперсемейства TNFR) и RELT (рецептор, экспрессируемый в лимфоидной ткани). Среди членов семейства TNF интенсивное исследование проводили с агонистами CD40, включая различные агонистические антитела к CD40, такие как полностью человеческое агонистическое моноклональное антитело к CD40 СР870893, с точки зрения их применения в терапии.
Протеинкиназы представляют собой семейство ферментов, которые катализируют фосфорилирование специфических остатков в белках. Проводили изучение ряда ингибиторов киназ в клиническом исследовании с целью применения в противораковых терапиях, при этом использовали, например, MK0457, VX-680, ZD6474, MLN8054, AZD2171, SNS-032, PTK787/ZK222584, сорафениб (BAY43-9006), SU5416, SU6668, AMG706, зактима (ZD6474), МР-412, дазатиниб, СЕР-701 (лестауртиниб), XL647, XL999, тайкерб (лапатиниб), MLN518 (прежде известный как СТ53518), PKC412, ST1571, AMN107, АЕЕ 788, OSI-930, OSI-817, сунитиниба малат (сутент; SU11248), ваталаниб (PTK787/ZK 222584), SNS-032, SNS-314 и акситиниб (AG-013736). Гефитиниб и эрлотиниб представляют собой два вводимых перорально ингибитора тирозинкиназ (TKI; tyrosine kinase inhibitor) - рецептора эпидермального фактора роста (EGFR; epidermal growth factor receptor).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Описание настоящего изобретения относится к векторам, сконструированным из последовательностей генома аденовируса шимпанзе ChAd68, для экспрессии двух или более иммуногенных полипептидов РАА. Вектор содержит (1) последовательность ДНК С68, (2) мультиантигенную конструкцию для экспрессии двух или более иммуногенных полипептидов РАА и (3) регуляторные последовательности, которые контролируют транскрипцию и трансляцию антигенных продуктов (т.е. иммуногенных полипептидов РАА). Последовательность ДНК С68, включенную в вектор, получают из геномной последовательности С68 посредством функциональной делеции одного или более вирусных генов, но ее достаточно для образования инфекционной вирусной частицы. В конкретном воплощении последовательность ДНК С68, используемая в векторе, представляет собой весь геном С68 с функциональными делециями только в участках Е1 и Е3.
Мультиантигенная конструкция, переносимая вектором, содержит нуклеотидные последовательности, кодирующие два или более иммуногенных полипептида РАА, выбранных из иммуногенного полипептида PSMA, иммуногенного полипептида PSA и иммуногенного полипептида PSCA. В некоторых воплощениях мультиантигенная конструкция, переносимая вектором, содержит (1) нуклеотидную последовательность, кодирующую по меньшей мере один иммуногенный полипептид PSMA, (2) нуклеотидную последовательность, кодирующую по меньшей мере один иммуногенный полипептид PSA, и (3) нуклеотидную последовательность, кодирующую по меньшей мере один иммуногенный полипептид PSCA. Мультиантигенные конструкции также могут включать в себя разделяющие последовательности, которые обеспечивают экспрессию отдельных полипептидов РАА, кодируемых данной конструкцией. Примеры разделяющих последовательностей включают последовательности 2А-пептидов и IRES (участки внутренней посадки рибосомы). В некоторых воплощениях вектор содержит мультиантигенную конструкцию, имеющую следующие структуры:
(1) PSA-F2A-PSMA-mIRES-PSCA;
(2) PSA-F2A-PSMA-T2A-PSCA;
(3) PSA-T2A-PSCA-F2A-PSMA и
(4) PSCA-F2A-PSMA-mIRES-PSA.
В некоторых воплощениях нуклеотидная последовательность, кодирующая иммуногенный полипептид PSA, содержит нуклеотиды 1115-1825 из SEQ ID NO: 58 или содержит нуклеотиды 1106-1825 из SEQ ID NO: 58, нуклеотидная последовательность, кодирующая иммуногенный полипептид PSCA, содержит нуклеотиды 1892-2257 из SEQ ID NO: 58 или содержит нуклеотиды 1886-2257 из SEQ ID NO: 58, и нуклеотидная последовательность, кодирующая иммуногенный полипептид PSMA, содержит нуклеотиды 2333-4543 из SEQ ID NO: 58 или содержит нуклеотиды 2324-4543 из SEQ ID NO: 58. В некоторых конкретных воплощениях мультиантигенная конструкция содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 33, 34, 35 и 36. В конкретном воплощении мультиантигенная конструкция содержит нуклеотидную последовательность, которая кодирует полипептидную последовательность с SEQ ID NO: 60. В другом конкретном воплощении мультиантигенная конструкция содержит нуклеотидную последовательность с SEQ ID NO: 61.
Согласно описанию настоящего изобретения также предложены композиции, содержащие векторы. В некоторых воплощениях композиция представляет собой иммуногенную композицию, полезную для вызова иммунного ответа на РАА у млекопитающего, такого как мышь, собака, обезьяна или человек. В некоторых воплощениях композиция представляет собой вакцинную композицию, полезную для иммунизации млекопитающего, такого как человек, для ингибирования аномальной пролиферации клеток, для обеспечения защиты от развития ракового заболевания (для использования в качестве профилактического средства) или для лечения расстройств (для использования в качестве терапевтического средства), ассоциированных со сверхэкспрессией РАА, таких как рак, в частности, рак предстательной железы.
Настоящее изобретение также относится к способам применения векторов или композиций для вызова иммунного ответа на РАА или для лечения раковых заболеваний, таких как рак предстательной железы, у млекопитающего, в частности, человека. В некоторых воплощениях векторы или композиции, в том числе вакцинные композиции, вводят млекопитающему, в частности, человеку, в комбинации с одним или более иммунномодуляторами, которые усиливают иммуногенность или влияние векторов или композиций. В некоторых конкретных воплощениях способ включает совместное введение вакцины, предложенной согласно настоящему изобретению, в комбинации по меньшей мере с одним ингибитором супрессорных клеток иммунной системы и по меньшей мере с одним усилителем эффекторных клеток иммунной системы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1. Схематическое представление вектора PJV7563.
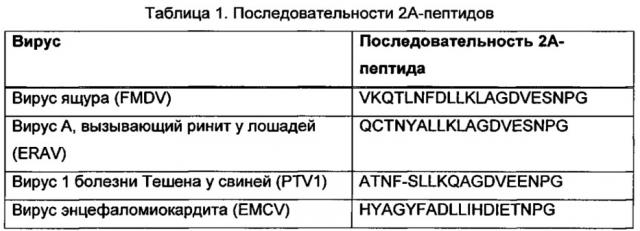
ФИГ. 2. Аминокислотное выравнивание пяти вирусных 2А-кассет. «Пропущенные» связи глицин-пролин отмечены звездочками.
ФИГ. 3. Последовательность предпочтительного IRES вируса EMCV (энцефаломиокардита). Сайт инициации трансляции отмечен звездочкой. В минимальном элементе IRES (mIRES) отсутствуют подчеркнутые первые 5 кодонов для L-белка EMCV.
ФИГ. 4. График, показывающий кривые выживаемости Каплана-Мейера для групп мышей из репрезентативного исследования, в котором оценивается влияние малата сунитиниба (сутента) и моноклонального антитела к CTLA-4 мыши (клон 9D9) на противоопухолевую эффективность вакцины против рака (вакцины) у несущих подкожные TUBO-опухоли мышей BALB/neuT.
ФИГ. 5. График, показывающий результаты анализа с использованием IFNγ-ELISPOT (метод иммуноферментных пятен) из репрезентативного исследования, в котором оценивается влияние CpG7909 и антитела к CD40 (Bioxcell, № ВЕ0016-2) на антигенспецифические T-клеточные ответы, индуцированные вакциной против рака (rHER2).
ФИГ. 6. Графики, показывающие результаты репрезентативного исследования, в котором оценивается иммуномодулирующая активность CpG7909 с точки зрения качества иммунных ответов, индуцированных вакциной против рака (путем эпидермальной доставки с помощью частиц (particle mediated epidermal delivery; PMED), с использованием анализа методом внутриклеточного окрашивания цитокинов, в котором измеряли цитокин-позитивные CD8 T-клетки (* указывает на Р меньше 0,05 согласно t-критерию Стьюдента).
ФИГ. 7. Графики, показывающие результаты репрезентативного исследования, в котором оценивается иммуномодулирующая активность CpG7909 с точки зрения качества иммунных ответов, индуцированных вакциной против рака (PMED), с использованием анализа методом внутриклеточного окрашивания цитокинов, в котором измеряли цитокин-позитивные CD4 T-клетки (ФИГ. 7) (* указывает на Р меньше 0,05 согласно t-критерию Стьюдента).
ФИГ. 8. Графики, показывающие результаты репрезентативного исследования, в котором оценивается иммуномодулирующая активность агонистического моноклонального антитела к CD40 мыши с точки зрения качества иммунных ответов, индуцированных вакциной против рака (PMED), с использованием анализа методом внутриклеточного окрашивания цитокинов, в котором измеряли цитокин-позитивные CD8 T-клетки (* указывает на Р меньше 0,05 согласно t-критерию Стьюдента).
ФИГ. 9. Графики, показывающие результаты репрезентативного исследования, в котором оценивается иммуномодулирующая активность агонистического моноклонального антитела к CD40 мыши с точки зрения качества иммунных ответов, индуцированных вакциной против рака (PMED), с использованием анализа методом внутриклеточного окрашивания цитокинов, в котором измеряли цитокин-позитивные CD4 T-клетки (* указывает на Р меньше 0,05 согласно t-критерию Стьюдента).
ФИГ. 10. График, показывающий кривые выживаемости Каплана-Мейера для групп мышей из репрезентативного исследования, в котором оценивается влияние сунитиниба малата (сутента) в низких дозах на противоопухолевую эффективность вакцины против рака у мышей BALB/neuT, несущих спонтанные опухоли молочной железы.
ФИГ. 11. График, показывающий организацию генома вектора AdC68-734.
CMV enh/pro обозначает непосредственно ранний энхансер и промотор цитомегаловируса человека; tet op обозначает тетрациклиновый оператор; Т2А обозначает 2А-пептиды вируса Thosea asigna; F2A обозначает 2А-пептиды вируса ящура; SV40 рА обозначает сигнал полиаденилирования обезьяньего вируса 40; LITR обозначает левый инвертированный концевой повтор; RITR обозначает правый инвертированный концевой повтор.
ФИГ. 12. Точечные диаграммы, демонстрирующие посредством проточной цитометрии экспрессию PSMA и PSCA на поверхности клеток А549, трансфицированных векторами AdC68, экспрессирующими тройной антиген.
ФИГ. 13. Результаты вестерн-блоттинга для лизатов клеток А549, инфицированных векторами AdC68.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. ОПРЕДЕЛЕНИЯ
Термин «адъювант» относится к веществу, которое способно усиливать, ускорять или пролонгировать иммунный ответ, вызываемый вакцинным иммуногеном.
Термин «агонист» относится к веществу, которое стимулирует (индуцирует, вызывает, усиливает или повышает) активность другой молекулы или другого рецептора. Термин «агонист» охватывает вещества, которые связываются с рецептором (например, антитело, гомолог природного лиганда из другого вида), и вещества, которые стимулируют функцию рецептора без связывания с ним (например, посредством активации ассоциированного белка).
Термин «антагонист» или «ингибитор» относится к веществу, которое частично или полностью блокирует, ингибирует или нейтрализует биологическую активность другой молекулы или другого рецептора.
Термин «совместное введение» относится к введению двух или более агентов одному и тому же субъекту в течение периода лечения. Два или более агентов могут быть включены в единую композицию и потому быть введены одновременно. Альтернативно, два или более агентов могут находиться в физически разделенных композициях и вводиться субъекту по отдельности либо последовательно, либо одновременно. Термин «введенный одновременно» или «одновременное введение» означает, что введение первого агента и введение второго агента совпадает по времени друг с другом, в то время как термин «введенный последовательно» или «последовательное введение» означает, что введение первого агента и введение второго агента не совпадает по времени друг с другом.
Термин «цитозольный» означает, что после того, как нуклеотидная последовательность, кодирующая конкретный полипептид, экспрессируется клеткой хозяина, экспрессированный полипептид остается внутри клетки хозяина.
Термин «вырожденный вариант» относится к нуклеотидной последовательности, в которой выполнены замены оснований по сравнению с референсной нуклеотидной последовательностью, но которая, вследствие вырожденности генетического кода, кодирует ту же аминокислотную последовательность, что и референсная нуклеотидная последовательность.
Термин «эффективное количество» относится к вводимому млекопитающему количеству, которого достаточно, чтобы вызвать желаемый эффект у данного млекопитающего.
Термин «фрагмент» заданного полипептида относится к полипептиду, который является более коротким по сравнению с заданным полипептидом и имеет 100% идентичности с последовательностью заданного полипептида.
Термин «идентичный» или процент «идентичности» в контексте двух или более нуклеотидных или полипептидных последовательностей относится к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или имеют конкретное процентное содержание аминокислотных остатков или нуклеотидов, являющихся одинаковыми при сравнении и выравнивании для максимального совпадения.
Термин «усилитель эффекторных клеток иммунной системы» или «усилитель IEC» относится к веществу, способному увеличивать или повышать число, качество или усиливать функцию одного или более типов иммунных эффекторных клеток млекопитающего. Примеры иммунных эффекторных клеток включают цитолитические CD8 T-клетки, CD40 T-клетки, NK-клетки и В-клетки.
Термин «иммуномодулятор» относится к веществу, способному изменять (например, ингибировать, ослаблять, повышать, усиливать или стимулировать) действие любого компонента системы врожденного, гуморального или клеточного иммунитета млекопитающего. Таким образом, термин «иммуномодулятор» охватывает термины «усилитель эффекторных клеток иммунной системы», определенный в данном описании, и «ингибитор супрессорных клеток иммунной системы», определенный в данном описании, а также вещество, которое воздействует на другие компоненты иммунной системы млекопитающего.
Термин «иммунный ответ» относится к любому детектируемому ответу на конкретное вещество (такое как антиген или иммуноген), производимому иммунной системой позвоночного животного-хозяина, включая, но не ограничиваясь этим, врожденные иммунные ответы (например, активацию каскада передачи сигнала посредством Toll-подобных рецепторов), клеточно-опосредованные иммунные ответы (например, ответы, опосредуемые T-клетками, такими как антигенспецифические T-клетки и неспецифические клетки иммунной системы) и гуморальные иммунные ответы (например, ответы, опосредуемые В-клетками, такие как образование и секреция антител в плазму крови, лимфу и/или тканевые жидкости). Примеры иммунных ответов включают изменение (например, усиление) активации Toll-подобных рецепторов, экспрессии или секреции лимфокинов (например, цитокинов (например, цитокинов типа Th1, Th2 или Th17) или хемокинов), активацию макрофагов, активацию дендритных клеток, активацию T-клеток (например, CD4+ или CD8+ T-клеток), активацию NK-клеток, активацию В-клеток (например, образование и/или секрецию антител), связывание иммуногена (например, антигена (например, иммуногенного полипептида)) с молекулой МНС (главного комплекса гистосовместимости), индуцирование ответа цитотоксических T-лимфоцитов («CTL»), индуцирование B-клеточного ответа (например, продуцирование антител), распространение (например, рост популяции клеток) клеток иммунной системы (например, T-клеток и В-клеток) и усиление процессинга и презентации антигена антигенпрезентирующими клетками. Термин «иммунный ответ» также охватывает любой детектируемый ответ на конкретное вещество (такое как антиген или иммуноген), производимый одним или более компонентами иммунной системы позвоночного животного in vitro.
Термин «иммуногенный» относится к способности вещества приводить к иммунному ответу, вызывать, стимулировать или индуцировать иммунный ответ либо улучшать, усиливать, повышать или пролонгировать уже имеющийся иммунный ответ на конкретный антиген независимо от того, связано оно или не связано с носителем, в присутствии или в отсутствие адъюванта.
Термин «иммуногенный полипептид PSA» относится к полипептиду, который является иммуногенным в отношении белка PSA человека или в отношении клеток, экспрессирующих белок PSA человека.
Термин «иммуногенный полипептид PSCA» относится к полипептиду, который является иммуногенным в отношении белка PSCA человека или в отношении клеток, экспрессирующих белок PSCA человека.
Термин «иммуногенный полипептид PSMA» относится к полипептиду, который является иммуногенным в отношении белка PSMA человека или в отношении клеток, экспрессирующих белок PSMA человека.
Термин «иммуногенный полипептид РАА» относится к «иммуногенному полипептиду PSA», «иммуногенному полипептиду PSCA» или «иммуногенному полипептиду PSMA», которые определены в данном описании выше.
Термин «ингибитор супрессорных клеток иммунной системы» или «ингибитор ISC» относится к веществу, способному снижать или подавлять количество или функцию супрессорных клеток иммунной системы млекопитающего. Примеры супрессорных клеток иммунной системы включают регуляторные T-клетки («Tper»), миелоидные супрессорные клетки и опухолеассоциированные макрофаги.
Термин «внутрикожкое введение» или «вводимый внутрикожко» в контексте введения вещества, такого как терапевтический агент или иммуномодулятор, млекопитающему, в том числе человеку, относится к доставке вещества в дермальный слой кожи млекопитающего. Кожа млекопитающего состоит из трех слоев - эпидермиса, дермы и подкожного слоя. Эпидермис представляет собой относительно тонкий жесткий наружный слой кожи. Большинство клеток в эпидермисе являются кератиноцитами. Дерма, следующий слой кожи, представляет собой толстый слой волокнистой и эластичной ткани (состоящей в основном из коллагена, эластина и фибриллина), придающий коже упругость и прочность. В дерме находятся нервные окончания, потовые железы и секретирующие кожное сало (сальные) железы, волосяные фолликулы и кровеносные сосуды. Толщина дермы варьирует в зависимости от места расположения кожи. У людей она составляет примерно 0,3 мм на веке и примерно 3,0 мм на спине. Подкожный слой состоит из жировой и соединительной ткани, в которой располагаются более крупные кровеносные сосуды и нервы. Толщина этого слоя варьирует по всему организму и от субъекта к субъекту. Термин «внутрикожкое введение» относится к доставке вещества во внутреннюю часть дермального слоя. В противоположность этому, «подкожное введение» относится к введению вещества в подкожный слой, а «местное введение» относится к нанесению вещества на поверхность кожи.
Термин «локальное введение» или «вводимый локально» охватывает термины «местное введение», «внутрикожкое введение» и «подкожное введение», каждый из которых определен в данном описании выше. Этот термин также охватывает «внутриопухолевое введение», что относится к введению вещества внутрь опухоли. Локальное введение предназначено для обеспечения высоких локальных концентраций вокруг места введения в течение периода времени, пока не будет достигнуно системное биораспределение введенного вещества, в то время как «системное введение» предназначено для всасывания введенного вещества в кровь и быстрого достижения системного воздействия путем распределения через кровеносную систему в органы или ткани по всему организму.
Термин «млекопитающее» относится к животному любого вида из класса млекопитающих. Примеры млекопитающих включают: людей; приматов, не являющихся человеком, таких как обезьяны; лабораторных животных, таких как крысы, мыши, морские свинки; домашних животных, таких как кошки, собаки, кролики, крупный рогатый скот, овцы, козы, лошади и свиньи; и содержащихся в неволе диких животных, таких как львы, тигры, слоны и тому подобное.
Термин «мембраносвязанный» означает, что после того, как нуклеотидная последовательность, кодирующая конкретный полипептид, экспрессируется клеткой хозяина, экспрессированный полипептид связывается, соединяется или иным образом взаимодействует с мембраной клетки.
Термин «опухолевое заболевание» относится к состоянию, при котором клетки пролиферируют с аномально высокой и неконтролируемой скоростью, превышающей таковую и находящейся в несогласованности с таковой в окружающих нормальных тканях. В результате этого обычно образуется твердое разрастание или уплотнение, известное как «опухоль». Этот термин охватывает опухолевые заболевания доброкачественного и злокачественного характера. Термин «опухолевое заболевание злокачественного характера», который в описании настоящего изобретения используется взаимозаменяемо с термином «рак», относится к опухолевому заболеванию, характеризующемуся способностью опухолевых клеток распространяться в другие места в организме (известной как «метастазирование»). Термин «опухолевое заболевание доброкачественного характера» относится к опухолевому заболеванию, при котором у опухолевых клеток отсутствует способность к метастазированию.
Термин «функционально связанный» относится к совместному расположению, в котором описанные таким образом компоненты находятся во взаимосвязи, позволяющей им функционировать предназначенным им способом. Контрольная последовательность, «функционально связанная» с трансгеном, соединена таким образом, что экспрессия данного трансгена осуществляется в условиях, совместимых с экспрессией контрольных последовательностей.
Термин «фармацевтически приемлемый эксципиент» относится к веществу в иммуногенной или вакцинной композиции, не являющемуся активным ингредиентом (таким как антиген, кодирующая антиген нуклеиновая кислота, иммуномодулятор или адъювант), которое совместимо с активными ингредиентами и не вызывает значительного неблагоприятного действия на субъектов, которым его вводят.
Термины «пептид», «полипептид» и «белок» используются в данном описании взаимозаменяемо и относятся к состоящей из аминокислот полимерной форме любой длины, которая может включать кодируемые и некодируемые аминокислоты, химически или биохимически модифицированные аминокислоты либо производные аминокислот и полипептиды с модифицированными полипептидными остовами.
Термин «предупреждение» или «предупреждать» относится к (а) предотвращению возникновения расстройства или (б) задержке начала возникновения расстройства или начала возникновения симптомов расстройства.
Термин «простатоассоциированный антиген» (или РАА) относится к ТАА (определенному в данном описании), который специфически экспрессируется на опухолевых клетках предстательной железы или экспрессируется с более высокой частотой или плотностью опухолевыми клетками по сравнению с неопухолевыми клетками из ткани того же типа. Примеры РАА включают PSA, PSCA и PSMA.
Термин «секретируемый» в контексте полипептида означает, что после того, как нуклеотидная последовательность, кодирующая данный полипептид, экспрессируется клеткой хозяина, экспрессированный полипептид секретируется за пределы клетки хозяина.
Термин «субоптимальная доза», когда его используют для описания количества иммуномодулятора, такого как ингибитор протеинкиназ, относится к дозе иммуномодулятора ниже минимального количества, необходимого для получения желаемого терапевтического эффекта в отношении подвергаемого лечению заболевания, если пациенту вводят только иммуномодулятор.
Термин «лечащий», «лечение» или «лечить» относится к нейтрализации расстройства, снижению тяжести расстройства либо снижению тяжести или частоты возникновения симптома расстройства.
Термин «опухолеассоциированный антиген» или «ТАА» относится к антигену, который специфически экспрессируется опухолевыми клетками или экспрессируется опухолевыми клетками с более высокой частотой или плотностью по сравнению с неопухолевыми клетками из ткани того же типа. Опухолеассоциированными антигенами могут быть антигены, в норме не экспрессируемые хозяином; они могут представлять собой мутированные, укороченные, неправильно свернутые или иные аномальные варианты молекул, обычно экспрессируемых хозяином; они могут быть идентичны обычно экспрессируемым молекулам, но экспрессироваться с аномально высокими уровнями; или они могут экспрессироваться в окружении или среде, которые являются аномальными. Опухолеассоциированными антигенами могут быть, например, белки или фрагменты белков, сложные углеводы, ганглиозиды, гаптены, нуклеиновые кислоты или любая комбинация этих или других биологических молекул.
Термин «вакцина» относится к иммуногенной композиции для введения млекопитающему для вызова иммунного ответа на конкретный антиген.
Термин «вектор» относится к молекуле нуклеиновой кислоты, способной перемещать или переносить молекулу чужеродной нуклеиновой кислоты. Молекула чужеродной нуклеиновой кислоты называется «инсерционным сегментом» или «трансгеном». Обычно вектор состоит из инсерционного сегмента и большей по длине последовательности, которая служит в качестве остова вектора. Термин «вектор» охватывает как экспрессирующие векторы, так и транскрипционные векторы. Термин «экспрессирующий вектор» относится к вектору, способному экспрессировать инсерционный сегмент в целевой клетке. Как правило, он содержит контрольные последовательности, такие как последовательности энхансера, промотора и терминатора, которые управляют экспрессией этого инсерционного сегмента. Термин «транскрипционный вектор» относится к вектору, способному транскрибироваться, но не транслироваться. Транскрипционные векторы используют для амплификации находящегося в них инсерционного сегмента. С учетом структуры или происхождения векторов, основные типы векторов включают плазмидные векторы, космидные векторы, фаговые векторы, например на основе фага лямбда, вирусные векторы, такие как аденовирусные (Ad) векторы, и искусственные хромосомы.
Б. ВЕКТОРЫ, СОДЕРЖАЩИЕ МУЛЬТИАНТИГЕННУЮ КОНСТРУКЦИЮ
Согласно одному из аспектов в описании настоящего изобретения предложен вирусный вектор, сконструированный из генома аденовируса шимпанзе ChAd68, для экспрессии двух или более иммуногенных полипептидов РАА. Аденовирус шимпанзе ChAd68 также обозначается в литературе как обезьяний аденовирус типа 25, С68, Chad68, SAdV25, PanAd9 или Pan9. Для удобства, аденовирус шимпанзе ChAd68 может быть обозначен в этом описании как «С68», и вирусный вектор, сконструированный из генома аденовируса шимпанзе ChAd68, обозначен как «вектор С68». Полноразмерная геномная последовательность С68 имеется в Genbank (номер доступа АС_000011.1) и приведена в SEQ ID NO: 57. Кроме того, полноразмерная геномная последовательность С68 и место расположения аденовирусных генов Е1а, E1b, Е2а, E2b, Е3, Е4, I1, I2, L3, L4 и L5 также приведены в патенте США 6083716.
Вектор С68, предложенный согласно описанию настоящего изобретения, содержит (1) последовательность ДНК С68 и (2) мультиантигенную конструкцию для экспрессии двух или более иммуногенных полипептидов РАА. Вектор также может содержать ненативные регуляторные последовательности, которые контролируют транскрипцию и трансляцию антигенных продуктов. Ненативными регуляторными последовательностями называют последовательности, которые не являются частью генома С68. Последовательность ДНК С68, мультиантигенная конструкция и регуляторные последовательности функционально связаны друг с другом.
Вектор С68 может быть репликационно-компетентным, условно репликационно-компетентным или репликационно-дефектным. Репликационно-компетентный вектор С68 может реплицироваться в типичных клетках хозяина, т.е. клетках, обычно поддающихся инфицированию аденовирусом. Репликационно компетентный вирусный вектор может иметь одну или более мутаций по сравнению с аденовирусом дикого типа (например, одну или более делеций, вставок и/или замен) в аденовирусном геноме, которые не ингибируют репликацию вируса в клетках хозяина. Условно реплицирующийся вектор С68 представляет собой вирусный вектор