Способ выделения фукозилированных антител
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, в частности к способу выделения антител, обладающих различными степенями фукозилирования. Способ основан на аффинности связывания антител с Fc-рецептором, иммобилизованными на подложке. Fc-рецептор согласно изобретению представляет собой FcγRIIIa(V158) с С-концевыми метками (Лизин)6 и (Гистидин)6. Настоящее изобретение позволяет повысить эффективность выделения антител, обладающих различными степенями фукозилирования. 3 н. и 19 з.п. ф-лы, 8 ил., 3 табл., 5 пр.
Реферат
Область техники
Настоящее изобретение относится к способу выделения антител, специфичных антител, имеющих различные степени фукозилирования. Способ основан на аффинности связывания антител с Fc-рецепторами. Кроме того, изобретение относится к применению Fc-рецепторов для выделения антител, имеющих различные степени фукозилирования.
Предшествующий уровень техники
IgG1 человека состоит из двух Fab (антиген связывающий фрагмент) фрагментов, включающих вариабельные участки, ответственные за распознавание антигена, и константного Fc-домена (кристаллизуемый фрагмент), взаимодействующего с компонентами иммунной системы и опосредующего функции иммунных эффекторов, такие как антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичноть (CDC). Углеводные структуры, прикрепленные к консервативному участку N-гликозилирования через аспарагин 297 (Asn297, N297) внутри домена СН2 константного участка обязательны для опосредования этих эффекторных функций (1-4).
Естественно, олигосахариды, прикрепленные к Fc-домену, представляют собой в основном двуантенарные структуры комплексного типа, варьирующие по своему составу биссекторного GlcNAc (N-ацетилглюкозамина), терминальных галактоз, фукозы кора и сиаловых кислот (Фигура 1).
Недавние исследования показали, что модификация углеводной композиции сильно влияет на антитело-опосредованные иммунные эффекторные функции (3-5). Низкий уровень галактозилирования положительно влияет на активацию комплемента, в то время как утрата фукозы кора приводит к более высокой аффинности связывания с FcγRIIIa и, таким образом, повышает ADCC (5-7). Некоторые подходы были развиты для управления профилем гликозилирования и получения терапевтических антител с улучшенными биологическими функциями (8-10).
Например, гликоинженерные антитела, полученные в клетках млекопитающих с повышенной экспрессией β(1,4)-N-ацетилглюкозаминтрансферазы (GnT) III и маннозидазы (Man) II, демонстрируют высокие пропорции биссекторных нефукозилированных олигосахаридов и запускают повышенный ADCC как результат свыше чем 50-кратно более высокой аффинности к FcγRIIIa (9). Однако углеводные модификации, вводимые за счет повышенной экспрессии GnT III, ингибирующей реакцию фукозилирования, приводят только к частично нефукозилированным антителам. Поскольку Fc-домен молекулы IgG несет два N-связанных участка гликозилирования, частичное ингибирование реакции фукозилирования может привести к различному распределению фукозы внутри пула антител. Например, препарат антитела может содержать смесь молекул, несущих один или два остатка фукозы, при этом некоторые из них полностью нефукозилированы. Очевидно, такие различные степени нефукозилирования влияют на общую аффинность к FcγRIIIa и приводят к различной биологической активности. Поэтому, подробная характеристика такого пула антител является обязательной.
Поскольку разница в аффинности к FcγRIIIa между фукозилированным и нефукозилированным IgG является более чем 50-кратной, данное взаимодействие может быть использовано для выделения различно фукозилированных видов в пуле антител и их независимой характеристики.
Существующие матрицы для аффинной хроматографии, применяемые для очистки IgG, не могут дифференцировать различные паттерны гликозилирования внутри пула IgG, поскольку иммобилизованный белок-ловушка специфично связывает белковый остов антитела. Например, белок А и белок G связываются в промежутке между доменами СН2 и СН3 Fc-участка, в то время как другие IgG-специфичные белки, такие как белок L, распознают константную часть каппа легкой цепи (11-13).
Для улучшения белков, несущих специфичные гликановые структуры, была разработана пектиновая афинная хроматография, например, при помощи лектина Aleuria aurantia (AAL), связывающего фукозосодержащие гликаны (14). Альтернативно, применяют антитела к гликану, распознающие специфичную углеводную структуру, например, антитела специфичные для антигена Lex (15). В то же время эти способы могут быть приемлемы для улучшения гликопротеинов, несущих специфичный углевод, они представляют собой ограниченное применение для улучшения гликопротеинов, утративших специфичный углевод, таких как нефукозилированные антитела. Более того, ни один из этих способов не является специфичным для антител и, таким образом, будет требовать жесткой очистки пула антител перед его нанесением на аффинную матрицу, чтобы избежать контаминации другими белками, несущими целевые гликановые структуры. Наконец, данные способы основаны на специфичных пектинах или антителах, которые могут быть сложны для получения, и не достаточно применимы в препаративных целях.
Учитывая их существенно повышенную активность в отношении индукции иммунной эффекторной функции, интересующей с точки зрения эксперимента, а также в терапевтических целях, желательно выделить частично или полностью нефукозилированные антитела из пула антител, содержащего полностью фукозилированные антитела. Настоящее изобретение предлагает простой и эффективный способ осуществления такого выделения.
Описание изобретения
Настоящее изобретение предлагает способ выделения на основе способности определенных Fc-рецепторов, таких как FcRγIIIa, распознавать фукозилированные и (частично или полностью) нефукозилированные антитела. В способе применяют иммобилизованные Fc-рецепторы для выделения различно фукозилированных антител из пула антител для аналитических, а также препаративных целей. Способ, описанный в данном документе, может быть применен аналитически для характеристики углеводной композиции пула антител. Поскольку он позволяет проводить скрининг большого числа образцов, способ может быть применен, например, для селекции хозяйских клонов клеток, продуцирующих гликоинженерные антитела с высоким содержанием нефукозилированных олигосахаридов. Препаративное применение позволяет получать популяции полностью нефукозилированных или полностью фукозилированных антител, различные FcγRIIIa-связывающие свойства и биологическая активность которых могут быть охарактеризованы.
В первом аспекте, настоящее изобретение предлагает способ выделения антител, имеющих различные степени фукозилирования, включающий этапы:
a) обеспечение популяции антител,
b) контактирование упомянутой популяции антител с Fc-рецептором, иммобилизованном на подложке,
c) элюция антител, неспецифично связанных с упомянутым Fc-рецептором, и
d) элюция антител, специфично связанных с упомянутым Fc-рецептором.
В конкретном воплощении, антитела представляют собой антитела к IgG, в частности антитела к IgG1. В некоторых воплощениях антитела содержат Fc-участок человека. В одном воплощении антитела представляют собой гликозилированные антитела. В конкретном воплощении антитела являются гликоинженерными, т.к. обладают измененной олигосахаридной структурой в их Fc-участке. В более конкретном воплощении антитела являются гликоинженерными, т.к. обладают повышенным соотношением нефукозилированных олигосахаридов в их Fc-участке по сравнению с соответствующим негликоинженерным антителом. В одном воплощении антитела продуцируют в хозяйской клетке, сконструированной для получения повышенной активности β(1,4)-N-ацетилглюкозаминилтрансферазы (GnT) III, по сравнению с несконструированной хозяйской клеткой. В более конкретном воплощении хозяйскую клетку дополнительно конструируют для получения повышенной активности α-маннозидазы II (ManII). Повышенная активность GnTIII обычно возникает в результате введения в хозяйскую клетку одного или более полинуклеотидов, кодирующих один или более полипептидов, обладающих активностью GnTIII, т.е. полипептидов, способных катализировать добавление остатка N-ацетилглюкозамина (GlcNAc) в связи β-1,4 к β-связанному маннозиду триманнозильного кора N-связанных олигосахаридов. Они включают слитые полипептиды, проявляющие сходную ферментативную активность, но не обязательно идентичную активности β(1,4)-N-ацетилглюкозаминилтрансферазы III, также известной как β-1,4-маннозил-гликопротеин 4-бета-N-ацетилглюкозаминил-трансфераза (ЕС 2.4.1.144), согласно комитету по номенклатуре международного общества биохимии и молекулярной биологии (NC-IUBMB), как оценено в конкретном биологическом исследовании, с или без зависимости от дозы. В конкретных воплощениях полипептид, обладающий активностью GnTIII, представляет собой слитый полипептид, включающий каталитический домен GnTIII и домен локализации в аппарате Гольджи гетерологичного полипептида, резидентного для аппарата Гольджи. В частности, домен локализации в аппарате Гольджи представляет собой домен маннозидазы II или GnTI, в частности домен локализации маннозидазы II. Альтернативно, домен локализации в аппарате Гольджи выбран из группы, состоящей из домена локализации маннозидазы I, домена локализации GnTII, и домена локализации α1,6-фукозилтрансферазы кора. Гликоинженерная методология, которая может быть применена для гликоинженирования антител с целью получения повышенного соотношения нефукозилированных олигосахаридов в их Fc-участке, описана в Umana et al., Nat Biotechnol 17, 176-180 (1999); Ferrara et al., Biotechn Bioeng 93, 851-861 (2006), и РСТ публикации №№ WO 99/54342, WO 2004/065540 и WO 03/011878, содержание каждого из которых включено в данный документ посредством ссылки во всей ее полноте.
В конкретных воплощениях, аффинность связывания Fc-рецептора в отношении антител зависит от степени фукозилирования антител. В конкретном воплощении аффинность связывания Fc-рецептора в отношении антител снижается пропорционально степени фукозилирования антител. В одном воплощении, в частности, где антитела представляют собой антитела к IgG, Fc-рецептор представляет Fcγ-рецептор. В конкретном воплощении, Fc-рецептор представляет собой FcγRIIIa. В более конкретном воплощении, Fc-рецептор представляет собой FcγRIIIa (V158). В некоторых воплощениях, в частности, где антитела содержат человеческий Fc-участок, Fc-рецептор является рецептором человека. В одном воплощении, Fc-рецептор представляет собой рекомбинантный Fc-рецептор (т.е. Fc-рецептор получают посредством рекомбинантной продукции).
В одном воплощении подложка, на которой иммобилизован Fc-рецептор, представляет собой полимерную матрицу. Полимерная матрица обычно присутствует в гранулированной форме. В одном воплощении полимерная матрица представляет собой поперечносшитую агарозу или ее производное. В конкретном воплощении полимерная матрица представляет собой Sepharose® (поперечно-сшитую агарозу, доступную от GE Healthcare, Уппсала, Швеция). В другом воплощении, полимерная матрица является поперечносшитым поли(стирол-дивинилбензолом). В конкретном воплощении полимерная матрица представляет собой POROS® (поперечносшитый поли(стирол-дивинилбензол), доступный от Applied Biosystems, Фостер-Сити, США. Fc-рецептор может быть иммобилизован на подложке различными способами. Специалисты в области техники смогут легко определить способ иммобилизации на основании свойств подложки. Например, иммобилизации на полимерной матрице обычно достигают посредством химической реакции белка, подлежащего иммобилизации, с функциональными группами (например, гидроксильными группами, альдегидными группами, эпоксидными группами), содержащимися в матрице. Приемлемые полимерные матрицы, а также химия связывания и протоколы хорошо известны в области техники. Иммобилизация на двух различных подложках также описана в примерах, приведенных ниже. В одном воплощении, подложка не является клеткой или клеточной мембраной. В конкретных воплощениях, способ представляет собой хроматографический способ. В одном таком воплощении, подложка заключена в хроматографическую колонку. В одном таком воплощении, контактирование популяции антител с Fc-рецептором проводят посредством пропускания популяции антител через хроматографическую колонку.
В конкретных воплощениях популяцию антител очищают. В конкретных воплощениях, популяцию антител аффинно очищают, в частности аффинно очищают при помощи белка А или белка G. Аффинная очистка, например, может быть выполнена в виде периодической очистки при помощи инкубирования популяции антител с аффинной матрицей, или в виде хроматографической очистки при помощи пропускания мобильной фазы популяции антител над аффинной матрицей стационарной фазы. В одном воплощении популяцию антител очищают при помощи аффинной хроматографии. В более конкретном воплощении, популяцию антител очищают посредством аффинной хроматографии при помощи белка А или белка G, в частности аффинной хроматографии при помощи белка А. В других воплощениях, популяцию антител очищают посредством эксклюзионной хроматографии или посредством комбинации аффинной хроматографии и эксклюзионной хроматографии.
В одном воплощении популяция антител предложена в растворе. В более конкретном воплощении популяция антител предложена в буферном растворе. В одном воплощении, буферный раствор имеет значение рН приблизительно 7,0-8,5, в частности значение рН приблизительно 8,0. В одном воплощении, буферный раствор представляет собой буферный раствор Триса. В еще одном конкретном воплощении буферный раствор представляет собой 10 мМ Трис, 50 мМ глицин, 100 мМ NaCl, рН 8 или 20 мМ Трис, 20 мМ МОПС β-(N-морфолино)пропансульфоновая кислота), 20 мМ цитрат натрия, 100 мМ NaCl, рН 8. В некоторых воплощениях контактирование популяции антител с Fc-рецептором проводят в буферном растворе. В конкретном воплощении буферный раствор является таким же, как буферный раствор, где присутствует популяция антител. В одном воплощении популяцию антител очищают посредством аффинной хроматографии при помощи белка А или белка G, и контактирование с Fc-рецептором проводят в таком же буферном растворе, в котором получают популяцию антител после аффинной хроматографии (включая нейтрализацию раствора антител после элюции из белка А). В конкретных воплощениях, нет необходимости в промежуточном этапе между очисткой и контактированием популяции антител с Fc-рецептором.
В некоторых воплощениях, способ дополнительно включает этап:
с1) промывки подложки.
В одном воплощении, упомянутая промывка включает контактирование подложки с буферным раствором, делающим возможным специфическое связывание антител с Fc-рецептором с последующим удалением упомянутого буферного раствора. В одном воплощении буферный раствор обладает значением рН приблизительно 7,0-8,5. В частности приблизительно 8. В одном воплощении буферный раствор представляет собой буферный раствор Триса. В еще одном конкретном воплощении буферный раствор представляет собой 10 мМ Трис, 50 мМ глицин, 100 мМ NaCl, рН 8 или 20 мМ Трис, 20 мМ МОПС β-(N-морфолино)пропансульфоновая кислота), 20 мМ цитрат натрия, 100 мМ NaCl, рН 8. В одном воплощении, упомянутый буферный раствор является таким же буферным раствором как тот, где присутствуют антитела. В одном воплощении такой же буферный раствор применяют для обеспечения (очищенной) популяции антител, находящихся в нем (этап а), для контактирования популяции антител с Fc-рецептором (этап Ь), для элюции антител неспецифически связанных с рецептором (этап с) и для промывки подложки (этап с1).
В конкретном воплощении способ позволяет выделять субпопуляции антител, где основная часть антител включает остатки фукозы ни в одном, в одном или в обоих из N-гликанов Fc-участка антитела. В еще одном конкретном воплощении способ делает возможным выделение антител, обладающих степенью фукозилирования по меньшей мере 90%, предпочтительно по меньшей мере 95%, антител, обладающих степенью фукозилирования не менее чем 20%, предпочтительно не менее чем 10%, и антител, обладающих степенью фукозилирования приблизительно 10%-75%, предпочтительно приблизительно 20%-60%. В одном воплощении способ приемлем для выделения субпопуляции антител, в основном состоящей из частично фукозилированных или полностью нефукозилированных антител. В одном воплощении способ приемлем для выделения субпопуляции антител, в основном состоящей из антител, включающих остатки фукозы ни в одном или в одном из двух N-гликанов Fc-участка антитела. В одном воплощении способ приемлем для выделения субпопуляции антител, в основном свободной от антител, содержащих остатки фукозы в обоих из двух N-гликанов Fc-участка антитела.
В конкретных воплощениях, способ предназначен для аналитических целей. В других воплощениях способ предназначен для препаративных целей.
В конкретных воплощениях, способ дополнительно содержит этап:
e) сбора антител, элюированных на этапе с) и/или этапе а).
В некоторых воплощениях способ дополнительно содержит этап:
f) применения собранных антител в экспериментальных или
терапевтических целях.
В одном воплощении элюированные антитела детектируют посредством УФ-измерения абсорбции при длине волны 280 нм.
В одном воплощении элюция этапа с) включает выделение антител, остающихся свободными в популяции антител после контактирования на этапе b). В случае, когда подложка заключена в хроматографической колонке и контактирование популяции антител с Fc-рецептором проводят посредством пропускания популяции антител через хроматографическую колонку, антитела, элюированные на этапе с), обнаруживают в токе сквозь хроматографическую колонку. В одном воплощении, антитела, элюированные на этапе с) представляют собой полностью фукозилированные антитела. В более конкретном воплощении антитела, элюированные на этапе с), обладают степенью фукозилирования по меньшей мере 90%, предпочтительно по меньшей мере 95%. В одном воплощении большинство антител, элюированных на этапе с) включают остатки фукозы в каждом из двух N-гликанов Fc-участка антитела.
В конкретных воплощениях, элюция этапа d) включает контактирование подложки с буферным раствором, который препятствует связыванию антител с Fc-рецептором. В одном таком воплощении буферный раствор имеет значение рН в диапазоне от приблизительно 3 до приблизительно 5. Предпочтительно в диапазоне от приблизительно 4 до приблизительно 5. В одном воплощении буферный раствор представляет собой буферный раствор Трис. В одном воплощении антитела, элюированные на этапе d), представляют собой частично фукозилированные и/или полностью нефукозилированные антитела. В более конкретном воплощении антитела, элюированные на этапе d), обладают степенью фукозилирования менее чем 90%, предпочтительно менее чем 75%, наиболее предпочтительно менее чем 60%. В одном воплощении большинство антител, элюированных на этапе d), включают остатки фукозы или в одном или ни в одном из двух N-гликанов Fc-участка антитела.
В конкретном воплощении элюцию этапа d) проводят при различных значениях рН. В одном воплощении значения рН представляют собой диапазон от приблизительно 3 до приблизительно 5, предпочтительно в диапазоне от приблизительно 4 до приблизительно 5. В конкретном воплощении значения рН включают 4,6 и 4,2. В другом конкретном воплощении элюция этапа d) делает возможным выделение частично фукозилированных антител и полностью нефукозилированных антител. В более конкретном воплощении элюция этапа d) делает возможным выделение антител, обладающих степенью фукозилирования менее чем 20%, предпочтительно менее чем 10%, и антител, обладающих степенью фукозилирования приблизительно 10%-75%, предпочтительно приблизительно 20%-60%. В еще одном конкретном воплощении, элюция этапа d) делает возможным выделение субпопуляции антител, где либо большинство антител включают остатки фукозы в одном из двух N-гликанов Fc-участка антитела, либо большинство антител включают остатки фукозы ни в одном из двух N-гликанов Fc-участка антитела. В некоторых воплощениях элюцию этапа d) проводят посредством последовательного контактирования подложки с рядом буферных растворов, препятствующих связыванию антител, обладающих различными степенями фукозилирования, с Fc-рецептором. В данном конкретном воплощении буферные растворы обладают различными значениями рН. В одном воплощении, значения рН представляют собой диапазон от приблизительно 3 до приблизительно 5, предпочтительно в диапазоне от приблизительно 4 до приблизительно 5. В конкретном воплощении значения рН включают 4,6 и 4,2. В одном воплощении буферные растворы представляют собой буферные растворы Триса. В более конкретном воплощении буферные растворы представляют собой 10 мМ Трис, 50 мМ глицин, 100 мМ NaCl или 20 мМ Трис, 20 мМ МОПС β-(N-морфолино)пропансульфоновая кислота), 20 мМ цитарат натрия, 100 мМ NaCl, с различными значениями рН.
В дополнительном аспекте изобретение охватывает применение Fc-рецептора в способе выделения антител, обладающих различными степенями фукозилирования. В одном аспекте, изобретение предлагает применение Fc-рецептора в способе по изобретению, как описано в данном документе. В одном воплощении, Fc-рецептор представляет собой Fcγ-рецептор. В конкретном воплощении Fc-рецептор представляет собой FcγRIIIa. В более конкретном воплощении Fc-рецептор представляет собой FcγRIIIa (V158). В одном воплощении Fc-рецептор является человеческим. В дополнительном воплощении Fc-рецептор представляет собой рекомбинантный Fc-рецептор. В конкретном воплощении Fc-рецептор иммобилизован на подложке. Подложка может включать любое из свойств, одно или в комбинации, описанных в предыдущих параграфах в отношении подложки, примененной в способе по изобретению.
В еще одном аспекте изобретения предложен Fc-рецептор, иммобилизованный на подложке для применения в способе выделения антител, обладающих различными степенями фукозилирования, таком как способ по изобретению. В одном воплощении Fc-рецептор представляет собой Fcγ-рецептор. В конкретном воплощении Fc-рецептор представляет собой FcγRIIIa. В более конкретном воплощении Fc-рецептор представляет собой FcγRIIIa (V158). В одном воплощении Fc-рецептор является человеческим. В дополнительном воплощении Fc-рецептор представляет собой рекомбинантный Fc-рецептор. Подложка может включать любое из свойств, одно или в сочетании, описанное в предыдущих параграфах в отношении подложки, применяемой в способе по изобретению.
Термины, применяемые в данном документе, обычно представляют собой таковые, применяемые в области техники, если не определено иное ниже.
Термин "антитело" в данном документе применяют в широком смысле и он охватывает различные структуры антител, включая но не ограничено моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), и фрагменты антител, при условии, что они включают Fc-участок или участок, эквивалентный Fc-участку иммуноглобулина. Термин также охватывает белки слияния, включающие Fc-участок или участок, эквивалентный Fc-участку иммуноглобулина.
Термин "иммуноглобулин" относится к белку, обладающему структурой природного антитела. Например, иммуноглобулины класса IgG представляют собой гетеротетрамерные гликопротеины массой приблизительно 150000 дальтон, состоящие из двух легких цепей и двух тяжелых цепей, являющихся дисульфидносвязанными. От N- до С-конца каждая тяжелая цепь обладает вариабельным участком (VH), также называемым вариабельным тяжелым доменом (HR) и тремя константными доменами (СН1, СН2 и СН3), также называемыми константными участками тяжелых цепей. В случае иммуноглобулина класса IgE тяжелая цепь дополнительно включает домен СН4. Следовательно, тяжелая цепь иммуноглобулина представляет собой полипептид, состоящий в направлении от N-конца к С-концу из следующих доменов: VH-CH1-HR-CH2-CH3-(CH4). Аналогично, от N- до С-конца, каждая легкая цепь обладает вариабельным участком (VL), также называемым вариабельным легким доменом, или вариабельным доменом легкой цепи, за которым следует константный легкий (CL) домен, также называемый константным участком легкой цепи. Следовательно, легкая цепь иммуноглобулина представляет собой полипептид, состоящий в направлении от N-конца к С-концу из следующих доменов: VL-CL. Тяжелая цепь иммуноглобулина может быть отнесена к одному из пяти типов, называемых α (IgA), δ (IgD), ε (IgE), γ (IqG) или μ (IgM), некоторые из них дополнительно могут быть разделены на подтипы, например, γ1 (IgG1), γ2 (IgG2), γ3 (IgG3), γ4 (IgG4), α1 (IgA1) и α2 (IgA2). Легкая цепь иммуноглобулина может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотной последовательности их константного домена. Иммуноглобулин фактически состоит из двух Fab-фрагментов и Fc-участка, связанного через шарнирную область иммуноглобулина.
"Класс" антитела или иммуноглобулина относится к типу константного домена или константному участку его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам антител, называют α, δ, ε, γ и μ, соответственно.
Термин "Fc-участок" или "Fc-домен" в данном документе применяют для определения С-терминального участка тяжелой цепи иммуноглобулина, которая включает по меньшей мере часть константного участка. Термин включает естественную последовательность Fc-участков и различных Fc-участков. Хотя, граница Fc-участка тяжелой цепи IgG может несколько варьировать, Fc-участок тяжелой цепи IgG человека обычно определяют как продолжающийся от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако, С-терминальный лизин (Lys447) Fc-участка может присутствовать или нет. Если не указано иное, в данном документе, нумерация аминокислотных остатков в Fc-участке или константном участке соответствует системе нумерации ЕС, также называемой индекс ЕС, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
"Участок, эквивалентный Fc-участку иммуноглобулина" предназначен для включения природных вариантов Fc-участка иммуноглобулина, а также вариантов, обладающих изменениями, продуцирующими замены, добавления или делеции, которые не увеличивают существенно способность иммуноглобулина опосредовать эффекторные функции (такие как антитело-зависимую клеточно-опосредованную цитотоксичность). Например, одна или более аминокислоты могут быть удалены с N-конца или С-конца Fc-участка иммуноглобулина без существенного снижения биологической функции. Такие варианты могут быть отобраны согласно общими правилам известным в области техники, так чтобы оказать минимальное влияние на их активность (см, например, Bowie et al., Science 247, 1306-10 (1990)).
Термин "фукозилирование" относится к присутствию остатков фукозы внутри олигосахаридов, прикрепленных к пептидному остову антитела. В частности, фукозилированное антитело включает α(1,6)-связанную фукозу глубоко внутри остатка N-ацетилглюкозамина (GlcNAc) в одном или обоих N-связанных олигосахаридах, прикрепленных к Fc-участку антитела, например, в позиции Asn297 Fc-домена IgG1 человека (система нумерации ЕС). Asn297 также может быль локализован приблизительно на ±3 аминокислоты выше или ниже позиции 297, т.е. между позициями 294 и 300, из-за незначительных вариаций последовательности иммуноглобулинов.
Степень "фукозилирования" представляет собой процентное соотношение фукозилированных олигосахаридов ко всем олигосахаридам, идентифицированным в образце антитела. Обработанном N-гликозидазой F посредством MALDI TOF масс-спектрометрии. В образце "полностью фукозилированного антитела" преимущественно все олигосахариды включают остатки фукозы, т.е. являются фукозилированными. В одном воплощении полностью фукозилированное антитело обладает степенью фукозилирования по меньшей мере 90%. Соответственно, отдельное антитело в таком образце обычно включает остатки фукозы в каждом из двух N-связанных олигосахаридов в Fc-участке. Напротив, в образце "полностью нефукозилированного антитела" преимущественно все олигосахариды являются не фукозилированными, и отдельное антитело в таком образце не включает остатки фукозы ни в одном из двух N-связанных олигосахаридов в Fc-участке. В одном воплощении, полностью нефукозилированное антитело обладает степенью фукозилирования менее 10%. В образце "частично фукозилированного антитела" только часть олигосахаридов включает фукозу. Отдельное антитело в таком образце может не включать или включать остатки фукозы в одном или обоих N-связанных олигосахаридах в Fc-участке, при условии, что или по существу все отдельные антитела образца не включают остатки фукозы в каком-либо из N-связанных олигосахаридов в Fc-участке, или по существу все отдельные антитела образца содержат остатки фукозы в обоих N-связанных олигосахаридах в Fc-участке. В одном воплощении частично фукозилированное антитело обладает степенью фукозилирования приблизительно от 10 до 75%.
Как употреблено в данном документе термины "гликоинженерное, гликоинженированное, гликоинжиниринг" относятся к любой манипуляции с пептидным остовом или пострансляционным модификациям природного или рекомбинантного полипептида или его фрагмента, которые изменяют паттерн гликозилирования полипептида. Гликоинжиниринг включает модификации в аминокислотной последовательности группы боковой цепи отдельных аминокислот или олигосахаридных структур, а также комбинации этих подходов. Гликоинжиниринг также включает метаболическое инженирование системы гликозилирования клетки, включая генетические манипуляции путей синтеза олигосахаридов для достижения измененного гликозилирования гликопротеинов, экспрессированных в клетке. Кроме того, гликоинжиниринг включает эффекты мутаций и клеточной среды на гликозилирование. В одном воплощении гликоинженерное антитело является результатом изменения активности гликозилтрансферазы в клетке хозяине, продуцирующей упомянутое антитело. Гликозилтрансферазы, например, включают β(1,4)-N-ацетилглюкозаминилтрансферазу III (GnTIII), β(1,4)-галактозилтрансферазу (GaIT), β(1,2)-N-ацетилглюкозаминилтрансферазу I (GnTI), β(1,2)-N-ацетилглюкозаминилтрансферазу II (GnTII) и α(1,6)-фукозилтрансферазу. В отдельном воплощении гликоинженерное антитело является результатом измененной активности глюкозаминилтрансферазы и/или фукозилтрансферазы в клетке-хозяине, продуцирующей упомянутое антитело. Антитело с повышенным соотношением нефукозилированных олигосахаридов в его Fc-участке может быть получено, например, посредством продукции антитела в клетке-хозяине, обладающей повышенной активностью β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), возможно дополнительно обладающей повышенной активностью маннозидазы II (ManII), или в клетке-хозяине, обладающей пониженной активностью α(1,6)фукозилтрансферазы.
"FcγRIIIa (V158)" относится к изоформе FcγRIIIa (также известного как CD16a; см. Uni Prot No. P08637, NCBI accession no. NP_000560 для белка человека), имеющей остаток валина (V) в позиции аминокислоты 158. Было показано, что IgG, связываемый FcγRIIIa (V158) лучше связывается FcγRIIIa (F158) (17).
"Специфично связывается" означает, что связывание является селективным для Fc-рецептора и может быть дифференцировано от нежелательного или неспецифического взаимодействия. Способность антитела связываться с Fc-рецептором может быть измерена или при помощи твердофазного иммуноферментного анализа (ELISA) или при помощи других техник, известных специалистам в области техники, например, резонанса поверхностных плазмонов (SPR), как описано в данном документе.
"Аффинность связывания" относится к силе суммарных нековалентных взаимодействий между единственным сайтом связывания молекулы (например, рецептора) и его партнером по связыванию (например, лиганда). Если не указано иное, как употреблено в данном документе, "аффинность связывания" относится к истинной аффинности связывания, которая отражает 1:1 взаимодействие между членами пары связывания (например, рецептор и его лиганд). Аффинность молекулы Х для ее партнера Y обычно может быть представлена посредством константы диссоциации (KD), представляющей собой соотношение констант скорости диссоциации и ассоциации (koff и kon, соответственно). Таким образом, эквивалентые аффинности могут содержать различные константы скорости, при условии, что соотношение констант скорости остается тем же. Аффинность может быть измерена посредством способов, хорошо известных в области техники, включая таковые описанные в данном документе. Конкретный способ измерения аффинности представляет собой резонанс поверхностных плазмонов (SPR).
Термин "очищенный" при употреблении в связи с популяцией антител означает, что популяция антител является преимущественно свободной от посторонних белков, не являющихся антителами. Различные способы очистки известны в области техники, включая высокоэффективную жидкостную хроматографию, ионообменную хроматографию, гель-электрофорез, аффинную хроматографию, эксклюзионную хроматографию и т.п. "Аффинно очищенная" популяция антител относится к популяции антител, очищенных при помощи аффинной матрицы, с которой антитела, но не посторонние не являющиеся антителами белки, специфично связываются, например, аффинной матрицы, содержащей белок А и белок G.
Термин "буферный раствор" как употреблено в данном документе относится к раствору, обладающему определенным значением рН, обычно содержащему буферное вещество, стабилизирующее рН раствора. Буферные вещества хорошо известны в области техники и включают, например, цитратные соли, ацетатные соли, соли гистидина, сукцинаты, малаты, фосфатные соли, лактаты или трис(гидроксиметил)амино-метан (Трис).
"Большинство" как употреблено в данном документе означает более чем 50%, предпочтительно более чем 60%, наиболее предпочтительно более чем 70% от общего.
Краткое описание графических материалов
Фигура 1: N-связанные олигосахариды, прикрепленные к Asn297 Fc-домену IgG1 человека. Сахара жирным шрифтом определяют пентасахаридный кор, добавление других сахарных остатков является вариабельным. GlcNAc: N-ацетилглюкозамин; Fuc: фукоза; Man: манноза; Gal: галактоза; NeuAc: N-ацетилнейраминовая кислота.
Фигура 2. Очистка растворимого FcγRIIIa (V158) человека. А) Хроматограмма аффинной хроматографии с применением иммобилизованных металлов (IMAC). Сплошная линия: А280нм; пунктирная линия: градиент. В) Хроматограмма эксклюзионной хроматографии (SEC). Сплошная линия: А280нм. С) SDS PAGE, окрашенный Кумасси. Линия 1: маркер молекулярного веса [кДа]; линия 2: редуцированный FcγRIIIa (V158). D) аналитическая SEC Хроматограмма (A280nm). Инъецировали 50 мкг образца.
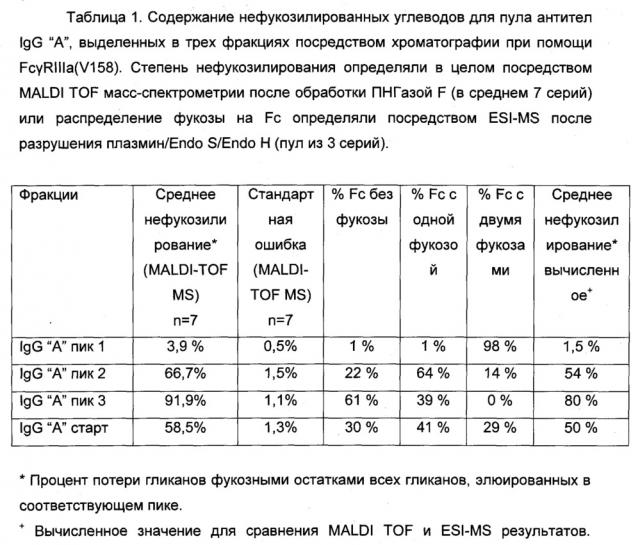
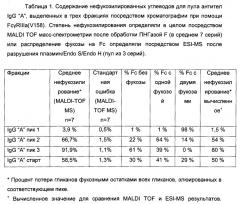
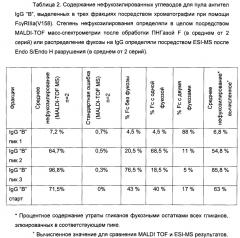
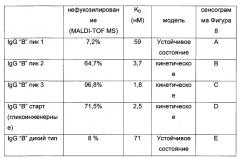
Фигура 3. Аналитическая хроматография FcγRIIIa (V158). Хроматограмма (А280нм) для 10 мкг А) гликоинженерный IgG "А"; В) дикий тип IgG "А"; С) гликоинженерный IgG "В"; D) дикий тип IgG "В". Пик, соответствующий фракции антитела с высоким содержанием нефукозилированных гликанов ("пик связывания") отмечен черным квадратом. Область "пика связывания" представляет собой следующее: А) 66% общей площади пика (48% нефукозилирования как определено посредством MALDI TOF масс-спектрометрии); В) 26% общей площади пика (10% нефукозилирования посредством MALDI TOF масс-спектрометрии); С) 75% общей площади пика (75% нефукозилирование посредством MALDI TOF масс-спектрометрии); D) 31% общей области пика (9% нефукозилирование посредством MALDI TOF масс-спектрометрии).
Фигура 4. Оценка аналитической хроматографии FcγRIIIa (V158). Процентное отношение области "пика связывания" хроматографической колонки FcgRIIIa (V158) общей площади пика, с учетом процентного отношения нефукозилирования, как определено посредством MALDI TOF масс-спектрометрии. А) Смеси гликоинженерного и дикого типа IgG "А" (0-100% гликоинженерного IgG). В) Смеси гликоинженерного и дикого типа IgG "В" (0-100% гликоинженерного IgG).
Фигура 5. Сравнение хроматографии белка А с последующей MALDI TOF масс-спектрометрией и хроматографии белка А с последующей хроматографией FcγRIIIa (V158) в качестве двух различных способов анализа степени фукозилирования антител, очищенных из супернатанта клеточной культуры (гликоинженерный IgG "С"). Процентное отношение области "пика связывания" хроматографической колонки FcγRIIIa (V158) общей области пика с учетом процентного отношения нефукозилирования, как определено при помощи MALDI TOF масс-спектрометрии.
Фигура 6. Препаративная хроматография FcγRIIIa (V158). Хроматограмма гликоинженерных IgG "А". IgG "А" элюируют в трех пиках: пик 1 представляет собой ток через колонку, пик 2 и 3 элюируют при помощи двух различных этапов рН. Обозначены пулы для пика 1, 2 и 3. Сплошная линия: А280нм; пунктирная линия: градиент; пу