Вакцина оспенная инактивированная эмбриональная сухая таблетированная для орального применения "тэовин" и способ ее получения
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к биотехнологии, и может быть использовано для получения вакцины оспенной сухой таблетированной для орального применения. Вакцина оспенная эмбриональная инактивированная содержит в одной таблетке биомассу вируса вакцины, штамм Б-51, а также вспомогательные компоненты-наполнители. При этом таблетка в своем составе содержит инактивированную 96% по объему этиловым спиртом биомассу вируса вакцины, штамм Б-51, выращенного на хорион-аллантоисных оболочках 12-13 суточных куриных эмбрионах при следующем содержании указанных компонентов, процент по массе: инактивированная биомасса вируса вакцины, штамм Б-51 - 81,8; аэросил марки АМ-1-300 - 6,0; сахароза - 10,0; кальция стеарат - 2,0; ванилин - 0,2. Использование данного изобретения позволяет проводить профилактику заболеваний человека, вызываемых возбудителями группы ортопоксвирусов и в первую очередь возбудителями натуральной оспы и оспы животных, патогенных для человека, в частности, применение гетерологичного штамма Б-51 усиливает антигенность вируса и приводит к увеличению иммуногенности вакцины. 3 табл.
Реферат
Изобретение относится к области биотехнологии, иммунологии и вирусологии, в частности к разработке и конструированию медицинских иммунобиологических препаратов для активной профилактики заболеваний человека, вызываемых возбудителями натуральной оспы и ортопоксвирусами, патогенными для человека.
Изобретение может быть использовано для создания грундиммунитета на первом этапе в двухэтапном методе вакцинации людей против натуральной оспы и оспы животных, патогенных для человека.
В 1980 г., учитывая ликвидацию натуральной оспы в мире, а также возникновение при вакцинации живыми вакцинами тяжелых поствакцинальных осложнений с летальными исходами, ВОЗ рекомендовано отменить вакцинацию против натуральной оспы.
Использование живой вакцины в настоящее время недопустимо из-за высокой вероятности поствакцинальных реакций и осложнений. В связи с этим особенно актуальна разработка безвредных и эффективных вакцин и методов их введения, к которым относятся инактивированные.
Известна вакцина оспенная живая сухая, лиофилизат для приготовления раствора для накожного применения (прототип), производитель: филиал ФГУП «НПО «Микроген» Минздрава России в г. Томске. Выпускается в ампулах по 0,1 мл или 0,2 мл (10 или 20 доз соответственно). Срок годности: вакцины - 2 года, растворителя - 3 года.
Недостатками вакцины являются поствакцинальные реакции сильной степени тяжести и вероятность возникновения осложнений. В связи с этим данную вакцину можно использовать только в двухэтапном методе вакцинации при наличии грундиммунитета или в условиях ревакцинации. Субстратом накопления вируса является кожа теленка, что усложняет технологию производства данного препарата в соответствии с правилами GMP (производство осуществляется в критических асептических зонах, относящихся к классу А/В (1, 2)). Еще одним недостатком препарата является скарификационный метод введения, что обеспечивает возможность проведения иммунизации на уровне 10-50 человек в час, против 728 - при оральном методе введения. Технология производства данного препарата из детрита кожи теленка является сложной, продолжительной по времени, а как следствие, дорогостоящей.
Известна вакцина оспенная эмбриональная живая таблетированная (ТЭОВак) [патент (19) RU (11) 2290949 (13) С1 (24) 13.05.2005] (прототип). Изобретение относится к получению оспенной эмбриональной живой таблетированной вакцины. Сущность изобретения заключается в выращивания вируса вакцины на хорион-аллантоисных оболочках (ХАО) 12-13-суточных куриных эмбрионах (КЭ), лиофильном высушивании с 15% лактозы, измельчении, смешивании с наполнителем и таблетированием с получением препарата, содержащего сухой вируссодержащий материал до 30% и наполнитель, состоящий из компонентов: лактозы - 87,8%, сахарозы - 10%, стеарата кальция - 2,0%, ванилина - 0,2%.
Преимущество изобретения заключается в получении таблетированной формы вакцинного препарата против патогенных для человека ортопоксвирусов. Таблетированная форма живой оспенной вакцины предназначена для массовой иммунизации людей. Недостатком вакцины является применение ее только в условиях ревакцинации людей в связи с возможностью развития поствакцинальных реакций и осложнений, характерных для живых вакцин.
Известна вакцина оспенная инактивированная сухая «ОспаВир» [(19) RU (11) 2259214 (13) С1 (21), (22) 2004102571/13, 28.01.2004, (51) МПК7 A61K 39/285, A61K 39/275, A61K 39/12, (73) Федеральное государственное унитарное предприятие "Научно-производственное объединение по медицинским иммунобиологическим препаратам «Микроген» Министерства здравоохранения Российской Федерации (RU)] (прототип).
Производство вакцины «ОспаВир» по сравнению с заявленной вакциной «ТЭОВин» включает ряд трудоемких, продолжительных по времени технологических стадий: выращивание вируса на коже теленка в асептических условиях, необходимость в очистке вируссодержащего материала от посторонней микрофлоры. Продолжительность стадии инактивации гамма-излучением Со60 составляет не менее 18 часов.
Вакцина «ОспаВир» также рекомендована для использования в двухэтапном методе вакцинации. Производство вакцины «ОспаВир» в отличие от заявленной «ТЭОВин» является сложным, дорогостоящим и продолжительным по времени.
Целью настоящего изобретения является разработка безвредного, эффективного, с простой технологией производства и, как следствие, более дешевого, инактивированного вакцинного препарата в таблетированной форме для двухэтапного метода вакцинации против натуральной оспы и ортопоксвирусов, патогенных для человека.
Сущность настоящего изобретения состоит в разработке инактивированной эмбриональной сухой таблетированной для орального применения вакцины «ТЭОВин», которая обеспечит создание грундиммунитета для последующего введения живой вакцины. Введение инактивированной вакцины перед введением живой исключает риск возникновения поствакцинальных реакций и осложнений, что делает двухэтапный метод вакцинации безвредным и эффективным. Таблетированная форма вакцины «ТЭОВин» позволяет ускорить проведение вакцинной кампании и делает вакцинацию для населения более привлекательной.
Технический результат заявленного изобретения заключается в реализации следующих параметров:
- в применении гетерологичного штамма Б-51, в отличие от гомологичного Л-ИВП, что усиливает антигенность вируса и приводит к увеличению иммуногенности вакцины;
- основным действующим началом вакцины «ТЭОВин» является сухая инскапсулированная фосфатно-кальциевым гелем и инактивированная 96% этиловым спиртом биомасса вируса вакцины;
- форма выпуска препарата «ТЭОВин» - таблетки жевательные, обеспечивает массовую вакцинацию, не требует дополнительных материалов в потребительской упаковке (например, стерильный растворитель и ампульный нож для «ОспаВир»);
- одна таблетка вакцины «ТЭОВин» содержит одну иммунизирующую дозу вакцины;
- вакцина «ТЭОВин» предусматривает оральный метод введению без соблюдения правил асептики и специально обученного медперсонала.
Указанный технический результат достигается за счет того, что вакцинный препарат «ТЭОВин» содержит инактивированную 96% этиловым спиртом и инкапсулированную фосфатно-кальциевым гелем биомассу вируса вакцины, штамм Б-51, выращенную на хорион-аллантоисных оболочках 12-13 суточных куриных эмбрионов.
Для улучшения всасывания инактивированного вируса в ротовой полости человека в состав таблетки введен аэросил марки AM-1-300. Для улучшения органолептических свойств в препарат введена сахароза и ванилин. Для прессования сухой биомассы в таблетку вводят стеарат кальция.
В таблетированной форме вакцинного препарата, в таблетке массой 0,25 г, заявленные компоненты находятся в следующем соотношении, процент по массе:
| инактивированная биомасса вируса вакцины, штамм Б-51 | 81,8 |
| аэросил марки AM-1-300 | 6,0 |
| сахароза | 10,0 |
| кальция стеарат | 2,0 |
| ванилин | 0,2 |
Вакцина «ТЭОВин» предназначена для двухэтапного метода вакцинации взрослого населения против натуральной оспы и ортопоксвирусов, патогенных для человека, по эпидемическим показаниям и планового оспопрививания для лиц, работающих с патогенными для человека ортопоксвирусами.
Одна таблетка вируса вакцины представляет собой одну иммунизирующую дозу.
Новизна предлагаемого изобретения заключается в том, что в настоящее время не известно применение инактивированной 96% этиловым спиртом эмбриональной оспенной вакцины в таблетированной форме для орального применения. Заявленный вакцинный препарат может быть использован в двухэтапном методе вакцинации в качестве более безвредного, эффективного и технологичного в настоящее время средства профилактики особо опасных инфекционных заболеваний натуральной оспы и оспы животных, патогенных для человека.
Изобретательский уровень заключается в том, что из уровня техники явным образом следует предложенное техническое решение, которое обеспечивает получение безопасного, эффективного и технологичного вакцинного препарата «ТЭОВин» для нужд населения и воинских контингентов Российской Федерации.
Промышленная применимость заключается в возможности использования для получения заявленного вакцинного препарата «ТЭОВин» типового биотехнологического оборудования и доступных в микробиологической и фармацевтической промышленности РФ материалов.
Предложенное техническое решение может быть использовано для получения безвредного вакцинного препарата для экстренной профилактики особо опасных инфекционных заболеваний, таких как натуральная оспа и оспа животных, патогенных для человека.
Пример выполнения
Способ получения инактивированной оральной вакцины «ТЭОВин» включает следующие технологические стадии:
- культивирование вируса вакцины, штамм Б-51, на ХАО 12-13 суточных КЭ;
- отбор ХАО куриных эмбрионов и их гомогенизация;
- внесение стабилизирующих компонентов в вируссодержащую суспензию;
- сублимационное высушивание стабилизированной вируссодержащей суспензии;
- инактивация биомассы вируса 96% спиртом этиловым в сухом полуфабрикате вакцины;
- отгонка инактиванта;
- гранулирование таблеточной массы и таблетирование препарата.
Препарат «ТЭОВин» готовили на основе вируса вакцины, штамм Б-51. В качестве субстрата накопления использовали ХАО 12-13 суточных КЭ. Концентрация вируса вакцины в вируссодержащей суспензии составляет не менее 1,0⋅108 ООЕ⋅мл-1. После высушивания вируссодержащей суспензии проводили инактивацию биомассы. В качестве инактиванта использовали этиловый спирт в концентрации 96% по объему. Одним из основных требований к инактивированной вакцине является ее безопасность, т.е. полное отсутствие в биомассе живого вируса. Полноту инактивации, т.е. отсутствие живого вируса, контролировали на ХАО 12-13 суточных КЭ путем трех репликативных пассажей. Из сухого инактивированного препарата готовили таблетированную форму для орального применения.
В одной таблетке массой 0,25 г содержится, процент по массе:
| инактивированная биомасса вируса вакцины, штамм Б-51 | 81,8 |
| аэросил марки АМ-1-300 | 6,0 |
| сахароза | 10,0 |
| кальция стеарат | 2,0 |
| ванилин | 0,2 |
Вакцинный препарат должен быть безопасным и иммунологически эффективным, т.е. формировать гуморальный иммунитет и защиту от инфекционного возбудителя.
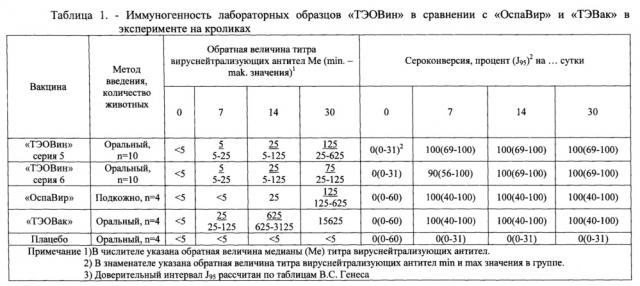
Иммуногенность вакцины «ТЭОВин» изучали в сравнении с иммуногенностью «ОспаВир» (прототип) и «ТЭОВак» на кроликах массой 2,5-3,0 кг породы «Шиншилла». Данные по иммуногенности указанных вакцинных препаратов представлены в таблице 1.
Из представленных в таблице 1 результатов видно, что гуморальный иммунитет у инактивированных вакцин «ТЭОВин» и «ОспаВир» значительно ниже, чем у живой «ТЭОВак». Гуморальный иммунитет у «ТЭОВин» и «ОспаВир» равноценен. Это позволяет рекомендовать инактивированную вакцину «ТЭОВин» для первого этапа двухэтапной вакцинации против натуральной оспы с применением «ТЭОВак» на втором этапе, что значительно повысит массовость и скорость вакцинации, которые играют важную роль в ликвидации различных эпидситуаций. Как видно из данных таблицы 1, на 7 сутки после иммунизации инактивированной вакциной «ТЭОВин» развивается минимальный гуморальный иммунитет.
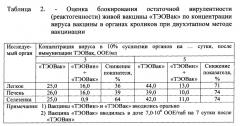
Me титров вируснейтрализующих антител (ВНА) составила 1:5, т.е. создается грундиммунитет, который позволяет приживляться и размножаться живому вирусу «ТЭОВак», а также блокировать остаточную вирулентность штамма Б-51, т.е. снижать реактогенность вакцины «ТЭОВак». Реактогенность двухэтапного метода вакцинации на первом этапе «ТЭОВин» и на 7 сутки на втором этапе «ТЭОВак» оценивали по концентрации живого вируса вакцины в органах иммунных животных. С этой целью на 3 и 5 сутки после введения живой вакцины «ТЭОВак» забирали наиболее чувствительные к вирусу вакцины органы кроликов: легкие, печень и селезенку, готовили 10% суспензию, которую титровали на ХАО 12-13 суточных КЭ. Результаты определения блокирования остаточной вирулентности (реактогенности) живой вакцины «ТЭОВак» по концентрации вируса вакцины в органах кроликов при двухэтапном методе вакцинации представлены в таблице 2.
Из представленных в таблице 2 результатов видно, что инактивированная вакцина «ТЭОВин» на 3 сутки после двухэтапного метода вакцинации снижает концентрацию вируса в исследуемых органах на 36-64%, а на 5 сутки - на 71-74%. Инактивированная вакцина за счет формирования грундиммунитета блокирует развитие и размножение вируса живой вакцины (эффект ревакцинации), в связи с чем снижается его концентрация в органах иммунных животных, и как следствие, снижается реактогенность живой вакцины при сохранении иммуногенности. На основании изложенного можно заключить, что двухэтапный метод вакцинации при применении изучаемой инактивированной вакцины «ТЭОВин» для первого этапа вакцинации и живой вакцины «ТЭОВак» для второго этапа вакцинации значительно снизят процент поствакцинальных реакций и полностью исключат поствакцинальные осложнения.
Результаты оценки иммуногенности позволили перейти к изучению протективного иммунитета при самостоятельном применении инактивированных вакцин «ТЭОВин» и «ОспаВир» (прототип) в составе двухэтапного метода вакцинации.
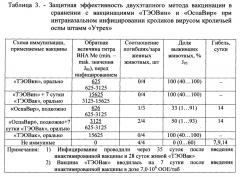
В таблице 3 представлены данные эффективности двухэтапного метода вакцинации в сравнении с вакцинациями «ТЭОВин» и «ОспаВир» при интраназальном инфицировании кроликов вирусом оспы кроликов штамм «Утрех».
Данные таблицы 3 свидетельствуют, что вакцина «ТЭОВин» и двухэтапная вакцинация с ее применением защищает 100% иммунных животных от гибели при интраназальном заражении вирусом оспы кроликов штамм Утрехт при инфицирующей дозе 25 LD50 при 100% гибели не иммунных животных. При применении инактивированной коммерческой вакцины «ОспаВир» (прототип) погибает 67% кроликов, а при двухэтапной вакцинации с применением «ОспаВир» - 50%. Эти данные свидетельствуют, что вакцина «ОспаВир» в отличие от «ТЭОВин» снижает формирование полноценного защитного иммунитета при введении живой вакцины «ТЭОВак» на втором этапе иммунизации.
Таким образом, представленные результаты свидетельствуют о создании экспериментального образца защитного препарата - таблетированной эмбриональной инактивированной оспенной вакцины для орального применения «ТЭОВин». Образец таблетированной вакцины может быть рекомендован для использования в двухэтапном методе иммунизации против натуральной оспы и оспы животных, патогенных для человека при первом этапе вакцинации.
Проведенное доклиническое изучение приготовленных экспериментальных серий образцов вакцины для орального применения «ТЭОВин» показало, что препарат обеспечивает 100% сероконверсию у иммунизированных животных (кроликов породы «Шиншилла» массой от 3 до 3,5 кг) с образованием ВНА к 14 суткам не мене 1:25 и защиту 100% иммунизированных модельных животных (кроликов породы «Шиншилла» массой от 3 до 3,5 кг) при их инфицировании вирусом оспы кроликов, штамм Утрехт в дозе 25 LD50, через 35 суток после вакцинации «ТЭОВин».
Вакцина оспенная эмбриональная инактивированная сухая таблетированная для орального применения, содержащая в своем составе в одной таблетке биомассу вируса вакцины, штамм Б-51, а также вспомогательные компоненты-наполнители, отличающаяся тем, что таблетка в своем составе содержит инактивированную 96% по объему этиловым спиртом биомассу вируса вакцины, штамм Б-51, выращенного на хорион-аллантоисных оболочках 12-13 суточных куриных эмбрионах, при следующем содержании указанных компонентов, процент по массе:
| инактивированная биомасса вируса вакцины, штамм Б-51 | 81,8 |
| аэросил марки АМ-1-300 | 6,0 |
| сахароза | 10,0 |
| кальция стеарат | 2,0 |
| ванилин | 0,2 |