Способ оценки состояния миокарда при кардиохирургических вмешательствах в условиях кардиоплегической защиты
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиохирургии, и может быть использовано при проведении оценки состояния миокарда при кардиохирургических вмешательствах в условиях кардиоплегической защиты. Для этого осуществляют оценку сократимости миокарда по значениям давления, развиваемым левым желудочком (ДР ЛЖ), показателю среднего давления в левом желудочке (СД ЛЖ), конечно-диастолическому давлению в левом желудочке (КДД), интенсивности флуоресценции никотинамиддинуклеотида (НАДН). Дополнительно оценивают показатели свободно-радикального окисления по уровню оксида азота и лактата, измеренных в оттекающей от сердца перфузионной жидкости. Измерение параметров проводят сразу после восстановления кровообращения. При одновременном снижении ДР ЛЖ менее 80 мм рт. ст., снижении СД ЛЖ менее 40 мм рт ст, увеличении КДД более 9 мм рт. ст., увеличении уровня оксида азота более 20 мкмоль/л и лактата более 12 ммоль/л, снижении уровня коэффициента флуоресценции НАДН менее 0,4 определяют наличие повреждений миокарда ишемического и реперфузионного характера. Способ обеспечивает раннее выявление повреждений миокарда ишемического и реперфузионного характера за счет оценки патогенетически значимых показателей. 5 табл., 2 пр.
Реферат
Изобретение относится к области медицины, в частности к анестезиологии, и реаниматологии, перфузиологии и сердечно-сосудистой хирургии и может быть использовано для определения ишемического и реперфузионного поражения миокарда при операциях на открытом сердца в условиях кардиопротекции.
Золотым стандартом лечения пациентов с ИБС является операция прямой реваскуляризации миокарда - коронарное шунтирование (КШ), потребность в которой оценивается как 300 операций на 1 миллион населения ежегодно (Ардашев В.Н и др., 1998; Белякин С.А. и др., 2003.; Булавин В.В. и др., 1990, Бокерия Л.А. и соавторы, 2013). Несмотря на современные достижения кардиохирургии данные операции требуют использования искусственного кровообращения (ИК) и защиты миокарда на фоне пережатия аорты и кардиоплегического (защищенного) ареста (остановки) сердца, а возникающие в таких условиях ишемические и реперфузионные повреждения миокарда остаются ведущими причинами развития острой сердечной недостаточности в раннем госпитальном периоде (Wijns W. et al., 2010).
Дефицит кровотока вследствие гипоксии циркуляторного и гемического генеза замедляет скорость окислительных процессов в кардиомиоцитах и трансформирует внутриклеточное дыхание с аэробного пути на анаэробный. При недостаточном обеспечении миокарда кислородом и питательными веществами каскад биохимических реакций направлен на сдвиг соотношения НАДН/НАД+ с превалированием левой части, что в свою очередь приводит к блокировке реакций цикла трикарбоновых кислот в матриксе митохондрий. В итоге истощаются запасы АТФ и новые молекулы не синтезируются. Стремительно снижается скорость β-окисления и работа транспортных систем, изменяется поляризация мембран, отражающаяся в трансминерализации клеток, отмечается сдвиг рН в кислую (лактат-ацидоз) сторону, что становится главным фактором в образовании активных форм кислорода. Комплекс патологических изменений метаболизма кардиомиоцитов приводит к гибели клеток и тканей - некротическим зонам или зонам инфаркта [Лукьянова Л.Д., 2004; Siegel 1994; Афанасьев В.В., 2005].
Прогрессирующие и необратимые ишемические повреждения миокарда могут быть остановлены незамедлительной реперфузией. Однако, помимо положительных эффектов, собственно реперфузия может приводить к миокардиальной, электрофизиологической и/или сосудистой дисфункции. Реперфузионные повреждения миокарда зачастую проявляются контрактильной дисфункцией («станнированный» или «оглушенный» миокард), повреждением сосудов микроциркуляторного русла и отсутствием восстановления кровотока на уровне тканей (феномен no-reflow), реперфузионными аритмиями и необратимым повреждением миокарда (lethal reperfusion injury).
Необходимость своевременного выявления ишемического и реперфузионного повреждения миокарда в клинической практике требует совершенствования методов их лабораторной диагностики. Имеющиеся на сегодняшний день биохимические способы тестирования ишемии миокарда (определение содержания миоглобина, активности МВ-фракции креатинфосфокиназы (КФК) и других ферментов в плазме крови) инерционны и дают положительные результаты лишь через несколько десятков минут или даже часов от начала клинической манифестации коронарной недостаточности.
Известен способ оценки состояния миокарда при выполнении реконструктивных операций на крупных магистральных сосудах, основанный на оценке уровня миокардиального кровотока и анализе газового состава артериальной и венозной крови, оттекающей от сердца [Пат.2250081 Рос.Федерация, МПК А61В 17/00, А61В 5/02, А61В 5/145. Способ интраоперационной оценки эффективности кардиохирургической коррекции / Окунева Г.Н., Власов Ю.А., Булатецкая Л.М., Караськов А.М и пр.; патентообладатель ГУ Новосибирский научно-исследовательский институт патологии кровообращения им. Аккад. Е.Н. Мешалкина МЗ РФ (RU) №2003113494/14, заявл. 07.05.03, опубл. 27.11.04, Бюл. №11. - 7 с.]. Способ включает регистрацию миокардиального кровотока перед кардиохирургическим вмешательством в разных точках эпикардиальной поверхности желудочков и предсердий при помощи лазер-доплеровского флоуметра (ЛДФ). Одновременно определяют артериовенозную разность содержания кислорода по миокарду и вычисляют величину потребления кислорода миокардом (ПО2миок), мл/(100 г/мин). После выполнения основного этапа кардиохирургической операции на работающем сердце производят повторные измерения субэпикардиального кровотока в заданных точках и анализ изменения газового состава в пробах крови, взятых из артерии и коронарного синуса сердца. Затем вновь определяют ПО2миок, которое отражает изменение состояния метаболизма сердца, обусловленное выполненным хирургическим вмешательством. При этом согласно способу величина потребления кислорода миокардом пропорциональна функциональной активности сердца, и если потребление кислорода миокардом после основного этапа реваскуляризации достоверно увеличилось, то делают вывод об устранении ишемии миокарда или ее существенном уменьшении, а если потребление кислорода миокардом после основного этапа операции не изменилось или уменьшилось, то делается вывод, что ишемия не устранена, а операция не эффективна.
Недостатком способа является то, что он применим для оценки ишемии миокарда при проведении операций на работающем сердце, а использование метода ЛДФ для оценки микроциркуляции на фоне реперфузии может быть неэффективно при развитии феномена «nо-reflow» и «slow-reflow». Кроме того, постановка катетера в коронарный синус для забора крови опасна с позиции травмы синуса, а оценка газового состава дает косвенный результат по метаболитам всей крови, оттекающей от миокарда.
Известен способ оценки повреждения миокарда при проведении операции на открытом сердце пациента при помощи биоимпедансометрии [Пат. 2444285 Рос. Федерация, МПК А61В 5/0402, А61В 17/00. Способ оценки состояния миокарда при проведении операции на открытом сердце / Бокерия Л.А., Муратов P.M., Мовсесян P.P., Бледжянц Г.А.; патентообладатель Учреждение Российской академии медицинских наук Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева (RU) №2010118280/14, заявл. 07.05.10, опубл. 20.11.11., Бюл. №32. - 6 с.]. Увеличение осмолярности кардиомиоцитов вследствие накопления в них ионов натрия, кальция, мелкодисперсных органических соединений, гипергидратации, повышения проницаемости и снижения механической прочности клеточных мембран может приводить к их перерастяжению, разрыву и гибели. Поэтому в качестве основного показателя ишемических и реперфузионных повреждений миокарда оценивают состояние внеклеточного пространства миокарда и наличие внутриклеточного отека кардиомиоцитов во время оперативного вмешательства. Для этого устанавливают датчик, имеющий не менее двух электродов, обеспечивая максимальный охват исследуемого участка миокарда, и проводят измерение электрического импеданса на низкой (Zнч) от 5 до 20 кГц и высокой (Zвч) от 100 до 500 кГц частотах. Измерения выполняют перед началом искусственного кровообращения, регистрируя исходную величину сигнала, после пережатия аорты и введения кардиоплегического раствора в коронарное русло и после снятия зажима с аорты и восстановления коронарного кровотока, регистрируя текущие величины импеданса. Если после пережатия аорты снижается текущая величина Zвч, то это означает, что нарастает внутриклеточный отек миокарда на фоне ишемического повреждения кардиомиоцитов, и при текущей величине Zвч на 25% и более ниже исходной величины оценивают защиту миокарда как недостаточную. Если после снятия зажима с аорты и восстановления коронарного кровотока текущая величина Zвч снижается ниже исходной величины, то это означает наличие отека кардиомиоцитов на фоне реперфузионного повреждения миокарда, и при снижении текущей величины Zвч на 85% и более ниже исходной величины оценивают защиту миокарда как неадекватную и предпринимают действия по лечению послеоперационной острой сердечной недостаточности пациента.
Недостатком способа является невозможность оценки метаболической активности миокардиоцитов и инвазивный характер установки электродов, которые подшивают к миокарду, что увеличивает риск послеоперационных кровотечений и нарушений ритма сердца.
Известен способ интраоперационной оценки повреждения миокарда при кардиохирургических вмешательствах, основанный на определении ультраструктуры кардиомиоцитов с использованием электронной микроскопии [Пат. 2435526 Рос. Федерация МПК 61В 17/00. Способ интраоперационной оценки эффективности защиты миокарда при коррекции врожденных пороков сердца / Углова Е.В., Ларионов П.М., Караськов A.M., Ломиворотов В.Н., и др.; патентообладатель Федеральное государственное учреждение «Новосибирский научно-Исследовательский институт патологии кровообращения имени Е.Н. Мешалкина Федерального агентства по высокотехнологичной медицинской помощи (RU) №2009127993/15, заявл. 20.07.09, опубл. 27.01.11., Бюл. №3. - 10 с.]. Для этого производят забор биоптата сердечной ткани и осуществляют анализ степени повреждения ДНК кардиоцитов на аноксическом и реперфузионном этапах операции, измеряя интенсивность флуоресценции ДНК и показатель процентного соотношения фрагментированной ДНК в ядре и в цитоплазме кардиоцитов. Снижение средних значений интенсивности флюоресценции показывает нарастание гипоксии в миокарде. Одновременное снижение интенсивности флуоресценции и значение показателя процентного соотношения фрагментированной ДНК в ядре и в цитоплазме, приближенное к 1:1, свидетельствуют об интраоперационном повреждении миокарда.
Недостатком способа является отсутствие диагностики в режиме реального времени и потребность в гистологической подготовке микропрепарата, что затрудняет немедленное использование полученных результатов диагностики в выборе медикаментозной тактики защиты миокарда.
Наиболее близким к заявляемому является способ интраоперационного мониторинга ишемического повреждения миокарда в условиях кардиоплегии при помощи флуоресцентной спектроскопии [Салмин, В.В. Использование флуоресцентной спектроскопии для оценки ишемического поражения миокарда / Салмин В.В., Салмина А.Б., Фурсов А.А., Фролова О.В., и пр. // Журнал Сибирского федерального университета. Биология. - 2011. - N 2: т 2. - с 142-157]. Способ включает анализ спектров лазер-индуцированной флуоресценции НАДН, зафиксированных на ишемизированном миокарде крыс при кардиоплегической защите, анализ суммарной НАД(Ф)Н- оксидазной активности, оценку концентрации лактата и малонового альдегида в гомогенате ткани миокарда.
Учитывая возможное совпадение пиков люминесценции НАДН с максимумом поглощения гемопротеидов (гемоглобин, миоглобин и др.), вводили комплексный параметр - индекс жизнеспособности (ηVIA), который
определяли как отношение максимального показателя отрицательной динамики интенсивности флуоресценции к максимальному показателю
положительной динамики флуоресценции, . При этом интенсивность флуоресценции I390 нм, имеющая отрицательную динамику, оценивается как изменение концентрации окисленных гемопротеидов, а интенсивность флуоресценции I490, имеющая положительную динамику изменения во время ишемии, интерпретировали как изменения концентрации НАДН. Одновременно выполняли оценку биохимических и морфологических критериев ишемии миокарда, таких как суммарная НАД(Ф)Н-оксидазная активность, концентрация лактата в гомогенате ткани миокарда и уровень малонового диальдегида. Полученные в ходе исследования результаты спектрального анализа были сопоставлены с данными морфологической картины и патобиохимических процессов в кардиомиоцитах при острой ишемии, а зарегистрированное изменение пула НАД(Ф)Н клеток явилось предшественноком развития необратимой контрактуры и лизиса миофибрилл, аккумуляции лактата и нарушения НАД(Ф)Н-оксидазной активности.
Недостатком способа является необходимость гомогенизации миокарда и использование «разрушающего контроля», что затрудняет применение данного метода в качестве мониторинга применительно к клинической практике. Кроме того способ не позволяет оценить реперфузионное поражение миокарда, которые являются компонентом формирования послеоперационного синдрома малого сердечного выброса.
Техническим результатом предложенного изобретения является раннее выявление повреждений миокарда ишемического и реперфузионного характера при выполнении кардихирургических вмешательствах на открытом сердце в условиях кардиоплегической защиты.
Технический результат достигается за счет того, что оценку состояния миокарда определяют на основании измерения гемодинамических показателей сократимости сердца, интенсивности флуоресценции пиридиновых нуклеотидов и продуктов свободно-радикального окисления липидов, измеренных в перфузионной жидкости, оттекающей от сердца, оцененных после восстановления кровоснабжения миокарда.
Предложенный способ основан на данных исследования, выполненного в ФГБНУ «НИИ КПССЗ» г. Кемерово, на изолированных сердцах половозрелых крыс-самцов линии Wistar массой 300±50 г (n=18). Содержание, кормление, уход и выведение с последующей утилизацией лабораторных животных проводили в соответствии с правилами Европейской конвенции (Страсбург, 1986).
Подготовку изолированных сердец осуществляли по методике Лангендорфа с использованием перфузионного раствора Кребса-Хензеляйта. После чего выполняли протокол перфузии изолированных сердец, включающий следующие этапы:
I - перфузия раствором Кребса-Хензеляйта в течение 20 мин;
II - гипоперфузия при скорости подачи раствора 20 мл/ч, охлажденного до +4°С кардиоплегическим раствором «Кустодиол» в течение 8 мин;
III - глобальная кардиоплегическая ишемия - 240 мин;
IV - реперфузия раствором Кребса-Хензеляйта в течение 20 минут.
На каждом этапе протокола проводили оценку состояния миокарда с анализом сократительной функции миокарда, интенсивности флуоресценции НАДН и оценкой биохимических параметров оксидативного стресса. С учетом сократимости миокарда, полученные экспериментальные данные были ретроспективно разделены на две группы:
- изолированные сердца с сохранением сократимости на 20 минуте реперфузии (n=10),
- изолированные сердца с достоверным ухудшением сократимости на 20 минуте реперфузии (n=8).
Полученные данные представлены по анализируемым параметрам в контрольные точки с учетом ретроспективного разделения препаратов изолированных сердец на группы.
Статистическую обработку данных осуществляли с помощью программы Statistica 6,0. Достоверность различий определяли на основании непараметрического критерия Манна-Уитни для несвязных пар. Использовали общепринятые параметрические методы статистического анализа (Newman Keuls тест), данные были представлены в виде медианы [25; 75 перцентилей]. Уровень статистической значимости учитывался при р<0,05.
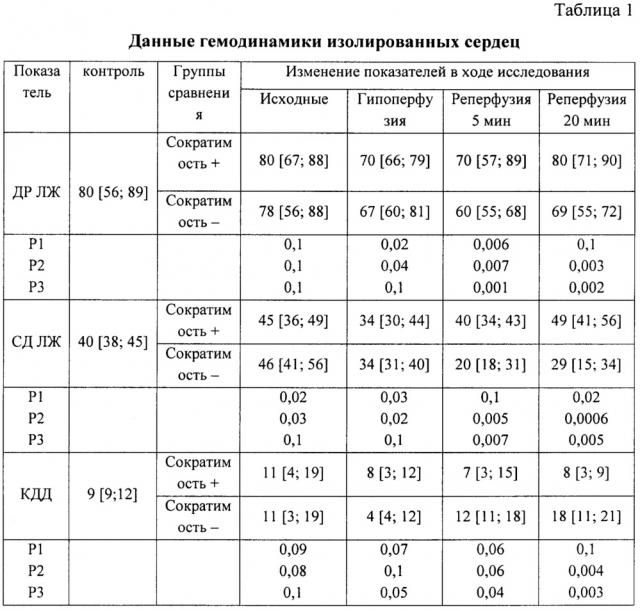
Анализ сократительной функции миокарда осуществляли при помощи аппарата для физиологических исследований МР36 компании Biopac Systems, Inc (California, USA), при измерении следующих параметров: давление, развиваемое левым желудочком (ДР ЛЖ), среднее давление в левом желудочке (СД ЛЖ), конечно-диастолическое давление в левом желудочке (КДД) (таблица 1).
Примечание: ДР ЛЖ - давление, развиваемое левым желудочком, СД ЛЖ - систолическое давление левого желудочка, КДД - конечно-диастолическое давление левого желудочка, p1 - достоверность между контролем и данными по этапам для первой групп, р2 - достоверность между контролем и данными по этапам для второй группы, p3 - достоверность между группами на этапах исследования.
Исходные показатели ДР ЛЖ в группах не отличались от контрольных показателей и при межгрупповом сравнении, что свидетельствует о сопоставимости исходного состояния сердца и адекватности выделения препарата изолированного органа. В ходе гипоперфузии наблюдали закономерное снижение сократимости по показателям ДРЛЖ, СДЛЖ и КДД.
После восстановления кровотока в первые минуты реперфузии в группе с ухудшенной сократимостью миокарда наблюдали снижение ДР ЛЖ и CP ЛЖ, что свидетельствовало о плохой контрактильности вследствие повреждения миокарда при ишемии и реперфузии и, вероятно, о индивидуально обусловленной неэффективности кардиоплегической защиты (феномен «невосстановленного кровотока», индивидуальные особенности анатомии коронарного русла). Параллельно со снижением изгоняющего давления ЛЖ отметили в группе с плохим сокращением миокарда рост КДД, что приводит к ухудшению коронарного перфузионного давления и к ухудшению коронарной перфузии, вторичной ишемии миокарда и росту вклада анаэробного метаболизма.
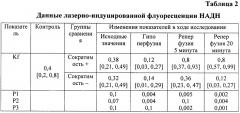
Регистрацию динамики флуоресценции одного из основных участников метаболизма миокарда никотинамидадениндинуклеотида (НАДН) осуществляли при помощи комплекса многофункциональной лазерной диагностики «ЛАКК-М» (НИИ «Лазма», Россия). При возбуждении ткани миокарда через оптоволоконный зонд на длине волны 365 нм спектроанализатор принимал рассеянное флуоресцентное излучение. Изменение интенсивности флуоресценции, на основании общеинтегрального сигнала, регистрировали в виде графика, отражающего зависимость интенсивности испускаемого излучения от его длины волны. При помощи программного обеспечения «ЛАКК-М» автоматически рассчитывался коэффициент флуоресценции (Kf) (таблица 2).
Примечание: Kf - коэффициент флуоресценции, p1 - достоверность между контролем и данными по этапам для первой групп, р2 - достоверность между контролем и данными по этапам для второй группы, р3 - достоверность между группами на этапах исследования.
Группа с плохим восстановлением миокарда демонстрировала снижение интенсивности флуоресценции на пятой минуте реперфузии, достоверно отличаясь от контроля и от аналогичного показателя в группе сравнения, что является признаком неэффективного клеточного дыхания в совокупности с накоплением лактата и оксида азота.
Известно, что потенциал митохондриальной мембраны контролирует генерацию свободных радикалов [Kristian et al., 1998]. В раннюю стадию реперфузии инициация оксидативного фосфорилирования, гиперактивности электронного транспорта и гиперполяризации мембраны митохондрий усиливает продукцию свободно-радикального окисления (СРО), что превосходит возможности инактивации последних существующих систем защиты от СРО [Ericinska et al., 1994]. Появление СРО в ходе ишемии и реперфузии возможно вследствие двух процессов: активности ксантин-оксидазной системы в эндотелиальных клетках и активности НАДН оксидазной системы в нейтрофилах [Sanderson et al., 2013].
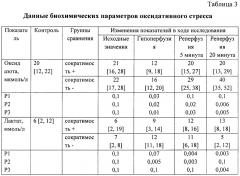
В качестве наиболее информативного показателя оксидативного стресса, при помощи иммуноферментного анализа, оценивали уровень оксида азота, который или обладает защитной функцией, или же вызывает эффект повреждения в условиях ишемии и реперфузии, что зависит от того, какая именно из синтаз оксида азота активизируется. Считается, что в условиях кардиоплегического арреста активизируется именно индуцибельная синтаза NO, что в свою очередь ведет к генерации пероксинитритов, пероксидации липидов, усилению продукции свободных радикалов и потенциированию ишемически-реперфузионного повреждения [van den Heuvel et al., 2013].
Примечание: p1 - достоверность между контролем и данными по этапам для первой групп, р2 - достоверность между контролем и данными по этапам для второй группы, р3 - достоверность между группами на этапах исследования.
Значимость вклада ишемического повреждения миокарда в группе с плохим восстановлением миокарда подтверждается увеличением лактата в данной группе, уровень достоверно отличался от аналогичных показателей группы с нормальным восстановлением, и накоплением метаболитов оксида азоты как показателя активности свободно-радикального окисления и подтверждения вклада реперфузионного повреждения в нарушение функции сократимости миокарда.
При сопоставлении полученных данных на основании контрольных показателей достоверно установлено, что в экспериментальной модели, максимально приближенной к реальной клинической ситуации (кардиохирургическое вмешательство с кардиоплегией и остановкой сердца), наиболее ранними критериями повреждения миокарда являются - снижение ДР ЛЖ менее 80 мм рт. ст., снижение СД левого желудочка менее 40 мм рт. ст., увеличение КДД более 9 мм рт. ст., увеличение уровня оксида азота более 20 мкмоль/л и лактата более 6 ммоль/л, а также снижение уровня коэффициента флуоресценции НАДН менее 0,4.
Пример 1. Крыса №1, линии Вистар, выделение изолированного сердца в условиях ингаляционного наркоза изофлюраном по методике Лангендорфа. Перфузия изолированного сердца выполнена с соблюдением протокола, полученные результаты представлены в таблице.
Гемодинамика изолированного сердца крысы №1
Примечание: ДР ЛЖ - давление, развиваемое левым желудочком, СД ЛЖ - систолическое давление левого желудочка, КДД - конечно-диастолическое давление левого желудочка, Kf - коэффициент флуоресценции.
На двадцатой минуте сохраняется нормальный уровень производительности и сократимости сердца. Сердце крысы демонстрирует нормальный в сравнении с контрольными значениями показатель интенсивности флуоресценции, а уровни лактата и оксида азота в оттекающем перфузате не превышают контрольных значений на всех этапах исследования.
Таким образом, при восстановлении спонтанного сокращения в начале реперфузии миокарда у изолированного сердца крысы отметили нормальную сократимость, подтвержденную сопоставимыми с контрольными значениями уровнем ДРЛЖ, СД ЛЖ и КДД.
Пример 2. Крыса №2, линии Вистар, выделение изолированного сердца в условиях ингаляционного наркоза изофлюраном по методике Лангендорфа. Протокол перфузии выполнен, результаты исследования оцениваемых параметров представлены в таблице.
Данные гемодинамики изолированного сердца крысы №2
Примечание: ДР ЛЖ - давление, развиваемое левым желудочком, СД ЛЖ - систолическое давление левого желудочка, КДД - конечно-диастолическое давление левого желудочка, Kf - коэффициент флуоресценции.
При восстановлении спонтанного сокращения в начале реперфузии миокарда у изолированного сердца крысы №2 отметили сниженную сократимость, подтвержденную уровнем ДРЛЖ менее контрольных значений, снижением СД левого желудочка менее 40 мм рт. ст., увеличением КДД более 9 мм рт. ст., что сопровождалось увеличением уровня оксида азота и лактата выше контрольных значений и сниженными показателями коэффициента флуоресценции НАДН, что позволило констатировать наличие ишемического и реперфузионного поражения в условиях кардиопротекции.
Способ оценки состояния миокарда при кардиохиругических вмешательствах в условиях кардиоплегической защиты, включающий оценку сократимости миокарда по значениям давления, развиваемым левым желудочком (ДР ЛЖ), показателю среднего давления в левом желудочке (СД ЛЖ), конечно-диастолическому давлению в левом желудочке (КДД), интенсивности флуоресценции никотинамиддинуклеотида (НАДН), а также показателей свободно-радикального окисления по уровню оксида азота и лактата, измеренных в оттекающей от сердца перфузионной жидкости, отличающийся тем, что измерения проводят сразу после восстановления кровообращения и при одновременном снижении ДР ЛЖ менее 80 мм рт. ст., снижении СД ЛЖ менее 40 мм рт. ст., увеличении КДД более 9 мм рт. ст., увеличении уровня оксида азота более 20 мкмоль/л и лактата более 12 ммоль/л, снижении уровня коэффициента флуоресценции НАДН менее 0,4 определяют наличие повреждений миокарда ишемического и реперфузионного характера.