Лечение рака
Иллюстрации
Показать всеНастоящая группа изобретений относится к медицине, а именно к онкологии, и касается лечения рака. Для этого идентифицируют опухоли, чувствительные к лечению акситинибом. Для определения чувствительности используют измерение уровней экспрессии полипептида CD68 в образце ткани из опухоли, а также процентное содержание CD68-положительных клеток и плотность CD68-положительных клеток в опухоли. Это обеспечивает высокую вероятность определения эффективности или неэффективности лечения аксинитинибом и, соответственно, выбора наиболее адекватной терапии для каждого конкретного больного. 8 н. и. 7 з.п. ф-лы, 2 пр., 11 ил.
Реферат
Область изобретения
Область описания настоящего изобретения охватывает молекулярную биологию, онкологию и клиническую диагностику.
Предшествующий уровень техники
Большинство противораковых лекарственных средств эффективны у некоторых пациентов, но не у других. Последнее может быть следствием генетической вариации среди опухолей, и может быть обнаружено даже среди опухолей у одного и того же пациента. Варьирование реакции у пациента особенно выражено в отношении направленных терапевтических средств. Таким образом, полный потенциал направленных терапевтических средств не может быть реализован без подходящих тестов для определения того, в отношении каких пациентов какие лекарственные средства окажут положительное действие. В соответствии с Национальными Институтами Здравоохранения (NIH) термин "биомаркер" определяют как "характеристику, которую объективно измеряют и оценивают как показатель нормальных биологических или патогенных процессов или фармакологическую реакцию на терапевтическое вмешательство".
Разработка улучшенных диагностических средств, основанных на открытии биомаркеров, обладает потенциалом к ускорению разработки новых лекарственных средств путем досрочной идентификации тех пациентов, которые наиболее вероятно продемонстрируют клиническую реакцию на данное лекарственное средство. Такие диагностические средства обладают потенциалом к значительному уменьшению размера, длительности и стоимости клинических испытаний. Способы, такие как геномика, протеомика и молекулярная визуализация, в настоящее время обеспечивают быстрое, чувствительное и достоверное обнаружение специфических генных мутаций, уровней экспрессии конкретных генов и других молекулярных биомаркеров. Несмотря на доступность различных способов молекулярного исследования опухолей, клиническое использование биомаркеров рака остается в значительной степени нереализованным, поскольку открыто относительно немного биомаркеров рака. Например, в недавней обзорной статье утверждается:
Сложность представляет собой открытие биомаркеров рака. Хотя существует клинический успех в нацеливании на молекулярно определенные подгруппы нескольких типов опухолей - таких как хроническая миелоидная лейкемия, желудочно-кишечная стромальная опухоль, рак легкого и мультиформная глиобластома - с использованием молекулярных агентов направленного действия, способность к применению такого успеха в более широком контексте весьма ограничена отсутствием эффективной стратегии оценки агентов направленного действия у пациентов. Проблема в основном заключается в неспособности отобрать пациентов с молекулярно определенными видами рака для клинических испытаний для оценки этих многообещающих новых лекарственных средств. Для этого решения требуются биомаркеры, которые надежно идентифицировали бы пациентов, которые наиболее вероятно испытывали бы благоприятное действие от конкретного агента (Sawyers, 2008, Nature 452:548-552, на стр. 548).
Комментарии, такие как вышеприведенный, иллюстрируют понимание необходимости обнаружения клинически полезных биомаркеров и диагностических способов, основанных на таких биомаркерах.
Существуют три отдельных типа биомаркеров рака: (1) прогностические биомаркеры, (2) предиктивные биомаркеры и (3) фармакодинамические (PD) биомаркеры. Прогностический биомаркер используют для классификации рака, например солидной опухоли в соответствии с агрессивностью, то есть скоростью роста и/или метастазирования и реакции на лечение. Он иногда называется как отличающий опухоли "с хорошим исходом" от опухолей "с плохим исходом". Предиктивный биомаркер используют для определения вероятности того, что конкретный пациент испытает благоприятное действие от лечения конкретным лекарственным средством. Например, пациенты, страдающие от рака молочной железы, у которых амплифицируется ген ERBB2 (HER2 или NEU), вероятно испытывают благоприятное действие от лечения трастузумабом (HERCEPTIN®), тогда как маловероятно, что пациенты без амплификации гена ERBB2 испытывают благоприятное действие от лечения трастузумабом. Биомаркер PD представляет собой показатель действия(действий) лекарственного средства на пациента, пока пациент принимает лекарственное средство. Соответственно, биомаркеры PD часто используют для установления уровня доз и частоты введения доз на ранних стадиях клинической разработки нового лекарственного средства. Обсуждение раковых биомаркеров смотри, например, в Sawyers, 2008, Nature 452:548-552.
Акситиниб (также известный как Inlyta®) представляет собой низкомолекулярный перорально вводимый ингибитор рецептора тирозинкиназы, который действует на рецепторы фактора роста эндотелия сосудов (VEGFR). Полагают, что акситиниб уменьшает рост и метастазирование опухоли путем ингибирования ангиогенеза и уменьшает рост опухоли и вызывает ремиссию путем действия непосредственно на клетки, которые экспрессируют и зависят от этих рецепторов. Акситиниб мультинационально одобрен для лечения метастатического почечно-клеточного рака (mRCC) после прогрессирования заболевания после применения цитокинов или сунитиниба (также известного как Sutent®) или устойчивости к ним.
Несмотря на большое количество доклинических и клинических исследований, сфокусированных на ингибиторах VEGFR, механизмы, ответственные за противоопухолевую активность таких ингибиторов, не полностью понятны. В частности, роль инфильтрирующихся в опухоль лимфоцитов при влиянии на прогноз mRCC у пациентов и чувствительность/устойчивость к антиангиогенным агентам не полностью понятна (например, смотри Polimeno et al., 2013, BJU Int 112:686-696). Как с другими типами направленной терапии, некоторые, но не все пациенты, испытывают благоприятное действие терапии акситинибом. Таким образом, существует потребность в диагностических способах, основанных на предиктивных биомаркерах, которые могут быть использованы для идентификации пациентов, страдающих от опухолей, которые вероятно (или маловероятно) реагируют на лечение акситинибом.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Как в данном описании будет обсуждаться подробнее, описание настоящего изобретения частично относится к обнаружению того, что инфильтрация в опухоль миелоидных клеток (то есть кластер дифференцировки 68 ʺCD68ʺ) (например, повышенные уровни CD68 в выражениях процентного содержания CD68-положительных клеток и плотности CD68-положительных клеток) в образце ткани из опухоли млекопитающего коррелирует с повышенной выживаемостью без прогрессирования заболевания при использовании ингибиторов VEGFR, таких как акситиниб. Соответственно, в описании настоящего изобретения предложены способы идентификации опухоли, которая более вероятно положительно реагирует на лечение ингибиторами, такими как акситиниб, и к способам лечения субъектов, страдающих от опухолей, которые, как идентифицировано, с большей вероятностью реагируют на ингибиторы VEGFR, такие как акситиниб.
Например, в одном из воплощений описание относится к способу идентификации опухоли, чувствительной к лечению ингибитором VEGFR, включающему: (а) измерение уровня экспрессии полипептида CD68 в образце ткани из опухоли, полученной от пациента-человека, рассматриваемого для лечения ингибитором VEGFR; и (б) сравнение уровня экспрессии CD68 на стадии (а) против порогового уровня экспрессии CD68, определяемого путем измерения экспрессии полипептида CD68 в образцах ткани опухолей, полученных от пациентов-людей, которых ранее лечили ингибитором VEGFR, и которые, как было продемонстрировано, устойчивы к ингибитору VEGFR, и пациентов-людей, которых ранее лечили ингибитором VEGFR, и которые, как было продемонстрировано, чувствительны к ингибитору VEGFR, где уровень экспрессии CD68 выше порогового уровня свидетельствует о том, что опухоль чувствительна к лечению ингибитором VEGFR. В одном из воплощений ингибитор VEGFR представляет собой акситиниб. В еще одном воплощении стадию измерения экспрессии полипептида CD68 осуществляют путем иммуногистохимии. В еще одном воплощении стадию измерения экспрессии полипептида CD68 путем иммуногистохимии осуществляют путем анализа изображения после сканирования всего слайда, при котором определяют процентное содержание CD68-положительных клеток в образце. В еще одном воплощении такие способы дополнительно включают стадию определения плотности CD68-положительных клеток в образце. В еще одном воплощении опухоль в любом из таких способов выбрана из группы, состоящей из опухоли молочной железы, опухоли легкого, опухоли почки, колоректальной опухоли и опухоли поджелудочной железы.
В еще одном воплощении в описании настоящего изобретения предложен способ лечения mRCC, включающий введение ингибитора VEGFR пациенту, у которого определено наличие опухоли mRCC, чувствительной к ингибитору VEGFR в соответствии с любым из описанных в данном описании способов. В одном из воплощений ингибитор VEGFR представляет собой акситиниб.
В еще одном воплощении в описании настоящего изобретения предложен способ лечения рака, включающий: а) определение процентного содержания CD68-положительных клеток в опухоли от субъекта; и б) введение этому субъекту ингибитора VEGFR, если указанное процентное содержание составляет по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 4,5%, по меньшей мере 4,6%, по меньшей мере 4,7%, по меньшей мере 4,8%, по меньшей мере 4,9%, по меньшей мере 5,0%, по меньшей мере 5,1%, по меньшей мере 5,2%, по меньшей мере 5,3%, по меньшей мере 5,4%, по меньшей мере 5,5%, по меньшей мере 5,6%, по меньшей мере 5,7%, по меньшей мере 5,8%, по меньшей мере 5,9%, по меньшей мере 6,0%, по меньшей мере 6,5%, по меньшей мере 7,0%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 15% или по меньшей мере 20%. В одном из воплощений ингибитор VEGFR представляет собой акситиниб.
В еще одном воплощении в описании настоящего изобретения предложен способ лечения рака, включающий: а) определение плотности CD68-положительных клеток в опухоли от субъекта; и б) введение этому субъекту акситиниба, если указанная плотность клеток составляет по меньшей мере 0,05 клеток/мм2, по меньшей мере 0,06 клеток/мм2, по меньшей мере 0,07 клеток/мм2, по меньшей мере 0,08 клеток/мм2, по меньшей мере 0,09 клеток/мм2, по меньшей мере 1,0 клетка/мм2, по меньшей мере 1,1 клеток/мм2, по меньшей мере 1,2 клеток/мм2, по меньшей мере 1,3 клеток/мм2, по меньшей мере 1,4 клеток/мм2 или по меньшей мере 1,5 клеток/мм2. В одном из воплощений ингибитор VEGFR представляет собой акситиниб.
В еще одном воплощении в описании настоящего изобретения предложен способ лечения рака, включающий введение субъекту, имеющему опухоль, ингибитора VEGFR, где по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 4,5%, по меньшей мере 4,6%, по меньшей мере 4,7%, по меньшей мере 4,8%, по меньшей мере 4,9%, по меньшей мере 5,0%, по меньшей мере 5,1%, по меньшей мере 5,2%, по меньшей мере 5,3%, по меньшей мере 5,4%, по меньшей мере 5,5%, по меньшей мере 5,6%, по меньшей мере 5,7%, по меньшей мере 5,8%, по меньшей мере 5,9%, по меньшей мере 6,0%, по меньшей мере 6,5%, по меньшей мере 7,0%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 15% или по меньшей мере 20% клеток в указанной опухоли являются CD68-положительными. В одном из воплощений ингибитор VEGFR представляет собой акситиниб.
В еще одном воплощении в описании настоящего изобретения предложен способ лечения рака, включающий введение субъекту, имеющему опухоль, ингибитора VEGFR, где плотность CD68-положительных клеток в указанной опухоли составляет по меньшей мере 0,05 клеток/мм2, по меньшей мере 0,06 клеток/мм2, по меньшей мере 0,07 клеток/мм2, по меньшей мере 0,08 клеток/мм2, по меньшей мере 0,09 клеток/мм2, по меньшей мере 1,0 клетка/мм2, по меньшей мере 1,1 клеток/мм2, по меньшей мере 1,2 клеток/мм2, по меньшей мере 1,3 клеток/мм2, по меньшей мере 1,4 клеток/мм2 или по меньшей мере 1,5 клеток/мм2. В одном из воплощений ингибитор VEGFR представляет собой акситиниб.
В еще одном воплощении в описании настоящего изобретения предложен способ лечения рака, включающий: а) определение процентного содержания С068-положительных клеток в опухоли от субъекта; б) определение плотности CD68-положительных клеток в этой опухоли; и в) введение этому субъекту ингибитора VEGFR, если указанное процентное содержание составляет по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 4,5%, по меньшей мере 4,6%, по меньшей мере 4,7%, по меньшей мере 4,8%, по меньшей мере 4,9%, по меньшей мере 5,0%, по меньшей мере 5,1%, по меньшей мере 5,2%, по меньшей мере 5,3%, по меньшей мере 5,4%, по меньшей мере 5,5%, по меньшей мере 5,6%, по меньшей мере 5,7%, по меньшей мере 5,8%, по меньшей мере 5,9%, по меньшей мере 6,0%, по меньшей мере 6,5%, по меньшей мере 7,0%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 15% или по меньшей мере 20%; и указанная клеточная плотность составляет по меньшей мере 0,05 клеток/мм2, по меньшей мере 0,06 клеток/мм2, по меньшей мере 0,07 клеток/мм2, по меньшей мере 0,08 клеток/мм2, по меньшей мере 0,09 клеток/мм2, по меньшей мере 1,0 клетка/мм2, по меньшей мере 1,1 клеток/мм2, по меньшей мере 1,2 клеток/мм2, по меньшей мере 1,3 клеток/мм2, по меньшей мере 1,4 клеток/мм2 или по меньшей мере 1,5 клеток/мм2. В одном из воплощений ингибитор VEGFR представляет собой акситиниб.
В еще одном воплощении в описании настоящего изобретения предложен способ лечения рака, включающий введение субъекту, имеющему опухоль, ингибитора VEGFR, где по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 4,5%, по меньшей мере 4,6%, по меньшей мере 4,7%, по меньшей мере 4,8%, по меньшей мере 4,9%, по меньшей мере 5,0%, по меньшей мере 5,1%, по меньшей мере 5,2%, по меньшей мере 5,3%, по меньшей мере 5,4%, по меньшей мере 5,5%, по меньшей мере 5,6%, по меньшей мере 5,7%, по меньшей мере 5,8%, по меньшей мере 5,9%, по меньшей мере 6,0%, по меньшей мере 6,5%, по меньшей мере 7,0%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 15% или по меньшей мере 20% клеток в указанной опухоли являются CD68-положительными; и где плотность CD68-положительных клеток в указанной опухоли составляет по меньшей мере 0,05 клеток/мм2, по меньшей мере 0,06 клеток/мм2, по меньшей мере 0,07 клеток/мм2, по меньшей мере 0,08 клеток/мм2, по меньшей мере 0,09 клеток/мм2, по меньшей мере 1,0 клетка/мм2, по меньшей мере 1,1 клеток/мм2, по меньшей мере 1,2 клеток/мм2, по меньшей мере 1,3 клеток/мм2, по меньшей мере 1,4 клеток/мм2 или по меньшей мере 1,5 клеток/мм2. В одном из воплощений ингибитор VEGFR представляет собой акситиниб.
В еще одном воплощении в описании настоящего изобретения предложен любой из раскрытых в данном описании способов, где указанная опухоль выбрана из группы, состоящей из опухоли молочной железы, опухоли легкого, опухоли почки, колоректальной опухоли и опухоли поджелудочной железы. В одном из воплощений в описании настоящего изобретения предложен любой из раскрытых в данном описании способов, где рак или опухоль представляет собой mRCC.
В других воплощениях осуществляют раскрытые в данном описании способы, где стадию измерения процентного содержания или плотности CD68-положительных клеток осуществляют с использованием иммуногистохимии и дополнительно используют анализ изображения после сканирования всего слайда из образца опухоли.
В некоторых воплощениях описания настоящего изобретения измерение содержания макрофагов осуществляют путем измерения присутствия или количества маркерного белка макрофагов. В других воплощениях измерение содержания макрофагов осуществляют путем определения количества макрофагов в данной клеточной популяции. Например, измерение содержания макрофагов может быть осуществлено путем иммуногистохимии, включающей обнаружение маркерного белка макрофагов. В еще одном воплощении измерение содержания макрофагов осуществляют путем измерения присутствия или количества мРНК, кодирующей маркерный белок макрофагов. Примеры маркерных белков макрофагов включают CCR2, CD14, CD68, CD163, CSF1R и MSR1. Анализ определения пороговой величины может включать анализ при помощи рабочей характеристической кривой (receiver operator characteristic curve analysis). Способы в описании настоящего изобретения полезны для тестирования различных типов опухолей, включающих, например опухоли молочной железы, опухоли легкого, опухоли почки, колоректальные опухоли и опухоли поджелудочной железы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показаны демографические и базовые характеристики субъектов, включенных в исследование А4061032.
На Фиг. 2 показано обобщение процентного содержания и плотности положительных клеток в отношении биомаркеров CD3 и CD68 по слайдам по сравнению с блоками, которые были собраны как часть исследования А4061032.
На Фиг. 3 показан график Каплана-Мейера PFS (выживаемости без прогрессирования заболевания) для сравнения величин меньше медианы и больше, чем медиана или равных медиане процентного содержания и плотности клеток, положительных в отношении биомаркера CD68.
На Фиг. 4 показан график Каплана-Мейера PFS для сравнения величин меньше медианы и больше, чем медиана или равных медиане процентного содержания и плотности клеток, положительных в отношении биомаркера CD68, у пациентов, которых ранее лечили Sutent®.
На Фиг. 5 показан график Каплана-Мейера PFS для сравнения величин меньше медианы и больше, чем медиана или равных медиане процентного содержания и плотности клеток, положительных в отношении биомаркера CD3.
На Фиг. 6 показан график Каплана-Мейера PFS для сравнения величин меньше медианы и больше, чем медиана или равных медиане процентного содержания и плотности клеток, положительных в отношении биомаркера CD3, у пациентов, которых ранее лечили Sutent®.
На Фиг. 7 показано обобщение OS (общей выживаемости) в соответствии с группой отсечения медианы меньше чем и больше чем или равной для каждого биомаркера CD3 и CD68 процентного содержания и плотности положительных клеток.
На Фиг. 8 показано обобщение OS в соответствии с группой отсечения медианы меньше чем и больше чем или равной для каждого биомаркера CD3 и CD68 процентного содержания и плотности положительных клеток у пациентов, которых ранее лечили Sutent®.
На Фиг. 9 показан график Каплана-Мейера OS для сравнения величин меньше медианы и больше, чем медиана или равных медиане для биомаркеров CD3 и CD68 для процентного содержания и плотности положительных клеток у пациентов, которых ранее лечили Sutent®.
На Фиг. 10 показано обобщение для биомаркеров CD3 и CD68, процентного содержания и плотности положительных клеток в соответствии с категорией реакции.
На Фиг. 11 показано обобщение для биомаркеров CD3 и CD68, процентного содержания и плотности положительных клеток в соответствии с категорией реакции у пациентов, которых ранее лечили Sutent®.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
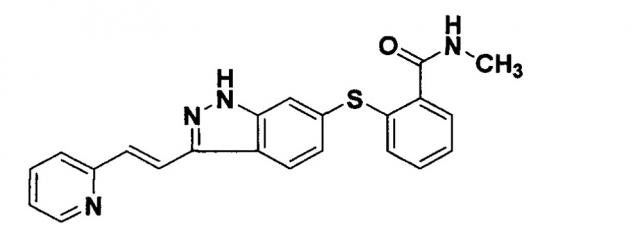
Используемые здесь Inlyta®, "AG-13736" и "акситиниб" обозначают 6-[2-(метилкарбамоил)фенилсульфанил]-3-Е-[2-(пиридин-2-ил)этенил]индазол, имеющий следующую химическую структуру, включая его соли и полиморфные модификации:
Используемый здесь "маркерный белок макрофагов" обозначает белок клеточной поверхности макрофагов, обнаружение которого полезно для идентификации макрофагов среди других типов клеток, присутствующих в образце ткани из опухоли. Примеры маркерных белков человеческих макрофагов представляют собой CCR2, CD14, CD68, CD163, CSFIR и MSRI. Другие маркерные белки макрофагов могут быть использованы в практическом применении описания настоящего изобретения.
Используемая здесь "рабочая характеристическая" (ROC) кривая обозначает график доли ложноположительных значений (чувствительность) относительно доли истинно положительных значений (специфичность) для бинарной системы классификации. При построении кривой ROC используют следующие определения:
- Доля ложноотрицательных значений "FNR" = 1 - TPR
- Доля истинно положительных значений "TPR" = истинно положительные значения / (истинно положительные + ложноотрицательные)
- Доля ложноположительных значений "FPR" = ложноположительные / (ложноположительные + истинно отрицательные)
Используемый здесь "реакция" или "реагирующий" в отношении лечения обозначает в отношении опухоли, которую лечат, что опухоль демонстрирует: (а) замедление роста, (б) прекращение роста или (в) ремиссию.
Используемый здесь "анализ определения порогового значения" обозначает анализ массива данных, представляющих данный тип опухоли, например рак почки у человека, для определения оценки порогового значения для данного конкретного типа опухоли. Массив данных, представляющих данный тип опухоли, может включать для каждой опухоли из группы таких опухолей: (а) реальные данные по реакции опухоли (реакция и отсутствие реакции на лечение, такое как акситиниб), и (б) содержание макрофагов и/или уровни экспрессии CD68.
Используемый здесь "оценка порогового значения" обозначает вышеприведенную оценку, где опухоль классифицируют как вероятно чувствительную к лечению, такому как лечение акситинибом.
Используемый здесь "уровень экспрессии CD68" или "уровень экспрессии полипептида CD68" обозначает уровень белка CD68, который экспрессируется в образце опухоли, и может быть определен при помощи любого подходящего аналитического способа, такого как иммуногистохимия. Кроме того, "уровень экспрессии CD68" может быть выражен различными терминами, включающими процентное содержание клеток в данном образце, которые определяют как "CD68-положительные", и плотность клеток в данном образце, которые определяют как "CD68-положительные".
Используемый здесь "CCR2" (хемокиновый (мотив С-С) рецептор 2, также известный как CD 192, CKR2, CMKBR2, MCP-I-R, CC-CKR-2, FLJ78302, MGC103828, MGC111760 и MGC168006) обозначает человеческий белок, кодируемый геном, идентифицированным как Entrez GenelD No. 729230, и его аллельными вариантами.
Используемый здесь "CD14" обозначает человеческий белок, кодируемый геном, идентифицированным как Entrez GenelD No. 929, и его аллельными вариантами.
Используемый здесь "CD68" (также известный как GP110; SCARD1; и DKFZp686M 18236) обозначает человеческий белок, кодируемый геном, идентифицированным как Entrez GenelD No. 968, и его аллельными вариантами.
Используемый здесь "CD68-положительная" клетка представляет собой клетку, в которой присутствие CD68 обнаруживают при помощи любого подходящего аналитического способа, такого как иммуногистохимия.
Используемый здесь "CD163" (также известный как MI 30 и ММ 130) обозначает человеческий белок, кодируемый геном, идентифицированным как Entrez GenelD No. 9332, и его аллельными вариантами.
Используемый здесь "CSF1R" (рецептор колониестимулирующего фактора 1, также известный как CSFR, FMS, FIM2, C-FMS и CD115) обозначает человеческий белок, кодируемый геном, идентифицированным как Entrez GenelD No. 1436, и его аллельными вариантами.
Используемый здесь "MSR1" (фагоцитарный рецептор макрофагов 1, также названный CD204, SCARA1, SR-A, phSRI и phSR2) обозначает человеческий белок, кодируемый геном, идентифицированным как Entrez GenelD No. 4481, и его аллельными вариантами.
Используемый здесь "HR" обозначает отношение рисков. На Фиг. 3, 4, 5, 6 и 9, с допущением пропорциональных рисков, отношение рисков больше, чем 1 указывает на уменьшение уровня рисков в сторону < медианы; отношение рисков меньше, чем 1 указывает на уменьшение уровня рисков в сторону >= медианы; и логранговые р-величины получали только тогда, когда N>=10 в обеих группах сравнения. На Фиг. 7 и 8, с допущением пропорциональных рисков, отношение рисков больше, чем 1 указывает на уменьшение уровня рисков в сторону < медианы; отношение рисков меньше, чем 1 указывает на уменьшение уровня рисков в сторону >= медианы; и логранговую р-величину получали только тогда, когда N>=10 в обеих группах сравнения; и статистику отношения рисков получали только тогда, когда N>=5 в обеих группах сравнения; тем не менее, логранговую р-величину и отношение рисков удаляли тогда, когда в обеих группах обнаруживали нулевую точку.
Клинические исследования
Inlyta®, далее называемый как акситиниб, представляет собой перорально вводимый низкомолекулярный ингибитор рецептора тирозинкиназы, который действует на рецепторы фактора роста эндотелия сосудов (VEGFR). Ожидается, что акситиниб уменьшает опухолевый рост и метастазирование путем ингибирования ангиогенеза и уменьшает опухолевый рост и вызывает ремиссию путем действия непосредственно на клетки, которые экспрессируют и зависят от этих рецепторов. Акситиниб мультинационально одобрен для лечения метастатического почечно-клеточного рака (mRCC) после прогрессирования заболевания после применения цитокинов или сунитиниба или устойчивости к ним.
Исследование А4061032 (идентификатор клинических испытаний: NCT00678392 (Clinical Trials. gov Identifier)) представляло собой регистрационное испытание 3 фазы, озаглавленное "Акситиниб (AG-013736) в качестве терапии второй линии метастатического почечно-клеточного рака: осевое испытание". Это испытание было разработано для того, чтобы продемонстрировать то, что акситиниб превосходит сорафениб в отношении замедления прогрессирования опухоли у пациентов, страдающих от mRCC, после неудачи одной схемы первой линии. В общей сложности планировали включить 650 пациентов, и 723 субъекта в конечном счете были вовлечены в исследование.
Как подробнее описано в примерах, фиксированные в формалине погруженные в парафин (FFPE) образцы опухоли собирали у пациентов, которые принимали участие в А4061032, и которые предоставили специфическое согласие для сбора образца опухоли. Инфильтрацию опухоли миелоидными клетками (кластер дифференцировки 68 "CD68") или лимфоцитами (кластер дифференцировки 3 "CD3") оценивали путем иммуногистохимии (IHC) в образцах опухолей 52 пациентов, которых лечили акситинибом. Задача заключалась в том, чтобы исследовать возможную ассоциацию этих биомаркеров с эффективностью, согласующуюся с гипотезой о том, что инфильтрация миелоидными клетками придает устойчивость к анти-ангиогенным агентам, нацеленным на путь VEGF-VEGFR2 (смотри Shojaei et al. (2007) Nat. Biotechnol. 25(8):911-920; и Lin et al. (2010) Eur. J. Cancer Suppl. 8(7):191).
Оценку CD3 и CD68 осуществляли путем анализа изображения после сканирования всего слайда. Интересующую область обводили кругом, и осуществляли алгоритм анализа изображения. Измеряли процентное содержание положительных клеток (количество положительных клеток/общее количество клеток) и плотность положительных клеток (например, количество положительных клеток/мм2). Некоторые пациенты были донорами блоков FFPE, а некоторые были донорами слайдов, нарезанных из блоков. Анализировали образцы всех пациентов, независимо от того, были ли они донорами материала для слайдов или блоков.
Для данных IHC оценивали 52 пациента, 33 из которых ранее лечили Sutent® (сунтинибом). Отсутствовали корреляции между данными по CD3 и любым из измеряемых конечных результатов. Как подробнее описано в примерах, для CD68 процентное содержание положительных клеток и плотность клеток тесно коррелировали и были в два раза выше у пациентов с объективной реакцией по сравнению с пациентами, не демонстрирующими объективную реакцию.
Независимо от предшествующего лечения, медиана выживаемости без прогрессирования заболевания (PFS) у пациентов с величинами ≥ медианы величин CD68 (отсечение = 5,21% положительных клеток или плотность клеток 0,08 клеток/мм2) составила 12,0 месяцев для обеих точек отсечения по сравнению с 3,7 и 3,8 месяцами, соответственно, для пациентов с величинами < медианы величин для биомаркера (отношение рисков [HR]=0,42, логранговая р-величина ≤ 0,01). Для пациентов, которых ранее лечили Sutent®, обнаружена похожая с PFS тенденция с пограничной статистической значимостью (р-величины: 0,066 и 0,056 для % положительных клеток и плотности клеток, соответственно). Похожие тенденции благоприятной эффективности обнаружены для объективной реакции и общей выживаемости (OS) пациентов с относительно более высоким количеством клеток CD68, хотя эти различия не были статистически значимыми, когда всех пациентов исследовали вместе или когда исследовали только пациентов, которых предварительно лечили Sutent®.
Дополнительные анализы при помощи рабочей характеристической кривой (ROC) осуществляли для более хорошего понимания чувствительности и специфичности базовых уровней опухоли CD68 и для оптимизации определения отсекающих значений для CD68 на основании исходных выбранных значений медианы для CD68. Выбрали отсекающие значения по умолчанию 2, 4, 6 и 8 месяцев для PFS, и вновь обнаружили, что пациенты с более высоким процентным содержанием CD68-положительных клеток и плотностью клеток имели большие значения PFS (или эквивалентно меньшую вероятность прогрессирования заболевания или смерти) в каждый из четырех моментов времени PFS.
Как подробнее описано в примерах, самые высокие обнаруженные величины чувствительности, специфичности и величины площади под кривой (AUC) были обнаружены для PFS 2 месяца, где AUC для кривой ROC составили 0,776 и 0,809 для процентного содержания CD68-положительных клеток и плотности клеток, соответственно, что указывает на убедительную общую диагностическую точность для PFS с использованием уровней экспрессии CD68. Оптимальные отсекающие значения для предсказания PFS на уровне 6 месяцев составляли 4,41% и 0,06 клеток/мм2 для процентного содержания и плотности CD68-положительных клеток, соответственно. Величины были похожими для пациентов, которых ранее лечили Sutent®.
Анализ ROC также использовали для измерения CD68 по сравнению с ORR (частотой объективных реакций). Как подробнее описано в примерах, AUC составляли 0,791 и 0,784 для процентного содержания и плотности CD68-положительных клеток, соответственно, что вновь указывает на убедительную общую точность предсказания ORR с использованием уровней экспрессии CD68. Оптимальные отсекающие значения для предсказания ORR составили 9,42% и 0,13 клеток/мм2 для процентного содержания и плотности CD68-положительных клеток, соответственно. Величины были похожими для пациентов, которых ранее лечили Sutent®. Для вероятности выживаемости через 21 месяц, представляющей собой величину медианы для испытания, анализ ROC не продемонстрировал статистически значимую ассоциацию с AUC 0,559,
В заключение, независимо от предшествующего лечения благоприятные PFS обнаружены для пациентов с более высокими уровнями опухолевых CD68. Медиана PFS у пациентов с величинами > величины медианы CD68 составила 12,0 месяцев для обоих отсекающих значений по сравнению с 3,7 и 3,8 месяцами для пациентов с величинами < величин медианы для биомаркера (HR=0,42, логранговая р-величина ≤ 0,01). Анализ ROC свидетельствовал об убедительной предсказывающей величине для этих данных через 2, 4, 6 и 8 месяцев, и уточненных отсекающих значениях (через 6 месяцев - 4,41% и 0,06 клеток/мм2 для процентного содержания CD68-положительных клеток и плотности клеток).
Соответственно, описание настоящего изобретения относится к обнаружению того, что более высокая экспрессия CD68 ассоциируется с более высокими ORR и более длительными PFS для пациентов, которых лечили ингибитором VEGFR, таким как акситиниб. Отсутствие ассоциации с OS может быть следствием искажающего результат лечения после прогрессирования при применении акситиниба. Эти наблюдения согласуются с механизмом увеличенной продукции VEGF и ассоциированным ангиогенным статусом с более высокой инфильтрацией макрофагов, и, таким образом, большей чувствительностью к эффектам лечения акситинибом. ROC анализ PFS, представляющий собой регистрационный конечный результат, демонстрировал большую чувствительность и специфичность после двух месяцев лечения.
Ранее сообщали о том, что экспрессия CD68 ассоциирована с исходом для пациентов с mRCC, получающих лечение тивозанибом (Lin et al. (2010) Eur. J. Cancer Suppl. 8(7):191). Также ранее показали, что миелоидные (CD11b Gr+) клетки придают устойчивость к бевацизумабу в животной модели рака легкого (Shojaei et al. (2007) Nat Biotechnol. 25(8):911-920). Эти данные могут согласовываться с более плохими исходами для пациентов с более высокими опухолевыми уровнями CD68. Тем не менее, последнее не было обнаружено в этом исследовании.
Для пациентов RCC значимый прогресс был получен при идентификации прогностических биомаркеров, но не были идентифицированы никакие предиктивные маркеры эффективности для направленных ингибиторов VEGFR, таких как акситиниб. В соответствии с недавним обзором (Tonini G et al. (2011) Exper Rev Anticancer Ther 11(6):921-930), выбор наиболее подходящей терапии для пациентов с RCC все еще зависит от критериев риска (MSKCC) и других прогностических критериев. Кроме того, авторы указывают на то, что эти комбинированные критерии обеспечивают информацию об исходе для пациента с RCC, и что необходимы эти предиктивные факторы реакции на терапию для mRCC. Существует необходимость в валидации потенциальных маркеров в рандомизированных клинических испытаниях (Id.). Стандартизация забора ткани и анализа также указывается как основная трудность в разработке молекулярных биомаркеров для потенциального направления терапии (Sonpavde G and Choueiri Т, (2012) Br J Cancer 107(7):1009-1016).
Способы и аналитические методы, которые могут быть использованы при осуществлении настоящего изобретения, дополнительно раскрыты ниже.
Образец ткани
Образец ткани из опухоли от пациента-человека может быть использован в качестве источника РНК, источника белка или источника тонких срезов для иммуногистохимии (IHC), таким образом, уровень экспрессии CD68 в образце может быть определен, как изложено в описании настоящего изобретения. Образец ткани может быть получен с использованием обычных приборов и процедур для биопсии опухоли. Эндоскопическая биопсия, эксцизионная биопсия, инцизионная биопсия, тонкоигольная пункционная биопсия, штанцевая биопсия, бритвенная биопсия и биопсия кожи представляют собой примеры признанных медицинских процедур, которые могут быть использованы специалистом в данной области техники для получения образцов опухолей. Образец опухолевой ткани должен быть достаточно большим для того, чтобы обеспечить достаточно РНК, белка или тонких срезов для измерения маркерного гена, например уровня экспрессии CD68 или визуализации макрофагов при помощи IHC, например экспрессии CD68-положительных клеток.
Образец опухолевой ткани может находиться в любой форме, которая дает возможность для измерения содержания макрофагов или, в частности, CD68. Другими словами, образец ткани должен быть достаточен для экстракции РНК, экстракции белка или приготовления тонких срезов. Соответственно, образец ткани может быть свежим, фиксированным при помощи подходящих криогенных способов или фиксированным при помощи некриогенных способов. Стандартный способ обработки образцов клинической биопсии заключается в фиксации тканевого образца в формалине и затем его заключения в парафин. Образцы в этой форме обычно известны как фиксированная в формалине заключенная в парафин (FFPE) ткань. Подходящие способы приготовления ткани для последующего анализа хорошо известны специалистам в данной области техники.
Содержание макрофагов
При практическом применении описания настоящего изобретения определение уровня содержания макрофагов (например количество макрофагов или экспрессия макрофагального маркера, такого как CD68, например экспрессия маркерного белка макрофагов или экспрессия мРНК, кодирующей маркерный белок макрофагов, такой как CD68) в образце ткани (например из опухоли) может быть осуществлено при помощи любого подходящего способа из нескольких существующих. Например, измерение содержания макрофагов опосредованно может быть осуществлено путем измерения экспрессии одного или более чем одного из генов, которые, как известно, полезны в качестве маркеров макрофагов, таких как CD68. В области техники известны различные способы измерения экспрессии генов. Такие способы могут быть использованы при определении уровня маркерных белков макрофагов или мРНК, кодирующей маркерные белки макрофагов. Примеры маркерных генов человеческих макрофагов представляют собой CCR2, CD14, CD68, CD163, CSF1R и MSR1. Также могут быть использованы другие маркеры макрофагов.
Анализ РНК
Обычный микроматричный анализ и количественная полимеразная цепная реакция (QPCR) представляют собой примеры способов определения