Способы очистки антител
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан способ очистки белка из раствора, содержащего по меньшей мере одну загрязняющую примесь, посредством аффинной хроматографии с суперантигеном, включающий: а) адсорбирование белка на суперантигене, иммобилизованном на твердом носителе; б) удаление по меньшей мере одной загрязняющей примеси посредством приведения в контакт иммобилизованного суперантигена, содержащего адсорбированный белок, с первым промывочным буфером, содержащим алифатический карбоксилат, где указанный алифатический карбоксилат содержит остов из 6-11 атомов углерода; и в) элюирование белка из суперантигена, иммобилизованного на твердом носителе; где белок выбран из группы, состоящей из растворимого рецептора, антитела, фрагмента антитела, одиночного вариабельного домена иммуноглобулина, Fab, F(ab')2, Fv, связанных через дисульфид Fv, scFv, мультиспецифического антитела с закрытой конформацией, связанных через дисульфид scFv или диатела. Также описан способ очистки белка из его содержащего загрязняющие примеси раствора посредством хроматографии с белком А, включающий: а) уравновешивание белка А, иммобилизованного на твердой фазе, уравновешивающим буфером для белка А; б) адсорбирование белка из содержащего загрязняющие примеси раствора на белке А, иммобилизованном на твердой фазе; в) удаление по меньшей мере одной загрязняющей примеси путем промывания твердой фазы первым промывочным буфером для белка А, содержащим 50 мМ или 55 мМ трис-основания, 45 мМ уксусной кислоты, по меньшей мере один алифатический карбоксилат, при рН 7,2, 7,5 или 8,0, где алифатический карбоксилат выбран из группы, состоящей из 100 мМ каприлата натрия и 20 мМ деканоата натрия; и (г) извлечение белка из твердой фазы элюирующим буфером для белка А, где все буферы приготовлены без добавления NaCl. Кроме того, описан способ очистки белка из его содержащего загрязняющие примеси раствора посредством хроматографии с белком L, включающий: а) уравновешивание белка L, иммобилизованного на твердой фазе, уравновешивающим буфером для белка L; б) адсорбирование белка из содержащего загрязняющие примеси раствора на белке L, иммобилизованном на твердой фазе; в) удаление по меньшей мере одной загрязняющей примеси путем промывания твердой фазы первым промывочным буфером для белка L, содержащим 52 мМ трис-основания, 48 мМ уксусной кислоты, по меньшей мере один алифатический карбоксилат, при рН 7,0, где алифатический карбоксилат выбран из группы, состоящей из 100 мМ каприлата натрия и 20 мМ деканоата натрия; и (г) извлечение белка из твердой фазы элюирующим буфером для белка L, где все буферы приготовлены без добавления NaCl. 3 н. и 35 з.п. ф-лы, 3 ил., 8 табл., 7 пр.
Реферат
Область изобретения
Настоящее изобретение относится к области очистки белков с применением суперантигена, такого как белок А, белок G или белок L, иммобилизованного на твердом носителе. В частности, изобретение относится к компонентам промывочного буфера и к способу использования промывочных буферов для удаления загрязняющих примесей из клетки-хозяина во время стадий промывки, минимизируя потерю желательного белкового продукта.
Предшествующий уровень техники
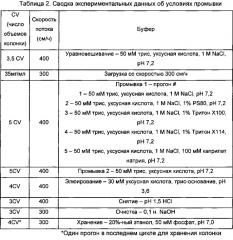
За последнее десятилетие аффинная хроматография с белком А стала признанной в качестве главного способа выбора для захвата моноклональных антител (mAbs) из потоков среды культивирования клеток млекопитающего. Эта стадия высокоспецифичной аффинности способна удалять 98% примесей за одну стадию благодаря специфическому связыванию между лигандом - белком А и Fc-областью антитела. В обычных рабочих условиях во время хроматографии с белком А осветленные потоки среды культивирования клеток вносят на колонку до достижения конкретной массы загрузки антител. Затем колонку обычно промывают буфером с высокой ионной силой для удаления загрязняющих примесей из клетки-хозяина, связанных со смолой посредством неспецифических взаимодействий. Затем антитело обычно элюируют из колонки посредством сдвига рН и собирают для дальнейшей обработки. Главная цель данного исследования, вследствие этого, представляет собой изучение применения детергентов, комбинированных с солями, для разрыва как ионных, так и гидрофобных взаимодействий и усиления удаления загрязняющих примесей из клетки-хозяина, снижая посредством этого нагрузку очистки на последующих стадиях выделения и очистки продукта.
Для крупномасштабной очистки много усилий затрачивается на оптимизацию компонентов промывочных и элюирующих буферов, чтобы максимально увеличить выход продукта. Однако в производственной ситуации, когда в одно и то же время очищается много различных белковых продуктов, разработка уникального промывочного буфера для каждого отдельного белкового продукта требует значительного времени и ресурсов для проверки различных компонентов буфера для определения подходящего промывочного буфера для каждого конкретного белкового продукта. "Универсальный" вспомогательный промывочный буфер, который можно было бы эффективно использовать с различными типами белков, может быть полезным и желательным. В настоящем изобретении предлагается способ очистки белков с использованием таких компонентов промывочного буфера.
Краткое изложение сущности изобретения
В одном аспекте настоящее изобретение направлено на способ очистки белка, содержащего антитело, фрагмент антитела или одиночный вариабельный домен иммуноглобулина, из раствора, содержащего по меньшей мере одну загрязняющую примесь, посредством хроматографии с суперантигеном, включающий: а) адсорбирование белка на суперантигене, иммобилизованном на твердом носителе; б) удаление по меньшей мере одной загрязняющей примеси посредством приведения в контакт иммобилизованного суперантигена, содержащего адсорбированный белок, с первым промывочным буфером, содержащим алифатический карбоксилат; и в) элюирование белка из суперантигена, иммобилизованного на твердом носителе.
В одном аспекте настоящее изобретение направлено на способ очистки белка из его содержащего загрязняющие примеси раствора посредством хроматографии с белком А, включающий:
а) уравновешивание белка А, иммобилизованного на твердой фазе, уравновешивающим буфером для белка А;
б) адсорбирование белка из содержащего загрязняющие примеси раствора на белке А, иммобилизованном на твердой фазе;
в) удаление по меньшей мере одной загрязняющей примеси путем промывания твердой фазы первым промывочным буфером для белка А, содержащим от примерно 50 мМ до примерно 55 мМ трис-основания, от примерно 45 мМ до примерно 50 мМ уксусной кислоты, по меньшей мере один алифатический карбоксилат при рН примерно 7,5, где алифатический карбоксилат выбран из группы, состоящей из примерно 100 мМ каприлата натрия, примерно 20 мМ деканоата натрия и примерно 20 мМ додеканоата натрия; и
г) извлечение белка из твердой фазы элюирующим буфером для белка А. В одном аспекте настоящего изобретения все буферы приготовлены без добавления NaCl.
В одном воплощении промывочный буфер для белка А дополнительно содержит от примерно 1 мМ до примерно 500 мМ ацетата натрия. В одном воплощении промывочный буфер для белка А содержит примерно 300 мМ ацетата натрия.
В одном аспекте настоящее изобретение направлено на способ очистки белка из его содержащего загрязняющие примеси раствора посредством хроматографии с белком L, включающий:
а) уравновешивание белка L, иммобилизованного на твердой фазе, уравновешивающим буфером для белка L;
б) адсорбирование белка из содержащего загрязняющие примеси раствора на белке L, иммобилизованном на твердой фазе;
в) удаление по меньшей мере одной загрязняющей примеси путем промывания твердой фазы первым промывочным буфером для белка L, содержащим от примерно 50 мМ до примерно 55 мМ трис-основания, от примерно 45 мМ до примерно 50 мМ уксусной кислоты, по меньшей мере один алифатический карбоксилат при рН примерно 7,5, где алифатический карбоксилат выбран из группы, состоящей из примерно 100 мМ каприлата натрия, примерно 20 мМ деканоата натрия и примерно 20 мМ додеканоата натрия; и
г) извлечение белка из твердой фазы при помощи элюирующего буфера для белка L. В одном аспекте настоящего изобретения все буферы приготовлены без добавления NaCl.
В одном воплощении промывочный буфер для белка L дополнительно содержит от примерно 1 мМ до примерно 500 мМ ацетата натрия. В одном воплощении промывочный буфер для белка L содержит примерно 300 мМ ацетата натрия.
Краткое описание чертежей
Фиг. 1 - результаты изучения концентрации каприлата - анти-OSM.
Фиг. 2 - результаты изучения концентрации каприлата - анти-IL13.
Фиг. 3 - результаты сравнительного анализа карбоновых кислот.
Подробное описание изобретения
Понятно, что данное изобретение не ограничивается конкретными способами, реагентами, соединениями, композициями или биологическими системами, которые, конечно, могут варьироваться. Понятно также, что терминология, используемая в данном описании изобретения, предназначается для цели описания только конкретных воплощений, и не предназначена для ограничения. При использовании в данном описании изобретения и прилагаемой формуле изобретения формы единственного числа включают объекты во множественном числе, если содержание не указывает явно на иное. Таким образом, например, ссылка на "полипептид" включает комбинацию двух или более полипептидов и тому подобное.
"Примерно" при использовании в данном описании изобретения при ссылке на измеряемую величину, такую как количество, период времени и тому подобное, предназначен охватывать отклонения на ±20% или ±10%, включая ±5%, ±1% и ±0,1% от конкретной величины, так как такие отклонения являются подходящими для выполнения раскрытых способов.
Если не указано иное, все технические и научные термины, используемые в данном описании изобретения, имеют то же значение, которое обычно понятно специалисту в области техники, к которой относится изобретение. Хотя любые способы и вещества, подобные или эквивалентные описанным в данном описании, можно применять на практике для тестирования настоящего изобретения, предпочтительные вещества и способы описаны в данном описании. При описании и составлении формулы настоящего изобретения используют следующую терминологию.
"Полипептид", "пептид" и "белок" используют взаимозаменяемо в данном описании для обозначения полимера из аминокислотных остатков. Полипептид может быть природного происхождения (полученный из тканей), рекомбинантным, или натуральным образом экспрессированным из прокариотических или эукариотических клеточных препаратов, или изготовленным химически посредством синтетических способов. Термины относятся к аминокислотным полимерам, в которых один или более аминокислотных остатков представляют собой искусственные химические миметики соответствующих природных аминокислот, а также к полимерам природных аминокислот и полимерам не встречающихся в природе аминокислот. Миметики аминокислот относятся к химическим соединениям, которые имеют структуру, отличающуюся от обычной химической структуры аминокислоты, но которая функционирует аналогично природной аминокислоте. Не встречающиеся в природе остатки подробно описаны в научной и патентной литературе; несколько показательных не встречающихся в природе композиций, полезных в качестве миметиков природных аминокислотных остатков, и методические указания описываются ниже. Миметики ароматических аминокислот могут быть образованы посредством замены, например, на D- или L-нафтилалан; D- или L-фенилглицин; D- или L-2-тиенилаланин; D- или L-1, -2,3- или 4-пиренилаланин; D- или L-3 тиенилаланин; D- или L-(2-пиридинил)-аланин; D- или L-(3-пиридинил)-аланин; D- или L-(2-пиразинил)-аланин; D- или L-(4-изопропил)-фенилглицин; D-(трифторметил)-фенилглицин; D-(трифторметил)-фенилаланин; D-пара-фтор-фенилаланин; D-или L-пара-бифенилфенилаланин; K- или L-пара-метокси-бифенилфенилаланин; D- или L-2-индол(алкил)аланины; и D- или L-алкилаланины, где алкил может представлять собой замещенный или незамещенный метил, этил, пропил, гексил, бутил, пентил, изопропил, изобутил, втор-изотил, изо-пентил или некислотные аминокислоты. Ароматические кольца не встречающейся в природе аминокислоты включают, например, тиазолильные, тиофенильные, пиразолильные, бензимидазолильные, нафтильные, фуранильные, пирролильные и пиридильные ароматические кольца.
"Пептид" при использовании в данном описании включает пептиды, которые представляют собой консервативные варианты пептидов, специально показанных в данном описании изобретения. "Консервативный вариант" при использовании в данном описании означает замену аминокислотного остатка другим биологически подобным остатком. Примеры консервативных вариантов включают, но без ограничения ими, замену одного гидрофобного остатка, такого как изолейцин, валин, лейцин, аланин, цистеин, глицин, фенилаланин, пролин, триптофан, тирозин, норлейцин или метионин, на другой, или замену одного полярного остатка на другой, такую как замена аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин, и тому подобное. Нейтральные гидрофильные аминокислоты, которые могут быть заменены друг другом, включают аспарагин, глутамин, серии и треонин. "Консервативный вариант" также включает использование замещенной аминокислоты вместо незамещенной родительской аминокислоты при условии, что антитела, полученные к замещенному полипептиду, также иммунореактивны по отношению к незамещенному полипептиду. Такие консервативные замены попадают в определение классов пептидов по изобретению. "Катионный" при использовании в данном описании изобретения относится к любому пептиду, который имеет суммарный положительный заряд при рН 7,4. Биологическая активность пептидов может быть определена посредством стандартных способов, известных специалисту в данной области техники и раскрытых в данном описании.
"Рекомбинантный" при использовании в отношении белка показывает, что белок был модифицирован путем интродукции гетерологичной нуклеиновой кислоты или белка или изменением нативной нуклеиновой кислоты или белка.
При использовании в данном описании "терапевтический белок" относится к любому белку и/или полипептиду, которых можно вводить млекопитающему, чтобы вызвать биологический или клинический ответ ткани, системы, животного или человека, которого добивается, например, исследователь или врач. Терапевтический белок может вызывать более одного биологического или клинического ответа. Кроме того, термин "терапевтически эффективное количество" означает любое количество, которое, при сравнении с соответствующим субъектом, который не получил такое количество, имеет результатом, без ограничения этим, исцеление, предупреждение или уменьшение интенсивности симптомов заболевания, расстройства или побочного эффекта, или снижение показателя распространения заболевания или расстройства. Термин также включает в свои рамки количества, эффективные в усилении нормальной физиологической функции, а также количества, эффективные в содействии физиологической функции у пациента, которая усиливает или поддерживает терапевтический эффект второго фармацевтического агента.
Все "аминокислотные" остатки, идентифицированные в данном описании, находятся в природной L-конфигурации. Аббревиатуры для аминокислотных остатков согласно стандартной номенклатуре полипептидов, показаны в следующей таблице.
Следует отметить, что все последовательности аминокислотных остатков представлены в данном описании формулами, чья ориентация слева направо представляет собой обычное направление от амино-конца к карбокси-концу.
В другом воплощении полипептид представляет собой антигенсвязывающий полипептид. В одном воплощении антигенсвязывающий полипептид выбран из группы, состоящей из растворимого рецептора, антитела, фрагмента антитела, одиночного вариабельного домена иммуноглобулина, Fab, F(ab')2, Fv, связанных через дисульфид Fv, scFv, мультиспецифичного антитела с закрытой конформацией, связанных через дисульфид scFv или диател.
Термин "антигенсвязывающий полипептид" при использовании в данном описании относится к антителам, фрагментам антител и другим белковым структурам, которые способны связываться с антигеном.
Термины Fv, Fc, Fd, Fab или F(ab)2 используются в их обычных значениях (см., например Harlow et al., Antibody A Laboratory Manual, Cold Spring Harbor Laboratory, (1988)).
"Химерное антитело" относится к типу созданного генно-инженерным путем антитела, которое содержит природную вариабельную область (легкую цепь и тяжелые цепи), полученную из донорного антитела, ассоциированную с константными областями легкой и тяжелой цепи, полученными от акцепторного антитела.
"Гуманизированное антитело" относится к типу созданного генно-инженерным путем антитела, CDR которого получены из иммуноглобулина донора, отличного от человека, а остальные происходящие из иммуноглобулина части молекулы получены из иммуноглобулина(ов) одного (или более) человека. Кроме того, остатки каркасной основы могут быть изменены для сохранения аффинности связывания (см., например, Queen et al., Proc. Natl. Acad Sci USA, 86: 10029-10032 (1989), Hodgson et al., Bio/Technology, 9: 421 (1991)). Подходящее человеческое акцепторное антитело может представлять собой антитело, выбранное из обычной базы данных, например базы данных KABAT.RTM., базы данных Los Alamos и базы данных Swiss Protein, по гомологии с нуклеотидной и аминокислотной последовательностями донорного антитела. Человеческое антитело, характеризующееся гомологией с каркасными областями донорного антитела (на основе аминокислот), может быть подходящим для получения константной области тяжелой цепи и/или вариабельной каркасной области тяжелой цепи для включения донорных CDR. Подходящее акцепторное антитело, способное отдавать константные области или вариабельные каркасные области легкой цепи, может быть выбрано аналогично. Следует заметить, что тяжелые и легкие цепи акцепторного антитела необязательно происходят от одного и того же акцепторного антитела. В известном уровне техники описано несколько способов получения таких гуманизированных антител, см., например, ЕР-А-0239400 и ЕР-А-054951.
Термин "донорное антитело" относится к антителу (моноклональному и/или рекомбинантному), которое отдает аминокислотные последовательности своих вариабельных областей, CDR или других функциональных фрагментов или их аналоги первому иммуноглобулиновому партнеру, чтобы получить измененную кодирующую область иммуноглобулина и результирующее экспрессированное измененное антитело с антигенной специфичностью и нейтрализующей активностью, свойственными донорному антителу.
Термин "акцепторное антитело" относится к антителу (моноклональному и/или рекомбинантному), гетерологичному с донорным антителом, которое отдает все (или любую часть, но в некоторых воплощениях - все) аминокислотные последовательности, кодирующие его каркасные области тяжелой и/или легкой цепи и/или его константные области тяжелой и/или легкой цепи, первому иммуноглобулиновому партнеру. В некоторых воплощениях человеческое антитело представляет собой акцепторное антитело.
"CDR" определяют как аминокислотные последовательности определяющей комплементарность области антитела, которые представляют собой гипервариабельные области тяжелых и легких цепей иммуноглобулина. См., например, Kabat et al., Sequences of Protein of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). В вариабельном участке иммуноглобулина присутствуют три CDR тяжелой цепи и три CDR легкой цепи (или области CDR). Таким образом, "CDR" при использовании в данном описании изобретения относится ко всем трем CDR тяжелой цепи или ко всем трем CDR легкой цепи (или ко всем CDR как тяжелой, так и легкой цепи, при необходимости). Структура и укладка белка антитела может означать, что другие остатки считаются частью антигенсвязывающей области и должны пониматься специалистом таким образом. См., например, Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p 877-883.
При использовании в данном описании изобретения термин "домен" относится к прошедшей фолдинг белковой структуре, которая имеет третичную структуру независимо от оставшейся части белка. Обычно домены отвечают за обособленные функциональные свойства белков и во многих случаях могут быть добавлены, удалены или перенесены в другие белки без потери функции оставшейся части белка и/или домена. "Одиночный вариабельный домен антитела" представляет собой домен прошедшего фолдинг полипептида, содержащий последовательности, свойственные вариабельным доменам антител. Поэтому он включает целые вариабельные домены и модифицированные вариабельные домены антитела, например, в которых одна или более петель была заменена последовательностями, которые не являются свойственными вариабельным доменам антитела, или вариабельные домены антитела, которые были укорочены или содержат N- или С-концевые удлинения, а также прошедшие фолдинг фрагменты вариабельных доменов, которые сохраняют по меньшей мере связывающую активность и специфичность полноразмерного домена.
Выражение "одиночный вариабельный домен иммуноглобулина" относится к вариабельному домену антитела (VH, VHH, VL, который специфически связывает антиген или эпитоп независимо от другой V-области или домена. Одиночный вариабельный домен иммуноглобулина может присутствовать в виде структуры (гомо- или гетеро-мультимер) с другими различными вариабельными областями или вариабельными доменами, когда другие области или домены не требуются для связывания антигена при помощи одиночного вариабельного домена иммуноглобулина (то есть когда одиночный вариабельный домен иммуноглобулина связывает антиген независимо от дополнительных вариабельных доменов). "Однодоменное антитело" или "dAb" представляет собой то же самое, что и "одиночный вариабельный домен иммуноглобулина", который способен к связыванию с антигеном, как этот термин используется в данном описании. Одиночный вариабельный домен иммуноглобулина может представлять собой вариабельный домен человеческого антитела, но также включает одиночные вариабельные домены антител от других видов, таких как грызуны (например, как раскрыто в WO 00/29004), VHH dAbs (нанотела) усатых акул и представителей семейства верблюдовых. VHH верблюдовых представляют собой полипептиды одиночного вариабельного домена иммуноглобулина, которые получены от представителей видов, включающих верблюдов, лам, альпак, дромадеров и гуанако, которые продуцируют антитела только с тяжелыми цепями, естественным образом лишенные легких цепей. Такие VHH домены могут быть гуманизированы согласно стандартным методикам, доступным в данной области техники, и такие домены тем не менее считаются "однодоменными антителами" согласно изобретению. При использовании в данном описании "VH" включает VHH домены верблюдовых. NARV представляют собой другой тип одиночного вариабельного домена иммуноглобулина, которые были идентифицированы у хрящевых рыб, включая усатых акул. Эти домены также известны как "Novel Antigen Receptor variable region" (обычно сокращено до V(NAR) или NARV). Подробности см. в Mol. Immunol. 44, 656-665 (2006) и US 20050043519 A.
Термин "эпитоп-связывающий домен" относится к домену, который специфически связывает антиген или эпитоп независимо от другой V-области или домена, он может представлять собой однодоменное антитело (dAb), например человека, одиночный вариабельный домен иммуноглобулина верблюдовых или акулы.
Термин "антигенсвязывающий участок", используемый в данном описании, относится к сайту белка, который способен к специфическому связыванию антигена, он может представлять собой одиночный домен, например эпитоп-связывающий домен, или он может представлять собой спаренные VH/VL домены, которые могут быть обнаружены в стандартном антителе. В некоторых аспектах изобретения антигенсвязывающие участки могут образовывать одноцепочечные Fv (ScFv) домены.
Термины "mAbdAb" и dAbmAb" при использовании в данном описании относятся к антигенсвязывающим белкам по настоящему изобретению. Эти два термина могут применяться взаимозаменяемо, и предназначены иметь одно и то же значение при использовании в данном описании.
В одном аспекте настоящего изобретение направлено на способ очистки белка, содержащего антитело, фрагмент антитела или одиночный вариабельный домен иммуноглобулина, из раствора, содержащего по меньшей мере одну загрязняющую примесь, посредством хроматографии с суперантигеном, включающий: (а) адсорбирование белка на суперантигене, иммобилизованном на твердом носителе; б) удаление по меньшей мере одной загрязняющей примеси посредством приведения в контакт иммобилизованного суперантигена, содержащего адсорбированный белок, с первым промывочным буфером, содержащим алифатический карбоксилат; и (в) элюирование белка из суперантигена, иммобилизованного на твердом носителе.
В одном воплощении аффинную хроматографию выполняют, используя суперантиген. "Суперантиген" относится к типичным лигандам, которые взаимодействуют с членами суперсемейства иммуноглобулинов в сайте, который отличен от сайтов связывания лиганда-мишени этих белков. Стафиллококковые энтеротоксины являются примерами суперантигенов, которые взаимодействуют с Т-клеточными рецепторами. Суперантигены, которые связывают антитела, включают, но без ограничения ими, белок G, который связывается с константной областью IgG (Bjorck and Kronvall, J. Immunol., 733:969 (1984)); белок А, который связывается с константной областью IgG и VH доменами (Forsgren и Sjoquist, J. Immunol., 97: 822 (1966)); и белок L, который связывается с Vu доменами (Bjorck, J. Immunol., 740: 1194 (1988). В одном воплощении суперантиген выбирают из группы, состоящей из белка А, белка G и белка L.
При использовании в данном описании термин "белок А" охватывает белок А, выделенный из природного источника, белок А, полученный синтетическим путем (например посредством пептидного синтеза или посредством рекомбинантных технологий), и его варианты, которые сохраняют способность связывать белки, которые имеют область CH2/CH3. Белок А может быть приобретен коммерческим образом от Repligen, Pharmacia и Fermatech.
При использовании в данном описании "аффинная хроматография" представляет собой хроматографический метод, в котором для осуществления хроматографического разделения используются специфические обратимые взаимодействия между биомолекулами, а не общие свойства биомолекул, такие как изоэлектрическая точка, гидрофобность или размер. "Аффинная хроматография с белком А" или "хроматография с белком А" относится к специфическому методу аффинной хроматографии, в котором используется аффинность IgG-связывающих доменов белка А в отношении Fc-участка молекулы иммуноглобулина. Этот Fc-участок содержит константные домены CH2 и CH3 иммуноглобулина человека или животного или домены иммуноглобулина, по существу подобные им. Белок А охватывает нативный белок из клеточной стенки Staphylococcus aureus, белок А, полученный рекомбинантными или синтетическими методами, и варианты, которые сохраняют способность связываться с Fc-областью. На практике хроматография с белком А охватывает использование белка А, иммобилизованного на твердом носителе. См. Gagnon, Protein A Affinity Chromotography, Purification Tools for Monoclonal Antibodies, pp. 155-198, Validated Biosystems, 1996. Белок G и белок L также можно применять для аффинной хроматографии. Твердый носитель представляет собой неводную матрицу, к которой прилипает белок А (например колонку, смолу, матрицу, шарики, гель и так далее). Такие носители включают агарозу, сефарозу, стекло, диоксид кремния, полистирол, коллодированный уголь, песок, полиметакрилат, поперечно-сшитый поли(стирол-дивинилбензол) и агарозу с нагруженной декстраном поверхностью и любой другой подходящий материал. Такие вещества хорошо известны в данной области техники. Для закрепления суперантигена на твердом носителе может быть использован любой подходящий метод. Способы фиксации белков на подходящих твердых носителях хорошо известны в данной области техники. См., например, Ostrove, in Guide to Protein Purification, Methods in Enzymology, 182: 357-371, 1990. Такие твердые носители с иммобилизованным белком А или белком L либо без них легко доступны из многих коммерческих источников, включая такие, как Vector Laboratory (Burlingame, Calif.), Santa Cruz Biotechnology (Santa Cruz, Calif.), BioRad (Hercules, Calif.), Amersham Biosciences (часть GE Healthcare, Uppsala, Sweden) и Millipore (Billerica, Mass.).
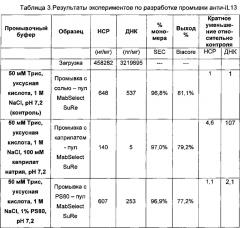
Алифатический карбоксилат может быть либо прямоцепочечным, либо разветвленным. В некоторых воплощениях алифатический карбоксилат представляет собой алифатическую карбоновую кислоту или ее соль, либо источником алифатического карбоксилата является алифатическая карбоновая кислота или ее соль. В некоторых воплощениях алифатический карбоксилат является прямоцепочечным и выбран из группы, состоящей из метановой (муравьиной) кислоты, этановой (уксусной) кислоты, пропановой (пропионовой) кислоты, бутановой (масляной) кислоты, пентановой (валериановой) кислоты, гексановой (капроновой) кислоты, гептановой (этантовой) кислоты, октановой (каприловой) кислоты, нонановой (пеларгоновой) кислоты, декановой (каприновой) кислоты, ундекановой (ундециловой) кислоты, додекановой (лауриновой) кислоты, тридекановой (тридециловой) кислоты, тетрадекановой (миристиновой) кислоты, пентадекановой кислоты, гексадекановой (пальмитиновой) кислоты, гептадекановой (маргариновой) кислоты, октадекановой (стеариновой) кислоты и эйкозановой (арахиновой) кислоты или любых их солей. Таким образом, алифатический карбоксилат может содержать углеродный остов из 1-20 атомов углерода в длину. В одном воплощении алифатический карбоксилат содержит остов из 6-12 атомов углерода. В одном воплощении алифатический карбоксилат выбран из группы, состоящей из капроата, гептаноата, каприлата, деканоата и додеканоата. В одном воплощении источник алифатического карбоксилата выбран из группы, состоящей из алифатической карбоновой кислоты, натриевой соли алифатической карбоновой кислоты и калиевой соли алифатической карбоновой кислоты. В одном воплощении промывочный буфер содержит каприлат натрия, деканоат натрия или додеканоат натрия. В одном воплощении промывочный буфер содержит от примерно 10 мМ до примерно 125 мМ каприлата натрия, от примерно 1 мМ до примерно 30 мМ деканоата натрия или от примерно 1 мМ до примерно 30 мМ додеканоата натрия. В одном воплощении промывочный буфер содержит примерно 100 мМ каприлата натрия, примерно 20 мМ деканоата натрия или примерно 20 мМ додеканоата натрия. В одном воплощении промывочный буфер содержит от примерно 1 мМ до примерно 500 мМ ацетата натрия. В одном воплощении промывочный буфер содержит примерно 300 мМ ацетата натрия.
В одном воплощении по меньшей мере одна загрязняющая примесь представляет собой белок клетки-хозяина или ДНК клетки-хозяина. В некоторых воплощениях клетка-хозяин выбрана из группы, состоящей из клеток СНО (яичника китайского хомячка), клеток NS0, клеток Sp2/0, клеток COS, клеток К562, клеток ВНК, клеток PER.C6 и клеток НЕК (почки эмбриона человека). Клетка-хозяин может представлять собой бактериальную клетку, выбранную из группы, состоящей из Е. coll (например W3110, BL21), B. subtilis и/или других подходящих бактерий; эукариотические клетки, такие как клетки грибов или дрожжевые клетки (например Pichia pastoris, Aspergillus sp., Saccharomyces cerevisiae, Schizosaccharomyces pombe, Neurospora crassa).
"Буфер" представляет собой забуференный раствор, который препятствует изменениям рН посредством его сопряженных кислотно-основных компонентов.
"Уравновешивающий буфер" в данном описании представляет собой буфер, используемый для приготовления твердой фазы для хроматографии.
"Загрузочный буфер" представляет собой буфер, который используют для загрузки смеси белка и загрязняющей(их) примеси(ей) на хроматографическую матрицу. Уравновешивающий и загрузочный буферы могут быть одинаковыми.
"Элюирующий буфер" используют для элюирования белков из хроматографической матрицы.
"Соль" представляет собой соединение, образованное посредством взаимодействия кислоты и основания.
В одном воплощении промывочный буфер содержит органическую кислоту, соль щелочного металла или аммониевую соль сопряженного основания органической кислоты и органическое основание. В одном воплощении промывочный буфер готовят без добавления NaCl.
В одном воплощении органическая кислота включает, но без ограничения ими, муравьиную кислоту, уксусную кислоту, молочную кислоту, лимонную кислоту, яблочную кислоту, малеиновую кислоту, глицин, фосфорную кислоту, глицил-глицин, янтарную кислоту, TES (2-{[трис(гидроксиметил)-метил]амино}этансульфоновая кислота), MOPS (3-(N-морфолино)-пропансульфоновая кислота), PIPES (пиперазин-N,N'-бис(2-этансульфоновая кислота)) и MES (2-Щморфолино)этансульфоновая кислота).
В одном воплощении органическое основание включает, но без ограничения ими, группу, состоящую из трис-основания, аргинина, бис-трис, бис-трис-пропана, бицина (N,N-бис(2-гидроксиэтил)глицин), HEPES (4-2-гидроксиэтил-1-пиперазинэтансульфоновая кислота), TAPS (3-{[трис(гидроксиметил)метил]амино}пропансульфоновая кислота) и трицина (N-трис(гидроксиметил)метилглицин).
В одном воплощении сопряженное основание органической кислоты представляет собой натриевую, калиевую или аммониевую соль сопряженного основания органической кислоты. В одном воплощении органическая кислота представляет собой уксусную кислоту, и сопряженное основание уксусной кислоты представляет собой натриевую соль.
В одном воплощении белок представляет собой антиген-связывающий белок. В одном воплощении антиген-связывающий белок представляет собой антитело. В одном воплощении антитело принадлежит к классу IgG. В одном воплощении антиген-связывающий белок представляет собой одиночный вариабельный домен иммуноглобулина.
В одном аспекте настоящее изобретение направлено на способ очистки белка из его содержащего загрязняющие примеси раствора посредством хроматографии с белком А, включающий:
(а) уравновешивание белка А, иммобилизованного на твердой фазе, уравновешивающим буфером для белка А;
(б) адсорбирование белка из содержащего загрязняющие примеси раствора на белке А, иммобилизованном на твердой фазе;
(в) удаление по меньшей мере одной загрязняющей примеси путем промывания твердой фазы первым промывочным буфером для белка А, содержащим от примерно 50 мМ до примерно 55 мМ трис-основания, от примерно 45 мМ до примерно 50 мМ уксусной кислоты, по меньшей мере один алифатический карбоксилат, при рН примерно 7,5, где алифатический карбоксилат выбран из группы, состоящей из примерно 100 мМ каприлата натрия, примерно 20 мМ деканоата натрия и примерно 20 мМ додеканоата натрия; и
(г) извлечение белка из твердой фазы элюирующим буфером для белка А. В одном воплощении все буферы готовят без добавления NaCl. В одном воплощении промывочный буфер для белка А дополнительно содержит от примерно 1 мМ до примерно 500 мМ ацетата натрия. В одном воплощении промывочный буфер для белка А содержит примерно 300 мМ ацетата натрия.
В одном воплощении уравновешивающий буфер содержит от примерно 50 мМ до примерно 55 мМ трис-основания, от примерно 45 мМ до примерно 50 мМ уксусной кислоты, при рН примерно 7,2; и элюирующий буфер содержит 1,8 мМ ацетата натрия и от примерно 28,2 мМ до примерно 300 мМ уксусной кислоты, при рН от примерно 2,4 до примерно рН 3,6.
В одном воплощении способ дополнительно включает следующую стадию после стадии (в) и перед стадией (г): удаление загрязняющих примесей путем промывания твердой фазы вторым промывочным буфером для белка А, содержащим 55 мМ трис-основания, 45 мМ уксусной кислоты, при рН примерно 7,2. В одном воплощении второй промывочный буфер для белка А приготовлен без добавления NaCl.
В одном воплощении способ дополнительно включает следующие стадии после стадии (г): (д) титрование раствора, содержащего извлеченный белок, до рН примерно 3,0 с помощью 30 мМ уксусной кислоты, 100 мМ HCl; (е) выдерживание раствора со стадии (д) при рН примерно 3,0 в течение от примерно 30 до примерно 60 минут; и (ж) доведение рН раствора со стадии (е) до рН примерно 7,5 посредством 1 М трис.
В одном воплощении способ дополнительно включает фильтрование раствора, полученного на стадии (ж).
В одном аспекте настоящее изобретение направлено на способ очистки белка из его содержащего загрязняющие примеси раствора посредством хроматографии с белком L, включающий:
(а) уравновешивание белка L, иммобилизованного на твердой фазе, уравновешивающим буфером для белка L;
(б) адсорбирование белка из содержащего загрязняющие примеси раствора на белке L, иммобилизованном на твердой фазе;
(в) удаление по меньшей мере одной загрязняющей примеси путем промывания твердой фазы первым промывочным буфером для белка L, содержащим от примерно 50 мМ до примерно 55 мМ трис-основания, от примерно 45 мМ до примерно 50 мМ уксусной кислоты, по меньшей мере один алифатический карбоксилат, при рН примерно 7,5, где алифатический карбоксилат выбран из группы, состоящей из примерно 100 мМ каприлата натрия, примерно 20 мМ деканоата натрия и примерно 20 мМ додеканоата натрия; и
(г) извлечение белка из твердой фазы при помощи элюирующего буфера для белка L. В одном воплощении все буферы готовят без добавления NaCl. В одном воплощении промывочный буфер для белка L дополнительно содержит от примерно 1 мМ до примерно 500 мМ ацетата натрия. В одном воплощении промывочный буфер для белка L содержит примерно 300 мМ ацетата натрия.
В одном воплощении уравновешивающий буфер содержит от примерно 50 мМ до примерно 55 мМ трис-основания, от примерно 45 мМ до примерно 50 мМ уксусной кислоты, при рН примерно 7,2; и элюирующий буфер содержит 1,8 мМ ацетата натрия и от примерно 28,2 мМ до примерно 300 мМ уксусной кислоты, при рН от примерно 2,4 до примерно рН 3,6.
В одном воплощении способ дополнительно включает следующую стадию после стадии (в) и перед стадией (г): удаление загрязняющих примесей путем промывания твердой фазы вторым промывочным буфером для белка L, содержащим 55 мМ трис-основания, 45 мМ уксусной кислоты, при рН примерно 7,2. В одном воплощении второй промывочный буфер для белка L готовят без добавления NaCl.
В одном воплощении способ дополнительно включает следующие стадии после стадии (г): (д) титрование раствора, содержащего извлеченный белок, до рН примерно 3,0 с помощью 30 мМ уксусной кислоты, 100 мМ HCl; (е) выдерживание раствора со стадии (д) при рН примерно 3,0 в течение от примерно 30 до примерно 60 минут; и (ж) доведение рН раствора со стадии (е) до рН примерно 7,5 посредством 1 М трис.
В одном воплощении способ дополнительно включает фильтрование раствора, полученного на стадии (ж).
"Раствор" может представлять собой среду для культивирования клеток, например поток питательных веществ клеточной культуры. Поток питательных веществ может быть профильтрованным. Раствор может представлять собой осветленную необработанную питательную среду (CUB)