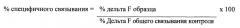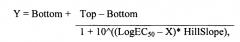Антитела к бета-амилоиду
Иллюстрации
Показать всеДанное изобретение относится к иммунологии. Предложена выделенная молекула антитела, которая является селективной в отношении связывания человеческого бета-амилоидного 1-42 пептида (Aβ1-42), а не человеческого бета-амилоидного 1-40 пептида (Aβ1-40). Также рассмотрена композиция, содержащая молекулу антитела, применение композиции при лечении болезни Альцгеймера, в улучшении когнитивной деятельности или замедлении снижения когнитивных способностей у пациента; способ снижения амилоидоза, лечения болезни Альцгеймера, улучшения когнитивной деятельности или замедления снижения когнитивных способностей у пациента, страдающего болезнью Альцгеймера или синдромом Дауна, и/или лечения макулярной дегенерации у индивидуума; выделенная нуклеиновая кислота, клетка-хозяин и способ получения молекулы антитела. Настоящее изобретение может найти дальнейшее применение в лечении состояний, ассоциированных с амилоидозом. 7 н. и 12 з.п. ф-лы, 19 ил., 16 табл., 7 пр.
Реферат
Область изобретения
Настоящее изобретение относится к антителам, которые связываются с человеческим бета-амилоидным 1-42 пептидом и его N-терминальными усечениями, совместно называемыми Аβn-42 пептиды, где n равно 1-29. Оно относится к антителам, которые являются селективными в отношении связывания с бета-амилоидным n-42 пептидом по сравнению с бета-амилоидным 1-40 пептидом. Настоящее изобретение также относится к применению антител к Аβn-42 для лечения состояний, ассоциированных с амилоидозом, в том числе болезни Альцгеймера.
Предпосылки изобретения
Болезнь Альцгеймера (AD) характеризуется нарастанием когнитивных нарушений, поражением памяти, что наносит ущерб социальной активности и профессиональной деятельности пациента. Дегенеративное заболевание вызывает утрату нервных клеток в головном мозге, что обуславливает когнитивные затруднения, связанные с речью и высшими функциями, такими как способность к логическому рассуждению, планированию, организации и мышлению, что, в конечном итоге, может приводить к изменениям личности. Конечные стадии заболевания характеризуются полной утратой способности к независимой деятельности.
Гистологически, AD (спорадическая и семейная) определяют по присутствию внутриклеточных нейрофибриллярных клубков (NFT) и внеклеточных бляшек. Бляшки представляют собой скопления β-амилоидного пептида (Аβ), образованного в результате неправильного расщепления белка-предшественника амилоида (АРР), трансмембранного белка, обнаруженного в нейронах и астроцитах в головном мозге. Отложения Аβ также обнаруживают в кровеносных сосудах пациентов, страдающих AD.
При AD особенно уязвимы холинергические нейроны, и последующее снижение количества нейромедиаторов негативно воздействует на другие нейромедиаторные системы. Другие симптомы заболевания включают оксидативный стресс, воспаление и апоптоз нейронов (запрограммированную клеточную смерть). У пациента, страдающего AD, широкомасштабная гибель нейронов приводит к снижению когнитивных способностей и, в конечном итоге, к смерти пациента. (Younkin, 1995; Borchelt et al., 1996; Selkoe, 1999).
Современные способы лечения являются только симптоматическими и представляются минимально эффективными с незначительными облегчениями симптомов на протяжении ограниченного периода времени. Однако, как полагают, сверхвыработка или изменения в уровнях Аβ являются ключевыми событиями в патогенезе спорадической и ранней AD. По этой причине, Аβ стал главной мишенью для разработки лекарственных средств, предназначенных для снижения его образования (Vassar et al., 1999) или для активации механизмов, которые ускоряют его клиренс из головного мозга.
Гипотеза амилоидного каскада предполагает, что выработка Аβ пептида негативно воздействует на функцию нейронов, тем самым, приводя к гибели нейронов и деменции при AD. Аβ вырабатывается из белка-предшественника амилоида (АРР), который расщепляется последовательно секретазами с образованием молекул с разными длинами. Основным компонентом бляшек является изоформа из 42 аминокислот, Аβ1-42, которая вовлечена в формирование нейротоксических олигомеров и формирование бляшек при патогенезе AD. Ряд изоформ Аβ, в том числе Аβ1-42, pGluAβ3-42, Аβ3-42 и 4-42, преобладает при AD головного мозга, из которых Аβ1-42 и Аβ4-42 являются основными формами в гиппокампе и коре при семейной и спорадической AD (Portelius et al., 2010).
Аβ, заканчивающийся остатком 42, является немногочисленным компонентом молекул Аβ, образуемых при процессинге АРР. Другие формы включают Аβ1-40 и N-терминальные усечения Аβn-40. Однако Аβ, заканчивающийся остатком 42, наиболее склонен к агрегации и приводит к отложению в амилоидных бляшках. В дополнение к наибольшей склонности к агрегации, Аβ1-42 пептид формирует растворимые полимеры с небольшим числом звеньев (или олигомеры), которые, как было показано, являются токсическими для нейронов в культуре. В отличие от крупных видимых отложений фибрилл, олигомеры не выявляются при типичных анализах на патологию. Олигомеры, характеризующиеся аналогичными свойствами, были выделены из головной мозга, больных AD, и они более тесно ассоциированы с прогрессированием заболевания, чем бляшки (Younkin, 1998; Walsh et al., 2005a; Walsh et al., 2005b).
Экспериментально полученные олигомеры, применяемые к срезам головного мозга или инъецируемые in vivo, вызывают прекращение долговременной потенциации (LTP) в гиппокампе, которая представляет собой форму хранения синаптической информации, хорошо известной как парадигма механизмов памяти (Lambert et al., 1998; Walsh et al., 2002; Wang et al., 2002). Растворимые олигомеры были вовлечены в физическую дегенерацию синапсов (Mucke et al., 2000). Реверсия нарушения памяти при помощи антител на мышиных моделях подтвердила развивающуюся концепцию, что олигомеры играют главную роль в синаптической недостаточности.
Генетические доказательства позволяют предположить, что повышенные количества Аβ1-42 и его N-терминальных усечений (Аβn-42) вырабатываются при многих, или даже при всех, генетических состояниях, которые вызывают семейную AD (Borchelt et al., 1996; Duff et al., 1996; Scheuner et al., 1996; Citron et al., 1998), что указывает на вероятность, что формирование амилоида может быть вызвано либо повышенным образованием Аβn-42, либо уменьшенным распадом или обоими процессами (Glabe, 2000). В частности, при семейной AD, вызывающей генетические мутации в гене АРР и/или в гене, кодирующем компонент комплекса γ-секретазы, пресенилин, повышается выработка Аβ1-42 относительно Аβ1-40. Также было высказано предположение, что абсолютное количество пептидов, вырабатываемых в головном мозге, может быть менее важным, чем соотношение Аβ пептидов (отраженное в изменении соотношения Аβ1-42 к Аβ1-40), в отношении образования токсических молекул Аβ (De Strooper, 2007; Kuperstein et al., 2010). В дополнение, при помощи животных моделей отложения амилоида, как на мышах, так и на Drosophila, можно предположить, что для образования отложений амилоида требуется Аβ1-42 (Greeve et al., 2004; Iijima et al., 2004; McGowan et al., 2005).
Результаты исследования вакцинации в 2000 подсказали возможные новые стратегии лечения AD. У трансгенной мыши PDAPP, в которой происходит сверхэкспрессия мутантного человеческого АРР (в котором аминокислота в положении 717 представляет собой фенилаланин вместо валина, встречающегося в норме), постепенно развивается множество нейропатологических признаков AD в зависимости от возраста и области головного мозга. Трансгенных животных иммунизировали пептидом Аβ1-42 либо перед появлением нейропатологий по типу AD (в возрасте 6 недель) или в старом возрасте (11 месяцев), когда отложение Аβ и некоторые последующие нейропатологические изменения хорошо сформировались. Иммунизация молодых животных фактически предупреждала развитие образования бляшек, дистрофии нейритов и астроглиоза. Лечение более старых животных также заметно снижало степень и прогрессирование этих AD-подобных нейропатологий. Было показано, что иммунизация Аβ1-42 приводила к образованию антител к Аβ и что Аβ-иммунореактивные моноцитные/микроглиальные клетки появлялись в области оставшихся бляшек (Schenk et al., 1999; Schenk et al., 2000). Однако, при применении на людях метод активной иммунизации привел к нескольким случаям менингоэнцефалита, наиболее вероятно, вследствие Т-клеточного ответа, и был прерван, хотя первоначальные результаты по эффективности действия были перспективными (Orgogozo et al., 2003; Gilman et al., 2005; Pride et al., 2008).
Вследствие этого, было исследовано несколько стратегий пассивной вакцинации. Периферического введения антител против Аβ было достаточно для снижения амилоидных бляшек (Bard et al., 2000). Несмотря на относительно небольшие сывороточные уровни антител, достигнутые в этих экспериментах, пассивно введенные антитела были способны проходить через гематоэнцефалический барьер и попадать в центральную нервную систему, покрывать бляшки и индуцировать клиренс уже существующего амилоида. При сравнении Aβ1-40-специфичного антитела, Aβ1-42-специфичного антитела и антитела, направленного против остатков 1-16 Аβ было показано, что все антитела снижали накопление Аβ в головном мозге мыши (Levites et al., 2006).
Позднее, было высказано предположение, что прохождение в ЦНС является наиболее вероятным путем проникновения для эффективного клиренса Аβ для пассивно вводимых антител (Golde et al., 2009). Однако, в дополнение к антителам, способным проходить через гематоэнцефалический барьер, в качестве возможного механизма действия была предложена гипотеза стока.
Гипотеза стока утверждает, что Аβ может удаляться из ЦНС непрямым образом, при помощи снижения концентрации пептида в плазме. В экспериментах, описывающих это, применяли антитело, которое связывает Аβ в плазме и, тем самым, удаляет Аβ из ЦНС. Это достигалось, поскольку антитело предупреждает приток Аβ из плазмы в ЦНС и/или меняет равновесие между плазмой и ЦНС вследствие снижения концентрации свободного Аβ в плазме (DeMattos et al., 2001). Также было показано, что средства связывания амилоида, не родственные антителам, являются эффективными в удалении Аβ из ЦНС в результате связывания в плазме. Было показано, что два средства связывания Аβ, гельзолин и GM1, которые удаляют Аβ плазмы, снижают или предупреждают амилоидоз головного мозга (Matsuoka et al., 2003).
Что касается безопасности, одним из признаков патогенеза при AD является церебральная амилоидная ангиопатия (САА), при этом происходит замещение гладкомышечных клеток сосудов на Аβ, главным образом Аβ1-40, в стенках мозговых артерий (Weller et al., 2003). Как было показано, лечение пациентов, страдающих AD, при помощи антител ко всем Аβ приводит к микрокровоизлияниям, отражающим удаление Аβ из стенки сосуда (Wilcock et al., 2009), что может неблагоприятно влиять на пациентов. Одним путем для избежания этого была разработка дегликозилированных антител, которые могут снижать механизмы клиренса, приводящие к микрокровоизлияниям и/или снижать скорость, с которой Аβ выводится из отложений в сосудах, предупреждая насыщение путей оттока (Wilcock et al., 2006).
Нацеленное воздействие на молекулы n-42β пептида при помощи Аβ42-специфичного антитела будет нацеливать на молекулу, которая представляет собой ключевую пептидную составляющую при AD головного мозга и является движущей силой образования бляшек. Антитело с первичной специфичностью в отношении молекул n-42-мономера и олигомера с небольшим числом звеньев, будет не только истощать эти молекулы, но также может предупреждать накопление других олигомерных молекул, которые, как было показано, токсичны для нейронов.
Краткое описание изобретения
Настоящее изобретение относится к полностью человеческим антителам, которые являются специфичными в отношении Аβ1-42 и его N-терминальных усечений и связываются с эпитопом между аминокислотами 29-42 Аβ42 пептида. Антитела по настоящему изобретению можно применять для профилактического и/или терапевтического лечения состояний, ассоциированных с бета-амилоидом, таких как AD, в том числе умеренных когнитивных нарушений (MCI) вследствие AD и синдрома Дауна.
Настоящее изобретение касается применения полностью человеческих антител для подавления изоформ Аβ пептида (n-42) в плазме, головном мозге и спинномозговой жидкости (CSF) для предупреждения накопления или способствовать устранению отложения Аβ n-42 изоформ в головном мозге и сосудистой системе головного мозга и для улучшения когнитивной деятельности.
В данном документе описано получение полностью человеческих антител к Аβ n-42 пептидам, которые распознают мономерные формы и олигомерные формы с небольшим числом звеньев (вплоть до и включая пентамер) Аβ n-42 и которые эпитопно картированы к области, охватывающей аминокислоты 17-42 на Аβ42 пептиде, более конкретно, к области, охватывающей аминокислоты 29-42 на Аβ42 пептиде.
Антитела согласно настоящему изобретению являются специфичными в отношении молекулы Аβ n-42 (где n является целым числом в диапазоне от 1 до 29) и, таким образом, можно ожидать селективно снижают ключевую движущую силу прогрессирования AD. Антитела согласно настоящему изобретению являются эффективными в связывании Аβ42 (а не Аβ40) в плазме, головном мозге и спинномозговой жидкости (CSF) человека, что приводит к повышенному клиренсу Аβ n-42 изоформ из головного мозга. Антитела согласно настоящему изобретению также эффективны в снижении связывания растворимых агрегатов Аβ42 с нейронами и, таким образом, часть антител, которая попадает в головной мозг, будет оказывать воздействие на здоровье нейронов.
В данном документе описаны сильные, высокоаффинные антитела, в том числе антитело с KD 320 пМ в отношении мономера. Такая высокая аффинность может обеспечивать эффективное подавление Аβ n-42 до уровней, обеспечивая профилактику и модификацию заболевания AD.
Уровни растворимых молекул Аβ42 и Аβ40 можно выявлять в головном мозге, CSF и крови при помощи стандартизированных анализов с применением антител, направленных против эпитопов на Аβ пептиде. Как показано на PK:PD крысы, описанной в данном документе, дозозависимое подавление свободного Аβ42 наблюдали в CSF крыс после периферического введения антитела. Также показано дозозависимое повышение общего Аβ42 в головном мозге крыс с несущественным воздействием на Аβ40 пептид.
Таким образом, в данном документе описаны антитела, которые характеризуются способностью проникать в головной мозг (0,1% общего периферического введения в CSF) и специфично подавлять ключевую токсическую молекулу Аβ42 (а не Аβ40) в CSF.
Специфичность и механизм действия антител согласно настоящему изобретению могут обеспечивать как профилактическое, так и терапевтическое лечение ряда заболеваний, связанных с накоплением амилоида, который накапливается в органах тела, в том числе различных стадий патогенеза заболевания AD: продромальной, легкой и умеренной AD, синдрома Дауна, а также макулярной дегенерации.
Антитела согласно настоящему изобретению могут обладать способностью обращать снижение когнитивных способностей, лечить снижение когнитивных способностей и предупреждать снижение когнитивных способностей у субъектов с диагнозом продромальная AD, от легкой до умеренной AD и синдром Дауна.
Соответственно, первый аспект настоящего изобретения относится к связывающим элементам в отношении человеческого Аβ1-42, особенно молекул антител.
Связывающие элементы, например молекулы антител, согласно настоящему изобретению могут характеризоваться каким-либо или всеми из следующих свойств.
Связывание с растворимым мономерным человеческим Аβ1-42 и/или олигомерным Аβ1-42.
Селективность в связывании Аβ1-42 по сравнению с Аβ1-40. Они могут не проявлять связывания с Аβ1-40 или связывание может быть несущественным. К примеру, молекулы антител согласно настоящему изобретению могут связывать мономерный Аβ1-42 с константой диссоциации (Kd), составляющей 500 пМ или меньше. Они могут не связывать Аβ1-40, или могут связывать Аβ1-40 с Kd больше 1 мМ.
Связывание с человеческим Аβ17-42. Соответственно, молекула антитела может распознавать эпитоп между аминокислотами 17-42 Аβ1-42 пептида, более конкретно, молекула антитела может распознавать эпитоп между аминокислотами 29-42 Аβ1-42 пептида.
Связывание с растворимым мономерным человеческим 3-пиро-42 (пироглутамат 3) и 11-пиро-42 (пироглутамат 11).
Связывание с человеческим Аβ1-43. И
Перекрестная реактивность с мышиным Аβ1-42.
Связывающий элемент может содержать набор HCDR и/или набор LCDR молекулы антитела, которая описана в данном документе. Примеры молекул антител согласно настоящему изобретению содержат VH-домен, содержащий набор HCDR (HCDR1, HCDR2 и HCDR3), и VL-домен, содержащий набор LCDR (LCDR1, LCDR2 и LCDR3), где HCDR и LCDR представляют собой HCDR и LCDR, соответственно, любого из антител Abet0380, Abet0007, Abet0144, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0344, Abet0368, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 или их GL-версии, последовательности которых показаны в прилагаемом перечне последовательностей. Соответствие между молекулами антител и идентификаторами последовательностей в перечне последовательностей обозначено в таблице 16.
Молекула антитела для человеческого Аβ1-42 может содержать
(i) VH-домен, содержащий набор HCDR: HCDR1, HCDR2 и HCDR3, расположенные между каркасными областями, где аминокислотные последовательности набора HCDR являются такими, которые показаны в таблице 16 для любого из антител Abet0380, Abet0007, Abet0144, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0344, Abet0368, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 или их GL-версии,
или может содержать такой набор HCDR с одной или двумя аминокислотными мутациями; и
(ii) VL-домен, содержащий набор LCDR: LCDR1, LCDR2 и LCDR3, расположенные между каркасными областями, где аминокислотные последовательности набора LCDR являются такими, которые показаны в таблице 16 для любого из антител Abet0380, Abet0007, Abet0144, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0344, Abet0368, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 или их GL-версии,
или может содержать такой набор LCDR с одной или двумя аминокислотными мутациями.
Молекула антитела согласно настоящему изобретению может содержать
(i) VH-домен, содержащий набор HCDR из Abet0380 или Abet0380 GL, где аминокислотные последовательности HCDR Abet0380 представляют собой
| HCDR1 | SEQ ID NO: 525, |
| HCDR2 | SEQ ID NO: 526 и |
| HCDR3 | SEQ ID NO: 527, |
или может содержать набор HCDR из Abet0380 или Abet0380 GL с одной или двумя аминокислотными мутациями и
(ii) VL-домен, содержащий набор LCDR из Abet0380 или Abet0380 GL, где аминокислотные последовательности LCDR Abet0380 представляют собой
| LCDR1 | SEQ ID NO: 534, |
| LCDR2 | SEQ ID NO: 535 и |
| LCDR3 | SEQ ID NO: 536, |
или может содержать набор LCDR из Abet0380 или Abet0380 GL с одной или двумя аминокислотными мутациями.
Молекула антитела может содержать
(i) VH-домен, содержащий набор HCDR: HCDR1, HCDR2 и HCDR3, расположенные между каркасными областями, где аминокислотные последовательности HCDR представляют собой
| HCDR1 | SEQ ID NO: 525, |
| HCDR2 | SEQ ID NO: 526 и |
| HCDR3 | SEQ ID NO: 527, |
или может содержать такой набор HCDR с одной или несколькими аминокислотными заменами, где одна или несколько замен выбраны из показанных в таблице 12 или таблице 14;
и
(ii) VL-домен, содержащий набор LCDR: LCDR1, LCDR2 и LCDR3, расположенные между каркасными областями, где аминокислотные последовательности LCDR представляют собой
| LCDR1 | SEQ ID NO: 534, |
| LCDR2 | SEQ ID NO: 535 и |
| LCDR3 | SEQ ID NO: 536, |
или может содержать такой набор LCDR с одной или несколькими аминокислотными заменами, где одна или несколько замен выбраны из показанных в таблице 13 или таблице 15;
VH-домен молекулы антитела может содержать область FW1, в которой аминокислотные остатки в положениях 26-30 по Kabat выбраны из показанных в таблице 14.
VH-домен молекулы антитела может содержать каркасные области тяжелой цепи FW1, FW2, FW3 и FW4, где аминокислотные последовательности каркасных областей тяжелой цепи представляют собой
| FW1 | SEQ ID NO: 528, |
| FW2 | SEQ ID NO: 529, |
| FW3 | SEQ ID NO: 530 и |
| FW4 | SEQ ID NO: 531, |
или где FW1 включает SEQ ID NO: 528 с одной или несколькими аминокислотными заменами, где одна или несколько замен в FW1 выбраны из показанных в таблице 12 или таблице 14.
VL-домен молекулы антитела может содержать каркасные области легкой цепи FW1, FW2, FW3 и FW4, где аминокислотные последовательности каркасных областей легкой цепи представляют собой
| FW1 | SEQ ID NO: 537, |
| FW2 | SEQ ID NO: 538, |
| FW3 | SEQ ID NO: 539 и |
| FW4 | SEQ ID NO: 540. |
Молекула антитела согласно настоящему изобретению может содержать
(i) аминокислотную последовательность VH-домена, показанную в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии,
или может содержать аминокислотную последовательность с одной или двумя аминокислотными мутациями; и
(ii) аминокислотную последовательность VL-домена, показанную в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии,
или может содержать такую аминокислотную последовательность с одной или двумя аминокислотными мутациями.
Молекула антитела согласно настоящему изобретению может содержать VH-домен с аминокислотной последовательностью, которая по меньшей мере на 85% идентична SEQ ID NO: 524, и VL-домен с аминокислотной последовательностью, которая по меньшей мере на 85% идентична SEQ ID NO: 533, где в VH-домене:
аминокислота 26 представляет собой М, G или S;
аминокислота 27 представляет собой G, F или D;
аминокислота 28 представляет собой N, Т, D или Н;
аминокислота 29 представляет собой F;
аминокислота 30 представляет собой N, S, K или Р;
аминокислота 31 представляет собой Y, V, R, Е или Т;
аминокислота 32 представляет собой Q, Y, D, S или Е;
аминокислота 33 представляет собой Т, Р, I или V;
аминокислота 34 представляет собой М;
аминокислота 35 представляет собой W;
аминокислота 50 представляет собой V;
аминокислота 51 представляет собой I;
аминокислота 52 представляет собой G;
аминокислота 52а представляет собой K, S или А;
аминокислота 53 представляет собой Т, S, N, D, G или Q;
аминокислота 54 представляет собой N, G, Т или Р;
аминокислота 55 представляет собой Е, G, N, K или Т;
аминокислота 56 представляет собой N, Т, R или K;
аминокислота 57 представляет собой I, Т, K или V;
аминокислота 58 представляет собой А, V или Т;
аминокислота 59 представляет собой Y;
аминокислота 60 представляет собой А;
аминокислота 61 представляет собой D;
аминокислота 62 представляет собой S;
аминокислота 63 представляет собой V;
аминокислота 64 представляет собой K;
аминокислота 65 представляет собой G;
аминокислота 95 представляет собой Е;
аминокислота 96 представляет собой W;
аминокислота 97 представляет собой М;
аминокислота 98 представляет собой D;
аминокислота 99 представляет собой Н;
аминокислота 100 представляет собой S;
аминокислота 100а представляет собой R;
аминокислота 100b представляет собой Р;
аминокислота 100с представляет собой Y;
аминокислота 100d представляет собой Y;
аминокислота 100е представляет собой Y;
аминокислота 100f представляет собой Y;
аминокислота 100g представляет собой G;
аминокислота 100h представляет собой М;
аминокислота 101 представляет собой D;
аминокислота 102 представляет собой V;
и где в VL-домене:
аминокислота 24 представляет собой S;
аминокислота 25 представляет собой G;
аминокислота 26 представляет собой Н;
аминокислота 27 представляет собой N;
аминокислота 28 представляет собой L или I;
аминокислота 29 представляет собой Е или G;
аминокислота 30 представляет собой D;
аминокислота 31 представляет собой K;
аминокислота 32 представляет собой F или W;
аминокислота 33 представляет собой А или V;
аминокислота 34 представляет собой S;
аминокислота 50 представляет собой R;
аминокислота 51 представляет собой D;
аминокислота 52 представляет собой D;
аминокислота 53 представляет собой K;
аминокислота 54 представляет собой R;
аминокислота 55 представляет собой Р;
аминокислота 56 представляет собой S;
аминокислота 89 представляет собой S или Q;
аминокислота 90 представляет собой S или А;
аминокислота 91 представляет собой Q;
аминокислота 92 представляет собой D;
аминокислота 93 представляет собой Т или S;
аминокислота 94 представляет собой V или Т;
аминокислота 95 представляет собой Т;
аминокислота 96 представляет собой R;
аминокислота 97 представляет собой V.
Молекула антитела согласно настоящему изобретению может содержать VH-домен с аминокислотной последовательностью, которая по меньшей мере на 85% идентична SEQ ID NO: 524, и VL-домен с аминокислотной последовательностью, которая по меньшей мере на 85% идентична SEQ ID NO: 533, где в YH-домене:
аминокислота 26 представляет собой М, G, S, V, A, N, Т или Н;
аминокислота 27 представляет собой G, F, S, Y, Е, D или Р;
аминокислота 28 представляет собой N, Q, Н, V, Е, Т, A, S, D, М или Р;
аминокислота 29 представляет собой F, I, Y, S, L или W;
аминокислота 30 представляет собой N, S, Т, Q, K, Н, R, G, Р, Е, K, А или D;
аминокислота 31 представляет собой Y, Н, K, Е, N, Т, R, V, Р, М, F, I, D или W;
аминокислота 32 представляет собой Q, Y, D, N, S, Е или Т;
аминокислота 33 представляет собой Т, Р, I или V;
аминокислота 34 представляет собой М или L;
аминокислота 35 представляет собой W;
аминокислота 50 представляет собой V;
аминокислота 51 представляет собой I;
аминокислота 52 представляет собой G;
аминокислота 52а представляет собой K, S, Р, A, N, G, Е, D, V или Т;
аминокислота 53 представляет собой Т, S, N, Н, Q, D, G или Е;
аминокислота 54 представляет собой N, G, Р, Т, Q, Е, М, K или А;
аминокислота 55 представляет собой Е, G, K, N, Q, Т, Н, D или А;
аминокислота 56 представляет собой N, Т, A, R или K;
аминокислота 57 представляет собой I, Т, N, S, K, F, Q, V или L;
аминокислота 58 представляет собой А, V, S, Т или N;
аминокислота 59 представляет собой Y;
аминокислота 60 представляет собой А;
аминокислота 61 представляет собой D;
аминокислота 62 представляет собой S, А или Т;
аминокислота 63 представляет собой V;
аминокислота 64 представляет собой K;
аминокислота 65 представляет собой G;
аминокислота 95 представляет собой Е;
аминокислота 96 представляет собой W;
аминокислота 97 представляет собой М;
аминокислота 98 представляет собой D или G;
аминокислота 99 представляет собой Н или R;
аминокислота 100 представляет собой S;
аминокислота 100а представляет собой R;
аминокислота 100b представляет собой Р;
аминокислота 100с представляет собой Y;
аминокислота 100d представляет собой Y;
аминокислота 100е представляет собой Y;
аминокислота 100f представляет собой Y;
аминокислота 100g представляет собой G;
аминокислота 100h представляет собой М или I;
аминокислота 101 представляет собой D;
аминокислота 102 представляет собой V или А;
и где в VL-домене:
аминокислота 24 представляет собой S или Т;
аминокислота 25 представляет собой G или Т;
аминокислота 26 представляет собой Н, R или Р;
аминокислота 27 представляет собой N или Н;
аминокислота 28 представляет собой L, I, V, F или Т;
аминокислота 29 представляет собой Е, М, G, S или N;
аминокислота 30 представляет собой D, A, S, G или Н;
аминокислота 31 представляет собой K или S;
аминокислота 32 представляет собой F или W;
аминокислота 33 представляет собой А, V, М, Т или I;
аминокислота 34 представляет собой S, Т или А;
аминокислота 50 представляет собой R;
аминокислота 51 представляет собой D;
аминокислота 52 представляет собой D;
аминокислота 53 представляет собой K;
аминокислота 54 представляет собой R;
аминокислота 55 представляет собой Р;
аминокислота 56 представляет собой S;
аминокислота 89 представляет собой S, Q или А;
аминокислота 90 представляет собой S, А или Т;
аминокислота 91 представляет собой Q;
аминокислота 92 представляет собой D или G;
аминокислота 93 представляет собой Т, Q, S, N или K;
аминокислота 94 представляет собой V, Т или F;
аминокислота 95 представляет собой Т;
аминокислота 96 представляет собой R;
аминокислота 97 представляет собой V, S или А.
Молекула антитела согласно настоящему изобретению может содержать:
(i) VH-домен с аминокислотной последовательностью, которая по меньшей мере на 90% идентична аминокислотной последовательности VH-домена, показанной в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии; и
(ii) VL-домен с аминокислотной последовательностью, которая по меньшей мере на 90% идентична аминокислотной последовательности VL-домена, показанной в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии.
Молекула антитела может содержать VH-домен и VL-домен, которые по меньшей мере на 90% идентичны VH-домену и VL-домену, соответственно, любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии.
Указанная процентная доля идентичности VH- и/или VL-домена может составлять по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99%.
Молекула антитела может содержать VH-домен и VL-домен любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии.
К примеру, молекула антитела может содержать аминокислотную последовательность VH-домена Abet0380-GL под SEQ ID NO: 524 и аминокислотную последовательность VL-домена Abet0380-GL под SEQ ID NO: 533.
Молекула антитела согласно настоящему изобретению может представлять собой антитело, которое конкурирует за связывание с Аβ1-42 с:
(i) молекулой антитела, содержащей аминокислотную последовательность VH-домена под SEQ ID NO: 524 и аминокислотную последовательность VL-домена под SEQ ID NO: 533,
(ii) молекулой антитела, кодируемой нуклеиновой кислотой, депонированной под номером доступа NCIMB 41890, 41891 или 41892.
Молекула антитела может содержать VH-домен и VL-домен, кодируемые:
(i) последовательностью нуклеиновой кислоты Abet0380-GL, депонированной под номером доступа 41890;
(ii) последовательностью нуклеиновой кислоты Abet0144-GL, депонированной под номером доступа 41891; или
(iii) последовательностью нуклеиновой кислоты Abet0377-GL, депонированной под номером доступа 41892.
Молекула антитела может содержать VH-домен и VL-домен, содержащие HCDR и LCDR, соответственно, депонированного антитела, указанного выше. Молекула антитела может представлять собой антитело, кодируемое депонированной нуклеиновой кислотой, указанной выше.
Также в данном документе описаны молекулы нуклеиновой кислоты, кодирующие связывающие элементы согласно настоящему изобретению, клетки-хозяева, содержащие нуклеиновую кислоту, и способы получения связывающих элементов при помощи экспрессии нуклеиновой кислоты и выделения связывающего элемента.
Дополнительные аспекты настоящего изобретения связаны с композициями, включающими молекулу антитела по любому из предыдущих пунктов, и один или несколько дополнительных компонентов, таких как фармацевтически приемлемый наполнитель, и с такими композициями для медицинского применения. Композиции, включающие связывающие элементы по настоящему изобретению, могут предусматриваться для применения в способе лечения организма человека или животного.
Связывающиеся элементы, которые описаны в данном документе, могут применяться в способах диагностики или лечения субъектов-людей или животных, например людей. Связывающие элементы по настоящему изобретению могут применяться для понижения уровней Аβ1-42 у индивидуума и/или для снижения амилоидоза. Связывающие элементы могут применяться для снижения амилоидоза и для лечения, снижения или предупреждения состояния, ассоциированного с амилоидозом. Состояния и заболевания, которые можно лечить, включают болезнь Альцгеймера, такую как продромальная, легкая или умеренная AD. AD, подвергаемая лечению при помощи настоящего изобретения, может представлять собой семейную или спорадическую AD. Настоящее изобретение можно применять для предупреждения, снижения или обращения умеренных когнитивных нарушений (MCI), ассоциированных с AD. Когнитивную деятельность можно улучшать и/или снижение когнитивных способностей можно ослаблять у пациентов, страдающих AD, или пациентов, страдающих синдромом Дауна. Настоящее изобретение также можно применять для лечения или предупреждения макулярной дегенерации, которая связана с бета-амилоидом (Ding et al. PNAS 108(28): Е279-287 2011).
Соответственно, в дополнительном аспекте настоящее изобретение предусматривает способ снижения амилоидоза, лечения болезни Альцгеймера, улучшения когнитивной деятельности или замедление снижения когнитивных способностей при болезни Альцгеймера или синдроме Дауна и/или лечения макулярной дегенерации у индивидуума, включающий введение индивидууму связывающего элемента по настоящему изобретению.
Эти и другие аспекты настоящего изобретения описаны более подробно ниже.
Краткое описание графических материалов
На фигуре 1 показаны результаты HTRF™-анализа прямого связывания очищенного Fab Abet0007 и серии бета-амилоидных пептидов. Клон Abet0007 проявляет связывание с человеческим бета-амилоидным 1-42 пептидом (фигура 1А) и мышиным бета-амилоидным 1-42 пептидом (фигура 1С), но демонстрирует отсутствие связывания с человеческим бета-амилоидным 1-40 пептидом (фигура 1В) или скремблированным человеческим бета-амилоидным 1-42 пептидом (фигура 1D). Антитело положительного контроля и антитело отрицательного контроля применяли для проверки надежности данного анализа.
На фигуре 2 показано ингибирование образования комплекса из биотинилированного человеческого бета-амилоидного 1-42 пептида и IgG2 Abet0007 при повышении концентраций конкурирующих пептидов. Образование комплекса ингибируют человеческие бета-амилоидные 1-42 , 11-42 , 17-42 и 1-43 пептиды. Его не ингибируют человеческий бета-амилоидный 1-40 пептид или пептид отрицательного контроля .
На фигуре 3 показаны кривые поверхностного плазмонного резонанса (BIAcore) для связывания человеческого бета-амилоидного 1-42 пептида с иммобилизованным IgG2 Abet0007 при концентрации пептида, составляющей 100 нМ (верхняя кривая), 50 нМ, 25 нМ, 12,5 нМ, 6,2 нМ и 3,1 нМ (нижняя кривая). Каждую кривую подгоняют к модели Ленгмюра 1:1.
На фигуре 4 показаны фотографии образца in vitro иммуногистохимического окрашивания IgG2 Abet0007. (А) Антитело положительного контроля проявляет сильное распознавание бляшек (балл = 4) на срезах головного мозга человека, страдающего AD (генотип АроЕ 3/3; стадия по Braak 6; концентрация антитела 20 мкг/мл). (В) Лидерный клон IgG2 Abet0007 проявляет отсутствие распознавания бляшек (балл = 0) на смежном срезе головного мозга (20 мкг/мл). (С) То же самое антитело положительного контроля проявляет сильное распознавание бляшек (балл = 4) на срезах головного мозга мыши Tg2576 (мыши возрастом 18 месяцев; концентрация антитела 20 мкг/мл). (D) Лидерный клон IgG2 Abet0007 проявляет отсутствие распознавания бляшек (балл = 0) на смежном срезе головного мозга мыши (20 мкг/мл).
На фигуре 5 показано ингибирование образования комплекса из человеческого бета-амилоидного 1-42 пептида и IgG Abet0042 при повышении концентрации scFv Abet0007 и scFv Abet0144 . В этом анализе клон Abet0144 является значительно более сильным, чем исходный клон Abet0007. Антитело отрицательного контроля включают для сравнения.
На фигуре 6 показаны кривые поверхностного плазмонного резонанса (BIAcore) для связывания очищенного scFv Abet0144 с иммобилизованным человеческим бета-амилоидным 1-42 пептидом при концентрации scFv, составляющей 400 нМ (верхняя кривая), 200 нМ, 100 нМ, 50 нМ и 12,5 нМ (нижняя кривая). Каждую кривую подгоняют к модели Ленгмюра 1:1.
На фигуре 7 показаны кривые поверхностного плазмонного резонанса (BIAcore) для связывания человеческого бета-амилоидного 1-42 пептида с иммобилизованным антителом IgG1-TM Abet0144-GL при концентрации пептида, составляющей 50 нМ (верхняя кривая), 25 нМ, 12,5 нМ, 6,25 нМ, 3,13 нМ и 1,56 нМ (нижняя кривая). Каждую кривую подгоняют к модели Ленгмюра 1:1.