Производные 5-этил-2-амино-1, 3, 4-тиадиазола, обладающие обезболивающей, противовоспалительной, противоаллергической и анальгетической активностями
Иллюстрации
Показать всеИзобретение относится к производным 5-этил-2-амино-1,3,4-тиадиазола, а именно N-(5-этил-1,3,4-тиадиазол-2-ил)-амиду N-ацетиламиногексановой кислоты (соединение 1), 5-этил-2-амино-1,3,4-тиадиазол сукцинату (соединение 2), 5-этил-2-амино-1,3,4-тиадиазол D,L-гидроксисукцинату (соединение 3). Технический результат - производные 5-этил-2-амино-1,3,4-тиадиазола, обладающие обезболивающей, противовоспалительной, противоаллергической и анальгетической активностями. 6 табл., 4 пр.
(1),
(2),
(3)
Реферат
Область применения
Изобретение относится к области медицины, конкретно к химическим соединениям, а именно к новым производным 5-Этил-2-амино-1,3,4-тиадиазола, обладающим обезболивающей, противовоспалительной, противоаллергической и анальгетической активностями.
N-(5-этил-1,3,4-тиадиазол-2-ил)-амид N-ацетиламиногексановой кислоты,
Соединение 1
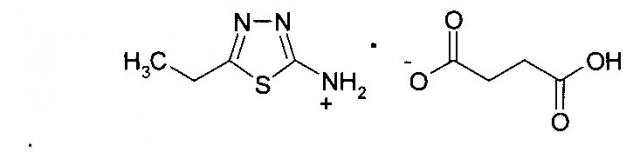
5-Этил-2-амино-1,3,4-тиадиазола сукцинат, Соединение 2
5-Этил-2-амино-1,3,4-тиадиазола D,L-гидроксисукцинат,
Соединение 3
Уровень техники
Одной из перспективных групп для поиска новых обезболивающих средств являются производные 1,3,4-тиадиазола. Производные тиадиазола по химической структуре имеют сходство с пиримидином и оксадиазолом. Атом серы тиадиазола придает этим соединениям липофильные свойства, что обеспечивает их проницаемость через биологические мембраны. Вместе с тем известно, что вещества, имеющие в своей структуре пятичленные гетероциклы, в том числе цикл тиадиазола, обладают широким спектром биологической активности. Среди производных тиадиазола известны соединения с бронхолитической, противовоспалительной, обезболивающей, антиоксидантной, противовирусной, антибактериальной, гепатопротекторной, антипролиферативной, нейропротекторной и другими видами активности. Преимуществом известных производных тиадиазола является большая широта терапевтического действия (Yijing Li et al., 2012).
Вышесказанное стимулирует поиск новых химических соединений с высокой противовоспалительной, антиаллергической и анальгезирующей активностями и относительной безопасностью применения среди новых производных тиадиазола.
Близким аналогом заявляемых соединений является известное вещество из класса тиадиазолов - N-(5-этил-1,3,4,- тиадиазол-2-ил)-4-нитробензамид (патент РФ №2448961), обладающее противовоспалительной, бронхолитической, противотуберкулезной активностями. Однако противовоспалительная активность этого соединения изучена только на модели сефадекс индуцированного бронхоальвеолита.
Известные противовоспалительные нестероидные лекарственные средства (НПВС), широко применяемые в медицинской практике, имеют ряд нежелательных побочных реакций: ульцерогенность, эрозивно-язвенные поражения желудочно-кишечного тракта с кровотечениями, выраженные изменения функции печени, почек и другие. Широко применяемые в медицине противовоспалительные, антиаллергические глюкокортикостероиды также обладают нежелательными побочными реакциями: отрицательное влияние на систему надпочечников, повышение АД, сниженте плотности костей и другие. (Машковский М.Д., Лекарственные средства, М. «Новая волна», 2013, с. 168-179, 561-562).
В доступной литературе заявляемые производные тиадиазола не описаны.
Раскрытие изобретения
Целью настоящего изобретения являются новые биологически активные производные 5-этил-2-амино-1,3,4-тиадиазола.
Поставленная цель достигается созданием новых производных тиадиазола и исследованием их биологической активности.
Предлагаемые новые производные 5-этил-1,3,4-тиадиазола обладают противовоспалительными свойствами, сопоставимыми с нестероидными противовоспалительными средствами НПВС, обезболивающей, противовоспалительной, противоаллергической и анальгетической активностями. В отличие от (НПВС) новые производные 5-этил-2-амино-1,3,4-тиадиазола практически не обладают ульцерогенностью.
Указанные свойства позволяют предполагать возможность применения предлагаемых новых соединений в качестве потенциальных противовоспалительных, антиаллергических лекарственных средств для лечения различных бронхолегочных заболеваний, воспалительных заболеваний опорнодвигательной системы, послеоперационных болей, ревматоидных, артритов, артрозов, васкулитов и других.
Заявляемые соединения могут быть использованы для создания лекарственных препаратов.
1. Синтез производных 5-этил-2-амино-1,3,4-тиадиазола (1,2,3)
Нами синтезированы новые производные тиадиазола, 5-этил-2-амино-1,3,4-тиадиазола, и исследована их биологическая активность.
Пример 1. N-(5-этил-1,3,4-тиадиазол-2-ил)-амид N-ацетиламиногексановой кислоты, соединение 1
В трехгорлую колбу, снабженную мешалкой, термометром и холодильником, загружают 100 мл ацетонитрила, 12,91 г (0,1 м) 2-амино-5-этил-1,3,4-тиадиазола, массу перемешивают, постепенно добавляют16,65 г (0,1 м) хлорангидрида N-ацетиламиногексановой кислоты, нагревают до кипения, через 3 часа отгоняют ацетонитрил, прибавляют 150 мл дистиллированной воды, тщательно перемешивают, нагревают до 80°С, через 15-20 минут осадок отфильтровывают, промывают на фильтре дистиллированной водой до рН 6-7 промывной воды, сушат до постоянного веса при 100-105°С.
Получают 26,48 г соединения 1.
Белый кристаллический порошок Тпл 208-210°С
Найдено, %: С 50,91; Н 7,23; N 19.56: S 11,23
C12H20N402S, Мм 284,34
Вычислено, %: С 50,70; Н 7,04; N 19.72: S 11,87
ИК-спектр, ∨см-1: 3380 (NH), 1782 (-N=C), 1540,1560 (СО NH амид)
УФ-спектр: 0,001% раствор в 0,01 м растворе натрия гидроксида имеет максимум при 257±2 нм.
Пример 2. N-(5-этил-1,3,4-тиадиазол-2-ил)-амид N-ацетиламиногексановой кислоты, соединение 1
Аналогично примеру 1 загружают 6.46 г (0,05 м) 2-амино-5-этил-1,3,4-тиадиазола, приливают 80 мл хлористого метилена и 18 мл пиридина. Массу перемешивают, постепенно добавляют 8,58 г (0,05 м) хлорангидрида N-ацетиламиногексановой кислоты, перемешивают при кипении 5-6 часов, отгоняют хлористый метилен, прибавляют 100 мл дистиллированной воды, нагревают при перемешивании до 80°С через 15-20 минут осадок отделяют, промывают на фильтре дистиллированной водой до рН 6-7 промывной воды, сушат до постоянного веса при 208-210°С.
Получают 12,95 г соединения 1 с выходом 93,5%. Тпл. 208-210°С.
ИК-спектр, ∨см-1: 3380 (NH), 1782 (-N=C), 1540,1560 (СО NH амид)
УФ-спектр: 0,001% раствор в 0,01 м растворе натрия гидроксида имеет максимум при 257±2 нм.
Пример 3. 2-амино-5-этил-1,3,4-тиадиазола бутандиоат (сукцинат), соединение 2
К 100 мл этилового спирта добавляют 12,91 г (0,1 м) 2-амино-5-этил-1,3,4-тиадиазола, 11.81 г (0,1 м) бутандиовой (янтарной) кислоты. Реакционную массу перемешивают и нагревают с обратным холодильником до 70-75°С, выдерживают в течение 30-40 минут. Растворитель отгоняют, осадок перекристаллизовывают из пропанола-2.
Получают 23,04 г, соединение 2, белые с желтоватым оттенком кристаллы, Тпл. 164-166°С.
Найдено %: С 38,83; Н 5,31; N 16,97: S 12,98
C8H13N304S, Мм 247,21
Вычислено %: С 38,87; Н 5,26; N 17,00: S 12,96
ИК-спектр, ∨см-1: 3346 (NH), 1780 (-N=C), 1540,1550 (СО NH амид)
УФ-спектр: 0,001% раствор в 0,1 м растворе кислоты хлористоводородной имеет максимум при 267±2 нм.
Пример 4. 2-амино-5-этил-1,3,4-тиадиазола гидроксибутандиоат (гидроксисукцинат), соединение 3
К 150 мл пропанола-2 добавляют 12,91 г (0,1 м) 2-амино-5-этил-1,3,4-тиадиазола, 13,42 г(0,1 м) гидроксибутандиовой кислоты. Реакционную массу перемешивают и нагревают до 75-80°С, выдерживают 1,0-1,5 часа. Растворитель отгоняют, осадок перекристаллизовывают из пропанола-2.
Получают 24,96 г соединения 3, белый с желтоватым оттенком кристаллический порошок, Тпл 134-136°С.
Найдено %: С 36,47; Н 5,09; N 15,91: S 12,11
C8H13N305S, Мм 263,29
Вычислено %: С 36,50; Н 4,94; N 15,99: S 12,17
ИК-спектр, ∨см-1: 3450 (ОН); 3348 (NH), 1782 (-N=C), 1565, (СОО-)
УФ-спектр: 0,001% раствор в 0,1 м растворе кислоты хлористоводородной имеет максимум при 267±2 нм.
2. Исследования биологической активности соединений 1, 2, 3
Экспериментальные исследования выполнены на 150 мышах (белых неинбредных) обоего пола массой 20,1±0,9 г и 170 белых неинбредных крысах обоего пола массой 234,4±4,9 г и на нелинейных мышах-самках (n=24), в соответствии с рекомендациями МЗРФ (Руководство по проведению доклинических исследований лекарственных средств. М. 2012)
Соединения 1, 2, 3 использовали в виде субстанций, вводили животным либо в виде растворов, применяя в качестве растворителя физиологический раствор натрия хлорида, либо в виде суспензии в полисорбате 80 (твин 80) или с 1% крахмалом (в случае внутрижелудочного введения).
В качестве препаратов сравнения использовали известные лекарственные препараты: диклофенак натрия ииндометацин, кетопрофен, а также глюкокортикостероиды, преднизалон. Животные контрольной группы получали физиологический раствор.
2.1. Оценка острой токсичности
Оценку острой токсичности новых производных тиадиазола осуществляли в диапазоне доз 320 мг/кг - 5120 мг/кг при внутрибрюшинном введении мышам, определяя значение LD50 по значению средних эффективных доз (В.Б. Прозоровский, 2007).
Результаты эксперимента показали, что значение LD50 при внутрибрюшинном введении мышам для соединения 1 - 834±81 мг/кг и 860,99 мг/кг для соединения 2 и 940,31 мг/кг для соединения 3.
Полученные данные позволили отнести соединения 1, 2, и 3 к малотоксичным веществам (3 класс токсичности) в соответствии с ГОСТом 12.1.007-76.
2.2. Оценка обезболивающей активности
2.2.1. Тест горячей пластины
Оценку обезболивающей активности новых производных тиадиазола проводили в экспериментах на белых неинбредных мышах с использованием теста горячей пластины. Было обнаружено, что при помещении подопытных животных на горячую пластину температурой 55°С порог болевой чувствительности (время до появления оборонительного рефлекса) составил 14,5±0,2 с.
Данные опытов с внутрибрюшинным введением диклофенака натрия (50 мг/кг) и соединения 2 приведены в таблице 1.
Обезболивающая активность в тесте горячей пластины при внутрибрюшинном введении мышам соединения 2 (48,9 мг/кг) и соединения 3 (45,3 мг/кг) отмечена на уровне диклофенака натрия (50 мг/кг).
2.2.2. Тест на модели химического раздражения
Данные приведены в таблице 2
Обезболивающая активность соединения 2 и соединения 3 при внутрибрюшинном введении в дозе 5% LD50 при термическом раздражении у мышей в тесте горячей пластины и при химическом раздражении брюшины у крыс была соответственно на уровне диклофенака натрия и кетопрофена.
2.3. Оценка противовоспалительной активности
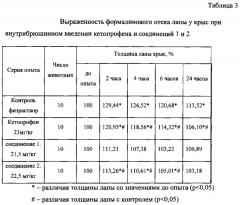
Противовоспалительную активность новых соединений оценивали на модели формалинового отека лапы у крыс. Было выявлено, что при субплантарном введении 0,1 мл 2% раствора формалина у подопытных крыс развивается выраженный отек лапы, о чем свидетельствует достоверное увеличение ее объема. Отмечено, что максимальный отек лапы (пик воспаления) развивался через 2 часа после введения формалина, при этом объем лапы у подопытных животных контрольной группы (физиологический раствор) увеличивался в среднем на 26,5% (р<0,05). Следует отметить, что и через 24 часа после введения формалина объем лапы у подопытных животных контрольной группы был в среднем на 13,5% больше, чем до введения флогогенного фактора (табл. 3).
В опытах с использованием кетопрофена (23 мг/кг) выраженность формалин-индуцированного отека лапы крыс была в среднем на 14% меньше, чем в контроле.
Эффективность соединений 1 и 2 была на уровне препарата сравнения кетопрофена или превосходила его.
Сопоставимые результаты были получены и в отношении торможения пролиферативной фазы воспаления. Так, у подопытных крыс, получавших ежедневно внутрижелудочно соединение 1 в дозе 21,5 мг/кг (0,05 DL50), пролиферативная реакция составила (р<0,05) 4,5 мг, что в среднем (р<0,05) в 5,98 раз меньше, чем в контроле. Торможение пролиферативной фазы воспаления при этом составило в среднем (р<0,05) 83,3%.
Пролиферативная реакция у крыс, получавших ежедневно внутрижелудочно кетопрофен в дозе 23 мг/кг (0,05 DL50), составила (р<0,05) 9,4 мг, что в среднем (р<0,05) в 2,86 раз меньше, чем в контроле.
Торможение пролиферативной фазы воспаления под влиянием соединения 1 составило (р<0,05) 83,3%, что в 1,28 раза меньше, чем при использовании кетопрофена (табл. 4).
2.4. Оценка анальгетической активности
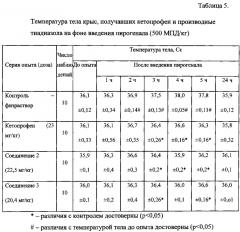
Оценку анальгетической активности соединений 2 и 3 осуществляли на модели гипертермической реакции у крыс, вызванной введением пирогенала.
В серии опытов с введением кетопрофена (23 мг/кг) достоверного повышения температуры тела у подопытных животных после введения пирогенала отмечено не было. Было выявлено, что соединение 2 при пероральном применении до введения пирогенного фактора также предупреждало повышение температуры тела у подопытных крыс. Выраженность жаропонижающей активности исследуемых соединений соответствовала эффектам кетопрофена (табл. 5).
2.5. Оценка противоаллергической активности
Анализ результатов экспериментов по оценке противоаллергической активности показал, что соединение 2 обладает способностью уменьшать выраженность реакции активной кожной анафилаксии у мышей. Было выявлено, что у подопытных мышей, сенсибилизированных овальбумином, при внутрикожном введении антигена (овальбумина) на 21-й день латентного периода сенсибилизации развивалась местная аллергическая реакция. Визуально кожная анафилаксия проявлялась окрашиванием участка кожи в синий цвет, что было связано с выходом красителя (Эванса синего) из кровеносного русла в очаг аллергического поражения (в месте внутрикожного ведения аллергена - овальбумина). В сериях опытов с использованием глюкокортикостероида преднизолона (0,5 мг/кг) выраженность реакции активной кожной анафилаксии была в среднем на 81,6% меньше, чем в контроле. Соединение 2 уменьшает выраженность кожной анафилаксии на 36,4%, по сравнению с контролем в 1,57 раза. Соединение 2 уменьшает выраженность кожной анафилаксии на 60,5%.
2.6. Оценка ульцерогенности
Патология желудочно-кишечного тракта, связанная с приемом нестероидных противовоспалительных препаратов (НПВП), является актуальной и серьезной проблемой современной медицины.
Ульцерогенность соединений 1 и 2 оценивали на крысах (n=80) при однократном и субхроническом внутрижелудочном введении. Острую НПВС-индуцированную гастропатию вызывали путем однократного внутрижелудочного введения стабилизированной твином 80 суспензии препарата крысам, лишенным пищи за 16 часов до исследования. Через 3 часа животных подвергали эвтаназии передозировкой эфира для наркоза, извлекали желудки, рассекали их по малой кривизне и промывали в физиологическом растворе для удаления содержимого. Проводили визуальную оценку состояния слизистой оболочки желудка с использованием лупы при ярком освещении. Определяли число и площадь деструкций, которые дифференцировали на точечные кровоизлияния, эрозии и язвы. Ульцерогенность соединений 1 и 2 оценивали по значению индекса Паулса (ИП) [Pauls F., Wick A.M., МасКеу Е.М. et al., 1947].
Ульцерогенность соединений 1 и 2 оценивали при однократном внутрижелудочном введении крысам (n=20) в дозе соединения 1 0,2% от DL50 (86,1 мг/кг) и при субхроническом внутрижелудочном введении (ежедневном в течение 4-х дней) крысам (n=20) в дозе соединения 1 0,05% от DL50 (21,5 мг/кг). Доза для соединения 2 составляла 38,36 мг/кг.
В качестве препарата сравнения использовали НПВП неселективного действия с известной ульцерогенностью индометацин.
Сравнительную ульцерогенность индометацина оценивали в остром эксперименте при однократном внутрижелудочном введении крысам (n=20) в дозе 0,2 DL50(10 мг/кг) и при субхроническом внутрижелудочном введении (ежедневном в течение 4-х дней) крысам (n=20) в дозе 0,05 DL50 (2,5 мг/кг).
Анализ морфологических изменений слизистой оболочки желудков крыс, получавших внутрижелудочно индометацин, подтвердил наличие у последних выраженных ульцерогенных свойств. Так, при однократном введении индометацина в дозе 10 мг/кг (0,2 DL50) через 3 часа у всех подопытных крыс были выявлены деструктивные изменения слизистой и серозной оболочек желудка. Установлено, что индометацин вызывал ярко выраженную гиперемию, отечность слизистой оболочки, гипертрофию желудочных складок, множественные точечные кровоизлияния и геморрагии, единичные глубокие дефекты, заполненные детритом. Кроме того, выявили множественные пристеночные сгустки крови, а также петехиальные кровоизлияния диаметром от 0,1 до 0,3 см.
Отмечено значительное количество точечных кровоизлияний (в среднем (р<0,05) 8,31 на одно животное), в то время как среднее количество эрозий и язв составило соответственно 1,21 и 2,16. Индекс Паулса составил 11,68 (таблица 6).
Анализ морфологических изменений слизистой и серозной оболочек желудков крыс, получавших однократно внутрижелудочно соединения 1 в дозе 86,1 мг/кг (0,2 DL50) и в дозе 21,5 мг/кг (0,05 DL50), показал, что слизистая оболочка желудков была серо-розовой с незначительной очаговой гиперемией, складки хорошо контурировались, отмечено полное отсутствие грубых язвенных повреждений и обширных кровотечений. Со стороны серозной оболочки отклонений от нормы обнаружено не было. Вместе с тем, у 35% подопытных животных было выявлено наличие незначительных деструктивных изменений.
Среднее количество незначительных точечных кровоизлияний на одно животное составило 2,12, что в 3,9 раза меньше, чем у животных, получавших внутрижелудочно индометацин. Также было отмечено, что количество эрозий на слизистой оболочке желудков крыс опытной группы было в 4,8 раз меньше, чем в группе сравнения, и составило в среднем (р<0,05) 0,25 на одно животное. Индекс Паулса у крыс, получавших однократно соединение 1, составил 0,83, что в 14 раз меньше, чем в группе сравнения.
При субхроническом введении значение индекса Паулса, характеризующего ульцерогенность, для соединения 1 в дозе 0,05 DL50 (21,5 мг/кг) составило 0,19, что было в 61,9 раза (р<0,05) меньше, чем для индометацина в дозе 0,05 DL50 (2,5 мг/кг).
Соединение 2 обладает меньшей ульцерогенной активностью, чем индометацин. Значение индекса Паулса при внутрижелудочном введении соединения 2 (38,36 мг/кг) было в 2,3 раза (р<0,05) меньше, чем при использовании индометацина (Таблица 6).
Проведенные эксперименты подтвердили выраженную ульцерогенность индометацина. При макроскопическом морфологическом исследовании желудка подопытных крыс, получавших внутрижелудочно индометацин (10 мг/кг), были выявлены выраженные изменения со стороны слизистой и серозной оболочек. Слизистая оболочка желудка была серо-белой, отечной со сглаженными складками и единичными глубокими дефектами, заполненными тканевым детритом. Кроме того, отмечались множественные пристеночные сгустки крови, а также петехиальные кровоизлияния диаметром от 0,1 до 0,3 см. Серозная оболочка желудка была гиперемирована, с выраженным сосудистым рисунком. Индекс Паулса при внутрижелудочном введении индометацина подопытным крысам составил 11,2.
Результаты макроскопических морфологических исследований показали, что в сериях опытов с использованием соединения (1) слизистая оболочка желудка была серо-розовой, складки хорошо контурировались, эрозивные дефекты не выявлялись, отмечалась незначительная очаговая гиперемия. Со стороны серозной оболочки отклонений от нормы выявлено не было.
Производные 5-этил-2-амино-1,3,4-тиадиазола, обладающие обезболивающей, противовоспалительной, противоаллергической и анальгетической активностями:
N-(5-этил-1,3,4-тиадиазол-2-ил)-амид N-ацетиламиногексановой кислоты (Соединение 1),
5-Этил-2-амино-1,3,4-тиадиазола сукцинат (Соединение 2),
5-Этил-2-амино-1,3,4-тиадиазола D,L-гидроксисукцинат (Соединение 3).