Биспецифические антитела против cd3*cd19
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии, в частности к иммунологии, и может быть использована для получения рекомбинантного моноклонального биспецифического антитела против CD3*CD19. Рекомбинантное моноклональное биспецифическое антитело против CD3*CD19, включающее две соединенных дисульфидными связями цепи, каждая из которых состоит из следующих доменов: VL (CD3)-L1-VH(CD19)-L2-VL(CD19)-L3-VH(CD3)-H-CH2-CH3(IgG2), где VL (CD3) и VH(CD3) - вариабельные домены легкой и тяжелой цепей антитела против CD3, VL(CD19) и VH (CD 19) - вариабельные домены легкой и тяжелой цепей антитела против CD 19, СН2-СН3 (IgG2) - Fc последовательность IgG2, характеризующаяся последовательностью SEQ ID NO: 5, L1, L2, L3 - линкерные последовательности, состоящие из 5-15 аминокислот, Н - шарнирная область, характеризующаяся последовательностью SEQ ID NO: 9. Группа изобретений относится также к фармацевтической композиции, содержащей вышеуказанное антитело и фармацевтически приемлемые носители и/или разбавители, для лечения В-клеточных заболеваний или истощения В-клеток. Заявленная группа изобретений позволяет получить рекомбинантное моноклональное биспецифическое антитело против CD3*CD19 для лечения гематологических злокачественных заболеваний В-клеточной природы. 5 н. и 8 з.п. ф-лы, 5 табл., 7 ил.
Реферат
Изобретение относится к биотехнологии, в частности к биспецифическим антителам против CD3*CD19, обладающим увеличенным временем полужизни в организме.
Биспецифические антитела (БАТ) против CD3*CD19 в настоящее время разрабатываются преимущественно для лечения злокачественных заболеваний B-клеток или истощения В-клеток, в том числе: неходжкинской лимфомы (WO 2010037835, RU 2228202), B-клеточного лейкоза (RU 2008129080), детской острой лимфобластической лейкемии (WO 20100052013) и т.д.
Ряд завершенных и проводимых в настоящее время исследований (например, J Clin Oncol, 2011, 29: 2493-8; Cancer, 2010, 116: 5568-74; Science, 2008, 321: 974-7; BLINCYTO, AmGen Recearch GmbH (NCT00560794, NCT00274742, NCT01207388, NCT01209286, NCT01471782, NCT01466179, NCT01741792); AFM11, Affimed Therapeutics AG (NCT02106091)) дают все основания полагать, что лекарственные препараты на основе биспецифических антител против CD3*CD19 обещают стать более эффективными в лечении упомянутых выше заболеваний.
Повышенная эффективность объясняется тем, что БАТ выполняют функцию адаптеров, которые физически соединяют T-клетки с опухолевыми клетками и запускают мощный сигнальный каскад рецепторного комплекса T-клеток посредством связывания с инвариантным компонентом CD3 T-клеточного рецептора. При этом второй (целевой) антиген-специфичный фрагмент узнает CD19, т.е. БАТ может соединить T-клетку и раковую клетку за счет одновременного связывания с CD3 и антигеном-мишенью. В этом случае происходит активация и пролиферация T-клеток, образование цитолитического синапса с высвобождением цитотоксических гранул и секреция цитокинов. Направленный лизис раковых клеток включает в себя перфорацию мембраны клетки-мишени с участием перфорина и последующий апоптоз, индуцированный гранзимами. Следует отметить, что после связывания с T-клетками, БАТ распознают антигены на поверхности раковой клетки так же, как обычные моноспецифические антитела. Таким образом, удается перенаправить цитотоксическую функцию T-клеток против опухолевых клеток, причем активность БАТ наблюдается уже при относительно низких (пикомолярных) концентрациях. Связывание же БАТ только с T-клеткой в отсутствие клетки-мишени не вызывает T-клеточную активацию.
Примеры биспецифических антител, известных из уровня техники (Blood, (ASH Annual Meeting Abstracts), 2009, 114:840), свидетельствуют о том, что эффективная терапевтическая концентрация препаратов, полученных на основе использования мультивалентных антител, существенно ниже по сравнению с классическими антительными противораковыми препаратами. Это способствует хорошей переносимости, возможности осуществления длительных курсов лечения и уменьшению риска побочных эффектов. Кроме того, требуемый объем и стоимость производства биспецифических антител ниже. Поэтому создание таких антител позволит существенно сократить масштабы и расходы на производство препаратов на их основе и, что самое главное, сделать эти лекарства доступными для всех пациентов, нуждающихся в подобной терапии.
В настоящее время было разработано и получено довольно много биспецифических антител против CD3*CD19. Однако наиболее перспективные из них представляют собой одноцепочечные молекулы как таковые, или нековалентные димеры, состоящие из одноцепочечных молекул. Например, блинатомумаб (антитело формата BiTE).
Однако при производстве одноцепочечных антител могут образовываться гомо- и гетеродимеры, что приводит к усложнению процесса выделения и очистки таких антител. С другой стороны, возможен обратный процесс - нежелательная диссоциация димеров, как это было показано, например, в статье Glockshuber et al., Biochemistry, 1990, vol. 29:1362-1367. Чтобы избежать этого, были предложены антитела, стабилизированные дисульфидными связями (Cell Oncol. (2012), 35:423-434), что позволило повысить как стабильность антитела в растворе, так и терапевтическую эффективность в сравнении с одноцепочечным антителом.
Наиболее близкими по формату, предложенному в настоящем изобретении, являются одноцепочечные антитела, раскрытые в патенте US 6759518. Указанные антитела состоят из двух пар вариабельных доменов различных специфичностей (A и B), разделенных пептидом из 12-40 аминокислот и, необязательно, содержат дополнительный эффекторный домен, представляющий собой пролекарство, активирующее фермент.
Однако такие антитела сохраняют указанные выше недостатки одноцепочечных антител, а наличие достаточно длинного пептида создает дополнительные степени свободы для вариабельных доменов, и, тем самым, может приводить к образованию мультимеров, что нежелательно. Кроме того, патент не содержит никакой информации о возможности получения антител против CD3*CD19 указанного типа.
В настоящее время наиболее успешным антителом против CD3*CD19 является препарат блинатумомаб (Blincyto, MT103), поэтому именно это антитело было выбрано в качестве препарата сравнения. Блинатумомаб состоит из двух доменов: домена анти-CD19 scFv из гибридомы HD37 и домена анти-CD3 scFv из гибридомы OKT3. Для получения антитела фрагмент ДНК VLCD19-VHCD19-VHCD3-VLCD3 экспрессируют в DHFR-отрицательных СНО клетках (патент RU 2228202). Блинатумомаб, в сравнении с полноразмерными антителами, имеет относительно небольшую молекулярную массу (55 кДа против 155 кДа), из-за чего быстро элиминируется из кровотока. Поэтому для достижения стабильных концентраций препарата в крови используется непрерывное внутривенное введение препарата в течение 2-4 недель за один цикл (в режиме две недели - капельница, две недели - перерыв), что достаточно трудно переносимо для пациента.
Задачей настоящего изобретения было получение антител против CD3*CD19 с увеличенным временем полужизни в организме человека, повышенной биодоступностью при подкожном введении, обладающих при этом достаточной эффективностью для применения в качестве лекарственных средств.
Таким образом, техническим результатом настоящего изобретения является расширение арсенала биспецифических антител против CD3*CD19 за счет создания антител, обладающих одной или несколькими из указанных выше характеристик.
Работа коллектива авторов настоящего изобретения над улучшением фармакокинетических характеристик антител против CD3*CD19 привела к созданию новой конструкции антитела, представляющей собой биспецифическую двуцепочечную молекулу, каждая цепь которой содержит Fc-часть обычного IgG и четыре связывающих домена, соединенных линкерами и расположенных в следующем порядке от N-конца к C-концу (см. Фиг. 1): VL(CD3)-L1-VH(CD19)-L2-VL(CD19)-L3-VH(CD3)-H-CH2-CH3(IgG2), где
VL(CD3), VL(CD19), VH(CD3) и VH(CD19) представляют собой вариабельные домены легкой и тяжелой цепей антител против CD3 и CD19 соответственно,
L1, L2, L3 - линкерные последовательности,
H - шарнирная область иммуноглобулина IgG2 и
CH2-CH3 (IgG2) - константная область Fc-домена иммуноглобулина IgG2. Две цепи соединены дисульфидными связями.
Обнаружилось, что такие биспецифические молекулы не только характеризуются увеличенным временем полужизни в организме в сравнении с антителом блинатомумаб (MT-103) за счет увеличенного размера самой молекулы, но также обладают усиленным цитотоксическим эффектом и неожиданно высокой биодоступностью при подкожном введении на уровне 60%. Последняя характеристика особенно важна, поскольку до настоящего времени, из-за малой биодоступности, препараты антител вводились преимущественно внутривенным путем, который более сложен и менее комфортен для пациента. Увеличенное время полувыведения, высокие эффективность и биодоступность при подкожном введении позволят уменьшить частоту введения препарата и увеличить удобство его применения.
В качестве линкеров могут быть использованы последовательности, состоящие из 5-15 аминокислот. Такая длина линкера, как подтвердили наши исследования, является наиболее оптимальной, так как позволяет вариабельным доменам антитела сохранять стабильную структуру и при этом достаточную подвижность. Полученные данные согласуются с результатами, представленными, например, в патентах RU 2228202 и US 6759518 для биспецифических одноцепочечных антител, где упоминается о длинах линкеров в 1-15 и 1-20 аминокислот, соответственно, при этом оптимальными считаются линкеры в 1-5 аминокислот.
Предпочтительно, чтобы аминокислоты, входящие в состав линкерной последовательности предложенных антител, выбирались из глицина, серина или аланина, или включали триплеты, составленные из указанных аминокислот. Предпочтительно, чтобы линкеры имели следующую структуру:
L1: (XXS)k, где k=2-3,
L2: (XXS)n, где n=4-5,
L3: (XXS)m, где m=2-3,
X=G, А.
Наиболее предпочтительно:
L1: GGSGGS,
L2: GGSGGSGGSGGSGGS,
L3: GGSGGS.
Настоящее изобретение также решает задачу конструирования плазмидной ДНК, содержащей последовательность биспецифического антитела предложенного формата, например, антитела GNR-047 против CD3*CD19, подходящей для экспрессии в клетках млекопитающих.
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pRA1451 размером 11308 п.о., кодирующей антитело GNR-047, а также подбора оптимальных условий производственного процесса, позволяющих получать антитела в клетках млекопитающих со стабильно высоким выходом, достаточным для промышленного производства.
Еще одним объектом изобретения является фармацевтическая композиция, в качестве активного компонента содержащая эффективное количество антитела против CD3*CD19, предложенного формата, предпочтительно, антитела GNR-047, а также применение такого антитела или фармацевтической композиции для лечения B-клеточных заболеваний, истощения В-клеток или замедления развития патологических состояний, ассоциированных с B-клеточными нарушениями. Предпочтительно, композиция содержит 10-100 мкг антитела.
Фармацевтические композиции по изобретению могут также включать необходимые компоненты, обычно используемые в фармацевтической химии, такие как буфер, поверхностно-активное вещество, стабилизатор и другие фармацевтически приемлемые добавки, растворители и наполнители.
Наиболее предпочтительным является использование следующих компонентов: натрий-фосфатный буфер, полисорбат 80 в качестве поверхностно-активного вещества, маннит - в качестве изотонического агента и гистидин - в качестве стабилизатора.
Фармацевтические композиции по изобретению, предназначенные для парентерального введения, дополнительно могут включать изотонические агенты, например, различные сахара, а также дополнительные стабилизаторы, например, аминокислоты, такие как аргинин, глицин, метионин, а также фармакологически совместимые консерванты и прочие целевые добавки, как это показано, например, в «Handbook of Pharmaceutical Excipients» (2ʺd ed. London: The Pharmaceutical Press; 1994).
Фармацевтические композиции по изобретению также могут быть получены в лиофилизированной форме, и в этом случае дополнительно включать фармацевтически приемлемые растворители и разбавители, например воду, физиологический раствор и другие обычно применяемые растворители.
Указанные эксципиенты могут использоваться в комбинации с другими активными ингредиентами (например, противораковыми или противовоспалительными средствами) при условии, что они не вызывают нежелательных эффектов.
Дозировка фармацевтических композиций по изобретению у пациентов может корректироваться в зависимости от веса, возраста, пола больного и наличия сопутствующих заболеваний.
Механизм действия предложенного антитела против CD3*CD19 аналогичен таковому, описанному для анти-CD3/анти-CD19 антитела - препарата блинатумомаб (MT103); и заключается в активации мультиспецифичного T-клеточного цитологического ответа против CD19+ клеток лимфомы. Поэтому фармацевтические композиции на основе антител предложенного формата против CD3*CD19, например на основе антитела GNR-047, согласно настоящему изобретению могут применяться для лечения всех гематологических раковых заболеваний (лимфом и лейкозов) B-клеточной природы, например, таких как B-клеточные опухоли из предшественников В-лимфоцитов, в том числе: B-лимфобластная лимфома/B-клеточный острый лимфобластный лейкоз из клеток-предшественников; B-клеточные опухоли из периферических (зрелых) B-лимфоцитов, в том числе: B-клеточный хронический лимфоцитарный лейкоз/лимфома из малых лимфоцитов (лимфоцитарная лимфома); B-клеточный пролимфоцитарный лейкоз; лимфоплазмоцитарная лимфома; селезеночная лимфома маргинальной зоны; волосатоклеточный лейкоз; плазмоклеточная миелома/плазмоцитома; экстранодальная B-клеточная лимфома маргинальной зоны MALT-типа; нодальная B-клеточная лимфома маргинальной зоны; фолликулярная лимфома; лимфома из клеток мантийной зоны; диффузная B-крупноклеточная лимфома; медиастинальная диффузная B-крупноклеточная лимфома; первичная экссудативная лимфома; лимфома/лейкоз Беркитта, а также для лечения аутоиммунных заболеваний, вызванных патологической регуляцией B-клеток, таких как ревматоидный артрит, системная красная волчанка, гломерулонефрит, рассеянный склероз и миастения гравис.
Описание фигур
Фиг. 1. Схематическое представление конструкции антитела GNR-047.
Фиг. 2. Схема конструирования экспрессионного вектора.
Фиг. 3. Карта экспрессионного вектора pRA1451.
Фиг. 4. Анализ способности препарата GNR-047 и MT-103 связывать нативный рецептор CD3 на клеточной линии Jurkat и рецептор CD19 на клеточной линии Raji.
Фиг. 5а. Исследование фармакокинетических характеристик GNR-047 при внутривенном введении в дозировке 0,5 мг/кг.
Фиг. 5б. Исследование фармакокинетических характеристик MT-103 при внутривенном введении в дозировке 0,5 мг/кг.
Фиг. 6а. Исследование фармакокинетических характеристик GNR-047 при подкожном введении в дозировке 2,0 мг/кг.
Фиг. 6б. Исследование фармакокинетических характеристик MT-103 при подкожном введении в дозировке 2,0 мг/кг.
Фиг. 7. Изменение среднего объема опухоли в процессе исследования
Описание последовательностей
SEQ ID №1 - аминокислотная последовательность вариабельного домена легкой цепи анти-CD3 антитела,
SEQ ID №2 - аминокислотная последовательность вариабельного домена тяжелой цепи анти-CD3 антитела,
SEQ ID №3 - аминокислотная последовательность вариабельного домена легкой цепи анти-CD19 антитела,
SEQ ID №4 - аминокислотная последовательность вариабельного домена тяжелой цепи анти-CD19 антитела,
SEQ ID №5 - аминокислотная последовательность константного домена CH2 CH3 IgG2,
SEQ ID №6 - предпочтительная аминокислотная последовательность линкера L1,
SEQ ID №7 - предпочтительная аминокислотная последовательность линкера L2,
SEQ ID №8 - предпочтительная аминокислотная последовательность линкера L3,
SEQ ID №9 - аминокислотная последовательность шарнирной области H,
SEQ ID №10 - аминокислотная последовательность антитела GNR-047.
Изобретение иллюстрируется приведенными ниже примерами.
Пример 1. Получение антитела против CD3*CD19
Конструирование рекомбинантных плазмидных ДНК
Для клонирования были выбраны коммерчески доступный вектор фирмы Selexis, содержащий генетический элемент SGE1, способствующий усилению экспрессии в результате непосредственной близости целевого трансгена с высокоактивным ядерным транскрипционным комплексом.
Ген GNR-047 был сконструирован в результате отжига перекрывающихся химически синтезированных олигонуклеотидов. Последовательность целевого гена GNR-047 была клонирована в коммерчески доступный вектор pUC19, в результате чего был получен вектор pAPG_GNR047, который использовали для дальнейшей работы. После обработки вектора pAPG_GNR047 эндодезоксирибонуклеазами рестрикции HindIII, XbaI (New Ingland Biolabs), образующими липкие концы, выделяли фрагмент размером 2235 п.о., который затем лигировали с линеаризованным по сайтам HindIII и XbaI экспрессионным вектором pST101. Полученная плазмида pRA1451 была верифицирована рестрикционным картированием. Схема конструирования экспрессионного вектора pRA1451 приведена на Фиг. 2.
После этого проводили последовательную двойную трансфекцию с последующей селекцией по резистентности к пуромицину с использованием стандартных методов.
Полученная плазмида pRA1451, кодирующая полипептид GNR-047, характеризуется следующими признаками:
- состоит из 11308 и.о.,
- имеет молекулярную массу 6.99 МДа,
- кодирует полипептид биспецифического антитела против CD3*CD19, GNR-047,
- обеспечивает устойчивость клеток млекопитающих, трансфицированных указанной плазмидой, к пуромицину;
- содержит следующие элементы:
- CMVe/EF1a pro - энхансер вируса CMV и промотор транскрипции гена фактора элонгации альфа,
- BGH pA - сигнал полиаденилирования бычьего гормона роста,
- sv40 enh - энхансер вируса SV40,
- SGE 1 - элемент прикрепления к ядерному матриксу,
- Amp - ген β-лактамазы,
- sv40 pro - промотор вируса SV40,
- puro - ген устойчивости к пуромицину,
- pA - синтетический сигнал полиаденилирования.
- содержит уникальные участки узнавания следующих эндонуклеаз рестрикции: AccI (6490 п.о.), AgeI (460 п.о.), ApaI (995 п.о.), BmgBI (3270 п.о.), BsmI (7269 п.о.), EcoRV (6457 п.о.), HindIII (1590 п.о.), NotI (11146 п.о.), PfoI (11021 п.о.), Pm1I (5699 п.о.), SpeI (4622 п.о.), SwaI (6466 п.о.), Tth111I (10585 п.о.).
Генетическая конструкция экспрессионного вектора приведена на фиг. 3.
Трансфекцию проводили с использованием коммерчески доступного штамма CHO-M (Selexis). Выбор линии клеток-продуцентов обусловлен необходимостью формирования оптимального профиля гликозилирования при синтезе человеческих белков, а также их стабильностью, безопасностью и возможностью применения суспензионных условий культивирования данной линии клеток, что является важнейшими параметрами для производства терапевтических антител.
Культивирование проводилось в режиме fed-batch с использованием питательной среды BalanCD CHO Growth A (Irvine Scientific) и нутриентной добавки CellBoost 3 (HyClone) в течение 10 суток при температуре 37°C, 5% CO2 в газовой фазе инкубатора. После культивирования культуральная жидкость осветлялась центрифугированием и передавалась на выделение.
Для выделения и очистки целевого продукта была разработана схема, включающая аффинную стадию с использованием сорбента на основе протеина A (с выходом продукта свыше 90%) и катионообменную хроматографию на сорбенте высокого разрешения, обеспечивающую эффективное разделение целевой формы белка и его олигомерных форм (выход целевой фракции более 80%). В результате были получены биспецифические антитела в количествах, достаточных для исследования их фармакокинетических и фармакодинамических свойств.
Пример 2. Фармацевтическая композиция на основе антитела против CD3*CD19.
Для проведения экспериментов на животных использовали фармацевтическую композицию следующего состава: 0,7 мг/мл антитела GNR-047, 150 мМ хлорид натрия, 1,8% маннитол, 20 мМ фосфат натрия, 0,01% полисорбат 80.
Условия очистки GNR-047 на последней хроматографической стадии процесса подобраны таким образом, что целевой белок элюируется с сорбента в виде концентрированной субстанции, содержащей все требуемые компоненты финальной формуляции. Таким образом, для приготовления готовой лекарственной формы раствор антитела с концентрацией около 5 мг/мл (концентрированный раствор, полученный в Примере 1 после хроматографической очистки) разбавляли до требуемой концентрации 0,7 мг/мл с использованием буфера готовой лекарственной формы при перемешивании. Полученный раствор подвергали стерилизующей фильтрации с использованием фильтра с диаметром пор 0,22 мкм и разливали в стерильные флаконы для хранения композиции и последующих экспериментов.
Для получения лиофилизированной композиции, раствор, содержащий антитело GNR-047 в буфере готовой формы (150 мМ хлорид натрия, 1,8% маннитол, 20 мМ фосфат натрия, 0,01% полисорбат 80), подвергали лиофилизации при стандартных условиях, включающих стадию замораживания и вакуумного обезвоживания. При этом хлорид натрия и маннит, использовали в качестве кристаллизующихся компонентов, наличие которых позволяет сформировать таблетку, а маннит также играл роль стабилизатора при лиофилизации. Полученный лиофильный препарат хранили при 4С в герметичных флаконах.
В качестве растворителя для восстановления лиофилизированной композиции использовали воду для инъекций. Для восстановления препарата к флакону, содержащему 17 мг лиофилизированной композиции антитела, при комнатной температуре добавляли 0,5 мл растворителя и осторожно перемешивали покачиванием до полного растворения. В качестве растворителя также может выступать бактериостатическая вода для инъекций, растворение в которой позволяет многократно использовать препарат в течение 7 дней.
Пример 3. Изучение биологической активности
Биологическую активность полученного антитела оценивали путем определения констант связывания в конкурентном анализе на клетках линии Раджи CD3-/CD19+ (Raji, ATCC® CCL-86) и Джуркат CD3+/CD19- (Jurkat, ATCC® TIB-152) из коллекции ATCC.
В качестве препарата сравнения использовали антитело MT-103 (блинатомумаб). После инкубации с целевыми молекулами в последовательных 10-кратных разведениях от 100 нМ до 0,1 нМ, к клеткам добавляли конкурирующее антитело (HD37 или ОКТ3) в концентрации 6 нМ. Клетки промывали натрий-фосфатным буферным раствором с pH 7,0 и прокрашивали anti-Human-FITS антителами. Прокрашенные клетки анализировали на FACS Calibur.
Результаты связывания приведены в Таблице 1 и на Фиг. 4.
Из таблицы видно, что антитело GNR-047 связывается, как с CD3, так и с CD19, причем в обоих случаях более эффективно, чем препарат сравнения MT103. Такие низкие, в сравнении с препаратом сравнения, значения IC50 могут объясняться наличием 2x валентностей для каждой специфичности (CD3 и CD19).
Пример 4. Сравнение фармакокинетических характеристик при внутривенном и подкожном введении
В виду того, что препарат GNR-047 показал улучшенные фармакокинетические характеристики при внутривенном введении по сравнению с MT103, целесообразным являлось определение фармакокинетических параметров при более удобном подкожном введении, при котором GNR-047 будет пролонгировано высвобождаться из депо в кровоток.
Для проведения эксперимента использовались крысы линии Sprague Dawley (Питомник лабораторных животных «Пущино» филиала Института биорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук) массой около 400 г, 3 крысы на группу.
Каждой крысе вводили исследуемое антитело GNR-047 или MT-103 внутривенно в дозировке 0,5 мг/кг или подкожно в дозировке 2,0 мг/кг. Образцы крови отбирали через определенные промежутки времени после инъекции, начиная с 5 мин, и определяли концентрации препаратов в плазме крови при помощи твердофазного иммуноферментного анализа (ELISA).
Полученные результаты представлены в таблице 2 и на Фиг. 5 и 6.
Где,
T1/2 - необходимое для снижения концентрации лекарственного препарата в плазме крови на 50% в результате элиминации; Cmax - наивысшее значение концентрации лекарственного препарата в плазме крови; AUC(0-t) - площадь, ограниченная фармакокинетической кривой и осью абсцисс во временном интервале с момента введения лекарственного препарата до момента отбора последней пробы крови; AUC(0-inf) - площадь, ограниченная фармакокинетической кривой и осью абсцисс, экстраполированная во времени с момента введения лекарственного препарата до бесконечности; - часть дозы лекарственного препарата (в %), достигшая системного кровотока после внесосудистого введения.
В результате было показано значительное увеличение времени полувыведения (T1/2) и экспозиция (AUC(0-inf) - площадь под фармакокинетической кривой) препарата GNR-047 в сравнении с препаратом MT103, при сохранении максимальной пиковой концентрации (Cmax) при внутривенном введении.
При подкожном введении крысам абсолютная биодоступность препарата GNR-047 составила порядка 60%, в то время как MT-103 показал очень низкую биодоступность - 6% (см. Фиг. 6б).
Пример 5. Сравнение противоопухолевой активности GNR-047 и MT 103 на модели опухолевого ксенотрансплантата клеток линии Raji (Раджи) у мышей NOD/SCID при реконституции МКПК человека.
Цель исследования заключалась в сравнении эффективности препаратов GNR-047 и MT103 у мышей NOD/SCID (Taconic, Дания) при нескольких уровнях дозы, на модели ксенотрансплантата опухолевых клеток линии Раджи с одновременной инъекций мононуклеарных клеток периферической крови (МКПК) человека иммунодефицитным мышам NOD/SCID.
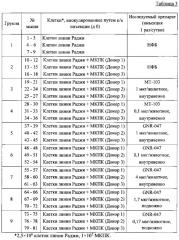
Клетки линии Раджи (лимфома Беркитта человека) предварительно смешивали с МКПК человека и инокулировали подкожно с последующим внутривенным или подкожным введением исследуемых препаратов. Для этого девяти экспериментальным группам иммунодефицитных мышей NOD/SCID (9 животных на группу) подкожно вводили или клетки линии Раджи лимфомы Буркитта человека, или суспензию предварительно смешанных клеток линии Раджи и МКПК человека. По три животных из каждой группы получали МКПК человека от одного из трех отдельных здоровых доноров (когорты 1,2 и 3). Через 2 часа после инокуляции клеток животным внутривенно или подкожно вводили, или НФБ (натрий-фосфатный буферный раствор), или исследуемые препараты GNR-047 или MT 103 в различных дозах. Вводимый объем составлял 200 мкл. Во всех группах в течение 45 дней (дни с 3 по 48) оценивали объем опухоли.
Вводимые растворы готовили путем разведения раствора (композиции) GNR-047, полученного в Примере 2 (0,7 мг/мл), или MT103 (0,52 мкг/мл) в 0,9% физиологическом растворе до получения концентрации 5 мкг/мл (доза 1 мкг) или 0,5 мкг/мл (доза 0,1 мкг). Экспериментальные группы описаны в таблице 3.
У экспериментальных животных определяли следующие показатели: выживаемость, масса тела, объем опухоли, масса опухоли.
Массу тела определяли в день 0 и в последующем регистрировали три раза в неделю до дня 48. Объем опухоли контролировали 3 раза в неделю со дня 3 до окончания исследования путем измерения большого и малого диаметра опухоли штанген-циркулем. На основании диаметров вычисляли объем опухоли, используя следующую формулу:
Объем = (малый диаметр)2 × большой диаметр × 0,5
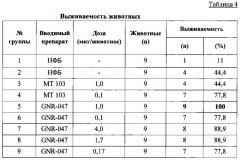
В контрольной группе 1, получавшей НФБ (только клетки линии Раджи), до завершения исследования выжили 11% животных. Выживаемость у животных группы 2, получавших клетки линии Раджи и МКПК человека, не изменилась. В обеих группах смертность была обусловлена исключительно эвтаназией по этическим соображениям (вследствие большого объема опухоли).
Введение GNR-047 и MT 103 повысило выживаемость в группах 3-9, что отражено в таблице 4, причем при большей дозе исследуемый препарат оказался более эффективным, чем препарат сравнения:
Критерии выведения экспериментальных животных из исследования: объем опухоли >10% массы тела; изъязвление опухоли; снижение массы тела >20%.
Рост опухоли значительно ингибировался или подавлялся во всех исследуемых группах, получавших GNR-047 или MT 103 (группы 3-9) по сравнению с контрольной группой 2, получавшей НФБ. При этом во всех исследуемых группах, получавших GNR-047 или MT 103, ингибирование роста опухоли оказалось статистически значимым (p≤0,05).
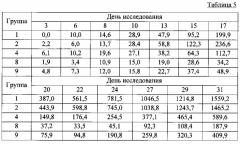
В таблице 5 приведены размеры опухоли для групп 1, 2, 4, 8 и 9, а соответствующие сравнительные графики, позволяющие оценить размер опухоли при внутривенном и подкожном введении (для групп 4, 8 и 9), приведены на Фиг. 7.
1. Рекомбинантное моноклональное биспецифическое антитело против CD3*CD19, включающее две соединенных дисульфидными связями цепи, каждая из которых состоит из следующих доменов: VL (CD3)-L1-VH(CD19)-L2-VL(CD19)-L3-VH(CD3)-H-CH2-CH3(IgG2), где
VL (CD3) и VH(CD3) - вариабельные домены легкой и тяжелой цепей антитела против CD3,
VL(CD19) и VH (CD 19) - вариабельные домены легкой и тяжелой цепей антитела против CD 19,
СН2-СН3 (IgG2) - Fc последовательность IgG2, характеризующаяся последовательностью SEQ ID NO: 5,
L1, L2, L3 - линкерные последовательности, состоящие из 5-15 аминокислот, Н - шарнирная область, характеризующаяся последовательностью SEQ ID NO: 9.
2. Антитело по п. 1, где линкеры выбраны из следующих последовательностей: L1:(XXS)k, где k=2-3, L2:(XXS)n, где n=4-5, L3:(XXS)m, где m=2-3, X=G, а Н:ERKCCVECPPCP.
3. Антитело по п. 2, где L1, L2, L3 характеризуются соответственно последовательностями SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8.
4. Антитело по п. 1, где вариабельные домены легкой и тяжелой цепей антитела против CD3, VL(CD3) и VH(CD3), характеризуются последовательностями SEQ ID NO: 1 и SEQ ID NO: 2, и вариабельные домены легкой и тяжелой цепей антитела против CD19, VL(CD19) и VH(CD19), характеризуются последовательностями SEQ ID NO: 3 и SEQ ID NO: 4.
5. Антитело по п. 1, представляющее собой антитело, характеризующееся аминокислотной последовательностью SEQ ID NO: 10.
6. Антитело по п. 5, где время полужизни составляет около 40-65 ч.
7. Применение антитела по любому из пп. 1-6 для лечения В-клеточных заболеваний или истощения В-клеток.
8. Фармацевтическая композиция для лечения В-клеточных заболеваний или истощения В-клеток, содержащая антитело по любому из пп. 1-6 в эффективном количестве.
9. Фармацевтическая композиция по п. 8, содержащая 10-100 мкг антитела против CD3*CD19 и фармацевтически приемлемые носители и/или разбавители.
10. Применение фармацевтической композиции по пп. 8 и 9 для лечения В-клеточных заболеваний или истощения В-клеток.
11. Применение по п. 10, отличающееся тем, что антитело по пп. 1-6 или фармацевтическая композиция по пп. 8 и 9 предназначены для подкожного введения.
12. Способ лечения В-клеточных заболеваний или истощения В-клеток, включающий введение пациенту, нуждающемуся в этом, эффективной дозы антитела по любому из пп. 1-6 или фармацевтической композиции по пп. 8 и 9.
13. Способ по п. 12, отличающийся тем, что антитело вводят подкожно.