Средство для создания фармакологических препаратов для лечения клещевого энцефалита
Иллюстрации
Показать всеИзобретение относится к области фармакологии, а именно к средству, обладающему противовирусной активностью в отношении клещевого энцефалита. Средство, обладающее противовирусной активностью в отношении клещевого энцефалита, характеризуется тем, что оно представляет собой экзополисахарид, полученный из морских бактерий Pseudoalteromonas nigrifaciens штамма КММ 156. Вышеописанное средство позволяет корригировать индуцированное вирусом клещевого энцефалита иммунодефицитное состояние организма. 2 табл.
Реферат
Изобретение относится к области экспериментальной медицины, а именно к разработке новых средств, обладающих противовирусной активностью в отношении клещевого энцефалита.
Клещевой энцефалит (КЭ) - это инфекционное трансмиссивное природно-очаговое заболевание, вызываемое вирусом клещевого энцефалита и передающееся иксодовыми клещами, при котором в 55% случаев наблюдаются тяжелые поражения нервной системы с формированием хронического прогредиентного течения либо с грубым остаточным неврологическим дефицитом. Известно, что эффективность элиминации вируса клещевого энцефалита определяется состоятельностью иммунного ответа, особенно клеточного.
Для предотвращения этого тяжелого заболевания большое значение имеет как можно более раннее применение высокоэффективных иммуномодулирующих препаратов, не оказывающих угнетающего действия на выработку собственных антител организмом человека и обладающих противовирусным действием за счет активации эндогенных механизмов антивирусной защиты. Кроме того, эти препараты должны быть безопасны в применении, удобны для использования в амбулаторных условиях и должны иметь минимум противопоказаний. Именно такие препараты позволят увеличить охват пострадавших от укусов клещей и снизить количество заболевших.
Известны препараты иммуноглобулина человека для профилактики и лечения клещевого энцефалита (Инструкция по применению иммуноглобулина человека против клещевого энцефалита. Минздрав РФ, утверждено Главным государственным врачом РФ Онищенко Г.Г., 08.09.99.; патент, РФ №2173171, МГЖ А61К 39/395, (Патент РФ №2261105 МПК А61К 38/19, А61Р 37/04, опубл. 27.09.2005 г).
Недостатками серопрофилактики клещевого энцефалита является сравнительно большая частота аллергических реакций на введение иммуноглобулинов, а также недостаточная эффективность лечения клещевого энцефалита, связанная с низким титром в гамма-глобулине специфичных антител.
Известны индукторы эндогенного интерферона для лечения КЭ, в частности циклоферон, арбидол, ридостин, а также полусинтетические интерфероны, полученные генно-инженерным способом, к которым относятся реаферон, анаферон, интрон, пэгинтрон (Вирусные и бактерийные препараты. - Томск: 1989, С. 134-138).
Основным недостатком всех лекарственных препаратов, содержащих интерферон, является их сравнительно высокая аллергогенность, а также связанные с этим побочные эффекты, от легких аллергических реакций, сопровождающихся лейкоцитозом, до анафилактических реакций и лейкопении.
Известно средство 7,3'-дисульфат лютеолина, полученный из водно-этанольного экстракта морских трав семейства Zosteraceae. Данное средство обладает антиоксидантным, кардиопротекторным, противодиабетическим, иммуномодулирующим, противовоспалительным, гепатопротекторным, противоопухолевым и противовирусным действием в отношении вируса клещевого энцефалита (патент РФ №2432959, МПК А61К 38/21, опубл. 11.10.2010). Средство 7,3'-дисульфат лютеолина способно защищать инфицированные клетки СПЭВ от цитопатического действия вируса КЭ, снижая титры вируса до 4,0 lg ТЦД50/мл.
Известно средство «йодантипирин», содержащее в качестве активного компонента 1-фенил-2,3-диметил-4-йодпиразолон-5, биофлавоноид лютеолин, входящий в состав многих растений, который является биологически активным веществом с разносторонним спектром действия, в том числе и обладающий противовирусным действием в отношении клещевого эцефалита (Патент РФ №2141826, МПК А61К 31/415 опубл. 27.11.1999 г.).
Известно средство «йодантипирин», содержащее в качестве активного компонента 1-фенил-2,3-диметил-4-йодпиразолон-5, биофлавоноид лютеолин, входящий в состав многих растений, который является биологически активным веществом с разносторонним спектром действия, в том числе и обладающий противовирусным действием в отношении клещевого эцефалита (Патент РФ №2141826, МПК А61К 31/415 опубл. 27.11.1999 г.).
Однако описанный в качестве прототипа препарат имеет невысокую эффективность, которая связана с тем, что активное вещество, 1-фенил-2,3-диметил-4-йодпиразолон-5, обладает способностью избирательно индуцировать бетта-интерферон, но при этом не активирует клеточное звено иммунитета.
Отличием заявленного технического решения от прототипа является то, что в заявленном средстве в качестве активного начала используют экзополисахарид, полученый из морских бактерий Pseudoalteromonas nigrifaciens штамма КММ 156. Которое не только оказывает противовирусное действие в отношении вируса КЭ, но и отменяет вирусиндуцированную супрессию клеток врожденного иммунитета человека, активируя NK- и NKT-клетки, увеличивая их цитотоксический потенциал и стимулируя процесс дегрануляции клеток. Это очень актуальное свойство, т.к. для средств, создающихся для лечения клещевого энцефалита, необходимы препараты, которые бы не только ингибировали репликацию вируса и элиминировали его из организма, но и корригировали индуцированное вирусом иммунодефицитное состояние человека.
Из уровня техники неизвестно заявляемое средство, обладающее противовирусной активностью в отношении клещевого энцефалита, которое обладает свойством корригировать индуцированное вирусом КЭ иммунодефицитное состояние человека.
Задачей настоящего изобретения является создание средства, обладающего одновременно противовирусным действием в отношении вируса клещевого энцефалита и свойством корригировать индуцированное вирусом КЭ иммунодефицитное состояние человека
Задача решена за счет использования средства, полученного из морских бактерий Pseudoalteromonas nigrifaciens штамма КММ 156.
Способ получения экзополисахарида из бактерий P. nigrifaciens штамма № КММ 156 простой, известен (Биоорганическая химия, 1993, т. 19, №3, с. 327-336).
Новизна заявляемого средства заключается в том, что оно не только оказывает противовирусное действие в отношении вируса КЭ, но и отменяет вирусиндуцированную супрессию клеток врожденного иммунитета человека, активируя NK- и NKT-клетки, увеличивая их цитотоксический потенциал и стимулируя процесс дегрануляции клеток.
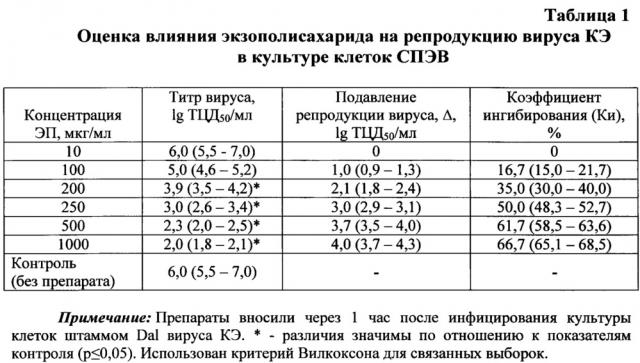
Противовирусная активность экзополисахарида бактерий P. nigrifaciens штамма КММ 156 в отношении наиболее распространенного на территории Российской Федерации флавивируса - вируса клещевого энцефалита (КЭ) - была доказана следующим образом. Для этого был использован высокопатогенный для человека штамм Dal'negorsk (Dal) вируса КЭ дальневосточного субтипа (Gene Bank: FJ402886), выделенный из мозга умершего больного очаговой формой КЭ. Исследования проводили на перевиваемой линии клеток почек эмбрионов свиней (СПЭВ). Клетки культивировали в 24-луночных пластиковых панелях со средой 199, 10% сыворотки эмбрионов коров и 100 ЕД/мл гентамицина. Поддерживающая среда содержала 1% эмбриональной сыворотки. Для определения противовирусного действия экзополисахарида монослой культуры клеток инфицировали 10-кратными разведениями штамма Dal вируса КЭ с исходным инфекционным титром 107 ТЦД50/мл. Через 1 час после инфицирования клеток вирусом (в разведениях от 10-1 до 10-7), вносили экзополисахарид в различных концентрациях (опыт) или среду без препарата (контроль) и инкубировали в СО2-инкубаторе в течение 5 суток. Учет ингибирования экзополисахаридом цитопатогенного действия вируса КЭ проводилось на 5 сут наблюдения. Критериями оценки эффективности препарата являются следующие показатели: снижение инфекционного титра вируса под воздействием препарата (Δ, lg); коэффициент ингибирования (КИ, %) и химиотерапевтический индекс (ХТИ).
Снижение уровня накопления вируса под действием препарата (Δ, lg) определяют по формуле: Δ=Ак-Ао (lg ТЦД50/мл), где Ак - титр вируса в контрольных образцах (без препарата); Ао - титр вируса в опытных образцах (с препаратом). Коэффициент ингибирования (Ки, %) рассчитывают по формуле: Ки=(Ак-Ао)/Ак×100%. За величину ХТИ принимают соотношение максимально переносимой концентрации (МПК) к минимально эффективной вирусингибирующей концентрации (МЭК), снижающей титр вируса не менее чем на 2 lg ТЦД50/мл (Миронов А.Н. с соавт., 2012).
При исследовании цитотоксичности экзополисахарида бактерий P. nigrifaciens штамма КММ 156 изучали воздействие различных концентраций этого соединения (1, 10, 100, 1000, 2000, 4000 и 5000 мкг/мл) на интактную культуру клеток СПЭВ. Установлено, что МПК (максимально переносимая концентрация, составляющая половину максимальной концентрации препарата, не оказывающей на клетки токсичного действия) экзополисахарида составила 2000 мкг/мл, т.е. данное соединение не токсично для используемой культуры клеток.
Изучение противовирусной активности экзополисахарида показало, что исследуемое соединение проявляет дозозависимый эффект на репродукцию вируса КЭ (табл. 1). Максимальная концентрация (1000 мкг/мл) экзополисахарида вызывает снижение титров вируса на 4,0 (3,7-4,3) lg ТЦЦ50/мл, подавляя его репродукцию на 66,7 (65,1-68,5)%. Минимальная вирусингибирующая концентрация (МЭК) экзополисахарида, снижающая титр вируса на 2 lg ТЦД50/мл, составила 200 мкг/мл. Химиотерапевтический индекс исследуемого соединения составил ХТИ=2000/200=10. Поскольку величина ХТИ наиболее достоверно характеризует специфическую противовирусную активность исследуемого вещества, то соединения с ХТИ>8 являются перспективными для дальнейшего изучения в исследованиях на животных (Миронов А.Н. с соавт., 2012).
Коррекция заявляемым экзополисахаридом индуцированного вирусом КЭ иммунодефицитного состояния клеток крови человека осуществлялась следующим образом.
Иммунная защита против вирусов формируется при участии многих механизмов врожденного и адаптивного иммунитета. Реализация врожденного иммунитета, участвующего в первой линии защиты от патогена, обусловлена деятельностью клеток-эффекторов, в том числе, NK-и NKT-клеток.
Ранее в наших исследованиях показано, что снижение активационной способности NK-клеток, вызванное штаммом Dal вируса КЭ, активно размножающимся в клетках крови, является одним из механизмов вирусиндуцированной супрессии врожденного иммунитета (Крылова Н.В. Клеточные и молекулярные механизмы противовирусной защиты при клещевом энцефалите: дис. … докт. биол. наук., Москва, 2015, 271 с.)
Актуален поиск препаратов, активирующих клетки врожденного иммунитета, т.к. активационные рецепторы индуцируют цитотоксическое действие NK- и NKT-клеток.
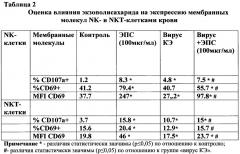
Влияние экзополисахарида (ЭПС) бактерий Pseudoalteromonas nigrifaciens и вируса клещевого энцефалита (при раздельной или совместной инкубации) на изменение уровня экспрессии мембранных молекул активации CD69 NK - и NKT-клетками определяли через 24 часа.
Материалом для исследования служила периферическая кровь с гепарином (25 БД/мл), полученная от здоровых доноров. Кровь разводили 1:2 питательной средой 199, содержащей 100 мг/мл гентамицина, и вносили в стерильные пластиковые пробирки. В контрольной пробирке находилась только кровь, разведенная средой 199 с гентамицином. Во 2-ю пробирку внесли ЭПС в конечной концентрации 100 мкг/мл, в 3-ю пробирку добавили вирус КЭ (инфицирующая доза 2 lg ТЦД50/0,1 мл), в 4-ю пробирку внесли одновременно ЭПС (100 мкг/мл) и вирус КЭ (2 lg ТЦЦ50/0,1 мл). Все образцы инкубировали в СО2-инкубаторе при 37°С в течение 24 часов.
Дегрануляцию NK- и NKT-клеток оценивали методом проточной цитометрии по экстернализации маркера CD107а после стимуляции in vitro, т.к. CD107а является чувствительным, специфичным и адекватным маркером дегрануляции клеток.
Оценку уровня экспрессии мембранных молекул осуществляли стандартным методом двух- или трехцветного иммунофлюоресцентного окрашивания цельной крови с использованием коммерческих лизирующего/фиксирующего (FACS Lysing Solution, Becton Dickinson) и оптимизированного фосфатно-солевого буфера для клеток крови (CellWash, Becton Dickinson) и панели мАТ (Beckman Coulter) согласно инструкции производителя.
Цитофлюорометрию осуществляли на проточном цитофлюориметре FACSCalibur (Becton Dickinson, США). В каждой пробе анализировали не менее 10000 клеток.
Гейтирование субпопуляций NK - и NKT-клеток производили с помощью трехцветного анализа по параметрам CD56 в зоне CD3-негативных (NK) или позитивных (NKT) лимфоцитов. Данные анализировали, используя программное обеспечение CellQuest Pro (Becton Dickinson).
Результаты представлены как процент клеток, экспрессирующих соответствующие маркеры, и в виде условных единиц средней интенсивности флюоресценции (MFI - mean fluorescence intensity), отражающие плотность молекул на поверхности клеток
Статистическую обработку полученных результатов проводили методами непараметрической статистики, которые включали расчет медианы и оценку различий с использованием критерия Вилкоксона для связанных групп.
Было установлено, что через 24 часа инкубации клеток крови со штаммом Dal вируса КЭ уровень экспрессии CD69 на NK- и NKT-клетках был статистически значимо ниже, чем в контрольной пробе (Табл. 2).
Известно, что экспрессия CD69 на NKT- и NK-клетках связана с их цитотоксической функцией.
Установлена роль CD69 в лизисе, осуществляемом активированными NK-клетками (Borrego F, Robertson MJ, Ritz J, J, Solana R. CD69 is a stimulatory receptor for natural killer cell and its cytotoxic effect is blocked by CD94 inhibitory receptor. Immunology. 1999; 97 (1) :p. 159-65)
Снижение активационной способности NK-клеток, вызванное штаммом Dal вируса КЭ, активно размножающимся в клетках крови, является одним из механизмов вирусиндуцированной супрессии врожденного иммунитета.
Инкубация клеток крови с ЭПС в течение 24 часов приводила к увеличению количества NKT- и NK-лимфоцитов, экспрессирующих CD69 и плотности этого рецептора на клетках. В случае одновременной инкубация клеток крови человека с вирусом КЭ и ЭПС происходило увеличение экспрессии активационного маркера CD69, что свидетельствует об отмене вирусиндуцированной супрессии NKT- и NK-лимфоцитов с помощью ЭПС Pseudoalteromonas nigrifaciens.
NK-клетки реализуют свою защитную функцию путем дегрануляции - выброса содержимого цитотоксических гранул при распознавании MHC-I-негативных мишеней. Дегрануляцию NK-клеток в ответ на стимуляцию вирусом КЭ и ЭПС исследовали при раздельной и совместной инкубации. В качестве маркера дегрануляции использовали экстернализацию антигена CD107а. Установлено, что ЭПС в большей степени стимулирует дегрануляцию NKT- и NK-клеток, чем вирус КЭ. Инкубация клеток крови одновременно с вирусом КЭ и ЭПС приводила к увеличению процента дегранулирующих клеток по сравнению с теми пробами, где стимулятором был только вирус КЭ.
Таким образом, в наших экспериментах показано, что ЭПС морских бактерий P. nigrifaciens при одновременной инкубации с вирусом КЭ проявляет противовирусную активность, активирует NK- и NKT-клетки, увеличивает их цитотоксический потенциал и стимулирует процесс дегрануляции клеток.
Средство, обладающее противовирусной активностью в отношении клещевого энцефалита, характеризующееся тем, что оно представляет собой экзополисахарид, полученый из морских бактерий Pseudoalteromonas nigrifaciens штамма КММ 156.