Комбинаторная терапия для лечения геморрагического шока
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа лечения геморрагического шока или массивной кровопотери у млекопитающих, который включает введение млекопитающему транексамовой кислоты в количестве от 0,005 до 0,5 г/кг массы тела в комбинации с рекомбинантным полноразмерным SERPING1 или его серпиновым доменом в количестве от 10 до 900 ME/кг массы тела. Изобретение обеспечивает значительное снижение смертности от геморрагического шока или массивной кровопотери. 5 з.п. ф-лы, 8 пр., 10 ил., 4 табл.
Реферат
Настоящее изобретение относится к медицине, а именно к лечению геморрагического шока и кровотечений с использованием комбинации антифибринолитика, выбранного из группы, включающей транексамовую, аминометилбензойную или ε-аминокапроновую кислоты, и полипептида, обладающего активностью SERPING1.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Тяжелые травмы являются одной из проблем здравоохранения. По статистике ВОЗ ежегодно в мире тяжелую травму получает 10 млн. человек, 250 тыс. из них погибает от шока («ВОЗ | Дорожно-транспортные травмы», WHO. [Online]. http://www.who.int/mediacentre/factsheets/fs358/ru). Основной причиной смерти таких пациентов является неконтролируемое посттравматическое кровотечение («Интенсивная терапия», №6,2014 г, стр. 5). Уровень травматизма в РФ составляет 8730,3 случаев на 100 тыс. взрослого населения. При этом 80% смертей от травм на дорогах связаны с неоказанием помощи в течение первого часа («Травмы, первая медицинская помощь при травмах, виды травматизма, последствия травм». [Online], http://www.medicinform.net/medhelp/medhelp6.htm).
Геморрагический шок наступает, когда острая кровопотеря превышает примерно 20% от нормального объема крови. Главной особенностью геморрагического шока является уменьшение объема циркулирующей крови, что приводит к гипоперфузии основных систем органов. Гипоперфузия приводит к недостатку питательных веществ и вызывает локальную ишемию тканей, что ведет к прогрессирующему повреждению многих органов и их последующей дисфункции. (Keith 1986). При реанимации путем замещения внутрисосудистого объема кровью или физиологическими растворами, происходит дальнейшее повреждение, вызванное реперфузией (Keith 1986).
Коагулопатия, ассоциированная с травмой и геморрагическим шоком, диагностируется у одной трети пациентов с травматическими кровотечениями при поступлении в лечебные учреждения. Травмированные пациенты с коагулопатией имеют значительно более высокую смертность в сравнении с пациентами с похожими травмами без коагулопатии. При травме и индуцированной геморрагическим шоком коагулопатии, в ходе реанимационных предприятий, как правило, применяется инфузионно-трансфузионная терапия. Однако наиболее эффективные меры, такие как протокол 1:1:1, который представляет собой комбинацию эритроцитарной массы, свежезамороженной плазмы крови и тромбоцитов, доступен только в стационарных пунктах квалифицированной медицинской помощи, таких как больницы. Кроме того, применение протокола 1:1:1 ограничивается сроком хранения отдельных компонентов. Рекомендуемый срок хранения эритроцитарной массы составляет 8 дней, а тромбоцитов - 5 дней. Более эффективной является трансфузия теплой свежей донорской крови, однако ее доступность еще более ограничена. (Vymazal 2015). Между тем, при лечении геморрагического шока чрезвычайно важно предпринять терапевтические меры как можно скорее, как правило, не позднее чем через 3 часа после начала массивного кровотечения. Во многих обстоятельствах, таких как дорожно-транспортные происшествия или ранения в ходе боевых действий, квалифицированная медицинская помощь доступна слишком поздно для эффективного лечения геморрагического шока. Поэтому для неотложной медицинской помощи, в машинах скорой помощи или пунктах сбора раненых необходимо наличие эффективного терапевтического средства для лечения геморрагического шока и вызванной травмой коагулопатии.
Во время геморрагического шока и реанимации также сильно повреждается желудочно-кишечный тракт. Происходит некроз кишечника и наблюдаются последующая бактериальная транслокация с выбросом эндотоксинов (Tamion, Richard et al., 1997). Это, как правило, приводит к значительному увеличению уровня воспалительных цитокинов, которые могут усилить полиорганную дисфункцию.
Поэтому существует потребность в создании терапевтического средства, которое не только позволяет эффективно лечить геморрагический шок, но и противодействует таким угрожающим жизни проявлениям геморрагического шока, как коагулопатия и секреция воспалительных цитокинов, проницаемость эпителия кишечника для бактерий и бактериальных эндотоксинов, снижает общую смертность после значительных кровотечений, и при этом может применяться при лечении геморрагического шока в полевых условиях.
SERPING1, также известный как ингибитор эстеразы С1 или С1-ингибитор, является членом семейства ингибиторов сериновых протеаз, серпинов. Посредством ингибирования C1s и C1r, субкомпонентов комплекса С1 классического пути активации (Arlaud, Reboul, Sim & Colomb, 1979; Nilsson, Sjoholm & Wiman, 1983; Nilsson & Wiman, 1983; RatnoffSchena et al., 1980; 1969; Sim, Arlaud & Colomb, 1980), SERPING1 играет ключевую роль в регуляции активности системы комплемента. SERPING1 также регулирует кинин-калликриеновую систему, ингибирует калликреин, фактор XIa и фактор XIIa (Aasen, Erichsen, Gallimore & Amundsen, 1980; Cullmann, Kovary, Dick, Czarnetzki & Echternach-Happle, 1982; Harpel & Cooper, 1975; Harpel, 1970; Ratnoff, 1969; Revak & Cochrane, 1976; Schapira, Scott & Colman, 1981; van der Graaf, Koedam & Bouma, 1983). SERPING1 опосредованно предотвращает активацию плазминогена через ингибирование калликреина и фактора XIIa, а также напрямую ингибирует плазмин в крови (Beattie, Ogston, Bennett, & Douglas, 1976; Haselager, Goote & Vreeken, 1976), что, в свою очередь, снижает фибринолиз (Travis & Salvesen, 1983), который является ключевой особенностью поздней стадии коагулопатии при тяжелом, жизнеугрожающем геморрагическом шоке. Опосредованное SERPING1 ингибирование калликреина, в свою очередь, снижает концентрацию в плазме брадикинина, вазоактивного пептида, который увеличивает проницаемость капилляров и экстравазацию плазмы. Действуя таким образом, SERPING1 противодействует эдеме и уменьшает отек, а также снижает индуцированную геморрагическим шоком проницаемость эндотелиальной ткани (Cheng et al., 2008; Schmidt, Stenzel, Gebhard, Martin & Schmidt, 1999). В противном случае, проницаемость эндотелия часто приводит к повреждению тканей и сепсису.
В модели контролируемой кровопотери у свиней, SERPING1 существенно снижал повреждения тканей почек, кишечника и легких в дозозависимой манере (100 и 250 МЕ/кг). Кроме того, rhSERPING1 в дозе 250 МЕ/кг заметно снизил метаболический ацидоз и уровень циркулирующего TNF-α (Dalle Lucca, Li et al., 2012).
Указанные свойства С1-эстеразного ингибитора свидетельствуют о возможности его использования в заместительной терапии при ангионевротических отеках, для профилактики и лечения сепсиса, в том числе септического шока, для профилактики и лечения полиорганной дисфункции, синдрома повышенной проницаемости капилляров при сепсисе и септическом шоке, для профилактики и лечения острого респираторного дистресс-синдрома, для адъювантной терапии при атеросклеротическом поражении сосудов, для профилактики и лечения ишемического инсульта и его осложнений, острого нарушения мозгового кровообращения, профилактики и лечения шоковых состояний в операционном и послеоперационном периодах при аортокоронарном шунтировании, для предупреждения и лечения шоковых состояний при проведении транслюминальной ангиопластики, для профилактики и лечения синдрома реперфузии после аортокоронарного шунтирования и транслюминальной ангиопластики в комбинации с прямыми антикоагулянтами, для профилактики и лечения реакции отторжения при трансплантации органов и тканей (в том числе - костного мозга), для лечения или предупреждения системных ревматологических заболеваний, протекающих с активацией комплемента (системная красная волчанка, системная склеродеромия, дерматомиозит, ревматоидный артрит и т.д.), для профилактики и лечения осложнений у больных с травматологическими повреждениями различной локализации, для адъювантной терапии любых состояний, в том числе - новообразований, протекающих с активацией системы комплемента (Davis, Cai et al., 2007, Liu, Lu et al., 2007, Davis, Mejia et al., 2008, Davis, Lu et al., 2010, Vo, Zeevi et al., 2015).
Коммерчески доступные препараты Беринерт и Синрайз, на основе ингибитора С1-эстеразы выделенного из человеческой плазмы крови, одобрены для лечения ангионевротического отека.
Производство SERPING1 может быть осуществлено различными способами. Получение pdSERPING1 (плазменного SERPING1) путем последовательной очистки из плазмы крови человека подробно описано, например, в международной заявке WO 2001046219 или патенте RU 2256464. Также описано производство рекомбинантного человеческого SERPING1 (rhSERPING1) из молока трансгенных животных (van Veen, Koiter et al., 2012) (патент US 7067713). Кроме того, rhSERPING1 может быть произведен в различных хозяевах в культуре эукариотических клеток (как описано, например, в WO 2011116291) или в прокариотах, с использованием общепринятых в настоящее время методов генетической инженерии. При этом С1-ингибитор может быть использован как в нативной форме, так и в виде активного фрагмента, полученного рекомбинантным или иным способом и сохраняющего функциональные способности, а также в виде мутантных форм, например, таких, как предложены в WO 2010002453.
В качестве антифибринолитических средств, применяемых при кровотечениях, в настоящее время используются три препарата, обладающих общими функциональными особенностями и механизмом действия. Это транексамовая, ε-аминокапроновая и аминометилбензойная кислоты.
Транексамовая кислота является синтетическим производным аминокислоты лизина и обладает антифибринолитической активностью вследствие обратимого связывания с плазминогеном, предотвращая его взаимодействие с фибрином и, таким образом, препятствует лизису фибринового сгустка. Лизиновые аминокислотные остатки белковой молекулы фибрина опосредуют связывание фибрина с лизин-связывающими сайтами молекулы плазминогена (Ferring Pharmaceuticals Inc. Lysteda (tranexamic acid) tablets: US prescribing information [online]. Available from URL: http://lvsteda.com/assets/pdf/PI_FERRING2010.pdf [Accessed 2012 Feb. 23], (Dunn and Goa 1999)). Транексамовая кислота связывается с высокой аффинностью (константа диссоциации [Kd]=1.1 ммоль/л) с одним из лизинсвязывающих сайтов плазминогена и с низкой аффинностью ([Kd]=1.1 ммоль/л) с другими 4 или 5 сайтами (Ferring Pharmaceuticals Inc. Lysteda (tranexamic acid) tablets: US prescribing information [online]. Available from URL: http://lvsteda.com/assets/pdf/PI_FERRING2010.pdf [Accessed 2012 Feb 23]).
Транексамовая кислота практически полностью блокирует связывание плазминогена или тяжелой цепи плазмина с фибрином, в основном путем связывания с высокоаффинным лизинсвязывающим сайтом плазминогена. Несмотря на то, в присутствие активатора плазминогена, такого как тканевый активатор плазминогена, плазминоген все еще может быть конвертирован в плазмин, после связывания с транексамовой кислотой он не может взаимодействовать и разрушать фибрин (Dunn and Goa 1999). Транексамовая кислота также блокирует связывание α2-антиплазмина с плазмином и его инактивацию плазмина. Кроме ингибирования плазмина, транексамовая кислота также конкурентно ингибирует активацию трипсиногена энтерокиназой, неконкуретно ингибирует трипсин и слабо ингибирует тромбин (Dunn and Goa 1999).
По результатам различных фибринолитических тестов сила связывания транексамовой кислоты с плазминогеном примерно в 6-10 раз больше, чем у другого синтетического производного лизина, ε-аминокапроновой кислоты, также являющейся антифибринолитическим препаратом (Dunn and Goa 1999). Лизинсвязывающие сайты плазминогена находятся в разных, так называемых доменах kringle, которые являются областью полипептидной цепи, состоящих из бета-структур, которые стабилизируются тремя дисульфидными связями. Как транексамовая, так и ε-аминокапроновая кислоты взаимодействуют с низкоаффинным лизинсвязывающим сайтом пятого домена kringle, который, по всей видимости, нужен для начальной ассоциации плазминогена с фибрином (Dunn and Goa, 1999). Высокоаффинный лизинсвязывающий первый домен kringle необходим для связывания карбокси-концевого лизинового остатка, который присутствует в фибрине только после его частичного гидролиза (Anonick, Vasudevan et al., 1992).
Аминометилбензойная кислота («Амбен») по механизму действия близка к ε-аминокапроновой кислоте; угнетает фибринолиз путем конкурентного торможения плазминогенактивирующего фермента и угнетения образования плазмина (Реестр лекарственных средств РФ http://www.rlsnet.ru/mnn_index_id_342.htm, (Langenbach, 2006)). По сравнению сеаминокапроновой кислотой аминометилбензойная кислота более активна, но в два раза менее активна, чем транексамовая кислота (DOBROKHOTOVA, DZHOBAVA et al., 2013) (Verstraete, 1985).
Таким образом, все три препарата оказывают сходное фармакологическое действие, являются синтетическими аналогами аминокислот, действуют по одному механизму, насыщая лизинсвязывающие сайты плазминогена, и имеют общие показания к применению и пути элиминации. Общим недостатком указанных препаратов является возможность появления тромбозов и тромбоэмболических заболеваний при их применении.
Наиболее эффективным средством лечения геморрагического шока для применения в условиях, когда стационарные медицинские учреждения недоступны, в настоящее время является транексамовая кислота.
Транексамовая кислота значительно снижает общую смертность и смерть из-за кровотечения у пациентов с сильными кровотечениями, вызванными травмами, особенно при введении в ранние сроки после травмы (collaborators, Shakur et al. 2010, collaborators, Roberts et al. 2011, Ker, Kiriya et al. 2012, Roberts, Prieto-Merino et al. 2014). Транексамовая кислота в настоящее время используется как препарат выбора военными медиками в США и Великобритании для лечения тяжелых боевых травм и кровотечений.
В США FDA (US Food and Drug Administration) транексамовая кислота также одобрена для перорального введения женщинам с тяжелыми менструальными кровотечениями и внутривенно для профилактики стоматологических кровотечений у пациентов с гемофилией. Однако транексамовая кислота часто используется не по прямому назначению, чтобы уменьшить кровотечение, вызванное различными причинами, в том числе травмой и хирургическими вмешательствами.
В РФ применение транексамовой кислоты одобрено по следующим показаниям: кровотечения или риск кровотечений на фоне усиления фибринолиза (злокачественные новообразования поджелудочной и предстательной желез, операции на органах грудной клетки, послеродовые кровотечения, ручное отделение последа, лейкоз, заболевания печени, предшествующая терапия стрептокиназой - случаи генерализованного фибринолиза; маточные, носовые, желудочно-кишечные кровотечения, гематурия, кровотечения после простатэктомии, конизации шейки матки по поводу карциномы, экстракции зуба у больных с геморрагическим диатезом - случаи местного фибринолиза), наследственный ангионевротический отек, аллергические заболевания (экзема, аллергические дерматиты, крапивница, лекарственная и токсическая сыпь), воспалительные заболевания (тонзиллит, фарингит, ларингит, стоматит, афты слизистой оболочки полости рта) (http://medi.ru/doc/x0937.htm).
Крупное рандомизированное, двойное слепое, плацебо-контролируемое, многонациональное клиническое испытание CRASH-2 (Clinical Randomization of an Antifibrinolytic in Significant Hemorrhage 2 - клиническая рандомизации антифибринолитка при значительном кровотечении) оценивало эффективность раннего использования транексамовой кислоты на взрослых пациентах с травмой (collaborators, Shakur et al., 2010). Исходя из результатов данного исследования транексамовая кислота существенно снижала смертность по всем причинам в течение 4 недель (первичная конечная точка испытания) и риск смерти вследствие кровотечения. Смертность по всем причинам в группе плацебо составляла 16%, тогда как в группе с применением транексамовой кислоты - 14,5%. Смертность в результате кровотечения в группе плацебо составляла 5,7%, а в группе с применением транексамовой кислоты - 4,9%.
Вторичный анализ CRASH-2 (Roberts, Prieto-Merino et al., 2014), сфокусированный на механизме действия транексамовой кислоты у пациентов с кровотечением, позволил сделать заключение о том, что наибольший эффект транексамовая кислота оказывает на снижение смертности в первый день после травмы. Транексамовая кислота, будучи примененной в первые 3 ч после травмы, снижает общую смертность в первый день и увеличивает последующее выживание на 20%.
Тем не менее, несмотря на значительное количество проведенных исследований, до сих пор никто не изучал применение транексамовой кислоты в комбинации с С1-ингибитором.
К недостаткам известных средств относится недостаточное снижение смертности, нежелательные побочные эффекты, вызванные реперфузией при применении стандартной инфузионно-трансфузионной терапии, характеризующиеся ранней активацией нейтрофилов и формированием свободных радикалов (Ioannou, Dalle Lucca et al., 2011). Секреция протеолитических ферментов, продуцируемых нейтрофилами, может приводить к дальнейшему повреждению тканей. Более того, образующиеся кислородные радикалы играют существенную роль в повреждении эндотелия после реперфузии и могут приводить к удлинению периода лечения раны. Широкое применение SERPING1, полученного из плазмы крови человека, осложняется его высокой стоимостью.
Таким образом, сохраняется потребность в эффективных средствах лечения геморрагического шока и сопровождающих его явлений. В настоящее время отсутствует разработанный метод, включающий в себя совместное применение антифибринолитика, выбранного из группы, включающей транексамовую, аминометилбензойную или ε-аминокапроновую кислоты, и полипептида, обладающего активностью SERPING1, для терапии геморрагического шока. Насколько известно авторам изобретения, не опубликовано ни одного примера, доказывающих повышенную эффективность подобной комбинации или просто показывающих совместное использование антифибринолитика из группы аминокислот и SERPING1 для терапии геморрагического шока.
Техническим результатом настоящего изобретения является расширение арсенала средств для лечения геморрагического шока посредством создания комбинации, включающей терапевтически эффективные количества полипептида, обладающего активностью SERPING1 и антифибринолитика, выбранного из группы, включающей транексамовую, аминометилбензойную или ε-аминокапроновую кислоты или их аналоги.
Указанная комбинация также позволяет предотвратить развитие или снизить остроту таких нежелательных явлений, непосредственно связанных с геморрагическим шоком, как коагулопатия, воспаление, отек, повреждение тканей, в частности эпителия кишечника, и связанную с этим транслокацию бактерий и бактериальных эндотоксинов. Заявленный способ позволяет проводить лечение геморрагического шока и сильных кровотечений в экстренных ситуациях и условиях, когда пациент не может быть доставлен в стационарное лечебное учреждение, то есть когда доступна только инфузионная терапия на основе кристаллоидов, коллоидов и другие инъекционные медикаменты, но не переливание донорской крови или комбинации эритроцитарной массы, свежезамороженной плазмы крови и тромбоцитов в условиях высококвалифицированной медицинской помощи.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Заявители впервые обнаружили, что комбинированное применение полипептида, обладающего активностью SERPING1 и антифибринолитика, выбранного из группы, включающей транексамовую, аминометилбензойную или ε-аминокапроновую кислоты или их аналоги, обеспечивает синергетический эффект, за счет которого улучшается выживаемость млекопитающих в условиях геморрагического шока.
В настоящем изобретении предложена комбинация, состоящая из терапевтически эффективных количеств полипептида, обладающего активностью SERPING1 и антифибринолитика, выбранного из группы, включающей транексамовую, аминометилбензойную или ε-аминокапроновую кислоты или их аналогов, применение данной комбинации для лечения геморрагического шока, а также способы лечения геморрагического шока с использованием данной комбинации и наборы для лечения, содержащие указанную комбинацию.
В соответствии с представленным изобретением, термин «полипептид, обладающий активностью SEPRING1» (далее SEPRING1 или C1INH) относится к белкам или их фрагментам, функционирующим как ингибиторы сериновых протеаз и ингибирующих протеазы, связанные с системой комплемента, предпочтительно протеазы C1r и C1s, а также протеазы MASP-1 и MASP-2, связанные с калликреин-кининовой системой, предпочтительно плазменный калликреин и фактор XIIa, и протеазы, связанные системой свертывания крови, предпочтительно фактор XIa. В настоящем изобретении «полипептид, обладающий активностью SEPRING1», может представлять собой С1-ингибитор как в нативной форме, так и в виде функционально активного фрагмента, или полипептида, содержащего мутации, и при этом сохраняющего функциональную активность.
В соответствии с представленным изобретением, в одном из вариантов SEPRING1 может быть модифицирован для улучшения биодоступности и/или периода полувыведения, для улучшения эффективности и/или снижения потенциальных побочных эффектов. Такие модификации могут быть выполнены рекомбинантным способом, химическим конъюгированием или другими известными специалисту в данной области способами. Примерами подобных модификаций могут быть гликозилирование, гибридный (химерный) белок, где С1-ингибитор слит с другим белком или полипептидом, таким как, например, альбумин или Fc-фрагмент иммуноглобулина. То есть речь идет о таких производных, которые сохраняют активность на уровне исходного белка. Примеры возможных модификаций описаны, например, в ЕР 1984503, US 20130108629.
Как понятно специалистам в данной области, любая форма SERPING1, которая сохраняет активность SERPING1, может быть использована в соответствии с настоящим изобретением.
Предпочтительно, терапевтически эффективное количество SERPING1 включает в себя дозировку от примерно 10 до примерно 900 ME/кг массы тела животного или человека и наиболее предпочтительно от около 80 до около 280 ME на кг массы тела.
Предпочтительно терапевтически эффективное количество антифибринолитика составляет от примерно 0,005 до 0,5 г/кг массы тела животного или человека и наиболее предпочтительно от около 0,01 г до 0,05 г/кг массы тела. Наиболее предпочтительно использование в качестве антифибринолитика транексамовой кислоты.
Комбинация может быть выполнена в виде фармацевтической композиции, включающей терапевтически эффективные количества SERPING1 и антифибринолитика, а также фармацевтически приемлемые добавки, разбавители, растворители, обычно используемые в фармацевтической химии.
Например, в качестве добавок могут применяться стабилизаторы, антиоксиданты, буферные агенты, наполнители, как это показано, например, в «Handbook of Pharmaceutical Excipients» (Rowe, Sheskey et al., 2012). Стандартные методы фармацевтических формуляций известны специалистам в данной области (Remington 1995).
В одном из вариантов фармацевтическая комбинация представляет собой раствор для внутривенного введения, содержащий терапевтически эффективные количества SERPING1 и транексамовой кислоты.
В другом варианте фармацевтическая комбинация представляет собой раствор для внутривенного введения, содержащий терапевтически эффективные количества SERPING1 и аминометилбензойной и/или ε-аминокапроновой кислоты.
В качестве дополнительных компонентов композиции могут содержать такие добавки как маннитол, крахмал, глюкозу, лактозу, сахарозу, стеарат натрия, моностеарат глицерина, хлорид натрия, глицерин, пропилен, гликоль, воду, этанол и тому подобное. В определенных вариантах фармацевтическая комбинация может содержать стабилизирующие рН буферные агенты, такие как цитрат или фосфат натрия, увлажнители и эмульгаторы, такие как полисорбат или плюроник. В определенных вариантах фармацевтическая комбинация может содержать стабилизаторы, такие как гистидин, аргинин или консерванты, такие как бензиловый спирт, антиоксиданты, такие как аскорбиновая кислота или альфа-токоферол, технологические вспомогательные вещества, красители, разбавители, такие как физиологический раствор (0,9% хлорид натрия) и другие известные добавки.
В одном из вариантов фармацевтические комбинации по изобретению могут быть приготовлены в виде композиции путем смешивания растворов транексамовой и/или аминометилбензойной и/или ε-аминокапроновой кислоты и SEPvPING1 при подходящем рН, с физиологически приемлемыми носителями. рН композиции может варьировать от примерно 6 до примерно 8. Композиции готовят, дозируют и вводят в соответствии с принципами надлежащей медицинской практики. Учитываемые факторы в связи с этим включают конкретное расстройство и клиническое состояние индивидуального пациента, причину расстройства, способ введения, режим введения и другие факторы, известные практикующим врачам.
В качестве примера, композиция для внутривенного введения может быть приготовлена путем растворения соединений по изобретению в подходящем буферном растворе, например, в натрий-фосфатном буфере с рН=6,5-7,5, добавления регулятора осмолярности, например, хлорида натрия, а также маннита в качестве стабилизатора. Полученный раствор может быть профильтрован с использованием, например, фильтра 0,22 микрон для удаления примесей и загрязнений. Полученный раствор может использоваться как таковой или быть подвергнут лиофилизации с использованием стандартных методов.
Фармацевтическая композиция для применения может быть упакована множеством различных способов в зависимости от того, предназначена ли она для проведения экстренных мероприятий в амбулаторных или полевых условиях. Как правило, изделие для отпуска включает в себя набор, содержащий контейнер с помещенной в него фармацевтической композицией в подходящей форме и контейнер с растворителем. Подходящие контейнеры известны специалистам в данной области и включают флаконы (пластиковые и стеклянные), ампулы и т.п. Контейнер может также иметь устойчивое к внешним воздействиям приспособление для предотвращения неосторожного доступа к содержимому упаковки. Дополнительно, контейнер имеет закрепленную на нем этикетку, на которой описано содержимое контейнера. Этикетка может также содержать соответствующие предостережения.
Предпочтительно фармацевтическая комбинация представляет собой набор, состоящий из фармацевтической композиции, включающей лиофилизат С1-ингибитора в смеси с порошком транексамовой, аминометилбензойной и/или ε-аминокапроновой кислоты и необходимыми фармацевтически приемлемыми добавками, в комплекте с растворителем или разбавителем. Наиболее предпочтительно использование транексамовой кислоты.
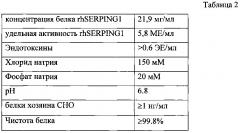
Примером лиофилизата С1-ингибитора может быть лиофилизат раствора, состоящего из следующих компонентов: 20-40 мг/мл С1-ингибитора; 40-60 мг/мл трегалозы; 2-10 мг/мл NaCl; 1,78 мг/мл Na2HPO4; 1,38 мг/мл NaH2PO4, рН 6,8. Примером растворителя может быть вода для инъекций, а примерами разбавителя - 0,9% раствор хлорида натрия или раствор Рингера.
Другой предпочтительный вариант комбинации представляет собой набор, состоящий из фармацевтической композиции, включающей лиофилизат С1-ингибитора в комплекте с раствором транексамовой, аминометилбензойной и/или ε-аминокапроновой кислоты, где оба компонента набора также могут содержать фармацевтически приемлемые добавки. Например, лиофилизат С1-ингибитора может быть получен любым стандартным способом из раствора, содержащего 20-40 мг/мл С1-ингибитора; 40-60 мг/мл трегалозы; 2-10 мг/мл NaCl; 15-30 мМ Na3PO4, рН 6,8. Аминокислота, такая как транексамовая, аминометилбензойная и/или ε-аминокапроновая, может быть использована в качестве раствора в воде для инъекций с концентрацией от 10 до 150 мг/мл. Предпочтительно, 50-100 мг/мл. После растворения лиофилизата С1-ингибитора в растворе соответствующей кислоты, композиция может быть дополнительно разбавлена 0,9% раствором хлорида натрия или раствором Рингера.
В некоторых случаях комбинация может быть представлена в виде набора для последовательного введения, содержащего флакон с раствором транексамовой, аминометилбензойной и/или ε-аминокапроновой кислоты и флакон с раствором С1-ингибитора, где оба компонента набора присутствуют в эффективных количествах, указанных выше, а также могут содержать фармацевтически приемлемые добавки.
Формы, содержащие лиофилизат, являются предпочтительными для использования в сложных полевых условиях, т.к. потенциально обладают максимальным сроком хранения в сравнении с комбинацией в форме раствора/растворов для введения, которая, несмотря на большее удобство в применении, как правило, требует более строгих условий для хранения.
Одним из основных преимуществ предложенной комбинации является удобство одновременного использования двух активных компонентов, обладающих синергетическим действием в случае одновременного введения пациенту, то есть имеющими больший терапевтический эффект, выражающийся в снижении риска смерти в результате геморрагического шока, чем каждый из них по отдельности или если бы они были введены тому же пациенту, но с существенной (в несколько часов) разницей во времени. Важно отметить, что данная комбинация позволяет сохранять активные компоненты в течение длительного срока годности в недостаточно контролируемых условиях хранения. Более того, данная комбинация заранее включает в себя максимальную терапевтически эффективную и безопасную дозировку обоих компонентов, что позволяет снизить риск врачебной ошибки, связанной с дозировкой.
Указанная комбинация может применяться для введения пациентам с геморрагическим шоком, а также для лечения кровотечений, потенциально могущих привести к геморрагическому шоку.
В соответствии с настоящим изобретением, SERPING1 или его аналоги, или производные, такие как химерные или слитые белки, или его функционально активный фрагмент в сочетании с антифибринолитиком, выбранном из транексамовой, аминометилбензойной и/или ε-аминокапроновой кислоты, вводят пациентам, после появления симптомов, связанных с геморрагическим шоком.
Еще одним объектом настоящего изобретения является способ лечения геморрагического шока, который позволяет снизить риск смерти, включающий в себя введение млекопитающему (животному или человеку), испытывающему шок, комбинации терапевтически эффективных количеств SERPING1 и транексамовой кислоты. В другом варианте, млекопитающему, испытывающему шок, вводят комбинацию терапевтически эффективных количеств SERPING1 и аминометилбензойной и/или ε-аминокапроновой кислоты.
Введение может осуществляться посредством внутривенного введения путем трансфузии, вместе с кристаллоидными растворами в ходе стандартной терапии для замещения объема кровопотери, а также болюсным способом путем внутривенной инъекции.
В наиболее предпочтительном варианте способ предусматривает одновременное введение SERPING1 и транексамовой кислоты в виде раствора для инъекций.
Однако допустимо последовательное введение указанных препаратов в течение короткого промежутка времени в пределах 1 часа. Предпочтительно, интервал между введением препаратов составляет 0-30 мин.
Предпочтительно, терапевтически эффективное количество SERPING1, вводимое пациенту, включает в себя дозировку от примерно 10 до примерно 900 МЕ/кг массы тела животного или человека и наиболее предпочтительно от около 80 до около 280 МЕ/кг массы тела. Предпочтительно терапевтически эффективное количество транексамовой, аминометилбензойной и/или ε-аминокапроновой кислоты составляет от примерно 0,005 до 0,5 г/кг массы тела животного или человека и наиболее предпочтительно от около 0,01 г до 0,05 г/кг массы тела.
Авторы настоящего изобретения впервые показали, что комбинированное применение SERPING1 и антифибринолитика, выбранного из транексамовой, аминометилбензойной и/или ε-аминокапроновой кислоты имеет значительно более сильный защитный эффект при геморрагическом шоке и острой массивной кровопотере, чем SERPING1 или один из упомянутых антифибринолитиков, например, транексамовая кислота, используемые по отдельности. Комбинированное применение SERPING1 и транексамовой, аминометилбензойной и/или ε-аминокапроновой кислоты улучшает выживаемость при геморрагическом шоке путем нормализации гемостаза (препятствуя развитию коагулопатии), путем противодействия воспалению, предотвращения повреждения тканей, минимизации шока, а также минимизации связанной с геморрагическим шоком транслокации из кишечника бактерий и бактериальных эндотоксинов.
В подтверждение вышеизложенного авторы показали, что заявленная комбинация существенно более эффективна в повышении выживаемости опытных животных в модели острой кровопотери и геморрагического шока, чем стандартная инфузионная терапия кристаллоидами или каждый из активных компонентов комбинации по отдельности. Также авторы показали, что одним из возможных механизмов действия заявленной комбинации может быть подавление связанного с коагулопатией гиперфибринолиза, на модели вторичного фибринолиза in vitro. Далее, авторы продемонстрировали, на модели отека in vivo и индуцированного эндотоксинами выброса цитокинов ex vivo/in vitro, что дополнительным преимуществом данной терапии может быть противодействие SERPING1 воспалительному процессу, проницаемости сосудов и цитокиновому шторму. Наконец, авторы показали, что в модели геморрагического шока in vivo, на крысах, заявленная комбинация эффективно противодействует разрушению эпителия кишечника, что, как следствие, приводит к снижению риска транслокации бактерий и их токсинов и наступлению септического шока.
Краткое описание чертежей
Фиг. 1. Воздействие rhSERPING1 на выброс воспалительных цитокинов в модели ex vivo/in vitro на цельной крови. Гистограмма отражает общее количество (AUC, пг/мл за 24 ч) ИЛ-6 (А) или ИЛ-1β (Б), выброшенное за 24 ч после индукции с помощью ЛПС (ЛПС - бактериальные полисахариды); rhC1INH23-500 - зрелый полноразмерный rhSERPING1, аминокислотные остатки 23-500; C1INH120-500 - усеченный по амино-концу rhSERPING1, содержащий серпиновый домен, аминокислотные остатки 120-500; rhC1INH23-122 - усеченный по карбокси-концу rhSERPING1, без серпинового домена, аминокислотные остатки 23-122; rhC1INH465ART/VKV - rhSERPING1 с мутациями в активном центре (аминокислотные остатки 465-467 Ala-Arg-Thr заменены на Val-Lys-Val), что привело к потери активности ингибитора сериновых протеаз; ЧСА - очищенный человеческий сывороточный альбумин.
Фиг. 2. Уменьшение отека лапы мыши, индуцированного каррагинаном, под воздействием rhSERPING1. Капиллярный кровоток в месте отека измеряли методом лазер-Допплеровской флоуметрии. Ось Y - 100% нормальный кровоток в здоровой лапе.
Фиг. 3. График выживаемости Каплана-Маейра для каждой экспериментальной группы: контроль - геморрагический шок без вмешательства (без инфузионной терапии); Раствор Рингера - инфузионная терапия раствором Рингера для компенсации гиповолемии; C1INH - rhSERPING1 (168 МЕ/кг); ТХА - транексамовая кислота (0,15 г/кг). Все крысы, прожившие 14 часов после геморрагического шока, были живы к 72 ч после геморрагического шока (время эвтаназии).
Фиг. 4. (А) Гистограмма выживания животных в каждой из экспериментальных групп геморрагического шока (группы приведены, как показано на Фиг. 3) через 72 ч после геморрагического шока. (С) Выживание животных на 72 ч после геморрагического шока, которым ввели комбинацию rhSERPING1 (C1INH) и транексамовой кислоты, зависит от дозы rhSERPING.
Фиг. 5. Типичные микрофотографии срезов тощей кишки, окрашенные гематоксилином и эозином. Стрелки указывают на бокаловидные клетки, наконечники - на полости Грюнхагена, являющиеся признаками дегенерации ворсинок. (А) - контроль, показывающий нормальный эпителий кишечника. (В) Группа с геморрагическим шоком, при реанимации раствором Рингера. (С) Группа с геморрагическим шоком, при реанимации раствором Рингера и транексамовой кислотой; (D) Группа с геморрагическим шоком, при реанимации раствором Рингера и rhSERPING1; (Е) Группа с геморрагическим шоком, при реанимации раствором Рингера и комбинацией rhSERPING1 с транексамовой кислотой.
Фиг. 6. Количественная оценка повреждения эпителия кишечника у животных с геморрагическим шоком и разными вариантами терапии. (А) Повреждения эпителия слизистой оболочки по шкале Чиу/Парк. (В) Количество бокаловидных клеток на срезе ворсинки. Экспериментальные группы обозначены как в Фиг. 3.
Фиг. 7. Тромбоэластограмма активированной нормальной плазмы крови человека. (А) Формирование сгустка в активированной плазме (контроль) (Б) Лизис сгустка, вызванный добавлением тканевого активатора плазминогена (t-РА/т-ПА). (В) Добавление транексамовой кислоты к активированной плазме крови человека не изменяет параметров свертываемости (образования сгустка) в активированной плазме.
Фиг. 8. Тромбоэластограмма активированной нормальной плазмы крови человека при добавлении т-ПА и rhSERPING1. (A) rhSERPING1 по отдельности не оказывает влияния на