Способ получения монотерпеновых сульфокислот
Иллюстрации
Показать всеИзобретение относится к способу получения монотерпеновых сульфокислот, заключающийся в окислении терпеновых тиолов диоксидом хлора путем добавления к раствору тиола водного или органического раствора диоксида хлора при мольном соотношении тиол : диоксид хлора - 1.0:0.5÷5.0, соответственно, при этом окисление ведут при температуре от 0°С до 30°С, в качестве исходных терпеновых тиолов используют: 10-сульфанилизопинокамфеол; 3-сульфанилмиртанол; 10-сульфанилизоборнеол; транс-вербентиол; неоментантиол; карантиол или гидроксикарантиолы, растворитель для исходного тиола выбирают из группы: спирты, простые эфиры, алифатические углеводороды, галогенированные алифатические углеводороды или азотсодержащие растворители, при этом получают соединения структурной формулы (I)
где R1 - H или
R - радикал пинановой структуры
или
или изоборнановой структуры
;
или камфановой структуры
;
или неоментановой структуры
;
или карановой структур
; или ,
где звездочками обозначена связь, через которую осуществляется присоединение к сульфогруппе соединения формулы (I), являющихся физиологически активными веществами и полупродуктами в органическом синтезе для получения физиологически активных монотерпеновых сульфамидов, сульфохлоридов, эфиров. Технический результат заключается в расширении арсенала новых терпеновых кислот заданной структуры, востребованных в органическом синтезе физиологически активных соединений, и в расширении областей применения исходных веществ. 10 пр.
Реферат
Изобретение относится к синтезу терпеновых сульфокислот, а также к их гидратам, сольватам и солям, в частности к солям пиридиния.
Алкан- и арилсульфокислоты используются в качестве полупродуктов в органическом синтезе, в производстве некоторых химико-фармацевтических препаратов. Наличие сульфогруппы в составе лекарственного препарата увеличивает его растворимость в воде, что обуславливает снижение токсичности, придает препарату несколько иную биологическую активность, а также создает предпосылки для создания инъекционных лекарственных форм.
Терпены являются физиологически активными соединениями природного происхождения. Они обладают бактерицидным, обезболивающим и отхаркивающим действиями, используются как антисептики, фунгициды и противовирусные средства. Введение сульфогруппы в молекулу терпена позволяет расширить спектр этой активности [Л.Е. Никитина, Н.П. Артемова, В.А. Старцева. Природные и тиомодифицированные производные: монография. - Germany: LAP LAMBERT, 2012, 168 с.], а также областей использования полученных терпеноидов, в том числе, и за счет увеличения растворимости нового соединения в воде.
Известно, что сульфокамфорная кислота используется в производстве лекарственных препаратов, обладающих коронарорасширяющей способностью, антибактериальной активностью, болеутоляющим свойством (сульфокамфокаин, полусинтетические пенициллины и цефалоспорины). Четвертичные соли пиридиния проявляют антисептические, вазо- и гепатопротекторные свойства; являются поверхностно-активными веществами; применяются в органическом синтезе.
Функционализация терпеновых соединений известными методами введения сульфогруппы в молекулу (взаимодействие с концентрированной серной кислотой, олеумом, хлорсульфоновой кислотой) осложняется высокой лабильностью терпенового фрагмента: большинство терпенов в условиях реакции подвергаются многочисленным перегруппировкам и осмолению. Поэтому известно крайне мало терпеновых сульфокислот.
В источнике информации [Organic Syntheses, N.Y.: John Wiley & Sons, Inc., 1973. V. 5, P. 194; Патент РФ 2119332, 1998] описано получение сульфокамфорной кислоты с выходами 27-42% реакцией камфоры с уксусным ангидридом и концентрированной серной кислотой. Недостатками методов являются невысокие выходы и ограниченный выбор субстрата, так как большая часть циклических терпенов в данных условиях подвергается перегруппировке исходной структуры.
В источнике информации [Traynor, Kane, Betkouski, Hirshy, J. Org. Chem. 1979. V. 44. P. 1557] описано получение натриевой соли пара-ментен-1-ен-7-сульфоновой кислоты реакцией β-пинена с бисульфитом натрия и нитратом калия. Реакция требует пониженного давления и нагревания в течение 4 ч до 110°С, протекает с превращением пинановой структуры в ментановую.
Прямых аналогов получения заявленных терпеновых сульфокислот выявлено не было.
Задачей настоящего изобретения является синтез новых монотерпеновых сульфокислот, полученных эффективным способом.
Технический результат заключается в том, что способ позволяет получить терпеновые сульфокислоты в одну стадию с сохранением структуры терпенового фрагмента исходного тиола, а при оптимальных условиях способ позволяет получить высокий выход целевого продукта. Технический результат достигается получением монотерпеновых сульфокислот, включая их гидраты, сольваты и фармацевтически приемлемые соли, структурной формулы (I)
,
где R1 - Н или ;
R - радикал пинановой структуры
; или ;
или изоборнановой структуры
или камфановой структуры
или неоментановой структуры
или карановой структур
; или ;
где звездочками обозначена связь, через которую осуществляется присоединение к сульфогруппе соединения формулы (I), являющихся физиологически активными веществами и полупродуктами в органическом синтезе для получения физиологически активных монотерпеновых сульфамидов, сульфохлоридов, эфиров.
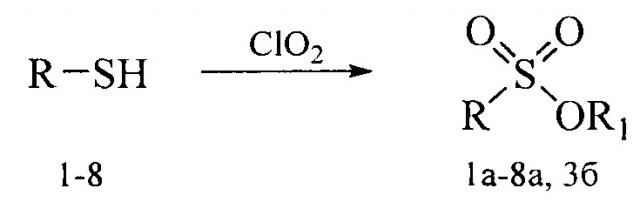
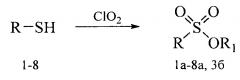
Получение терпеновых сульфокислот осуществляется окислением терпеновых тиолов в водно-органическом растворителе диоксидом хлора (схема 1) путем добавления к раствору тиола водного или органического раствора диоксида хлора при мольном соотношении реагентов равном 1.0:0.5÷5.0 соответственно, при температуре от 0 до 30°С. Согласно изобретению в качестве субстратов используют терпеновые тиолы, а именно 10-сульфанилизопинокамфеол (1), 3-сульфанилмиртанол (2), 10-сульфанилизоборнеол (3), транс-вербен- (4), неоментан- (5), каран- (6) и гидроксикарантиолы (7, 8). Растворитель для приготовления раствора исходного тиола выбирают из группы спиртов, простых эфиров, алифатических углеводородов, галогенированных алифатических углеводородов, азотсодержащих растворителей; растворитель для экстракции диоксида хлора выбирают из группы галогенированных алифатических углеводородов, простых эфиров, алифатических углеводородов, азотсодержащих растворителей, спиртов или воду.
Схема 1. Окисление тиолов
В качестве исходных субстратов брали оптически чистые тиолы, полученные по известным методикам: 10-сульфанилизопинокамфеол (1) [О.А. Банина, Д.В. Судариков, Ю.В. Крымская, Л.Л. Фролова, А.В. Кучин. Синтез хиральных гидрокситиолов на основе кислородсодержащих производных α- и β-пинена. ХПС. 2015. Т.2. С. 231], 3-сульфанилмиртанол (2) [,, , J. Tamariz, P. Joseph-Nathan, L.G. Zepeda, Highly diastereoselective nucleophilic additions using a novel myrtenal-derived oxathiane as a chiral auxiliary, Tetrahedron: Asymmetry. 2001. V. 12. P. 3095], 10-сульфанилизоборнеол (3) [B.M. Eschler, R.K. Haynes, M.D. Ironside, S.K remmydas, D.D. Ridley, T.W. Hambley. J. Org. Chem. 1991. V. 56. P. 4760], неоментантиол (5) [L.A. Subluskey, L.C. King. Isobornylisothiouronium salts. J. Am. Chem. Soc. 1951. V. 73. Is. 6. P. 2647], транс-вербентиол (4) [И.А. Вакуленко, В.А. Старцева, Л.Е. Никитина, Н.П. Артемова, Л.Л. Фролова, А.В. Кучин, ХПС. 2005. Т.6. С. 585], карантиол (6) [A. Banach, , P. Ozimek. Phosphorus, Sulfur, and Silicon and the Related Elements. 2014. V. 189 (2). P. 274] и гидроксикарантиолы (7, 8) [О.A. Банина, Д.В. Судариков, П.А. Слепухин, Л.Л. Фролова, А.В. Кучин. Стереоселективный синтез гидрокситиолов карановой структуры и дисульфидов на их основе, ХПС. 2016. Т. 52(2). С. 240].
Водный раствор ClO2 - промышленный продукт, концентрацию которого определяли титрованием по известной методике [Т.А. Туманова, И.Е. Флис. Физико-химические основы отбелки. М.: Лесная промышленность, 1972, 236].
Способ позволяет получить терпеновые сульфокислоты в одну стадию с сохранением структуры терпенового фрагмента исходного тиола с высоким выходом. Для подбора оптимальных условий синтеза сульфоновых кислот варьировались природа растворителя, соотношение тиол : диоксид хлора и время реакции. Были опробованы такие растворители как вода, пиридин, дихлорметан, метанол, гексан. Соотношение тиол : диоксид хлора изменялось от 1:0.5 до 1:5, время реакции - от 1 до 4 ч.
Оптимальными являются условия при использовании в качестве растворителя для исходного тиола - пиридин, а для диоксида хлора - воду при соотношении субстрат: реагент равном 1:2÷1:3. Использование данных условий приводит к повышению выхода целевого продукта до 96% (от теоретического). Реакция протекает при комнатной температуре (18-27°С) в течение короткого промежутка времени (1 ч).
ИК-спектры регистрировали на ИК-Фурье-спектрометре Shimadzu IR Prestige 21 в тонком слое. Спектры ЯМР 1Н и 13С регистрировали на спектрометре Bruker Avance-300 (300.17 МГц для 1Н и 75.48 МГц для 13С) в растворах CDCl3 (внутренний стандарт - сигнал хлороформа) и D2O с добавлением 4,4-диметил-4-силапентан сульфоната натрия (DSS) в качестве внутреннего стандарта. Полное отнесение сигналов 1Н и 13С выполняли с помощью двумерных гомо- (1Н-1Н COSY, 1Н-1Н NOESY) и гетероядерных экспериментов (1Н-13С HSQC, НМВС). Масс-спектры регистрировали на высокоэффективном жидкостном хроматографе с масс-селективным детектором Thermo finnigan LCQ Fleet (растворитель - CH3OH). Детектирование проводили по положительным и отрицательным ионам.
Получение новых соединений показано на следующих примерах.
Пример 1. Растворяли 0.05 г (0.27 ммоль) 10-сульфанилизопинокамфеола (1) в пиридине (С=0.02 моль/л). Добавляли к нему водный раствор ClO2 в мольном соотношении (1): ClO2=1:2.
Перемешивали в течение 1 ч. Растворители отгоняли на роторном испарителе. Для удаления остатков пиридина согласно [С.К. Огородников, Т.М. Лестева, В.Б. Коган. Азеотропные смеси. Ред. В.Б. Коган. Л.: Химия, 1971, 428] снова добавляли толуол и воду и повторно выпаривали под вакуумом. Экстрагировали водой и бензолом. Водную фазу отделяли, отгоняли на роторном испарителе, остаток представляет собой дигидрат (1S,2S,3S,5R)-3-гидрокси-6,6-диметилбицикло[3.1.1]гептаи-2-ил-метансульфоновой кислоты (1а). Выход в пересчете на сухой продукт 0.059 г (94%). ИК-спектр (KBr, v, см-1): 3435 ш (ОН), 2931 с, 1469, 1217 с, 1157 с, 1124 с (SO2), 1084 (SO2), 1037 с (С-О), 758 с, 732 с, 536. Спектр ЯМР 1Н (D2O, δ, м.д.): 0.90 с (3Н, Н8), 1.57 д (1Н, Н7α J 9.9 Гц), 1.22 с (3Н, H9), 1.67-1.74 м (1Н, Н4α), 1.94-1.99 м (2Н, H1, Н5), 2.16-2.20 (1H, H7β), 2.36-2.45 м (1Н, H4β), 2.51-2.58 м (1Н, Н2), 3.01-3.08 дд (1H, H10α, J 14.7, 6 Гц), 3.14-3.20 дд ((1H, H10β, J 15.3, 6 Гц), 4.20-4.27 дт (1H, H3, J 9.4, 4.7 Гц), 8.30 уш.с (6H, ОН, Н2O). Спектр ЯМР 13С (D2O, δ, м.д.): 22.8 (С8), 26.6 (С9), 32.7 (С7), 36.9 (С4), 37.7 (С6), 40.9 (С5), 45.4 (С1), 48.4 (С2), 56.8 (С10), 69.7 (С3). Найдено, %: С 44.80; Н 8.25; S 11.66. C10H18O4S⋅2H2O. Вычислено, %: С 44.44; Н 8.15; S 11.85.
Пример 2. (1S,2S,3S,5R)-3-Гидрокси-6,6-диметилбицикло[3.1.1]гептан-2-ил-метансульфоновая кислота (1а) получена по методике, описанной в примере 1. Растворитель - метанол. Выход 0.024 г (38%).
Пример 3. (1S,2R,3S,5R)-2-(Гидроксиметил)-6,6-диметилбицикло[3.1.1]-гептан-3-сульфоновая кислота (2а) получена окислением тиола (2) по методике, описанной в примере 1. Выход 96%. ИК-спектр (KBr, v, см-1): 3383 ш (ОН), 3065 с, 2935 с, 1631, 1539, 1485, 1225 с, 1197 с, 1157 с (SO2), 1035 с, 997 с, 968 с (SO2), 756 с, 684 с, 607. Спектр ЯМР 1Н (D2O, δ, м.д.): 0.95 с (3Н, H8), 1.08 (1Н, Н7α, J 9.9 Гц), 1.23 с (3Н, Н9), 1.96 м (1Н, Н5), 2.13-2.18 м (2Н, Н4α, Н1), 2.30-2.38 м (2Н, Н4β, Н7β), 2.43-2.50 м (1H, H2), 3.07 м (1H, Н3), 3.66 т (1Н, H10α, J 10.6 Гц), 3.84 м (1Н, Н10β), 4.94 уш.с (1Н, ОН). Спектр ЯМР 13С (D2O, δ, м.д.): 22.2 (С8), 26.7 (С9), 28.7 (С4), 29.9 (С7), 37.8 (С6), 40.1 (С5), 40.8 (С1), 45.4 (С2), 52.9 (С3), 64.9 (С10). Масс-спектр (ESI, 5 кВ), m/z (Iотн (%)): 232.19 (100) [М-2Н], 230 (50), 214 (32.5).
Пример 4. ((1R,2S,4S)-2-Гидрокси-(7,7-диметилбицикло[2.2.1]гептан-1-ил)метансульфоновая кислота (3а) получена по методике, описанной в примере 1. Соотношение (3): ClO2=1:3. Время синтеза 3 ч. Выход 57%. ИК-спектр (KBr, v, см-1): 3431 уш. с (ОН), 3074 с, 1631, 1443 с, 1251 (SO2), 1199, 1172 (SO2), 1035 (ОН), 970 (SO2), 756, 678 с, 601. Спектр ЯМР 1Н (D2O, δ, м.д.): 0.83 с (3Н, H8), 0.99 (3Н, H9), 1.07-1.08 м (1Н, H5α), 1.40-1.41 м (1H, Н6α), 1.73-1.75 м (5Н, H3, Н4, H5β, Н6β), 2.86 д (1Н, H10α, J 14.3 Гц), 3.30 д (1Н, H10β, J 14.3 Гц), 4.04-4.06 м (1Н, Н2). Спектр ЯМР 13С (D2O, δ, м.д.): 19.3 (С8), 19.8 (С9), 26.7 (С5), 38.1 (С3), 44.1 (С4), 47.8 (С7), 49.8 (С7), 50.1 (С10), 76.6 (С2).
Пример 5. (E)-((1S,4R)-3,3-Диметилбицикло[2.2.1]гептан-2-илиден)-метансульфоновая кислота (3б) получена по методике, описанной в примере 1. Соотношение (3): ClO2=1:3. Время синтеза 4 ч. Получена в смеси с кислотой (3а) в соотношении (3а) : (3б)=2:1. Содержание по ЯМР 34%. Данные ЯМР спектров кислоты (36) получены путем вычитания из спектра смеси соединений (3а) и (3б). Спектр ЯМР 1Н (D2O, δ, м.д.): 1.03 с (3Н, Н8), 1.05 с (3Н, Н9), 1.2-1.73 м (6Н, Н5α, Н5β, Н6α, Н6β, Н7α, Н7β), 1.96 м (1Н, H4), 3.58 д (1Н, Н1, J 4.4 Гц), 5.99 с (1Н, Н10), 8.17 т (2Н, НРу, J 6.6 Гц), 8.70 т (1H, НРу, J 7.97 Гц), 8.86 д (2Н, НРу, J 5.5 Гц). Спектр ЯМР 13С (D2O, δ, м.д.): 22.9 (С5), 24.7 (С8), 27.0 (С6), 27.8 (С9), 36.8 (С7), 42.7 (С1), 46.7 (С4), 47.8 (С3), 117.8 (С10), 127.5 (СPy), 141.1 (СРу), 147.3 (СРу), 169.7 (С2). [C10H16SO3]HNC5H5. Масс-спектр (ESI, 5 кВ), m/z (Iотн (%)): 296.11 [М+Ру+Н]+ (96), 591 [2(М+Ру)+Н]+.
Пример 6. (1R,5R)-4,6,6-триметилбицикло[3.1.1]гепт-3-ен-2-сульфоновая кислота (4а) получена из тиола (4) по методике, описанной в примере 1. Выход 86%. Выделена и идентифицирована в виде соли пиридиния [C10H16SO3]HNC5H5. ИК-спектр (KBr, v, см-1): 3431 ш (ОН), 3061, 2515 ш (N+H), 1631, 1537, 1485, 1294 с (SO2), 1151 с (SO2), 1051, 1028 с (SO2), 819, 758, 721, 684. Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.84 с (3Н, H8), 0.96-1.09 (1H, Н7α), 1.15 с (3Н, Н9), 1.68 с (3Н, H10), 1.94-2.06 м (2Н, H1, Н7β), 2.30-2.40 м (1H, Н5), 5.29-5.35 м (1Н, H3), 5.49-5.57 м (Н, Н4), 8.02 т (2Н, HРу, J 6.87 Гц), 8.44 т (1Н, НPy, J 7.97 Гц), 9.00 д (2Н, НPy, J 5.5 Гц) 14.64 с (1Н, ОН). Спектр ЯМР 13С (CDCl3, δ, м.д.): 19.70 (С8), 22.80 (С10), 25.00 (С7), 25.49 (С9), 46.32 (С1), 46.86 (С6), 48.15 (С5), 71.00 (С4), 109.45 (С3), 127.82 (СPy), 142.95 (СPy), 145.08 (СPy), 156.70 (С2).
Пример 7. (1S,2S,5R)-2-изопропил-5-метилциклогексан-1-сульфоновая кислота (5а) получена окислением тиола (5) по методике, описанной в примере 1. Выход 78%. ИК-спектр (KBr, ν, см-1): 3410 с (ОН), 2953 с, 1182 с (SO2), 1070 (SO2), 1014, 885, 582.
Спектр ЯМР 1Н (D2O, δ, м.д., J, Гц): 0.83 д (3Н, Н7, J 6.1 Гц), 0.90 д (3Н, H10, J 6.6 Гц), 0.88-0.97 м (1H, Н4α), 0.99 д (3Н, Н9, J 6.6 Гц), 1.13-1.38 м (2Н, Н6α, Н2), 1.62-1.95 м (5Н, H3α, H3β, Н4β, Н5, Н8), 2.25 д.д (1Н, H6α, J 13.8, 2.2 Гц), 3.39-3.45 м (1Н, Н1). Спектр ЯМР 13С (D2O, δ, м.д.): 20.87 (С10), 21.39 (С9), 21.84 (С7), 23.74 (C3), 26.07 (С5), 29.10 (С8), 34.90 (С4), 37.78 (С6), 47.29 (С2), 58.82 (С1).
Пример 8. (1R,3S,4R,6S)-4,7,7-триметилбицикло[4.1.0]гептан-3-сульфоновая кислота (6а) получена окислением тиола (6) по методике, описанной в примере 1. Выделена и идентифицирована в виде соли [C10H18SO3]HNC5H5. Выход 76%. ИК-спектр (KBr, ν, см-1): 3437 ш (ОН), 2983, 2515 ш (N+H), 1631, 1543, 1487, 1215 с (SO2), 1159 с (SO2), 1035, 999 с (SO2), 756,684. Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.25-0.35 (1Н, Н1), 0.42-0.64 (1H, Н6), 0.66-0.82 м (Н, Н5α), 0.75 д (6Н, H8, H10, J 6.6 Гц), 0.94 д (3Н, Н9, J 7.2 Гц), 0.89-1.00 м (1Н, Н2α), 1.75-1.89 м (1Н, Н5β), 1.98-2.14 м (2Н, H2β, Н3), 0.94 д.д.д (1Н, Н4, J 11.8, 7.4, 3.9 Гц), 8.12 т (2Н, HPy, J6.87 Гц), 8.65 т (1H, HPy, J 7.97 Гц), 8.96 д (2Н, HPy, J 5.5 Гц), 9.46 с (1H, N+H). Спектр ЯМР 13С (CDCl3, δ, м.д.): 14.89 (С8), 17.41 (С7), 17.51 (С9), 18.37 (С2), 19.18 (С1), 22.23 (С6), 26.20 (С3), 26.27 (С5), 27.95 (С10), 59.00 (С4), 127.84 (СРу), 142.21 (СРу), 146.29 (CPy).
Пример 9. (1R,3S,4S,6S)-4-гидрокси-4,7,7-триметилбицикло[4.1.0]-гептан-3-сульфоновая кислота (7а) получена окислением тиола (7) по методике, описанной в примере 1. Выход 92%. ИК-спектр (KBr, ν, см-1): 3423 ш (ОН), 2983, 2648 ш (N+H), 1631, 1539, 1485, 1249 с (SO2), 1207, 1157 с (SO2), 1035, 999 с (SO2), 756, 682. Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.61 т (1Н, Н1, J 8.5 Гц), 0.77-0.98 м (2Н, Н5α,Н6), 0.84 с (3Н, Н8), 0.91 с (3Н, Н9), 1.24 д.д (1Н, Н2α, J 15.7, 6.3 Гц), 1.38 с (3Н, Н10), 2.00 д.д (1Н, H2β, J 16.0, 8.8 Гц), 2.22-2.35 м (1Н, Н5β), 2.95 д.д (1H, Н4, J 12.0, 2.0 Гц), 7.98 т (2Н, HРу), 8.45 т (1Н, HРу) 8.96 д (2Н, HРу), 10.57 уш. с (1Н, Н11). Спектр ЯМР 13С (CDCl3, δ, м.д.): 14.84 (С8), 17.81 (С1), 18.59 (С7), 20.74 (С5), 23.62 (С6), 26.47 (С10), 27.85 (С9), 35.44 (С2), 67.81 (С4), 71.15 (С3), 127.27 (СРу), 142.06 (СРу), 145.86 (СРу).
Пример 10. (1R,3R,4R,6S)-4-гидрокси-4,7,7-триметилбицикло[4.1.0]-гептан-3-сульфоновая кислота (8а) получена окислением тиола (8) но методике, описанной в примере 1. Выход 96%. Выделена в виде соли [C10H16(OH)SO3]HNC5H5. ИК-спектр (KBr, v, см-1): 3410 уш.с (ОН), 2933 с, 2700 с (N+H), 1633, 1543, 1487 с, 1249 (SO2), 1211, 1161 (SO2), 1035 (SO2), 1001, 756, 682 с, 601. Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.60 т (1Н, Н1, J 8.5 Гц), 0.75 т.д (1Н, H6, J 9.2, 5.2 Гц), 0.92 с (3Н, H8), 0.96 с (3Н, Н9), 1.20 д.д (1H, Н2α, J 14.3, 3.9 Гц), 1.39 с (3Н, Н10), 1.93 д.д (1H, Н2β, J 14.0, 10.2 Гц), 2.10-2.26 м (1Н, Н5α), 2.27-2.43 м (1Н, Н5β), 2.70 д.д (1Н, Н4, J 11.8, 7.4 Гц), 7.98 т (2Н, НPy), 8.45 т (1H, НPy), 8.96 д (2Н, НPy). Спектр ЯМР, 13С (CDCl3, δ, м.д.): 15.33 (С8), 17.78 (С7), 18.30 (С1), 19.77 (С6), 20.97 (С5), 22.39 (С10), 28.46 (С9), 35.53 (С2), 64.46 (С4), 70.53 (C3), 127.27 (СРу), 142.06 (СРу), 145.86 (СРу).
Терпены являются физиологически активными соединениями природного происхождения; обладают бактерицидным, обезболивающим и отхаркивающим действиями, благодаря чему используются как антисептики, фунгициды и противовирусные средства. Введение сульфогруппы в молекулу терпена позволяет расширить спектр этой активности [Л.Е. Никитина, Н.П. Артемова, В.А. Старцева. Природные и тиомодифицированные производные: монография. - Germany: LAP LAMBERT, 2012, 168 с.], а также областей использования полученных терпеноидов, в том числе за счет увеличения растворимости нового соединения в воде и, как следствие, снижения его токсичности и возможности создания инъекционных лекарственных форм. Дальнейшая модификация терпеновых сульфокислот, согласно приведенным ниже примерам, позволит получать новые физиологически активные соединения с заданными свойствами.
где R - терпенил, R1, R2, R3 - алкил.
Способ получения монотерпеновых сульфокислот, включая их гидраты, сольваты и фармацевтически приемлемые соли, заключающийся в окислении терпеновых тиолов диоксидом хлора путем добавления к раствору тиола водного или органического раствора диоксида хлора при мольном соотношении тиол : диоксид хлора - 1.0:0.5÷5.0, соответственно, при этом окисление ведут при температуре от 0°С до 30°С, в качестве исходных терпеновых тиолов используют: 10-сульфанилизопинокамфеол; 3-сульфанилмиртанол; 10-сульфанилизоборнеол; транс-вербентиол; неоментантиол; карантиол или гидроксикарантиолы, растворитель для исходного тиола выбирают из группы: спирты, простые эфиры, алифатические углеводороды, галогенированные алифатические углеводороды или азотсодержащие растворители, при этом получают соединения структурной формулы (I)
где R1 - H или
R - радикал пинановой структуры
или
или изоборнановой структуры
;
или камфановой структуры
;
или неоментановой структуры
;
или карановой структур
; или ,
где звездочками обозначена связь, через которую осуществляется присоединение к сульфогруппе соединения формулы (I), являющихся физиологически активными веществами и полупродуктами в органическом синтезе для получения физиологически активных монотерпеновых сульфамидов, сульфохлоридов, эфиров.