Композиция для сбора и хранения днк или днк-содержащих биологических следов (варианты) и её применение
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложены композиции для сбора и хранения ДНК или ДНК-содержащих биологических следов (варианты), а также средство для пропитки гигроскопичных материалов-носителей и осуществления смывов ДНК-содержащих биологических следов, наложений или ДНК с целью их хранения и/или транспортировки, где данное средство представляет собой вышеуказанные композиции. Причём композиции включают 1-40 мΜ Трис (гидроксиметил) аминометан, 0,05-1% об. Твин 20, 0,05-1% об. Тритон Х-100, 1-200 мМ K2SO4, 1-200 мМ KCl, 0,01-0,5 мМ ЭДТА, 1-20% глицерин, 0,01-0,4% NaN3 и воду. Изобретения обеспечивают стабильность ДНК биологических образцов в широком диапазоне температур в течение длительных периодов времени. 5 н. и 21 з.п. ф-лы, ил.,0 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к буферной жидкой композиции, предназначенной для сбора и хранения ДНК или ДНК-содержащих биологических следов, в том числе потожировых следов, в сухом и жидком виде. Указанная композиция обеспечивает стабильность ДНК биообразцов в широком диапазоне температур в течение длительных периодов времени.
Уровень техники
В настоящее время в медицине и криминалистике молекулярно-генетический анализ является одним из самых доказательных методов анализа биологических следов человека: потожировых следов (ПЖС), следов крови, слюны, спермы и т.д. В биологических следах, например, таких как ПЖС, содержится малое количество генетического материала, и его зачастую недостаточно для идентификации образца. Изъятие биологических наложений на месте происшествия достаточно часто проводится с использование стандартных методов, без учета особенностей исследуемого объекта и сложившихся обстоятельств. Этап проведения лабораторных исследований полученных образцов может быть отсрочен и наступить через длительный период времени. Зачастую причиной непригодности для идентификации отобранного биологического материала на месте происшествия является его неправильный сбор, транспортировка и хранение. Поэтому большое значение имеет выбор эффективного способа сбора биологических следов, обеспечивающего сохранение количества и качества отобранного материала.
Хранение биологического материала, в частности смывов биологических следов, на твердом носителе (например, на хлопчатобумажной ткани) в сухом виде перед проведением лабораторных исследований является наиболее распространенным и простым способом, при котором биообразцы находятся в условиях комнатной температуры без использования дорогостоящей техники. Носитель со смывом биологических следов для предотвращения деградации молекул ДНК должен быть хорошо высушен перед хранением, защищен от действия солнечного света, высокой температуры и влажности воздуха.
Наиболее часто используемым способом сбора на месте происшествия биологических следов является проведение смывов при помощи марлевых салфеток, смоченных в деионизованной воде. При работе со смывами биологических следов, содержащих малое количество генетического материала, например ПЖС, получение полного генетического профиля лица, оставившего свои следы, сопряжено со значительными трудностями. Это можно объяснить как изначально низким содержанием генетического материала в следах, так и возможной деградацией активной ДНК-матрицы с течением времени в условиях отсутствия стабилизирующих ДНК факторов (Фалеева Т.Г., Иванов И.Н., Мишин Е.С., Внукова Н.В., Корниенко И.В. Проблемы молекулярно-генетической идентификации потожировых следов отпечатков пальцев человека // Судебно-медицинская экспертиза. - 2016. - №2. - С.14-18).
При работе в области молекулярно-генетических исследований можно столкнуться с образцами смывов биологических следов и наложений, выполненных с использованием физиологического раствора. Физиологический раствор, содержащий NaCl в высокой концентрации (около 150 мМ), способен ингибировать реакцию энзиматической амплификации, что может затруднять проведение «прямой» полимеразной цепной реакции (ПЦР), то есть ПЦР без предварительного выделения и очистки препаратов ДНК.
Буфер TE широко используется в биохимии и молекулярной биологии для растворения ДНК или РНК и предотвращения деградации нуклеиновой кислоты. Буфер TE состоит из 10 мМ Трис-HCl рН=8,0, 0,1-1,0 мМ ЭДТА. Несмотря на свои защитные свойства в отношении генетического материала данный буфер не получил широкого применения в качестве среды для хранения, выполненных с его использованием, смывов биообразцов в сухом виде.
В патенте RU 2567145 предлагается композиция для хранения ДНК-содержащих препаратов или ДНК и ее применение для консервации биологических образцов, обеспечивающее сохранность нуклеиновых кислот. Композиция включает 0,5-4% натрий лауроилсаркозин, являющийся детергентом и ингибитором ПЦР, а также ЭДТА (этилендиамин-N,N,N',N'-тетраацетат) в высоких концентрациях (5-20 мМ), которые ингибируют ПЦР и существенно затрудняют или делают невозможным проведение «прямой» ПЦР без добавления различного рода активаторов (обычно неионных детергентов).
В патенте RU 2164532 предлагаются способы и наборы реагентов для генамплификационной диагностики методами ПЦР и РНК-ПЦР. Предлагаемые способы и наборы предназначены для генотестирования, генодиагностики и не обеспечивают длительного хранения генетического материала с их использованием. Набор реагентов для выделения суммы ДНК и РНК содержит лизирующий раствор, в состав которого входят натрий лауроилсаркозин, являющийся детергентом, а также йодистый натрий и/или гуанидинтиоцианат, которые способны ингибировать ПЦР, существенно затруднять или делать невозможным проведение «прямой» ПЦР.
В патенте RU 2258710 предлагается новый цитокин zalpha11-лиганд. Описан способ получения антитела к полипептиду zalpha11-лиганда. Описанные жидкие буферные композиции не обеспечивают длительного хранения генетического материала с их использованием. Высокие концентрации NaCl (100 мМ) и SDS (ДСН, додецилсульфат натрия), являющегося мощным детергентом, в составе лизирующего буфера способны ингибировать ПЦР, существенно затруднять или делать невозможным проведение «прямой» ПЦР.
В патенте RU 2132853 предлагается способ идентификации продуктов из смеси, продукт, полученный при идентификации, способ получения смеси и способ совместного получения катализирующей нуклеиновой кислоты и продукта. Использование высоких концентраций MgCl2 (60 мМ) для реакции транскрипции в составе 5х Т7 РНК полимеразного буфера приведет к полному ингибированию ДНК-Taq-полимеразы (которая полностью ингибируется концентрациями MgCl2 свыше 10 мМ), препятствуя или делая невозможным проведение ПЦР.
В патенте CZ 304780 (В6) предлагается способ хранения ДНК гистопатологического материала. Наличие в состав раствора K лизирующего буфера протеиназы K в концентрации 20 мг/мл способно (без дополнительной очистки) полностью ингибировать ПЦР за счет ферментного гидролиза ДНК-Taq-полимеразы.
В патенте US 6310045 В1 предлагаются композиции и методы для иммунотерапии рака. Высокие концентрации NaCl (150 мМ) и SDS (додецилсульфат натрия), являющегося мощным детергентом, в составе используемого лизирующего буфера для клеток способны ингибировать ПЦР или делать невозможным проведение «прямой» ПЦР.
В патенте KR 20040026519 (А) предлагается метод выделения ДНК для ПЦР анализа трансгенной рыбы. Описанный способ не обеспечивает длительного хранения генетического материала. Наличие SDS (додецилсульфат натрия), являющегося мощным детергентом, и высокой концентрации NaOH (20 мМ) в составе буферного раствора-Х способно ингибировать ПЦР и существенно затруднять проведение «прямой» ПЦР. Высокие концентрации MgCl2 (5 мМ) в составе буферного раствора-Y способствуют возникновению неспецифичных продуктов амплификации при постановке «прямой» ПЦР.
В патенте KR 20020029476 (А) предлагается лизирующий буферный реагент для одностадийного выделения гена. Описанный способ не обеспечивает длительного хранения генетического материала. Наличие высоких концентраций ЭДТА (этилендиамин-N,N,N',N'-тетраацетат) (10 мМ) в составе лизирующего буфера способно ингибировать ПЦР (за счет образование хелатных комплексов с ионами магния (II) и, соответственно, «выключения» их из реакции энзиматической амплификации) или существенно затруднять проведение «прямой» ПЦР.
В патенте CN 102796727 (А) предлагается способ экстракции нуклеиновых кислот грамположительных бактерий. Описанный способ не обеспечивает длительного хранения генетического материала. Наличие в экстракте А детергентов SDS (додецилсульфат натрия) и натрий лауроилсаркозина, а также фенола в составе экстракта В используемого реагента способно ингибировать ПЦР или делать невозможным проведение «прямой» ПЦР.
В патенте ЕА 004880 предлагается набор для анализа обратной транскриптазы и его применение. Описанный способ не обеспечивает длительного хранения генетического материала. Использование в составе набора для составления анализов обратной транскриптазы ионов двухвалентного металла Mg2+ в концентрации свыше 10 мМ приводит к ингибированию ДНК-Taq-полимеразы, тем самым препятствует проведению ПЦР. Наличие гепаринсульфата в качестве ингибитора РНКазы в составе набора способно ингибировать ПЦР или делать невозможным проведение «прямой» ПЦР.
В патенте KR 20030006505 предлагается лизирующий клетки буфер для выделения ДНК и способ выделения ДНК с его использованием. Описанный способ не обеспечивает длительного хранения генетического материала. Наличие таких поверхностно активных веществ, как SDS (додецилсульфат натрия) и сульфата саркозила, являющихся детергентами, а также протеазы в составе лизирующего буфера способно ингибировать ПЦР или делать невозможным проведение «прямой» ПЦР.
В патенте US 6071698 предложен буфер для выделения ДНК и способ его использования. Описанная жидкая буферная композиция предназначена для экстракции ДНК и не обеспечивает длительного хранения генетического материала с ее использованием. Использование высоких концентраций NaCl (0,15-2,0 Μ) и ЭДТА (этилендиамин-N,N,N',N'-тетраацетат) (180-500 мМ) в буфере для выделения ДНК способно ингибировать ПЦР или делать невозможным проведение «прямой» ПЦР.
В патенте US 20020115089 А1 предлагается технология одновременного сбора ДНК и ненуклеиновых аналитов. Наличие высоких концентраций хлорида натрия (1-20 мг/см2), хлорида кальция (1-20 мг/см2), ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат) (0,05-0,15 М), мощного детергента додецилсульфата натрия (SDS, 0,2-1%), протеиназы K (50-150 мкг/мл) в составе композиций способно ингибировать ПЦР или делать невозможным «прямой» ПЦР.
В лабораторных условиях смывы биологических следов и наложений на поверхности исследуемых объектов могут проводиться при помощи различных лизирующих растворов с известным составом, например, 10 мМ трис-HCl, рН 7,5, 10 мМ Na2ЭДТА, 50 мМ NaCl, 2% SDS (Корниенко И.В., Харламов С.Г. Методы исследования ДНК человека. Выделение ДНК и ее количественная оценка в аспекте судебно-медицинского исследования вещественных доказательств биологического происхождения: учебно-методическое пособие / И.В. Корниенко, С.Г. Харламов. Ростов н/Д: ЮФУ, 2012. - 216 с.) и коммерческими, в состав которых входят соли гуанидиния в высоких (несколько моль) концентрациях, например лизирующий буфер (Lysis buffer) набора реагентов DNA IQ™ System (Promega, США) и лизирующий буфер (Lysis buffer) набора реагентов PrepFiler™ User Guide (Applied Biosystems, США). Однако такой способ получения биологического материала подразумевает незамедлительное выполнение экстракции ДНК, а проведение «прямой» ПЦР невозможно вследствие ингибирования реакции компонентами растворов.
При выделении ДНК из биологических следов, содержащих изначально малое количество генетического материала, например, таких как потожировое вещество, необходим способ, который позволил бы осуществлять экстракцию с минимальными потерями генетического материала, максимально исключить контаминацию исследуемых объектов посторонней ДНК и выполнять «прямую» ПЦР без предварительной очистки препарата.
Выделение ДНК при помощи ионообменной смолы Chelex-100 позволяет с минимальными потерями извлекать генетический материал, однако он не всегда обеспечивает необходимую чистоту получаемого препарата. При использовании этого способа сложно получить концентрированный препарат ДНК без угрозы ингибирования ПЦР частицами ионообменной смолы Chelex-100.
Метод фенол-органической экстракции применим к изначально большому объему биологического материала, так как сопряжен со значительными потерями ДНК в процессе ее экстракции. Высокая токсичность и сложность утилизации реагентов отрицательно сказалась на популярности данного метода, и в настоящее время в большинстве лабораторий он заменен такими методами как нуклеосорбция с помощью диоксида кремния (силики), реализованным в большинстве коммерческих наборов (Essentials of Nucleic Acid Analysis. A Robust Approach. Ed. Keer J.T., Birch L. Published by The Royal Society of Chemistry. Cambridge. - 2008. - 248 p.; Корниенко И.В., Фалеева Т.Г. Усовершенствованный метод выделения ДНК человека из биологических образцов, содержащих малое количество генетического материала, с помощью набора реагентов DNA IQ (PROMEGA) // Клинико-лабораторный консилиум. - 2013. - №4 (47). - С.49-53.). Одними из таких наборов реагентов являются системы для выделения ДНК «DNA IQ™» (Promega, США) и PrepFiler™ User Guide (Applied Biosystems, США), при помощи которых можно получить высокоочищенные препараты ДНК как вручную, так и с помощью роботизированной техники. Несмотря на это данные наборы реагентов достаточно дорогостоящи, а методы с их использованием включают многоэтапный процесс экстракции ДНК, что приводит к ее незначительной потере и риску контаминации образцов. Однако даже столь небольшие потери ДНК крайне существенны при работе с объектами, содержащими изначально малое количество генетического материала.
Таким образом, универсального способа с использованием жидкой буферной композиции для осуществления сбора и хранения ДНК-содержащих биологических следов, содержащих малое количество генетического материала, в сухом и жидком виде, обеспечивающей стабильность ДНК в широком диапазоне температур и ее экстракцию без потерь, до настоящего времени предложено не было.
Раскрытие изобретения
В настоящем изобретении предложены:
(1) Композиция для сбора и хранения ДНК или ДНК-содержащих биологических следов, содержащая буферный раствор, включающий 1-40 мМ Трис (гидроксиметил) аминометан, 0,05-1% об. Твин 20, 1-200 мМ K2SO4, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), 1-20% глицерин, 0,01-0,4% NaN3 (азид натрия), вода - остальное.
(2) Композиция (1), где буферный раствор представляет собой смесь растворов 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Твина 20, 87,1 мг K2SO4, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
(3) Композиция (1), где ДНК-содержащий след представляет собой биообразец.
(4) Композиция (1), где соотношение буфера к биообразцу составляет 10:1.
(5) Композиция (1), где биообразец представляет собой потожировое вещество, следы крови, слюны, влагалищного секрета, спермы, суспензии клеток, смешанные биологические следы, препараты ДНК.
(6) Композиция для сбора и хранения ДНК или ДНК-содержащих биологических следов, содержащая буферный раствор, включающий 1-40 мΜ Трис (гидроксиметил) аминометан, 0,05-1% об. Тритон Х-100, 1-200 мМ K2SO4, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), 1-20% глицерин, 0,01-0,4% NaN3 (азид натрия), вода - остальное.
(7) Композиция (6), где буферный раствор представляет собой смесь растворов 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Тритона Х-100, 87,1 мг K2SO4, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
(8) Композиция (7), где ДНК-содержащий след представляет собой биообразец.
(9) Композиция (7), где соотношение буфера к биообразцу составляет 10:1.
(10) Композиция (7), где биообразец представляет собой потожировое вещество, следы крови, слюны, влагалищного секрета, спермы, суспензии клеток, смешанные биологические следы, препараты ДНК.
(11) Композиция для сбора и хранения ДНК или ДНК-содержащих биологических следов, содержащая буферный раствор, включающий 1-40 мМ Трис (гидроксиметил) аминометан, 0,05-1% об. Твин 20, 1-200 мМ KCl, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), 1-20% глицерин, 0,01-0,4% NaN3 (азид натрия), вода - остальное.
(12) Композиция (11), где буферный раствор представляет собой смесь растворов 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Твина 20, 37,3 мг KCl, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
(13) Композиция (12), где ДНК-содержащий след представляет собой биообразец.
(14) Композиция (12), где соотношение буфера к биообразцу составляет 10:1.
(15) Композиция (12), где биообразец представляет собой потожировое вещество, следы крови, слюны, влагалищного секрета, спермы, суспензии клеток, смешанные биологические следы, препараты ДНК.
(16) Композиция для сбора и хранения ДНК или ДНК-содержащих биологических следов, содержащая буферный раствор, включающий 1-40 мМ Трис (гидроксиметил) аминометана, 0,05-1% об. Тритон Х-100, 1-200 мМ KCl, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), 1-20% глицерин, 0,01-0,4% NaN3 (азид натрия), вода - остальное.
(17) Композиция (16), где буферный раствор представляет собой смесь растворов 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Тритона Х-100, 37,3 мг KCl, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
(18) Композиция (17), где ДНК-содержащий след представляет собой биообразец.
(19) Композиция (17), где соотношение буфера к биообразцу составляет 10:1.
(20) Композиция (17), где биообразец представляет собой потожировое вещество, следы крови, слюны, влагалищного секрета, спермы, суспензии клеток, смешанные биологические следы, препараты ДНК.
(21) Применение композиций (1)-(20) для пропитки гигроскопичных материалов-носителей и осуществления смывов ДНК-содержащих биологических следов, наложений или ДНК с целью их изъятия, хранения и/или транспортировки.
(22) Применение (21), где гигроскопичный материал-носитель представляет собой хлопчатобумажную ткань, волокнистые вещества (например, ватный тампон), бумажный носитель (например, хроматографическая бумага).
(23) Применение (21), где ДНК-содержащий биологический след, наложение или ДНК представляют собой сухой биообразец.
(24) Применение (21), где ДНК-содержащий биологический след, наложение или ДНК находятся в жидком виде.
I. Объекты настоящего изобретения представляют собой жидкие буферные композиции для пропитки пористых гигроскопичных носителей, например марлевых салфеток, ватных тампонов, бумаги, с целью осуществления сбора, транспортировки и хранения следов ДНК-содержащего биологического материала путем их смывов, либо нанесения на носители, пропитанные данными буферными растворами, обеспечивающими стабильность ДНК биообразцов в широком диапазоне температур в течение длительных периодов времени в сухом виде.
Знак «%», как используется в настоящем изобретении, означает процентное содержание по массе указанного компонента в указанной композиции, буфере.
В настоящем изобретении используются термины «биологические следы и наложения», «ДНК-содержащие следы», которые означают любые выделения человеческого организма, содержащие генетический материал, оставленные их хозяином на различных поверхностях объектов окружающей среды в виде наложений и пропитываний.
Одним из постоянных составляющих буферных композиций является 0,01-0,4% NaN3 (азид натрия), оказывающий выраженный антимикробный и антимикотический эффект без ингибирования ПЦР.
Также постоянным составляющим композиций является 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат). В животных тканях в больших количествах присутствуют ионы Fe2+ и Fe3+ в составе гемоглобина и высвобождающиеся при его денатурации. Константа связывания ЭДТА с ионами железа составляет ≈10-4 M-1 Fe2+) и ≈10-24 М-1 (Fe3+) (Sillen, L.G., Martell, А.Е. Stability Constants of Metallon Complexes. The Chemical Society, London. - 1964.). Таким образом, благодаря наличию ЭДТА в составе буфера устраняется ингибиторный эффект ионов железа, оказываемый на ПЦР. При этом, малые концентрации ЭДТА в буфере не способны оказывать ингибирующий эффект на ПЦР, тем самым, не препятствуя проведению «прямой» ПЦР.
Слабощелочная среда наиболее оптимальна для хранения препаратов ДНК. Поэтому для создания буферной емкости, поддержания слабощелочного значения рН и стабилизации молекул ДНК используется раствор Трис (1-40 мМ Трис (гидроксиметил) аминометан).
С целью стабилизации ДНК-Taq-полимеразы в состав композиций входят такие активаторы, как Твин 20 (0,05-1% об.), Тритон Х-100 (0,05-1% об.).
Стабилизация фермента ДНК-Taq-полимеразы за счет увеличения времени полужизни фермента при высоких температурах (от +90°C до +97,5°C) на этапе денатурации ДНК-матрицы при проведении ПЦР осуществляется за счет использования активаторов энзиматической амплификации: K2SO4 (1-200 мМ), KCl (1-200 мМ), глицерина (1-20%), что позволяет существенно повысить эффективность реакции.
Настоящее изобретение представляет собой комбинации вышеперечисленных компонентов в буфере:
1. Буферная жидкая композиция (1) представляет собой смесь растворов (1-40 мМ Трис (гидроксиметил) аминометан, предпочтительно 10 мМ, 0,05-1% об. Твин 20, предпочтительно 0,5% об., 1-200 мМ K2SO4, предпочтительно 50 мМ, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), предпочтительно 0,1 мМ, 1-20% глицерин, предпочтительно 5%, 0,01-0,4% NaN3 (азид натрия), предпочтительно 0,1%). Например, смесь 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Твина 20, 87,1 мг K2SO4, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
2. Буферная жидкая композиция (2) представляет собой смесь растворов (1-40 мМ Трис (гидроксиметил) аминометан, предпочтительно 10 мМ, 0,05-1% об. Тритон Х-100, предпочтительно 0,5% об., 1-200 мМ K2SO4, предпочтительно 50 мМ, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), предпочтительно 0,1 мМ, 1-20% глицерин, предпочтительно 5%, 0,01-0,4% NaN3 (азид натрия), предпочтительно 0,1%). Например, смесь 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Тритона Х-100, 87,1 мг K2SO4, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
3. Буферная жидкая композиция (3) представляет собой смесь растворов (1-40 мМ Трис (гидроксиметил) аминометан, предпочтительно 10 мМ, 0,05-1% об. Твин 20, предпочтительно 0,5% об., 1-200 мМ KCl, предпочтительно 50 мМ, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), предпочтительно 0,1 мМ, 1-20% глицерин, предпочтительно 5%, 0,01-0,4% NaN3 (азид натрия), предпочтительно 0,1%). Например, смесь 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Твина 20, 37,3 мг KCl, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
4. Буферная жидкая композиция (4) представляет собой смесь растворов (1-40 мМ Трис (гидроксиметил) аминометан, предпочтительно 10 мМ, 0,05-1% об. Тритон Х-100, предпочтительно 0,5% об., 1-200 мМ KCl, предпочтительно 50 мМ, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), предпочтительно 0,1 мМ, 1-20% глицерин, предпочтительно 5%, 0,01-0,4% NaN3 (азид натрия), предпочтительно 0,1%). Например, смесь 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Тритона Х-100, 37,3 мг KCl, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
Рабочую поверхность гигроскопичного предмета-носителя (марлевая салфетка, ватный тампон и т.д.) полностью пропитывают в одной из четырех вышеуказанных буферных жидких композициях в соотношении 20-150 мкл раствора на 1 см2 (в зависимости от емкости пористого носителя) материала предмета-носителя непосредственно перед осуществлением смыва сухих либо после полного высушивания для смыва жидких следов ДНК-содержащего биологического материала (потожировое вещество, следы крови, слюны, влагалищного секрета, спермы, суспензия клеток, смешанные биологические следы, препараты ДНК), после чего подвергают высушиванию при комнатной температуре.
При использовании бумаги, например, хроматографической, в качестве предмета-носителя проводится ее пропитка путем однократного нанесения на нее одной из четырех вышеуказанных буферных жидких композиций в количестве 20-150 мкл на 1 см2, после чего бумага подвергается высушиванию при комнатной температуре. На предмет-носитель наносится биологический образец в жидком виде (фильтрат выполненного смыва, суспензия клеток, препарат ДНК и т.д.) в количестве 20-1000 мкл в пересчете на площадь от 1 см2 до 10 см2 при толщине бумажного носителя от 0,15 до 1,0 мм, после чего бумага также подвергается высушиванию при комнатной температуре.
Таким образом, настоящее изобретение относится к композициям, сохраняющим стабильной ДНК следов биологических образцов, отобранных путем смыва, либо нанесения на гигроскопичный предмет-носитель, обеспечивая наиболее длительное хранение ДНК в широком температурном диапазоне.
II. Еще одним объектом настоящего изобретения является способ хранения препаратов ДНК в стабильной форме в жидкой композиции для хранения, включающий в себя:
(i) добавление буферной жидкой композиции по настоящему изобретению в качестве разбавителя на заключительном этапе выделения ДНК;
(ii) смешивание очищенного образца ДНК и буферного раствора по настоящему изобретению в соотношении 1:10; и
(iii) хранение препарата ДНК.
Объекты настоящего изобретения представляет собой жидкие буферные композиции для хранения препаратов ДНК в жидком виде в широком диапазоне температур (от -70°C до +40°C).
Настоящее изобретение представляет собой комбинации вышеперечисленных компонентов в буфере:
1. Буферная жидкая композиция (1) представляет собой смесь растворов (1-40 мМ Трис (гидроксиметил) аминометан, предпочтительно 10 мМ, 0,05-1% об. Твин 20, предпочтительно 0,5% об., 1-200 мМ K2SO4, предпочтительно 50 мМ, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), предпочтительно 0,1 мМ, 1-20% глицерин, предпочтительно 5%, 0,01-0,4% NaN3 (азид натрия), предпочтительно 0,1%): 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Твина 20, 87,1 мг K2SO4, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
2. Буферная жидкая композиция (2) представляет собой смесь растворов (1-40 мМ Трис (гидроксиметил) аминометан, предпочтительно 10 мМ, 0,05-1% об. Тритон Х-100, предпочтительно 0,5% об., 1-200 мМ K2SO4, предпочтительно 50 мМ, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), предпочтительно 0,1 мМ, 1-20% глицерин, предпочтительно 5%, 0,01-0,4% NaN3 (азид натрия), предпочтительно 0,1%): 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Тритона Х-100, 87,1 мг K2SO4, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
3. Буферная жидкая композиция (3) представляет собой смесь растворов (1-40 мМ Трис (гидроксиметил) аминометан, предпочтительно 10 мМ, 0,05-1% об. Твин 20, предпочтительно 0,5% об., 1-200 мМ KCl, предпочтительно 50 мМ, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), предпочтительно 0,1 мМ, 1-20% глицерин, предпочтительно 5%, 0,01-0,4% NaN3 (азид натрия), предпочтительно 0,1%): 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Твина 20, 37,3 мг KCl, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
4. Буферная жидкая композиция (4) представляет собой смесь растворов (1-40 мМ Трис (гидроксиметил) аминометан, предпочтительно 10 мМ, 0,05-1% об. Тритон Х-100, предпочтительно 0,5% об., 1-200 мМ KCl, предпочтительно 50 мМ, 0,01-0,5 мМ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетат), предпочтительно 0,1 мМ, 1-20% глицерин, предпочтительно 5%, 0,01-0,4% NaN3 (азид натрия), предпочтительно 0,1%): 12,1 мг Трис (гидроксиметил) аминометана, 50 мкл Тритона Х-100, 37,3 мг KCl, 2 мкл 0,5 Μ ЭДТА (этилендиамин-Ν,Ν,Ν',Ν'-тетраацетата), 500 мкл глицерина, 10 мг NaN3 (азид натрия), доведенную до 10 мл стерильной деионизованной водой.
Таким образом, настоящее изобретение относится к жидкой композиции, сохраняющей стабильной ДНК, содержащей ДНК и один из четырех вышеперечисленных буферных растворов в соотношении 1:10, обеспечивая наиболее длительное хранение препаратов ДНК в широком температурном диапазоне.
Дополнительные объекты и преимущества изобретения указаны в следующем далее разделе описания и частично становятся очевидными из описания или могут быть изучены при применении изобретения. Объекты и преимущества изобретения понимают и реализуют при помощи подробно перечисленных в прилагаемой формуле изобретения элементов и сочетаний.
Следует понимать, что в рамках заявленного изложенное выше общее описание и следующее далее подробное описание являются лишь иллюстративными и поясняющими и не ограничивают объем изобретения. Дополняющие включенные и составляющие часть данного описания фигуры иллюстрируют некоторые варианты преимущества изобретения и вместе с описанием помогают объяснить принципы изобретения.
Краткое описание чертежей
На Фиг. 1 показаны результаты электрофореза в 1% геле агарозы препаратов ДНК, выделенных при помощи наборов реагентов PrepFiler™ User Guide (Applied Biosystems, США) (проба 1), «DNA IQ™» (Promega, США) (проба 2), жидких буферных композиций 1 (проба 3), 2 (проба 4) и контрольные образцы (пробы 5, 6) в трех параллелях ((1), (2) и (3)).
На Фиг. 2 показаны графики накопления продуктов ПЦР, отражающие отсутствие ингибирующего влияния на реакцию амплификации бумаги для хроматографии FN100, пропитанной жидкой буферной композицией 1 (1) или деионизованной водой (2), а также хлопчатобумажной ткани (3) и (4).
На Фиг. 3 ((1), (2)) показаны результаты электрофореза в 2% геле агарозы ПЦР-продуктов в присутствии бумаги для хроматографии FN100, пропитанной жидкой буферной композицией 1 или деионизованной водой, и хлопчатобумажной ткани.
На Фиг. 4 показаны графики ПЦР препаратов ДНК смывов, выполненных с помощью жидких буферных композиций 1 ((1), (2)) или 3 ((3), (4)), либо деионизованной воды ((5), (6)), которые хранили при комнатной температуре 7 ((1), (3), (5)) и 30 ((2), (4), (6)).
На Фиг. 5 показаны результаты электрофореза в 2% геле агарозы ПЦР-продуктов - препаратов ДНК, полученных из смывов, выполненных с помощью жидких буферных композиций 1 или 3, либо деионизованной воды, которые хранили при комнатной температуре 0 суток (контроль) (1), 5 суток (2) и 7 суток (3).
На Фиг. 6 показаны графики накопления продуктов ПЦР образцов слюны, где растворителем являлись деионизованная вода, физиологический раствор, буфер TE или жидкая буферная композиция 3 (буфер 3), при инкубации +22°C (1) и +70°C (2) в течение 30 минут, а также образцов слюны, где растворителем являлись лизирующие растворы из наборов реагентов DNA IQ™ System, PrepFiler™ User Guide, Prep-n-Go, «А», при инкубации +22°C (3) и +70°C (4) в течение 30 минут.
На Фиг. 7 показаны графики накопления продуктов ПЦР внутреннего положительного контроля (канал Су5) в присутствии деионизованной воды, физиологического раствора, буфера ТЕ, жидкой буферной композиции 3 (буфера 3) (1), а также лизирующих растворов из наборов реагентов DNA IQ™ System, PrepFiler™ User Guide, Prep-n-Go, «А», ингибирующих ПЦР (2).
На Фиг. 8 показаны графики накопления продуктов ПЦР препаратов ДНК из смывов потожирового вещества, выполненных с поверхности гладкого металлического предмета, при помощи жидкой буферной композиции 3 (1), физиологического раствора (2), буфера TE (3) или деионизованной воды (4).
Осуществление изобретения
Пример 1.
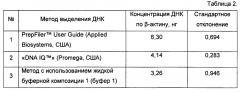
Для сравнительного исследования методов выделения ДНК из биологических следов проводили оценку потерь ДНК известной концентрации в процессе ее экстракции при помощи наборов реагентов PrepFiler™ User Guide (Applied Biosystems, США), «DNA IQ™» (Promega, США) и жидких буферных композиций 1, 2 (буферов 1, 2), предлагаемых в настоящем изобретении. Исследования по каждому из методов проводили в семи параллелях.
В качестве генетического материала использовали контрольную ДНК человека из тест-набора «XY-Детект» (ООО «Синтол») в конечной концентрации 0,1 нг/мкл.
1. Выделение ДНК при помощи набора реагентов PrepFiler™ User Guide (Applied Biosystems, США) проводили согласно базовому протоколу для выделения геномной ДНК.
Помещали по 10 мкл препаратов ДНК с концентрацией 0,5 нг/мкл в стандартные 1,5 мл микроцентрифужные пробирки. Добавляли по 300 мкл PrepFiler™ Lysis buffer и по 3 мкл 1,0 Μ DTT. Перемешивали на вортексе при низких оборотах 5 секунд, затем кратко центрифугировали. Инкубировали образцы в термошейкере при +70°C и 900 об/мин в течение 40 минут. Центрифугировали микроцентрифужные пробирки при 12000 g в течение 2 минут. Переносили лизат в чистые 1,5 мл пробирки. Добавляли в пробирки, содержащие лизат, по 15 мкл магнитных частиц. Перемешивали на вортексе при низких оборотах 5 секунд, затем кратко центрифугировали. Добавляли по 180 мкл изопропанола (Binding buffer). Перемешивали на вортексе при низких оборотах 5 секунд, затем кратко центрифугировали. Помещали пробирки в шейкер и перемешивали 10 минут при 1000 об/мин в условиях комнатной температуры. Перемешивали образцы на вортексе. Ставили пробирки в магнитный штатив и держали до тех пор, пока осадок не прекратит накапливаться (2 минуты). Держа пробирки в магнитном штативе, отбирали и удаляли надосадок. Добавляли по 300 мкл PrepFiler™ Wash buffer в пробирки. Перемешивали на вортексе при максимальной скорости так, чтобы на стенках пробирок не было видно магнитных частиц, затем кратко центрифугировали. Помещали пробирки в магнитный штатив на 30-60 секунд. Держа пробирки в магнитном штативе, отбирали и удаляли надосадок. Данный этап промывки повторяли три раза. Держа пробирки в магнитном штативе, сушили магнитные частицы 7 минут на столе. Добавляли по 50 мкл PrepFiler™ Elution Buffer в пробирки. Перемешивали на вортексе при максимальной скорости 5 секунд так, чтобы на стенках пробирок не было видно магнитных частиц, затем кратко центрифугировали. Инкубировали пробирки в термошейкере и при +70°C и 900 об/мин в течение 5 минут. Перемешивали на вортексе при максимальной скорости так, чтобы на стенках пробирок не было видно магнитных частиц, затем кратко центрифугировали. Ставили пробирки в магнитный штатив и держали до тех пор, пока осадок не прекратит накапливаться (как минимум 1 минута). Переносили надосадок (который должен содержать геномную ДНК) в новые 1,5 мл пробирки для хранения.
2. Выделение ДНК при помощи набора реагентов «DNA IQ™» (Promega, США) проводили согласно базовому протоколу для выделения геномной ДНК.
Помещали по 10 мкл препаратов ДНК с концентрацией 0,5 нг/мкл в стандартные 1,5 мл микроцентрифужные пробирки. Добавляли по 250 мкл Promega™ Lysis buffer и по 2,5 мкл 1,0 Μ ДТТ. Перемешивали на вортексе при низких оборотах 5 секунд, затем кратко центрифугировали. Инкубировали образцы в термошейкере при +70°C и 900 об/мин. в течение 30 минут. Центрифугировали микроцентрифужные пробирки при комнатной температуре при 10000 g в течение 2 минут. Переносили лизат в чистые 1,5 мл пробирки. Предварительно перемешав, добавляли по 7,0 мкл DNA IQ™ Resin смолы (суспензии магнитных частиц) к растворам, содержащим ДНК. Смесь образца в лизирующем буфере с магнитными частицами встряхивали на вортексе в течение 3 секунд. Инкубировали при комнатной температуре в течение 5 минут, перемешивая на вортексе каждые 30 секунд. Устанавливали пробирки в магнитный штатив. Автоматической пипеткой тщательно отбирали и удаляли раствор, стараясь не нарушить осадка магнитных частиц на стенках пробирок. Добавляли к осадку по 100 мкл Promega™ Lysis buffer. Пробирки встряхивали на вортексе в течение 2 секунд. Устанавливали пробирки в магнитный штатив и полностью удаляли Promega™ Lysis buffer. Добавляли в пробирки по 100 мкл 1Х-отмывающего буфера (Promega™ Wash Buffer). Пробирки встряхивали на вортексе в течение 2 секунд. Устанавливали пробирки в магнитный штатив и удаляли отмывающий буфер. Промывку отмывающим буфером повторяли еще 2 раза. Устанавливали пробирки в магнитный штатив с открытой крышкой. Сушили осадок магнитных частиц при комнатной температуре в течение 5 минут. Добавляли по 50 мкл элюционного буфера (Promega™ Elution Buffer). Встряхивали на вортексе в течение 2 секунд. Инкубировали пробирки в микротермостате +65°C в течение 5 минут при постоянном перемешивании 900 об/мин. После инкубации образцы перемешивали при максимальной скорости в течение 2 секунд. Ставили пробирки в магнитный штатив и держали до тех пор, пока осадок не прекратит накапливаться (как минимум 1 минута). Переносили надосадок (который должен содержать геномную ДНК) в новые 1,5 мл пробирки для хранения.
3. Выделение ДНК с использованием жидких буферных композиций 1, 2 (буферов 1, 2), предлагаемых в настоящем изобретении.
Состав жидкой буферной композ