Способ получения глюкозочувствительных полимерных гидрогелей
Иллюстрации
Показать всеИзобретение относится к области биохимии и медицины, к способу получения глюкозочувствительных полимерных гидрогелей, которые могут применяться в качестве носителей для контролируемого выделения инсулина при появлении глюкозы. Способ получения глюкозочувствительных полимерных гидрогелей осуществляют путем полимеризации под действием окислительно-восстановительного инициатора водного раствора, содержащего 0,15-0,5% мас. N-(2-D-глюкоз)акриламида, 3,0-5,0% мас. акриламида, 0,01-0,06% мас. N,N-метиленбисакриламида, 0,05-0,15% мас. конканавалина А и 0,03-0,10% мас. меркаптоуксусной кислоты. Технический результат – полученный способом гидрогель обеспечивает выделение повышенного количества инсулина на начальной стадии появления глюкозы при последующем регулируемом выделении в последующее время действия. 3 табл., 7 пр.
Реферат
Изобретение относится к области химии полимеров, биохимии и медицины, а именно к способу получения глюкозочувствительных полимерных гидрогелей, которые могут применяться в качестве носителей для контролируемого выделения инсулина при появлении глюкозы в окружающей среде.
Как известно, жизненно важные вещества полипептидной природы (ферменты, ингибиторы, гормоны и т.п.) синтезируются внутри организма, а не попадают в него с пищей. Последнее невозможно, так как протеолитические ферменты, участвующие в процессе пищеварения, гидролизуют белки до аминокислот. Поэтому для устранения дефицита такого белка его вводят в организм инъекционно, минуя пищеварительный тракт.
Одним из таких препаратов является гормон поджелудочной железы инсулин - полипептид, вырабатываемый β-клетками островков Лангерганса поджелудочной железы. Инсулин является универсальным гормоном, влияющим на большое число процессов, протекающих в организме, таких как: транспорт глюкозы через мембрану; утилизация глюкозы; ингибирование глюконеогенеза (образования глюкозы из предшественников неуглеводной природы); метаболизм глюкозы; метаболизм липидов; метаболизм белков; размножение клеток и т.д. Частичная или полная недостаточность инсулина приводит к сахарному диабету. Уже сейчас по некоторым оценкам, в мире страдают от диабета около 300 миллионов человек, причем выявлена четкая тенденция к увеличению роста числа больных.
В физиологических условиях инсулин вырабатывается поджелудочной железой в ответ на повышение концентрации глюкозы. Пороговой для секреции инсулина является концентрация глюкозы 80-100 мг/100 мл крови, а максимальная скорость секреции достигается при концентрации глюкозы 300-500 мг/100 мл. Секреция инсулина носит двухфазный характер. Немедленный ответ или первая фаза реакции начинается в пределах одной минуты после повышения концентрации глюкозы, продолжается первые 8-10 минут. Затем скорость выделения инсулина резко замедляется и наступает вторая более медленная и продолжительная фаза практически равномерного выделения инсулина, резко обрывающаяся после удаления глюкозы [Марри Р., Греннер Д., Мейес П. Родуэлл В. Биохимия человека. - М.: Мир 1993. С. 247].
Обычно (в норме) инсулин попадает в печень через кровеносные сосуды, соединенные с портальной печеночной веной. Печень, в свою очередь, контролирует количество инсулина, достигающего другие органы и ткани. При инъекционном же введении инсулина (а это наиболее распространенный способ лечения сахарного диабета) такой контроль отсутствует, физиологическое соотношение между концентрациями инсулина и глюкозы нарушается, что и является причиной таких осложнений при сахарном диабете, как сердечно-сосудистые заболевания, расстройство функций головного мозга и т.д. [М. Saffran, in: Targeting of Drags: The Challenge of Peptides and Proteins, G. Gregoriadis (ed.), Plenum Press, New York (1992), pp. 89-95].
Поскольку повышение концентрации глюкозы в крови - главный стимул секреции инсулина поджелудочной железой в живом организме, то крайне перспективным представляется создание систем, которые, будучи имплантированы в организм больного, контролируемо выделяли бы инсулин в ответ на повышение концентрации глюкозы по естественному, двухфазному, механизму.
Известен способ получения глюкозочувствительных полимерных гидрогелей путем взаимодействия углеводных производных инсулина с конканавалином A [Sato S., Yeong S.Y., McRea Y.C., Kim S.W. Self-regulating insulin-delivery systems. II. In vitro studies. // J. Control. Release. 1984. V. 1. P. 67-77]. В качестве углеводных производных инсулина используют N-сукцинилглюкозамин-инсулин, N-глутарилглюкозамин-инсулин, n-(глутарилоамидо)фенил-α-(D-глюкопиранозид)-инсулин, n-(глутарилоамидо)фенил-α-(В-маннопиранозид)-инсулин, n-(сукциниламидо)фенил-α- (D-глюкопиранозид)-инсулин, n-(сукциниламидо)фенил-α-(D-маннопиранозид)-инсулин. Конканавалин А - белок с молекулярной массой 102000, имеющий четыре места связывания углеводов. При реакции с углеводным производным инсулина конканавалин А выполняет роль сшивающего агента, образуя комплексные соединения с остатками углеводов. При появлении глюкозы в окружающей среде она вытесняет углеводное производное инсулина из его комплекса с конканавалином А, в результате чего гидрогель распадается и в окружающую среду выделяется углеводное производное инсулина.
Недостатком этого способа является выделение в окружающую среду всех компонентов полимерного гидрогеля, а также невозможность применения этой системы для контролируемого выделения инсулина, а не его углеводного производного.
Известен способ получения глюкозочувствительных полимерных гидрогелей путем взаимодействия декстранов с конканавалином A [Tang М., Zhang R., Bowyer A., Eisenthal R., Hubble J.A reversible hydrogel membrane for controlling the delivery of macromolecules. // Biotechnol. Bioeng. 2003. V. 82. № 1. P. 47-53].
Недостатком этого способа является выделение в окружающую среду при взаимодействии с глюкозой всех компонентов полимерного гидрогеля.
Известен способ получения глюкозочувствительных полимерных гидрогелей путем взаимодействия производного глюкозы с конканавалином А [И.Л. Валуев, В.В. Чупов, Г.А. Сытов, Л.И. Валуев, Н.А. Платэ. Фазообратимые гидрогели на основе акриламида и N-(2-D-глюкоз)акриламида. // Высокомолек. соед., 1997, Т. 39Б, №4, С. 751-754].
В качестве производного глюкозы используют сополимер 3,9-14,5% мол. N-(2-D-глюкоз)акриламида и 85,5-96,1% мол. акриламида, а взаимодействие осуществляют путем смешивания водного раствора, содержащего 10-25% мас. сополимера N-(2-D-глюкоз)акриламида и акриламида, с водным раствором конканавалина А.
При реакции с глюкозосодержащим полимером конканавалин А выполняет роль сшивающего агента, образуя комплексные соединения с остатками глюкозы, принадлежащими различным полимерным цепям. В результате реакции образуется гидрогель, степень набухания которого в воде определяется содержанием звеньев N-(2-D-глюкоз)акриламида в сополимере и соотношением N-(2-D-глюкоз)акриламид/конканавалин А. При добавлении определенного количества глюкозы она вытесняет конканавалин А из комплекса, в результате чего происходит разрушение гидрогеля с образованием растворимого сополимера N-(2-D-глюкоз)акриламида и акриламида и растворимого комплекса конканавалин А - глюкоза. Если в гидрогель предварительно был введен инсулин, то при разрушении гидрогеля происходит выделение инсулина в раствор. Таким образом, синтезированная система представляет собой модель поджелудочной железы, способной выделять определенное количество инсулина в ответ на появление в растворе определенного количества глюкозы.
Недостатком этого способа является одностадийное выделение инсулина, а также образование растворимого синтетического сополимера N-(2-D-глюкоз)акриламида с акриламидом при выделении инсулина. При использовании в живых организмах этот сополимер накапливается в организме, сорбируясь на мембранах клеток и приводя к токсическому эффекту.
Наиболее близким по технической сущности и достигаемым результатам является способ получения глюкозочувствительных полимерных гидрогелей путем полимеризации под действием окислительно-восстановительного инициатора водного раствора, содержащего 0,15-0,5% мас. N-(2-D-глюкоз)акриламида, 3,0-5,0% мас. акриламида, 0,01-0,06% мас. N,N-метиленбисакриламида и 0,05-0,15% мас. конканавалина А [Валуев И.Л., Ванчугова Л.В., Валуев Л.И., Глюкозочувствительные гидрогелевые системы // Высокомол. соед. 2011. Т. 53А. №5. С. 691-695].
Полимерные цепи в полученных гидрогелях сшиты ковалентными связям N,N-метиленбисакриламида и связями между конканавалином А (Кон А) и звеньями N-(2-D-глюкоз)акриламида (ГАА). В растворе глюкозы связь «Кон А- звено ГАА» замещается связью «Кон А - глюкоза» и степень набухания гидрогелей увеличивается, что приводит к выделению предварительно введенного в гидрогель инсулина. Выделение инсулина происходит равномерно в одну стадию и через 60 мин составляет до 80% от первоначально введенного в гидрогель инсулина.
Недостатком этого способа является равномерное выделение инсулина.
Задачей изобретения является повышение скорости выделения инсулина на начальном этапе.
Техническим результатом, достигаемым при использовании изобретения, является реализация физиологического пути изменения концентрации инсулина при увеличении уровня глюкозы в растворе.
Технический результат достигается тем, что в способе получения глюкозочувствительных полимерных гидрогелей путем полимеризации под действием окислительно-восстановительного инициатора водного раствора, содержащего 0,15-0,5% мас. N-(2-D-глюкоз)акриламида, 3,0-5,0% мас. акриламида, 0,01-0,06% мас. N,N-метиленбисакриламида и 0,05-0,15% мас. конканавалина А, водный раствор дополнительно содержит 0,03-0,10% мас. меркаптоуксусной кислоты.
Пример 1
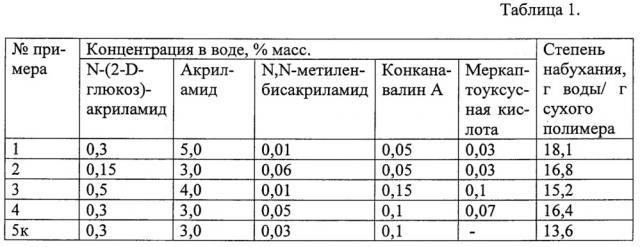
При комнатной температуре и постоянном перемешивании в 94,6 мл дистиллированной воды растворяют 5,0 г акриламида, 0,3 г N-(2-D-глюкоз)акриламида, 0,01 г N,N-метиленбисакриламида, 0,05 г конканавалина А и 0.03 г меркаптоуксусной кислоты. После полного растворения в раствор добавляют 0,04 г персульфата аммония и 40 мкл N,N,N',N'- тетраметилэтилендиамина. Образовавшийся раствор дегазируют в круглодонном сосуде на водоструйном насосе (давление 50 мм рт.ст.) и оставляют при комнатной температуре до окончания реакции (1,0-1,5 ч). Об окончании реакции свидетельствует образование бесцветного геля. Полученный гель извлекают из сосуда, измельчают и промывают 10-кратным избытком дистиллированной воды. Степень набухания полученного гидрогеля в воде равна 18,1 г воды/г сухого полимера.
Примеры 2-4. Процесс проводят по примеру 1, используя различные количества N-(2-D-глюкоз)акриламида, акриламида, N,N-метиленбисакриламида, конканавалина А и меркаптоуксусной кислоты (таблица 1).
Пример 5к (контрольный) проводят по способу-прототипу без использования меркаптоуксусной кислоты.
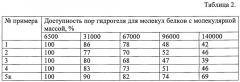
Пример 6. Проницаемость гидрогелей для молекул белков различной молекулярной массы оценивают путем выдерживания гидрогелей с раствором белка при 4°С в течение 24 ч и измерением концентрации белка в растворе спектрофотометрически при 280 им. Учитывая соотношение объемов гидрогелей и растворов, рассчитывают количество пор, доступных для каждого белка, принимая за 100% количество пор, доступных для воды. В качестве белка используют инсулин (М=6.5×103), овомукоид (М=31×103), сывороточный альбумин (М=67×103), гексокиназу (М=96×103) и алкогольдегидрогеназу (М=14×104).
Результаты приведены в таблице 2.
Видно, что гидрогели, полученные по заявленному способу, отличаются от известных глюкозочувствительных гидрогелей повышенным (в среднем на 25%) содержанием пор небольших размеров, недоступных для белков с молекулярной массой выше 140000.
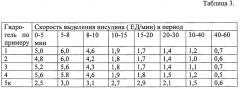
Пример 7. Насыщение гидрогелей инсулином проводят путем инкубирования лиофильно высушенных гидрогелей с раствором инсулина (25 ЕД/мл) до равновесного набухания. Набухшие гидрогели, содержащие 130 ЕД инсулина помещают в проточную кювету объемом 15 мл, через которую со скоростью 3.0 мл/мин прокачивают физиологический раствор (0.9% раствора хлорида натрия), содержащий 250 мг глюкозы на 100 мл, и измеряют количество выделившегося из гидрогеля инсулина. Концентрацию инсулина в растворе определяли спектрофотометрическим при 280 нм. Скорость выделения инсулина (ЕД/мин) приведена в таблице 3.
Видно, что выделение инсулина в раствор глюкозы из гидрогелей, полученных по заявленному способу, происходит двухстадийно. Максимальная скорость достигается к восьмой минуте и составляет 5,6-6,0 ЕД/мин, а затем инсулин накапливается в растворе с равномерно понижающейся скоростью 1,9-0,7 ЕД/мин. Выделение инсулина из гидрогелей, полученных по способу-прототипу, в течение всего времени наблюдения равномерно снижается от 3,0-2,5 ЕД/мин до 1,5-0,6 ЕД/мин.
Таким образом, предлагаемое изобретение позволяет получать полимерные гидрогели, способные, в отличие от известных, аналогично поджелудочной железе выделять повышенное количество инсулина на начальной стадии появления глюкозы.
Предельные количества веществ, используемых при получении полимерного гидрогеля, определяются следующим. При концентрации N-(2-D-глюкоз)акриламида ниже 0,15% мас. и концентрации конканавалина А ниже 0,05% мас. полимерные гидрогели практически не изменяют степень набухания при увеличении концентрации глюкозы, а при концентрации N-(2-D-глюкоз)акриламида выше 5,0% мас. и концентрации конканавалина А выше 0,15% мас. увеличение степени набухания гидрогелей происходит при чрезвычайно высокой концентрации глюкозы, порядка 600 мг/100 мл. При концентрации N,N-метиленбисакриламида ниже 0,01% мас. образуются гидрогели с чрезвычайно низкой механической прочностью, а при концентрации N,N-метиленбисакриламида выше 0,06% мас. образуются жесткие гидрогели, диффузия инсулина из которых чрезвычайно затруднена. Меркаптоуксусная кислота в количестве ниже 0,03 мас. % не способна изменять характер распределения пор в гидрогеле, в при концентрации выше 0,10 мас. % она ингибирует полимеризацию.
Способ получения глюкозочувствительных полимерных гидрогелей путем полимеризации под действием окислительно-восстановительного инициатора водного раствора, содержащего 0,15-0,5% мас. N-(2-D-глюкоз)акриламида, 3,0-5,0% мас. акриламида, 0,01-0,06% мас. N,N-метиленбисакриламида и 0,05-0,15% мас. конканавалина А, отличающийся тем, что водный раствор дополнительно содержит 0,03-0,10% мас. меркаптоуксусной кислоты.