Способ прогнозирования раннего развития язвенной болезни двенадцатиперстной кишки
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к гастроэнтерологии, и касается раннего прогнозирования язвенной болезни двенадцатиперстной кишки (ЯБДПК) у татар Республики Башкортостан в возрасте до 45 лет. Сущность способа: выделяют ДНК из лимфоцитов периферической венозной крови, проводят генотипирование полиморфизма rs1800872 гена IL10 методом полимеразной цепной реакции с последующим рестрикционным анализом. При выявлении протективного генотипа А/А прогнозируют низкий риск развития ЯБДПК у лиц татарской этнической принадлежности в возрасте до 45 лет. Использование изобретения повышает точность прогноза за счет определения патогенетического механизма воспаления, упрощает исследование. 2 табл., 1 пр.
Реферат
Изобретение относится к медицине, в частности к терапии, гастроэнтерологии, генетике.
Значительная распространенность язвенной болезни (ЯБ) двенадцатиперстной кишки среди населения молодого возраста, хроническое рецидивирующее течение, вызывающее большие трудопотери и серьезные для жизни осложнения указывают на актуальность проблемы диагностики этого заболевания.
В настоящее время большинство гастроэнтерологов рассматривают ЯБ как мультифакторное, полиэтиологическое заболевание, имеющее наследственную предрасположенность [В.Т. Ивашкин, Т.П. Лапина, И.В. Маев, В.В. Чернин, Я.С. Циммерман и др.]. Известно наличие конкретных генетических факторов, обусловливающих наследственную предрасположенность к ЯБ.
В настоящее время в патогенезе ЯБ большую роль отводят цитокинам, в связи с чем проводится активное изучение генов провоспалительных цитокинов IL-1β, IL-6, IL-8 и TNF-α для прогнозирования риска развития заболевания.
Известен способ прогнозирования вероятности возникновения язвенной болезни 12-перстной кишки (ЯБДПК), который основан на определении генетических маркеров системы АВО, систем MN, Р, Льюис, иммуноглобулина Gm 1, типа гаптоглобина (Hp), трансферрина (Tf), альфа-1-антитрипсина (αI-AT), кислой фосфатазы (АСР), фосфоглюкомутазы (PGM), эстеразы D (EsD). Определяют тип ушной серы. Каждому маркеру определяют прогностический коэффициент (ПК), суммируют полученные ПК. При сумме ПК, равной + 10 и выше, прогнозируют предрасположенность к развитию язвенной болезни 12-перстной кишки [патент РФ №2143684 от 27.12.1999]. Недостатком метода является необходимость исследования большого количества генетических маркеров и расчет суммарного ПК.
Известен способ раннего прогнозирования развития язвенной болезни двенадцатиперстной кишки у европеоидов Республики Хакасия, заключающийся в том, что проводят выделение ДНК из лимфоцитов венозной крови и выявление генотипа СС АА полиморфизма + 3953 гена IL-1 методом полиморфизма длин рестрикционных фрагментов и R2R2 IL-1Ra VNTR у пациентов носителей генотипа sls2 vacA Helicobacter pylori методом полимеразной цепной реакции; установленным факторам риска присваивают градации (А1-А2) и числовые значения; после чего определяют прогностические коэффициенты P1, Р2 по формулам: Р1=-1,54+0,57⋅А1+0,53⋅А2 и Р2=0,21+1,77⋅А1+1,70⋅А2, где А1 - генотип полиморфизма С+3953Т IL-1: ТТ=0,44, TC=0,51, СС=2,63; А2 - генотип полиморфизма IL-1Ra VNTR: R2R2=1,74, R2R3=8,08, R2R4=1,33, R3R3=1,59, R3R4=0,30, R4R4=0,51 при P1>P2 прогнозируют низкий риск, a при P1<P2 прогнозируют высокий риск развития ЯБ [патент РФ №2542459 от 20.02.2015]. Недостатком данного метод является трудоемкость подсчета.
Наиболее близким аналогом изобретения является диссертационное исследование Габбасовой Л.В. (Габбасова Л.В. Клинико-генетическое исследование язвенной болезни двенадцатиперстной кишки. Дисс. к.м.н. Ижевск, 2013), в которой показано, что в группе контроля по сравнению с больными чаще встречаются генотип rs1800872*AA и аллель rs1800872*A (р=0,017, OR=0,091 и р=0,025, OR=0,544, соответственно). Основным недостаткам аналога является то, что в исследование включены пациенты разных возрастных групп (18-60 лет).
Задачей изобретения стала разработка способа прогнозирования развития ЯБДПК у народов Башкортостана в возрасте от 18 до 45 лет на основе генетических маркеров и факторов риска развития заболевания.
Технический результат при использовании изобретения - повышение точности прогноза за счет определения патогенетического механизма воспаления, упрощение исследования.
Указанный технический результат достигается тем, в способе прогнозирования развития язвенной болезни двенадцатиперстной кишки (ЯБДПК) у татар Республики Башкортостан, включающем выделение ДНК из лимфоцитов венозной крови, генотипирование полиморфного локуса rs1800872 гена IL10 методом полимеразной цепной реакции с последующим рестрикционным анализом, прогнозирование низкого риска развития ЯБДПК при выявлении генотипа АА, согласно изобретению, прогнозируют низкий риск развития ЯБДПК у лиц в возрасте от 18 до 45 лет.
Отбор пациентов проводился на основании клинических, эндоскопических и морфологических данных после получения информированного согласия на участие в исследовании. Диагноз язвенной болезни двенадцатиперстной кишки верифицировался на основании данных эндоскопического исследования. В исследование не включались пациенты с сочетанной патологией, а также пациенты, получавшие в последние 6 месяцев антибактериальные, противовоспалительные препараты.
Нами проведено изучение распределения частот аллелей и генотипов полиморфного варианта IL10 (-627C>А) у 128 больных ЯБДПК и 102 человек контрольной группы в возрасте от 18 до 45 лет методом ПЦР-анализа в этнически подразделенных выборках. Исследование продемонстрировало достоверную разницу в распределении частот генотипов данного полиморфного локуса у татар, недостоверную разницу у русских и в общей выборке, которым применяли дополнительно подсчет нормированного интенсивного показателя.
Использование предлагаемого способа диагностики обеспечивает высокую информативность своевременного прогнозирования развития ЯБДПК, обеспечивает своевременное и рациональное проведение комплекса терапевтических мероприятий.
Предлагаемый способ осуществляется следующим образом.
Молекулярно-генетические методы
Материалом для генетического исследования служили образцы ДНК, выделенные из венозной крови больных башкир, русских, татар по этнической принадлежности. Молекулярно-генетические исследования выполнены совместно с лабораторией молекулярной генетики человека отдела геномики ФБГУН Института биохимии и генетики Уфимского Научного Центра РАН РБ. Объектом исследования служили образцы ДНК, полученные из лимфоцитов периферической венозной крови больных ЯБ, практически здоровых лиц. ДНК выделяли из венозной крови стандартным методом фенольно-хлороформной экстракции с небольшими модификациями (Mathew С., 1984; Johns М. Et al., 1989; Sambrook I., 1989). Идентификацию продуктов амплификации проводили в ультрафиолетовом свете после электрофореза в 7%-ном полиакриламидном геле. После гель окрашивали раствором бромистого этидия и анализировали в проходящем ультрафиолетовом свете на трансиллюминаторе «Vilber Lourmat», ТСР-20 М. Размеры аллелей определяли путем одновременного электрофореза с маркером (ДНК фага λ, гидролизированного рестриктазой Pstf). При анализе электрофореграмм использовали видеогельдокументирующую систему.
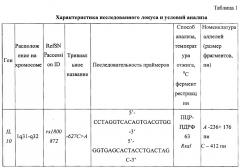
Анализ полиморфных вариантов генов осуществляли методом ПЦР-ПДРФ с использованием локусспецифичных олигонуклеотидных праймеров (Kato S. et al., 2001; Keso Т. et al., 2000) (табл. 1).
Выделение геномной ДНК
ДНК выделяли из периферической крови методом фенольно-хлороформной экстракции по Мэтью [Mathew С.С., 1984]. Кровь набирали в пробирки, в качестве консерванта использовали глюгицир в соотношении 8:2 (кровь:глюгицир), тщательно перемешивали и хранили при температуре 4°С не более двух недель. Для получения фракции клеточных ядер к 8 мл крови добавляли 40 мл лизирующего буфера (320 мМ сахароза; 5 мМ MgCl2; 1% тритон Х-100; 10 мМ трис-HCl, pH=7,6) и центрифугировали 20 мин при температуре 40°С и 4000 об/мин. Надосадочную жидкость сливали, к осадку повторно приливали 20 мл лизирующего буфера и центрифугировали при тех же условиях в течение 10 мин. К полученному осадку добавляли 400 мкл буфера Soline ЭДТА (25 мМ ЭДТА, pH 8,0 и 75 мМ NaCl), 40 мкл 10% SDS, 30-40 мкл протеиназы К (10 мг/мл) и инкубировали при 37°С в течение 16 часов. Из полученного лизата выделяли ДНК. Экстракцию ДНК проводили в три этапа: забуференным фенолом (200 мкл меркаптоэтанола на 50 мл фенола - Трис-HCI, pH 7,8), смесью фенол-хлороформа (1:1) и хлороформом (2 мл изоамилового спирта на 48 мл хлороформа) в равных объемах. Выделение ДНК проводили, смешивая лизат и растворитель до образования однородной эмульсии, разделение фаз осуществляли центрифугированием при 10000-12000 об/мин в течение 10 мин. ДНК осаждали двумя объемами 96% этанола. Осадок промывали 70% этанолом, подсушивали на воздухе, затем растворяли в дистиллированной воде и хранили при -20°С.
Полимеразная цепная реакция синтеза ДНК
Амплификацию изученных локусов проводили с помощью метода полимеразной цепной реакции (ПЦР) синтеза ДНК на амплификаторе "Терцик" производства компании «ДНК-технология» (г. Москва). Для амплификации использовали реакционную смесь объемом 25 мкл, которая содержала 2,5 мкл 10xTaq-буфера (67 мМ трис-HCl (pH 8,8), 16,6 мМ (NH4)2SO4,, 1,5 мМ MgCl2, 0,01% Tween-20), 0,1 мкг геномной ДНК, смесь dNTP (dATP, dGTP, dCTP, dTTP по 200 мкМ каждого), 1 ед. ДНК-полимеразы Termus aquaticus (производства фирмы «Силекс», г. Москва) и 5-10 пМ локусспецифичных олигонуклеотидных праймеров.
Рестрикционный анализ
Для определения нуклеотидных замен проводили гидролиз амплифицированных фрагментов соответствующей рестриктазой. Метод электрофореза в полиакриламидном геле. Разделение фрагментов ДНК после амплификации и рестрикции проводили при помощи электрофореза в 7% полиакриламидном геле (ПААГ), приготовленном из 30% раствора ПААГ (соотношение акриламид:N,N'-метиленбисакриламид - 29:1). Электрофорез проводили в 1×ТБЕ буфере (0,089 М трис-HCl; 0,089 М борная кислота; 0,002 ЭДТА, pH=8,0). Перед нанесением на гель пробы смешивали в соотношении 5:1 с краской, содержащей 0,25% бромфенолового синего, 0,25% ксиленцианола и 15% фикола. После окончания электрофореза гель окрашивали раствором бромистого этидия и фотографировали при УФ-освещении.
Для проверки соответствия эмпирического распределения частот генотипов теоретически ожидаемому равновесию Харди-Вайнберга использовали критерий χ2 с поправкой Йейтса на непрерывность. Силу ассоциаций оценивали в значениях показателя отношения шансов (OR), рассчитывали его 95% доверительный интервал (95% CI) (Животовский Л.А., 1991) с использованием компьютерной программы R×C (ROW×Columns) по алгоритму Roff D.A. (1989).
Исследование продемонстрировало достоверную разницу в распределении частот генотипов данного полиморфного локуса у татар: установлено, что гомозиготный генотип А/А достоверно чаще встречается в группе контроля, чем у больных ЯБДПК 17,39% и 1,92% соответственно, р=0,022, OR=0,093, CI 95% (0,011-0,777).
Маркером пониженного риска развития ЯБДПК у индивидов этнической татарской принадлежности является генотип АА полиморфного варианта - 627С>A (rs1800872) гена IL10 (табл. 2).
Ramis I.B. et al., 2015 показали, что инфекция Н.р. вызывает воспаление, приводящее к увеличению IL-10. Анализ полиморфизма гена IL-10 в позиции 819 в биоптате 151 пациента с Н.р. – инфекцией, и 76 лиц без Н.р. показал высокую связь развития воспаления, вызванного Н.р.
Пример
Больной М., 28 лет, татарской этнической принадлежности. Без наследственной отягощенности, диагноз хронический гастрит. Проведено исследование по предлагаемой методике. Установлено: является носителем генотипа А/А полиморфного локуса rs1800872 гена IL10, так как данный генотип встречается с большей частотой в группе контроля, соответственно, в отношении развития ЯБДПК риск низкий. В процессе динамического наблюдения образование язвенного дефекта слизистой двенадцатиперстной кишки не наблюдалось.
Способ прогнозирования развития язвенной болезни двенадцатиперстной кишки (ЯБДПК) в возрасте до 45 лет у татар Республики Башкортостан, включающий выделение ДНК из лимфоцитов венозной крови, генотипирование гена интерлейкина методом полимеразной цепной реакции с последующим рестрикционным анализом, отличающийся тем, что проводят генотипирование полиморфного локуса rs1800872 гена IL10 и при выявлении генотипа АА прогнозируют низкий риск развития ЯБДПК у татар.