Преобразование карбоната металла в хлорид металла
Иллюстрации
Показать всеИзобретение относится к способу получения хлорида металла Mx+Clx-, в котором карбонат металла в виде твердого вещества превращают в реакции с хлорирующим агентом с образованием хлорида металла Mx+Clx-, причем металл М выбирают из группы щелочных металлов, щелочноземельных металлов, Al и Zn, при этом «х» соответствует валентности катиона металла, причем в качестве реагента дополнительно добавляют металл, который отличается от металла М карбоната металла или соответствует ему. Также изобретение относится к устройству для исполнения способа. Предложенный способ является более энергоэффективным. 2 н. и 17 з.п. ф-лы, 10 ил.
Реферат
Изобретение относится к способу получения хлорида металла Mx+Clx-, в котором карбонат металла в виде твердого вещества взаимодействует с хлорирующим реагентом с образованием хлорида металла Mx+Clx-, причем металл М выбирается из группы щелочных металлов, щелочноземельных металлов, Al и Zn, предпочтительно Li и Mg, в особенности предпочтительно Li, и «х» соответствует валентности катиона металла, причем в качестве реагента дополнительно добавляется металл М, а также к устройству для исполнения способа.
В патентных документах WO2012/038330 и WO2013/156476 описывается, как дымовые газы/отходящие газы могут быть обработаны электроположительными металлами литием или магнием, чтобы получить ценные вещества и высококачественную тепловую энергию, и тем самым снизить загрязнение атмосферы.
В патентном документе WO2012/038330 продемонстрировано, что СО2 с литием реагирует с образованием ценных веществ, таких как монооксид углерода или ацетилен, которые впоследствии могут быть преобразованы в метанол или прочие ценные вещества. Высвобождающаяся тепловая энергия может быть использована для того, чтобы стимулировать разделение метанола и СО2, или даже для производства пара.
При этом существенными являются следующие реакции и соображения:
2Li+CO2→Li2O+CO-314,9 кДж/моль (сравнение: C+О2→CО2-393,5 кДж/моль)
4Li+CО2→2Li2О+C-803,94 кДж/моль
C+CO2→2CO+172,5 кДж/моль; который может быть преобразован в метанол
2C+2Li→Li2C2; который может быть преобразован в ацетилен (соотношение CО2:Li)
Li2CO3+4C→Li2C2+3CO
Li2O+CO2→Li2CO3; Li2CO3→Li2O+CO2 при соответственных температурах около 1500°С
Энтальпии образования (298K): Li2O=-597,90 кДж/моль;
Li2CO3=-1215,87 кДж/моль.
2Li+2CO2→Li2CO3+CO-539 кДж
После гидролиза получается высокощелочная суспензия Li2CO3.
Li2C2+H2O→HC=CH+2LiOH
Li2O+CO2→Li2CO3
В патентном документе WO2013/156476 представлено, что обработки дымового газа/отходящего газа с использованием высокой растворимости солей на основе лития и серы и низкой растворимости карбоната лития могут предусматривать также обессеривание:
6Li+SО2→Li2S+2Li2О
8Li+SО3→Li2S+3Li2О
Li2О+SО2→Li2SО3-438,7 кДж/моль
Затем должна быть разделена образованная после сгорания СО2 и SO2 с принудительным окислением суспензия, которая содержит Li2CO3 и Li2SO4. К счастью, все сернолитиевые соли хорошо растворимы в воде (например, сульфат лития с 350 г/л при комнатной температуре (около 25°С)). В отличие от Na2S2O5, Li2S2O5 или Li2SO3 имеют высокую растворимость. Это значит, что все сернистые соединения остаются в растворе, тогда как Li2CO3 (растворимость 13 г/л) образуется в виде осадка и может быть получен для повторного использования в виде довольно чистого продукта (см. патентный документ WO2010/000681). Хорошая растворимость сульфата лития при этом отличает его от CaSO4 (2 г/л), который получается в процессе обессеривания согласно прототипу.
Все эти последовательности технологических стадий завершаются слегка влажным, довольно чистым карбонатом лития. Восстановление карбоната лития до металлического лития может быть достигнуто, например, преобразованием карбоната в хлорид, и последующим электролизом эвтектической смеси хлорида калия/лития.
1. Li2CО3+2HCl→2LiCl+H2О+CО2
(энтальпия реакции: -96 кДж/моль).
2. Li2CО3+Cl2→2LiCl+1/2О2+CО2
(энтальпия реакции: ~5 кДж/моль)
Обычно в способе приготовления хлорида лития для получения лития либо карбонат лития, либо гидроксид лития вводится в реакцию с хлороводородной кислотой (соляной кислотой) в водном растворе. После выпаривания и кристаллизации кристаллы выделяются и высушиваются, чтобы получить очень гигроскопичный безводный хлорид лития, как описано автором Jürgen Deberitz в работе «Lithium, Die Bibliothek der Wissenschaft» («Литий, библиотека науки»), том 2, стр. 37, 2006 (ISBN-13: 978-3-937889-36-8). Наибольшую трудность в таком процессе, какой описан в патенте США № 6048507, представляет высокое энергопотребление, теоретически 30×103 кДж/кг. До сих пор источнику энергии, который применяется для химического превращения, не уделялось никакого внимания.
Дополнительный способ, который описан в патентных документах CA 2340528 А1 и US 20130001097 A1, состоит в том, что карбонат лития вводится в реакцию с газообразным хлором, чтобы получить безводный хлорид лития. Приготовление безводного хлорида лития из порошкообразного карбоната лития в реакторе с псевдоожиженным слоем описано в патентном документе WO 2014/005878.
Кроме того, существует потребность в усовершенствованном способе получения хлорида металла из карбоната металла, в частности, из энергетических соображений.
Теперь же было обнаружено, что эффективное получение, в частности, также с энергетической точки зрения, хлорида металла из карбоната металла, то есть, например, прямое хлорирование карбоната лития с использованием хлорирующего реагента, возможно таким образом, что при получении дополнительно добавляется металл М, который поставляет энергию для процесса. К тому же добавлением металла М предотвращаются загрязнения и трудоемкие стадии дегидратации.
Кроме того, согласно изобретению была найдена эффективная последовательность химических реакций, чтобы получить хлорид металла и в конечном итоге металл М из карбоната лития.
Согласно одному аспекту, настоящее изобретение относится к способу получения хлорида металла Mx+Clx-, в котором карбонат металла в виде твердого вещества взаимодействует с хлорирующим реагентом с образованием хлорида металла Mx+Clx-, причем металл М выбирается из группы щелочных металлов, щелочноземельных металлов, Al и Zn, предпочтительно Li и Mg, в особенности предпочтительно Li, и «х» соответствует валентности катиона металла, причем в качестве реагента дополнительно добавляется металл М. Согласно определенным вариантам исполнения, металл М при этом также может представлять собой металл, который отличается от иона металла в карбонате металла. Так, например, при использовании карбоната лития в качестве карбоната металла могут прибавляться литий, натрий, калий, кальций и/или магний. Как правило, может добавляться такой металл, который позднее не является вредным для электролиза хлорида металла. Согласно определенным вариантам исполнения, такой металл, который отличается от металла в карбонате металла, может быть даже благоприятным, когда, например, может образовываться эвтектическая смесь для электролиза хлорида металла. Согласно определенным вариантам исполнения, металл М соответствует металлу в карбонате металла.
Согласно одному дополнительному аспекту, настоящее изобретение относится к устройству для проведения реакции карбоната металла в виде твердого вещества с хлорирующим реагентом с образованием хлорида металла Mx+Clx-, причем металл М выбирается из группы щелочных металлов, щелочноземельных металлов, Al и Zn, предпочтительно Li и Mg, в особенности предпочтительно Li, и «х» соответствует валентности катиона металла, причем в качестве реагента дополнительно добавляется металл М, включающему
первый реактор для взаимодействия карбоната металла и хлорирующего реагента;
первое загрузочное устройство для карбоната металла, которое конфигурировано для введения карбоната металла в виде твердого вещества в первый реактор;
второе загрузочное устройство для хлорирующего реагента, которое конфигурировано для подачи хлорирующего реагента в первый реактор;
первое разгрузочное устройство для хлорида металла, которое конфигурировано для выведения хлорида металла из первого реактора; и
второе разгрузочное устройство для газообразных продуктов взаимодействия карбоната металла и хлорирующего реагента, которое конфигурировано для выведения из первого реактора газообразных продуктов реакции карбоната металла с хлорирующим реагентом,
дополнительно включающему третье загрузочное устройство для металла М, которое конфигурировано для введения металла М в первый реактор.
О дополнительных аспектах настоящего изобретения можно заключить из зависимых пунктов формулы изобретения и подробного описания.
Описание чертежей
Сопроводительные чертежи призваны наглядно показать варианты осуществления настоящего изобретения и содействовать дополнительному пониманию их. В связи с описанием они служат для разъяснения концепций и принципов изобретения. Другие варианты исполнения и многие из указанных преимуществ выявляются с учетом чертежей. Элементы чертежей не обязательно представлены в масштабе относительно друг друга. Одинаковые, функционально сходные и одинаково действующие элементы, признаки и компоненты на фигурах чертежей в каждом случае снабжены теми же самыми обозначениями, если не оговорено иное.
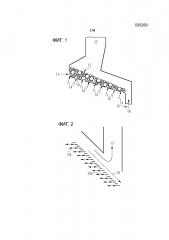
Фигура 1 схематически показывает реактор с колосниковой решеткой, который может быть использован в соответствующем изобретению способе и соответствующем изобретению устройстве.
Фигура 2 схематически показывает подробный вид реактора с колосниковой решеткой в одном примере исполнения, который может быть применен в соответствующем изобретению способе и соответствующем изобретению устройстве.
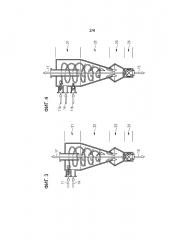
Фигура 3 схематически показывает циклонный реактор, который может быть использован в соответствующем изобретению способе и соответствующем изобретению устройстве.
Фигура 4 схематически показывает дополнительный циклонный реактор, который может быть применен в соответствующем изобретению способе и соответствующем изобретению устройстве.
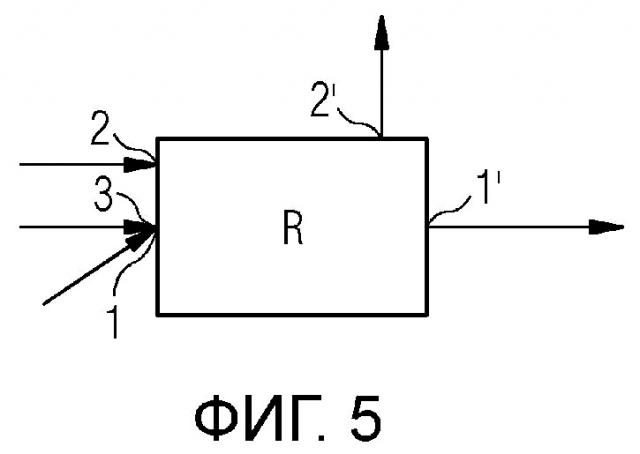
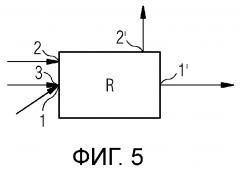
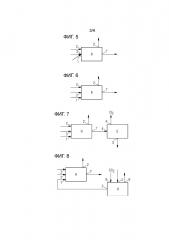
Фигура 5 схематически показывает один пример осуществления настоящего изобретения.
Фигура 6 схематически показывает один дополнительный пример осуществления настоящего изобретения.
Фигура 7 схематически показывает один пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство.
Фигура 8 схематически показывает один пример осуществления настоящего изобретения, который дополнительно включает второй реактор.
Фигура 9 схематически показывает один пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство и второй реактор.
Фигура 10 схематически показывает один дополнительный пример осуществления настоящего изобретения, который дополнительно включает электролизное устройство и второй реактор.
Подробное описание изобретения
В рамках изобретения указывается на то, что приведенные в порядке примера уравнения представляют суммарные уравнения, и протекающие химические процессы могут быть явно более сложными.
Настоящее изобретение в первом аспекте относится к способу получения хлорида металла Mx+Clx-, в котором карбонат металла в виде твердого вещества взаимодействует с хлорирующим реагентом с образованием хлорида металла Mx+Clx-, причем в качестве реагента дополнительно добавляется металл М, и «х» соответствует валентности катиона металла (например, 1 для Li, 2 для Mg, 3 для Al). В таком способе металл М выбирается из группы щелочных металлов, предпочтительно Li, Na, К, Rb, Cs, щелочноземельных металлов, предпочтительно Mg, Са, Sr, Ва, а также Al и Zn. Согласно определенным вариантам исполнения, металл М представляет собой Li или Mg, и предпочтительно Li. Возможны также смеси металлов, соответственно карбонатов металлов и хлоридов металлов. В результате добавления металла М согласно изобретению становится возможным стимулирование протекающих слабо эндотермически или слабо экзотермически реакций карбоната металла с хлорирующим реагентом с использованием экзотермической реакции металла М с хлорирующим реагентом, так что благодаря этому выделяемая в этой реакции тепловая энергия также содействует реакции карбоната металла с хлорирующим реагентом.
Согласно определенным вариантам исполнения, при этом в реакцию не подводится никакая дополнительная тепловая энергия, например, с использованием нагревательных устройств, и в определенных вариантах исполнения из способа даже может быть получена тепловая энергия, которая затем может быть использована, например, для производства пара для привода паровых генераторов, и/или для подогревания карбоната металла, и/или хлорирующего реагента, и/или металла М.
Согласно определенным вариантам исполнения, дополнительно добавляемый металл М также может представлять собой металл, который отличается от иона металла в карбонате металла. Так, например, при использовании карбоната лития в качестве карбоната металла могут добавляться литий, натрий, калий, кальций и/или магний. Как правило, может добавляться такой металл, который позднее не вредит электролизу хлорида металла. Согласно определенным вариантам исполнения, такой металл, который отличается от металла в карбонате металла, может быть даже благоприятным, когда, например, может образовываться эвтектическая смесь для электролиза хлорида металла. Согласно определенным вариантам исполнения, металл М соответствует металлу в карбонате металла.
Согласно определенным вариантам исполнения, металл М применяется в весовом соотношении «металл/карбонат металла» менее 5/10, предпочтительно менее 1/10, и в особенности предпочтительно менее 0,5/10, для получения тепловой энергии. Согласно определенным вариантам исполнения, весовое соотношение «металл/карбонат металла» регулируется таким образом, что реакция в соответствующем изобретению способе протекает как самоподдерживающаяся благодаря выделяемой тепловой энергии, однако без генерирования чрезмерной избыточной энергии, которая затем используется, например, путем охлаждения и производства пара для привода паровых генераторов, и/или для подогревания карбоната металла и/или хлорирующего реагента и/или металла М, так как при этом возникают неизбежные потери. Однако, когда имеется достаточное количество металла М, который, например, образуется электролизом хлорида металла с использованием избыточной энергии из возобновляемых источников энергии, может быть также добавлено большее количество металла М, например, в моменты времени, в которые не имеется избыточная энергия из возобновляемых источников энергии, так что тогда из выделившейся в соответствующем изобретению способе тепловой энергии может быть получен электрический ток. В таком случае металл М представляет собой своего рода аккумулятор энергии, который получен с использованием избыточной энергии из возобновляемых источников энергии, и затем возмещает энергию, когда это потребуется.
Согласно определенным вариантам исполнения, металл М в соответствующем изобретению способе может вводиться вместе с карбонатом металла. Этим путем может быть тем самым упрощен способ и вместе с этим также устройство для исполнения способа. При подаче металла М и карбоната металла через одно отверстие в первом реакторе также возможно, что выделение тепловой энергии из реакции М с хлорирующим реагентом происходит в месте, в котором она требуется для реакции карбоната металла с хлорирующим реагентом. Благодаря смешению металла М и карбоната металла это генерирование тепловой энергии при необходимости может быть надлежащим образом оптимизировано. Металл М может вводиться в разнообразных формах, например, в виде твердого вещества, например, в форме частиц, и/или как жидкость в форме расплава, причем в случае частиц или жидкости он также может быть распылен.
В соответствующем изобретению способе хлорирующий реагент не является конкретно ограниченным, пока обеспечивается образование хлорида металла, то есть, из хлорирующего реагента высвобождаются хлор и, соответственно, радикалы хлора, и он может быть подведен газообразным, жидким или, соответственно, в растворе в подходящем растворителе, или в виде твердого вещества, однако предпочтительно добавляется газообразным, жидким или в виде твердого вещества, особенно предпочтительно газообразным. Согласно определенным вариантам исполнения, в качестве хлорирующего реагента применяется хлор, оксалилхлорид, фосген, дифосген или трифосген, предпочтительно хлор или оксалилхлорид, особенно предпочтительно хлор. Согласно определенным вариантам исполнения, хлорирующий реагент не является фосгеном, дифосгеном и/или трифосгеном. Также могут применяться смеси хлорирующих реагентов. Также может добавляться, например, монооксид углерода в качестве реагента и, соответственно, катализатора.
Согласно определенным вариантам исполнения, преобразование/взаимодействие карбоната металла, металла М и хлорирующего реагента происходит в сухом состоянии, то есть, не используется никакой растворитель, и предпочтительно в первый реактор подаются и взаимодействуют только карбонат металла, металл М и хлорирующий реагент.
Кроме того, согласно определенным вариантам исполнения в циркуляцию не вводятся никакие дополнительные вещества, которые затем должны быть опять отделены.
При взаимодействии карбоната металла и металла М с хлорирующим реагентом могут образовываться газообразные продукты, например, такие как СО2, О2, СО и т.д. Они могут быть выпущены в атмосферу, например, через разгрузочное устройство, и/или запасены как ценные продукты, и/или направлены на дополнительное реагирование. Так, например, СО может быть введен в реакции с водородом с образованием алканов, алкенов, спиртов и т.д.
В определенных вариантах исполнения хлорид металла по завершении взаимодействия карбоната металла и металла М с хлорирующим реагентом преобразуется опять в металл М, предпочтительно электролизом. Кроме электролиза, преобразование может быть выполнено также другим подходящим путем.
Здесь предпочтительный электролиз не является особенно ограниченным, и может, например, включать электролиз жидкого расплава соединения формулы Mx+Clx-, или же электролиз водного раствора соединения формулы Mx+Clx-.
При применении электролиза жидкого расплава хлорида металла формулы Mx+Clx- получается то преимущество, что достигается более высокая эффективность, и к тому же не образуется водород в качестве побочного продукта, который по обстоятельствам является нежелательным.
С другой стороны, когда электролиз выполняется как электролиз водного раствора соединения формулы Mx+Clx- с образованием водорода, этот водород используется, например, как ценный продукт, или, согласно определенным вариантам исполнения, при взаимодействии с образующимся при реакции карбоната металла, металла М и хлорирующего реагента монооксидом углерода преобразуется в дополнительные химические продукты, такие как алканы, алкены, спирты и т.д.
Для достижения эффективного электролиза, например, при более низких температурах, для электролиза жидкого расплава может быть сформирована, например, эвтектическая смесь солей с соединением Mx+Clx- добавлением подходящих добавок, которая затем подвергается электролизу. Однако при этом может быть неблагоприятным то, что металл М получается в виде смеси с другими металлами, и тем самым при необходимости должен быть отделен от них. При применении, например, Li в качестве металла М он при электролизе LiCl может быть отделен, например, позднее, чем труднорастворимый карбонат лития, так что совсем не обязательно, что такой недостаток возникает.
В определенных вариантах исполнения при соответствующем изобретению взаимодействии карбоната металла и металла М с хлорирующим реагентом может быть получена дополнительная тепловая энергия, которая при необходимости может быть использована для производства электрической энергии, и/или для подогревания металла М и/или карбоната металла и/или хлорирующего реагента. Также может быть использована электрическая энергия для электролиза хлорида металла, как было представлено выше. Согласно предпочтительным вариантам исполнения, энергия для электролитического преобразования Mx+Clx- в М и Cl2 по существу получается из избыточной энергии, предпочтительно от возобновляемых источников энергии, или от обычных источников энергии, то есть, например, более чем на 30%, предпочтительно более чем на 70%, более предпочтительно более чем на 80%, и наиболее предпочтительно более чем на 90%, в расчете на общее энергопотребление в электролизе. Например, избыточная энергия от возобновляемых источников энергии для этого имеется в распоряжении тогда, когда от возобновляемых и/или традиционных источников энергии поставляется большее количество тока, чем расходуется потребителями. В частности, в связи с этим подразумевается энергия, которая может быть произведена такими источниками энергии, как солнечные батареи, ветровые установки, гидроэлектростанции, геотермические установки, биотопливные энергоустановки (на биомассе) или подобные, и которая не может отбираться потребителями локально, регионально и/или надрегионально к моменту времени производства. При этом не исключается, что энергия также поступает из прочих источников, например из традиционных источников электроэнергии и/или из вышеуказанной полученной энергии при взаимодействии карбоната металла и по обстоятельствам металла М с хлорирующим реагентом. Согласно особенно предпочтительным вариантам исполнения, энергия, которая используется для электролиза соединения формулы Mx+Clx-, на 100% поступает от возобновляемых источников энергии, причем для эксплуатации электролизного устройства также энергия, которая не связана непосредственно с электролизом соединения формулы Mx+Clx-, как, например, для целей освещения или для работы насосов и т.д., также может происходить из прочих источников энергии, но также из возобновляемых источников энергии.
Согласно определенным вариантам исполнения, полученный металл М, по меньшей мере частично, например более чем на 20 вес.%, более чем на 50 вес.%, более чем на 80 вес.%, более чем на 90 вес.% или более чем на 95 вес.%, преобразуется в реакции с диоксидом углерода в карбонат металла, так что возникает циркуляция металла. Возможно также полное преобразование (100 вес.%) полученного металла М с диоксидом углерода в карбонат металла. Например, это может зависеть от спроса на металл М на рынке, или, соответственно, от доступности энергии, например, избыточной энергии из возобновляемых источников энергии. В альтернативном варианте, металл М также после первого иного взаимодействия преобразуется с диоксидом углерода в карбонат металла, например, для чего сначала получается нитрид металла, который затем после гидролиза реагирует с диоксидом углерода с образованием карбоната металла. Также могут происходить как непосредственное преобразование металла М с диоксидом углерода, так и первое иное превращение металла М, например, с азотом и дальнейшая реакция с диоксидом углерода, причем здесь также могут быть преобразованы более 20 вес.%, более 50 вес.%, свыше 80 вес.%, более 90 вес.% или более 95 вес.% металла М. Здесь также возможно полное преобразование (100 вес.%) полученного металла М в карбонат металла.
В таком процессе циркуляции металла отдельные стадии, то есть, взаимодействие карбоната металла и металла М с хлорирующим реагентом, преобразование хлорида металла в металл М и хлор, а также взаимодействие металла М с диоксидом углерода, также могут выполняться в различные моменты времени, например, в различные дни, месяцы или сезоны года, например, в зависимости от доступности избыточной энергии из возобновляемых источников энергии, как и в различных местах, причем отдельные полученные соединения, хлорид металла, металл М, хлор и карбонат металла затем подходящим путем, например, по железной дороге, грузовым автомобильным транспортом, на судах, ленточным транспортером, по трубам и т.д., транспортируются в отдельные места, и там или на месте производства, по обстоятельствам также могут складироваться. Также из полученного хлора могут быть опять приготовлены хлорирующие реагенты, или же хлор используется в качестве хлорирующего реагента и тем самым запасается или транспортируется.
Способ, а также устройство для получения карбоната металла из металла М и диоксида углерода не являются конкретно ограниченными, и, например, могут включать сжигание металла М, по обстоятельствам с расплавлением и/или предварительным нагреванием металла М, в содержащей диоксид углерода атмосфере, при необходимости с зажиганием металла М, причем здесь также для отдельных процессов, для которых требуется энергия, может быть использована, например, избыточная энергия из возобновляемых источников энергии, но также по обстоятельствам энергия от экзотермического сгорания металла М в диоксиде углерода. При взаимодействии металла М и диоксида углерода и, соответственно, содержащей диоксид углерода атмосферы, которая также может включать, например, воздух, азот и т.д., также могут образовываться различные, по обстоятельствам газообразные ценные продукты, такие как ацетилен, СО, водород, кислород, аммиак и т.д., которые претерпевают дальнейшие превращения или как таковые могут быть запасены и/или использованы. При этом также может быть возможным, что карбонат металл образуется в смеси с другими твердыми веществами, от которых он при необходимости может быть отделен.
Согласно определенным вариантам исполнения, взаимодействие карбоната металла и металла М с хлорирующим реагентом происходит в реакторе с колосниковой решеткой, или механически движимом реакторе со стационарным слоем, или в циклонном реакторе.
При этом реактор с колосниковой решеткой, механически движимый реактор со стационарным слоем и циклонный реактор согласно изобретению не являются конкретно ограниченными.
Согласно определенным вариантам исполнения, взаимодействие проводится в реакторе с колосниковой решеткой, при котором хлорирующий реагент подается в виде газа в прямоточном режиме с карбонатом металла и/или предварительно подогреваемым хлорирующим реагентом.
Примерный реактор с колосниковой решеткой представлен на фигуре 1. Через загрузочное устройство 11 для карбоната металла и металла М в реактор с колосниковой решеткой подается карбонат металла и металл М таким образом, что на колосниковой решетке 13 формируется слой 12 карбоната металла/металла, причем подача карбоната металла и металла М может производиться через раздельные отверстия и, соответственно, загрузочные устройства. Сквозь колосниковую решетку 13 производится подача 14 хлорирующего реагента. Как представлено на фигуре 1, подача 14 хлорирующего реагента проводится через всю колосниковую решетку 13, однако не исключается, что подача 14 хлорирующего реагента выполняется также только на отдельных участках колосниковой решетки 13, например вблизи загрузочного устройства 11 для карбоната металла и/или металла М, и/или что подача 14 хлорирующего реагента производится с различными количествами веществ, соответственно массами или объемами, на различных местах колосниковой решетки 13. Согласно определенным вариантам исполнения, подаваемый хлорирующий реагент перед подачей 14 может подогреваться, например, с помощью нагревательного устройства, и/или нагретым отходящим газом, и/или нагретым твердым веществом, и/или нагретой жидкостью в соответствующем изобретению процессе. На конце прореагировавшее и/или, по обстоятельствам, непрореагировавшее твердое вещество выводится через разгрузочное устройство 15 для включающего хлорид металла твердого вещества, например, через вертикальную шахту 16. Газообразные продукты взаимодействия карбоната металла и хлорирующего реагента могут выводиться через разгрузочное устройство 17 для газообразных продуктов взаимодействия карбоната металла и хлорирующего реагента.
Колосниковые решетки предназначены для того, чтобы обеспечивать преобразование твердых веществ при длительных временах удерживания, и одним примером этого являются топки с колосниковой решеткой, как они в качестве примера показаны в работе авторов Loo, Sjaak van; Koppejan, Jaap: «Handbook of Biomass Combustion» («Руководство по сжиганию биомассы»). Лондон: издательство Earthscan, стр. 134-144, 2008 год. Принцип работы топки с колосниковой решеткой является общеизвестным и хорошо разработан. Как также показано в порядке примера на фигуре 1, участвующее в реакции твердое вещество может вводиться на верхнем конце колосниковой решетки 13.
Поскольку твердое вещество должно перемещаться из реакционной камеры поверх колосниковой решетки 13, чтобы обеспечивать непрерывную работу реактора, колосниковая решетка согласно определенным вариантам исполнения состоит из подвижных частей, которые делают возможным транспорт твердого вещества. На фигуре 2 схематически показан принцип действия примерной механической цепной колосниковой решетки. В этом случае колосниковая решетка 13 выполнена из отдельных стержней 13а, 13b, из которых, например, каждый второй стержень является горизонтально подвижным, тогда как другие стержни 13b зафиксированы. Благодаря этому могут эффективно обеспечиваться как транспорт, так и шуровка твердого вещества. При этом все подвижные стержни могут иметь, например, общий привод, и тем самым двигаться в одной фазе.
Другой вариант состоит в том, что стержни подразделены на группы или даже управляются по отдельности, в результате чего процесс взаимодействия может контролироваться очень точно, и обеспечивается полное преобразование, как представлено в патентном документе DE 10137520 АI. Контролируемый режим движения стержней колосниковой решетки может обеспечивать возможность регулирования и выравнивания толщины слоя расположенного на колосниковой решетке горючего материала/твердого вещества, такого как поток 18 твердого вещества. В связи с примерным технологическим режимом, предусматривающим подачу хлорирующего реагента с нижней стороны колосниковой решетки (нижнее дутье), тем самым достигается однородное протекание слоя твердого вещества, причем, однако, технологический газ может подаваться и по-иному. Представленный вариант с пропусканием потока с нижней стороны, кроме равномерного преобразования твердого вещества, может вести к минимизации выноса пыли. Чтобы обеспечить как однородное полное преобразование, так и незначительный вынос пыли, согласно определенным вариантам исполнения можно контролировать толщину слоя, например, с использованием соответствующих датчиков и/или камер и/или может выполняться регулируемая подача хлорирующего реагента через всю область слоя.
Кроме того, на фигуре 2 представлено выведение примерного преобразованного технологического газа через разгрузочное устройство 17 в прямоточном режиме, которое, например, может выполняться, причем, однако, могут быть предусмотрены также многочисленные разгрузочные устройства 17 или же выведение преобразованного технологического газа может проводиться по-иному. Согласно определенным вариантам исполнения, выведение избыточного, по обстоятельствам частично непрореагировавшего технологического газа производится, например, на конце выгрузки твердого вещества из реакторной камеры.
Далее представлен примерный процесс взаимодействия карбоната лития и лития в качестве карбоната металла и металла М с хлором как хлорирующим реагентом в реакторе с колосниковой решеткой. Эта реакция является эндотермической в очень незначительной степени. При этом для подведения необходимой для реакции энергии используется сам литий, или, альтернативно, также для общего процесса, в частности электролиза хлорида металла, совместимый другой металл М, чтобы избежать загрязнения и трудоемких стадий дегидратации. Энтальпия образования LiCl, соответственно образования соответствующего хлорида металла, настолько высока (-409 кДж/моль для LiCl), что только 1-2 процента, например, электролитически полученного лития должны быть привлечены к дополнительной переработке, чтобы обеспечить эту важную стадию.
2Li+Cl2→2LiCl (ΔHr==-409 кДж/моль)
Литий может вводиться в реактор, например, в жидкостной, распыленной форме (например, из твердого лития, который нагревается до температуры >180°С и распыляется), или примешивается в форме частиц твердого лития.
Поскольку реакция карбоната лития и хлора является слегка эндотермической, и из соображений эффективности должно быть необходимым подведение только небольшого количества энергоносителей, реакция предпочтительно проводится по возможности при низкой температуре. Согласно определенным вариантам исполнения, при этом требуется более длительное время пребывания для более полного преобразования Li2CO3 в LiCl. Существуют различные реакционные принципы, которые обеспечивают возможность более длительного времени пребывания твердого вещества в реакционной зоне. Обсуждаемые вещества делают возможным применение установки с колосниковой решеткой.
При вышеуказанном процессе, в котором только с добавлением чистого лития в качестве энергоносителя имеет место слабо экзотермический тепловой эффект, тепловой поток следует за Li2СО3. При добавлении чистого лития на начало колосниковой решетки вследствие перепада концентраций в этой области происходит усиленное выделение тепла. В результате работы в прямоточном режиме неиспользованное в этой области тепло может переноситься в дальнейшие расположенные ниже по потоку участки колосниковой решетки. Кроме того, с развитием преобразования на колосниковой решетке следует ожидать снижения скорости реакции вследствие уменьшения концентрации Li2СО3 и расходования чистого лития. Это может сделать целесообразным предварительное подогревание технологического газа, что совместно с подачей технологического газа в прямоточном режиме ведет к нагреванию слоя твердого вещества. Благодаря обеим мерам, предварительному подогреванию технологического газа и подаче технологического газа в прямоточном режиме, можно противодействовать снижению скорости реакции и обеспечивать возможность полного преобразования.
Согласно дополнительным определенным вариантам исполнения, взаимодействие проводится в циклонном реакторе, который подогревается и/или в который металл М вводится в различных положениях в реакционной зоне.
Примерные циклонные реакторы представлены на фигурах 3 и 4, причем циклонные реакторы на фигурах 3 и 4 по большей части имеют одинаковую конструкцию, кроме того, что представленный на фигуре 3 циклонный реактор включает одно загрузочное устройство 11 для карбоната металла и металла М, тогда как показанный на фигуре 4 циклонный реактор имеет отдельное загрузочное устройство IIa для карбоната металла и отдельное загрузочное устройство IIb для металла М. Кроме того, оба представленных циклонных реактора имеют впускной канал 14 для хлорирующего реагента, разгрузочное устройство 15 для твердого вещества, включающего хлорид металла, и разгрузочное устройство 17 для газообразных продуктов взаимодействия карбоната металла и хлорирующего реагента, причем они включают в качестве компонентов, например, реакционную зону 21, например, в форме осесимметричной верхней части, сепарационную зону 22, которая, например, выполнена конической, как показано на фигуре, расширительную камеру 23, и шлюзовой затвор 24 барабанного типа в качестве примера разгрузочного устройства для твердого вещества, например, такого, какие имеются в циклонном сепараторе. Но соответствующий изобретению циклонный реактор может быть сформирован иным образом. Кроме того, могут быть также предусмотрены многие разгрузочные устройства 17 или же выведение прореагировавшего технологического газа может выполняться по-иному. Также выгружаемое твердое вещество, наряду с хлоридом металла, может включать другие вещества, такие как непрореагировавшие реагенты или прочие.
Например, для взаимодействия Li2СО3 и газообразного хлора до LiCl может быть использован циклонный реактор, например, в форме циклонного сепар