Рекомбинантное антитело, специфичное к фактору некроза опухоли и маркеру иммунных клеток миелоидного ряда
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Предложено рекомбинантное антитело, состоящее из двух однодоменных антител VHH, специфичных к ФНО, содержащее домен специфичности к ФНО и к гликопротеину CD11b, содержащее домен специфичности к маркеру иммунных клеток миелоидного ряда CD11b, соединенных между собой белковым линкером. Техническим результатом предлагаемого изобретения является уменьшение размера антитела в 2 раза и способность блокировать ФНО на клетках миелоидного ряда человека, включая моноциты и гранулоциты, и экспрессироваться в бактериальной системе в растворимом виде. 5 ил.
Реферат
Изобретение относится к области иммунологии, а именно к выделенным биспецифическим аффинным реагентам, таким как антитела или фрагменты антител, которые связываются с фактором некроза опухоли (ФНО) и маркером молекул макрофагов и/или нейтрофилов, и может быть использовано для лечения аутоиммунных заболеваний, например, таких, как ревматоидный артрит, болезнь Бехтерева, болезнь Крона, неспецифический язвенный колит, псориаз и др.
Открытие важной роли ФНО в патогенезе аутоиммунных заболеваний привело к разработке новых лекарственных средств, представляющих собой моноклональные антитела, блокирующие физиологическую активность этого цитокина.
Блокировка ФНО моноклональными терапевтическими антителами при таких аутоиммунных заболеваниях, как ревматоидный артрит, болезнь Бехтерева, болезнь Крона, псориаз и др., приводит к прерыванию порочного круга активации иммунной системы, эффективному контролю симптомов патологического воспалительного процесса, замедлению разрушения суставов и вызывает у пациентов стойкую ремиссию даже после отмены приема анти-ФНО препаратов.
Хотя данные ингибиторы ФНО доказали свою эффективность в лечении аутоиммунных заболеваний, применение данных средств требует тщательной оценки соотношения польза/риск для конкретного больного. Это определяется частотой негативных последствий, таких как развитие множественного склероза, тромбоэмболии, инфекции верхних дыхательных путей, развитие латентных оппортунистических инфекций, в том числе туберкулеза, и т.д.
Поэтому перед исследователями по-прежнему стоит задача поиска новых более эффективных технических решений для решения проблемы побочных эффектов ингибиторов и обеспечения минимального влияния на физиологические механизмы функционирования иммунной системы.
Одним из перспективных подходов в анти-ФНО терапии, потенциально позволяющим избежать большинства побочных эффектов, является применение антител, избирательно удерживающих этот цитокин на поверхности ФНО-продуцирующих клетки миелоидного ряда, не препятствуя при этом его высвобождению из других клеточных источников.
Известны технические решения по созданию антител, включающие использование неприродных биоинженерных белков на основе антител верблюдовых, в частности их единственного антиген-распознающего домена VHH, малый размер которых обеспечивает лучшее проникновение в ткани и позволяет узнавать необычные, «скрытые», для классических антител конформационные эпитопы.
Примеры антител-специфичных к ФНО на основе VHH, отражены в следующих патентах: RU 2530553 С2, RU 2455312 С2.
Однако данные антитела блокируют системный ФНО и по характеру действия сходны с препаратами, представляющими собой классические моноклональные антитела.
Наиболее близким к заявляемому является техническое решение, выбранное авторами предлагаемого изобретения в качестве прототипа и описанное в заявке на выдачу патента (US 20150284460 А1, дата публикации 8.10.15 г.).
Изобретение-прототип относится к рекомбинантным биспецифическим аффинным реагентам, таким как антитела или фрагменты антител, которые связываются с ФНО и маркером молекул макрофагов и/или нейтрофилов.
Использование биспецифических аффинных реагентов согласно изобретению позволяют нейтрализовать патогенную субпопуляцию ФНО, в то время как субпопуляция ФНО, выполняющая защитную функцию, не затрагивается.
В заявке на патент, поставленной задачей является получение рекомбинантных биспецифических антител против ФНО и маркера иммунных клеток миелоидного ряда F4/80.
При этом домен против ФНО представляет собой биоинженерный белок на основе антиген-распознающего домена верблюдовых VHH, а домен против F4/80 представляет собой одноцепочечный вариабельный фрагмент (scFv) классического антитела.
Основным недостатком прототипа является то, что маркер F4/80 характерен для клеток миелоидного ряда мышей, а у человека он экспрессируется лишь на эозинофилах, что ограничивает применение данного биспецифического антитела в лечении заболеваний человека.
Кроме этого, из-за своего относительно большого размера (~48 кДа) данный белок экспрессируется в бактериальных системах в малых количествах и преимущественно в нерастворимом виде.
Задачей, на решение которой направленно предлагаемое изобретение, является создание антител против ФНО и маркера иммунных клеток миелоидного ряда, способных нейтрализовать патогенную субпопуляцию ФНО при одновременном сохранении защитной популяции в организме человека.
Поставленная задача решается тем, что рекомбинантное биспецифическое антитело против ФНО и маркера иммунных клеток миелоидного ряда, содержащее биоинженерные белки на основе антиген-распознающего домена верблюдовых VHH, состоит из двух однодоменных антител, специфичных к ФНО и к гликопротеину CD11b, соединенных между собой белковым линкером. При этом домен специфичный к ФНО имеет аминокислотную последовательность (SEQ ID NO. 1); домен, специфичный к маркеру иммунных клеток миелоидного ряда CD11b, имеет аминокислотную последовательность (SEQ ID NO. 2); линкер имеет аминокислотную последовательность (SEQ ID NO.3).
Сущность изобретения состоит в том, что создано биспецифическое антитело, состоящее из двух однодоменных антител разной специфичности. Одно из этих антител способно специфично связываться с ФНО человека, блокируя его физиологическую активность (SEQ ID NO: 1), второе специфично связывается с гликопротеином CD11b, экспрессирующимся на поверхности миелоидных клеток (SEQ ID NO: 2). Антитела соединены между собой «жестким» линкером (SEQ ID NO. 3).
Для этого однодоменное антитело VHH, специфично связывающееся с ФНО человека, имеет следующую аминокислотную последовательность:
Второе антитело, специфично связывающееся с гликопротеином CD11b, экспрессирующемся на поверхности миелоидных клеток, имеет следующую аминокислотную последовательность:
Линкер, связывающий антитела, имеет следующую аминокислотную последовательность:
Перечень последовательностей представлен в таблице на Фиг. 1.
Техническим результатом изобретения является уменьшение размера антитела в 2 раза и способность блокировать ФНО на клетках миелоидного ряда человека, включая моноциты и гранулоциты, и экспрессироваться в бактериальной системе в растворимом виде.
Новизна заявляемого изобретения подтверждается тем, что по доступной научной и практической информации для решения поставленной задачи предлагаемое техническое решение не использовалось, а так как предлагаемое решение обеспечивает наличие свойств, не совпадающих со свойствами известных решений, то оно обладает изобретательским уровнем.
Существенность отличительных признаков изобретения состоит в том, что достигается новый положительный эффект, а именно новые антитела имеют специфичность к маркеру человеческих клеток миелоидного ряда и характеризуются меньшим размером (~25 кДа).
Созданное биспецифическое антитело способно распознавать ФНО на поверхности продуцирующих его человеческих клеток миелоидного ряда, удерживать его, блокируя его физиологическую активность, в то же время не препятствуя высвобождению ФНО, продуцируемого другими клеточными источниками, и, предположительно, играющих защитную роль.
Кроме этого, данное биспецифическое антитело успешно продуцируется в бактериальной системе экспрессии в растворимом виде.
Научно-технический уровень изобретения обусловлен научно-исследовательскими опытными и экспериментальными работами по объединению двух однодоменных антител разной специфичности в одно, что потребовало:
- проведения субклонирования;
- проведения генно-инженерных манипуляций с кодирующими последовательностями однодоменных антител с целью их эффективной наработки в бактериальной системе экспрессии и последующей эффективной очистки (в качестве продуцента действующего вещества использовали бактериальные культуры E.coli);
- выбора оптимального белкового линкера, связывающего две последовательности однодоменных антител;
- разработки протокола получения биспецифического белка;
- оценки функциональной характеристики полученного белка, включающей в себя оценку связывания биспецифического антитела с CD11b и ФНО и оценку его блокирующих свойств.
В результате было получено рекомбинантное биспецифическое антитело, решающее поставленную задачу.
Осуществление настоящего изобретения
Стадия 1. Получение генетического конструкта биспецифического антитела, специфично связывающего CD11b и человеческий ФНО.
Методом полимеразной цепной реакции получены кДНК, кодирующие человеческий антиФНО и антиCD11b. В качестве матрицы используют синтетические последовательности, кодирующие искомые белки (SEQ ID NO. 1 и SEQ ID NO. 2 соответственно).
кДНК, кодирующую анти-CD1lb, обрабатывают эндонуклеазами рестрикции NcoI и NotI.
кДНК, кодирующую антитело против ФНО, обрабатывают эндонуклеазами рестрикции NotI и XhoI.
Для клонирования используют вектор pET28b, обработанный рестриктазами NcoI и XhoI.
Т.о. получают конечную генетическую конструкцию следующей структуры: анти-CD1lb-линкер-анти-ФНО-гексагистидиновый модуль. Транскрипция мРНК, кодирующей «химерный» белок, находится под контролем Lac-оператора E.coli, промотора и терминатора бактериофага Т7.
Стадия 2. Продукция биспецифических антител
Продукцию однодоменных антител проводят в Е. coli (штамм Rosetta 2 (DE3) pLysS). Экспрессию белка индуцируют добавлением 0,5 мМ индолил-бета-D-галактопиранозида и клетки инкубируют при интенсивном перемешивании в течение 6 часов при 25°C. Биспецифическое антитело выделяют из лизата бактериальных клеток с использованием металлхелатной хроматографии с помощью колонок Poly-Prep gravity-flow column (BioRad, Франция), содержащих смолу на сефарозной матрице, заряженную Со2+ (Invitrogen, кат. № R 90115).
Макрофаги, выделенные из бедренной кости гуманизированных по гену ФНО мышей линии 750huTNFKI, культивируют в течение 10 дней при температуре 37°C в СО2-инкубаторе на кондиционной среде клеток линии L929 (АТСС® CCL-1™). Затем в концентрации 100000 кл/мл клетки переносят в 96-луночные микропланшеты (Eppendorf, 30730127) и культивируют в течение суток. Затем в культуру макрофагов добавляют полученные биспецифические антитела в диапазоне концентраций от 2 пг/мл до 20 мг/мл, культивируют в течение 30 мин при температуре 37°C в присутствии 5% СО2. После этого культуру макрофагов отмывают от среды, содержащей биспецифические антитела, и добавляют к ней липополисахарид в концентрации 100 нг/мл. Затем культуру макрофагов культивируют в течение 4 часов при температуре 37°C в присутствии 5% СО2 и собирают надосадочную жидкость.
Полученную в результате описанной процедуры надосадочную жидкость используют для оценки эффективности связывания ФНО на поверхности макрофагов биспецифическими антителами с помощью метода иммуноферментного анализа. Иммуноферментный анализ проводят с помощью набора реагентов Human TNF alpha ELISA (Affymetrix, кат. №88-7346-88).
Эффективность нового рекомбинантного антитела подтверждена приводимыми ниже данными.
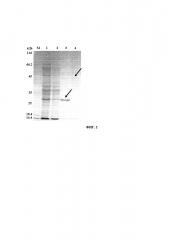
На Фиг. 2 представлена электрофореграмма полиакриламидного геля с образцами. полученными в ходе очистки биспецифических антител (БАТ), по сравнению с прототипом, где М - маркер молекулярных масс; 1 - лизат клеточной биомассы; 2 - несвязавшаяся с колонкой фракция белков; 3 - очищенный биспецифический белок (растворимая фракция); 4 - очищенный прототип (растворимая фракция).
Чистота полученных биспецифических антител составила более 95%.
На Фиг. 3 представлены результаты иммуноферментного анализа, из которых следует, что созданное биспецифическое антитело эффективно связывается с макрофагами и блокирует высвобождение макрофагального ФНО.
Величина столбцов на чертеже соответствует количеству ФНО в образцах, рассчитанных согласно калибровочной кривой. ЛПС - высвобождение ФНО из макрофагов после стимуляции их липополисахаридом. ЛПС+БАТ - высвобождение ФНО из макрофагов после их стимуляции ЛПС и блокировки биспецифическим антителом. ЛПС+КАТ - высвобождение ФНО из макрофагов после их стимуляции ЛПС и блокировки контрольным антителом. В качестве контрольного антитела использовалось биспецифическое антитело, один домен которого связывается с белком, экспрессирующимся на поверхности макрофагов F4/80, а второй домен связывается с ФНО, не блокируя его физиологических функций.
На Фиг. 4 представлены результаты оценки способности и эффективности блокировки человеческого ФНО in vitro на клетках линии WEHI 164, из которых следует, что разработанное биспецифическое антитело (5) способно блокировать биологическую активность человеческого ФНО более эффективно по сравнению с прототипом (6). В качестве контроля (7) были использованы контрольные антитела (КАТ).
Для оценки способности биспецифического антитела блокировать человеческий ФНО использовали колориметрический МТТ-тест на вторичной культуре эукариотических клеток мышиной фибросаркомы WEHI 164 (АТСС® CRL-1751™), чувствительной к ФНО человека, а также рекомбинантный ФНО человека, предоставленный лабораторией молекулярных механизмов иммунитета ИМБ им. Энгельгардта РАН (Москва).
Клетки WEHI 164 культивировали в концентрации 100000 кл/мл на 96-луночных микропланшетах (Eppendorf, 30730127), затем добавляли биспецифическое антитело в диапазоне концентраций от 10 пМ до 100 мМ с рекомбинантным человеческим ФНО в летальной концентрации, инкубировали в течение 24 ч при температуре 37°C в присутствии 5% CO2. Количество погибших клеток оценивали колориметрически с помощью планшетного фотометра Multiskan FC (Thermo Fisher Scientific, США) на длине волны 570 нм.
На Фиг. 5 представлена диаграмма выживаемости экспериментальных животных в модели острой гепатотоксичности, индуцированной введением летальной дозы ЛПС (400 нг/г веса животного) и Д-галактозамина (800 мкг/г веса животного), где 8 - выживаемость мышей при введении физ. раствора; 9 - выживаемость мышей при введении 1,5 мкг/г веса БАТ; 10 - выживаемость мышей при введении 7,5 мкг/г веса БАТ; 11 - выживаемость мышей при введении 15 мкг/г веса БАТ. Из этих данных следует, что введение биспецифического антитела в дозе 15 мкг/г веса мыши обеспечивает 100% выживаемость животных.
Эти данные свидетельствуют об эффективной блокировке ФНО биспецифическими антителами в концентрации 15 мкг/г веса.
Рекомбинантное антитело, специфичное к фактору некроза опухоли и маркеру иммунных клеток миелоидного ряда, содержащее биоинженерный белок на основе антиген-распознающего домена верблюдовых VHH, отличающееся тем, что рекомбинантное антитело состоит из двух однодоменных антител VHH, специфичных к ФНО, содержит домен специфичности к ФНО с аминокислотной последовательностью SEQ ID NO:1 и к гликопротеину CD11b, содержит домен специфичности к маркеру иммунных клеток миелоидного ряда CD11b с аминокислотной последовательностью SEQ ID NO: 2, соединенных между собой белковым линкером с аминокислотной последовательностью SEQ ID NO: 3.