Способ модификации дрожжей schizosaccharomyces pombe с помощью cre-lox системы бактериофага р1, трансформант, полученный таким способом, и способ микробиологического синтеза молочной кислоты
Иллюстрации
Показать всеИзобретение относится к микробиологии и биотехнологии. Предложен способ модификации дрожжей S. pombe, включающий трансформацию в клетку гена, кодирующего Cre-рекомбиназу, под контролем индуцибельного промотора совместно с маркерным геном, интеграцию экспрессионной кассеты, содержащей фрагмент ДНК и маркерный ген, фланкированный loxP сайтами, выщепление маркерного гена по loxP-сайтам за счет индукции синтеза Cre-рекомбиназы. При трансформации ген, кодирующий Cre-рекомбиназу, совместно с маркерным геном интегрируют в состав хромосомы, при этом маркерный ген фланкирован lохР сайтами, а после трансформации до интеграции кассеты дополнительно осуществляют выщепление маркерного гена по loxP-сайтам. Предложен также трансформант для получения молочной кислоты, полученный указанным способом и в котором инактивирован или делетирован один или несколько генов алкогольдегидрогеназ, а в хромосому интегрированы один или несколько генов лактатдегидрогеназ рода Lactobacillus. С использованием указанного трансформанта осуществляют способ микробиологического синтеза молочной кислоты. Предложены также штамм Schizosaccharomyces pombe ВКПМ Y-4248, штамм Schizosaccharomyces pombe ВКПМ Y-4249, штамм Schizosaccharomyces pombe ВКПМ Y-4250, являющиеся вариантами указанного трансформанта и продуцентами молочной кислоты. 6 н. и 7 з.п. ф-лы, 5 ил., 4 пр.
Реферат
Изобретение относится к области биотехнологии и генетической инженерии, а именно к способам конструирования штаммов Schizosaccharomyces pombe.
Разработка способов генной и метаболической инженерии для новых объектов биотехнологии - штаммов промышленно-значимых микроорганизмов представляется актуальной задачей. Дрожжи S. pombe являются перспективным микроорганизмом для конструирования на их основе штаммов-продуцентов белков, органических кислот, в частности янтарной и молочной, и других соединений [US 2015232895, US 20120214214, RU 2268304, RU 2539092].
Известен способ модификации штаммов путем последовательного многократного введения фрагментов ДНК в хромосому клеток с использованием Cre-loxP системы. Система состоит из фермента Cre-рекомбиназы, которая рекомбинирует пару коротких выбранных последовательностей, называемых loxP-последовательностями. Cre-lox система известна как сайт-специфическая рекомбинантная технология, которая позволяет многократно вводить фрагменты ДНК в хромосому микроорганизмов, используя два маркерных гена, и широко применяется для внесения делеций, вставок, транслокаций и инверсий в специфические сайты клеточной ДНК [Journal of Biotechnology 131 (2007) 20-26; Nucleic Acids Research, 2002, V. 30, No. 6, p 2-8].
Ближайшим аналогом заявляемого способа является способ, описанный в [Biosci. Biotechnol. Biochem., 68 (3), 545-550, 2004] и предусматривающий использование Cre-lox системы бактериофага Р1 для введения множественных делеций в штамм S. pombe.
Описанный способ включает следующие стадии:
- трансформация клеток S. pombe репликативной плазмидой, содержащей ген Cre-рекомбиназы под индуцибельным ослабленным промотором nmt 41 совместно с маркерным геном;
- совместная интеграция фрагмента ДНК, гомологичного к выбранному участку хромосомы, и другого маркерного гена, окруженного loxP сайтами, в состав хромосомы дрожжей S. pombe;
- выщепление второго маркерного гена по loxP-сайтам за счет индукции синтеза Cre-рекомбиназы, что приводит к делеции выбранного участка хромосомы.
Для делеций другого участка хромосомы снова проводят совместную интеграцию фрагмента ДНК гомологичного к выбранному участку и второго маркерного гена с последующим его выщеплением при индукции работы Cre-рекомбиназы.
Недостатками такого способа являются:
- необходимость использования двух маркерных генов, что часто предъявляет дополнительные специальные требования к модифицируемому штамму и существенно усложняет генетическую работу;
- необходимость выщепления репликативной плазмиды с локализованным на ней геном Cre-рекомбиназы при конструировании штаммов-продуцентов (в противном случае штамм несет ген устойчивости к антибиотику, что осложняет его использование в промышленности, а присутствие плазмиды приводит к снижению выхода целевого продукта);
- необходимость использования ослабленных синтетических промоторов, что требует дополнительных затрат на их синтез (использование природных индуцибельных промоторов невозможно из-за сильного подавления роста клеток).
Задачей данного изобретения является расширение арсенала способов модификации дрожжей Schizosaccharomyces pombe, а также расширение арсенала рекомбинантных микроорганизмов, продуцирующих молочную кислоту.
Поставленная задача решена путем разработки способа модификации дрожжей S. pombe, включающего в себя:
- трансформацию дрожжей интегративной экспрессионной кассетой, содержащей ген Cre-рекомбиназы под индуцибельным промотором и маркерный ген, фланкированный loxP сайтами (при этом ген Cre-рекомбиназы совместно с маркерным геном, фланкированным loxP сайтами, интегрируется в состав хромосомы);
- выщепление маркерного гена по loxP-сайтам за счет индукции синтеза Cre-рекомбиназы;
- интеграцию кассеты, содержащей фрагмент ДНК и маркерный ген, фланкированный loxP сайтами, при этом маркерным геном может являться тот же ген, который используется для интеграции гена Cre-рекомбиназы, а фрагментом ДНК может являться не только последовательность для гомологичной интеграции, но и ген для экспрессии;
- выщепление маркерного гена по loxP-сайтам за счет индукции синтеза Cre-рекомбиназы.
В результате получают трансформант, несущий в составе хромосомы интегрированный фрагмент ДНК.
В качестве индуцибельного промотора может быть использован любой подходящий для работы в S. pombe промотор, например nmt1, nmt41, nmt81, или другие [http://www-bcf.usc.edu/~forsburg/vectortable.html].
Последовательное многократное введение фрагментов ДНК в состав хромосомы дрожжей S. pombe осуществляют путем повторной совместной интеграции необходимого фрагмента ДНК и выбранного маркерного гена с последующим его выщеплением.
Способ применим для конструирования штаммов, продуцирующих органические кислоты, ферменты и другие биологически-активные соединения путем многократного введения необходимых фрагментов ДНК.
Поставленная задача также решена путем конструирования предложенным способом трансформантов дрожжей Schizosaccharomyces pombe, в которых инактивирован или делетирован один или несколько генов алкогольдегидрогеназ, а в хромосому интегрированы один или несколько генов лактатдегидрогеназ. Полученные трансформанты продуцируют молочную кислоту.
В приведенных примерах в качестве гена для инактивации используют ген алкогольдегидрогеназы adh1, а в качестве ДНК фрагментов - гены ldh, кодирующие аминокислотные последовательности лактатдегидрогеназ Lactobacillus plantarum [GenBank: ACJ15334.1], Lactobacillus acidophilus [NCBI: WP 003549000.1], Lactobacillus amylovorus [NCBI: WP 013437112.1].
Задача решена также тем, что заявлен способ микробиологического синтеза молочной кислоты, включающий культивирование в подходящих условиях заявленного трансформанта дрожжей Schizosaccharomyces pombe, в котором инактивирован или делетирован один или несколько генов алкогольдегидрогеназ, а в хромосому интегрированы один или несколько генов лактатдегидрогеназ.
Изобретение проиллюстрировано следующими фигурами:
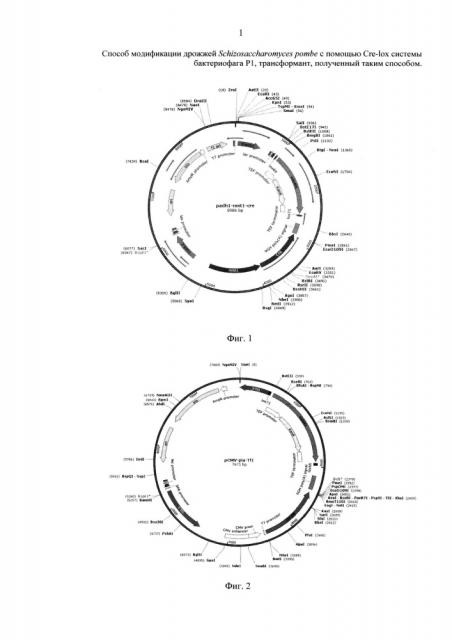
Фиг. 1 Экспрессионная интегративная плазмида padh1-nmt1-Cre.
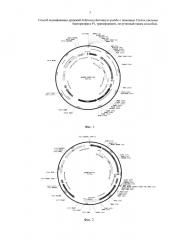
Фиг. 2 Экспрессионная интегративная плазмида pCMV-pla-Tf1.
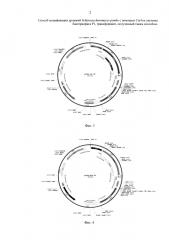
Фиг. 3 Экспрессионная интегративная плазмида pCMV-aci-Tf1.
Фиг. 4 Экспрессионная интегративная плазмида pCMV-amy-Tf1.
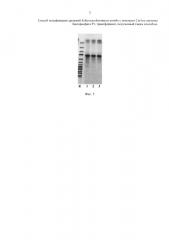
Фиг. 5 Электрофореграмма ПЦР-анализа трансформантов по примерам 1-3
Пример 1. Получение трансформанта дрожжей S. pombe с инактивированным геном adh1, в хромосому которого интегрировано несколько копий гена лактатдегидрогеназы из Lactobacillus plantarum.
1.1 Трансформация дрожжей интегративной экспрессионной кассетой, содержащей ген Cre-рекомбиназы
Методом клонирования [Sambrook J., Maniatis Т., Fritsch Е. Molecular cloning: a laboratory manual. - N.Y.: Cold Spring Harbor Laboratory, 1989.] генетических элементов в коммерческий вектор pUC19 получают экспрессионную интегративную плазмиду padh1-nmt1-Cre (фиг. 1). В качестве источника гена Cre-рекомбиназы используют ДНК бактериофага Р1 (ВКПМ РН-1029). Синтезируют ДНК гена cre методом ПЦР с использованием праймеров pr-cre-1 и pr-cre-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1, соответственно:
pr-cre1
pr-cre-2
Плазмида (фиг. 1) содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер kanMX, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Ген Cre-рекомбиназы фага Р1 под контролем nmt1 промотора.
3. Область для интеграции - фрагменты нуклеотидной последовательности гена алкогольдегидрогеназы adh1 дрожжей S. pombe.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду padh1-nmt1-Cre обрабатывают эндонуклеазами рестрикции Sac1, Kpn1. Полученные фрагменты плазмиды разделяют в агарозном геле, выделяют и очищают фрагмент плазмиды, размером 6024 п.о. Полученный фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе ген Cre-рекомбиназы под контролем nmt1 промотора; маркерный ген kanMX, фланкированный сайтами lох 66 и lох 71 и обуславливающий у дрожжей S. pombe устойчивость к антибиотику G418; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют фрагменты гена adh1, что позволяет его (ген adh1) инактивировать.
Дрожжи S. pombe трансформируют указанной интегративной экспрессионной кассетой методом электропорации. (http://www-bcf.usc.edu/~forsburg/tfmn.html)
Для получения трансформантов используют штамм S. pombe ВКПМ Y-3106, который предварительно выращивают в жидкой питательной среде YPD (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) до концентрации 1×108 клеток на 1 мл. Клетки центрифугируют, промывают в ледяной стерильной воде, а затем в ледяном растворе 1М сорбитола. Клетки инкубируют в 25 мМ растворе дитиотрейтола в течение 15 минут, затем промывают в ледяном растворе 1М сорбитола. Клетки ресуспендируют в ледяном растворе 1 М сорбитола в концентрации 1-5×109 клеток на 1 мл. Аликвоту, объемом 40 мкл клеточной суспензии, переносят в охлажденный эппендорф, добавляют 400 нг ДНК экспрессионной интеграционной кассеты и инкубируют во льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при следующих условиях: 1,5 кВ, 400 Ом, 25uF. После порации добавляют 1 мл ледяного раствора 1М сорбитола.
Селекцию трансформантов ведут на агаризованной среде YES (http://www-bcf.usc.edu/~forsburg/media.html) с добавлением глюкозы (2 мас. %) в течение 5 суток при температуре 30°C. В качестве селективного агента добавляют антибиотик G418 в количестве 130 мкг/мл. Отбирают трансформанты с отключенным геном adh1 по стандартной методике [http://www-bcf.usc.edu/~forsburg/disruptions.html].
1.2 Выщепление маркерного гена
Выщепление маркерного гена по loxP-сайтам осуществляют за счет индукции синтеза Cre-рекомбиназы. Трансформанты выращивают в течение 24 ч в жидкой питательной среде YPD с добавлением 2% глюкозы. Дрожжевые клетки отмывают трижды в равном объеме стерильной дистиллированной воды от тиамина, присутствующего в среде и ингибирующего работу nmt1 промотера. Далее клетки помещают в минеральную среду YNB (Himedia), без содержания тиамина, и инкубируют в течение 8 часов. Далее клетки высевают на агаризованную питательную среду YPD (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %). Инкубируют в течение 48 ч при 30°С. Полученные колонии реплицируют на чашку с агаризованной средой YPD и 2% глюкозой без селективного давления и аналогичную чашку с антибиотиком G418. Отбирают колонии, не способные к росту на чашке, содержащей антибиотик G418. Полученные таким образом трансформанты не содержат маркерный ген kanMX.
1.3 Интеграция кассеты, содержащей фрагмент ДНК (ген ldh Lactobacillus plantarum) и маркерный ген, в хромосому дрожжей S. pombe
Интегративную экспрессионную плазмиду pCMV-pla-Tf1, представленную на фиг. 2, получают методом клонирования. В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus plantarum ВКПМ В-7636. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-pla-1 и pr-pla-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1, соответственно:
pr-pla-1
pr-pla-2
Экспрессионная интегративная плазмида pCMV-pla-Tf1 (фиг. 2) содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер kanMX, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Фрагмент ДНК (ген ldh Lactobacillus plantarum) под контролем CMV промотора.
3. Область для интеграции - нуклеотидная последовательность ретротранспозона Tf1.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-pla-Tf1 обрабатывают эндонуклеазами рестрикции BamH1, Nae1. Полученные фрагменты разделяют в агарозном геле, выделяют и очищают фрагмент, размером 5320 п.о. Полученный фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе фрагмент ДНК, кодирующий аминокислотную последовательность гена ldh Lactobacillus plantarum, под контролем CMV промотора; маркерный ген kanMX, фланкированный сайтами lox 66 и lox 71 и обуславливающий у дрожжей S. pombe устойчивость к антибиотику G418; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность ретротранспозона Tf1.
Трансформацию дрожжей S. pombe указанной интегративной экспрессионной кассетой и селекцию трансформантов осуществляют, как описано в п. 1.1.
Продукцию молочной кислоты трансформантами оценивают в чашечном тесте с добавлением мела по зонам гидролиза. В тесте используют агаризованную среду YPD с добавлением глюкозы (2 мас. %) и мела (0,5 мас. %). В качестве контроля используют штамм Schizosaccharomyces pombe Y-3106.
Наиболее продуктивные трансформанты, показавшие наибольшее соотношение диаметра зоны гидролиза к диаметру колонии на чашках с мелом, отбирают и используют для выщепления маркерного гена по способу, описанному в п. 1.2.
Трансформанты, потерявшие маркерный ген, культивируют в жидкой питательной среде для определения продукции молочной кислоты.
Посевную культуру выращивают в пробирках (50 мл) с 10 мл жидкой питательной среды YPD с добавлением глюкозы (2 мас. %) при 30°С в течение 24 ч на качалке с 250 об/мин. Посев ферментационной среды осуществляют в соотношении 1/10 об.
Ферментацию проводят при 30°С на качалке с 150 об/мин в питательной среде состава (мас. %): дрожжевой экстракт - 0,5, пептон - 1, вода - остальное, с добавлением глюкозы (18 мас. %) в пробирках (50 мл) с рабочим объемом 5 мл. Ферментацию продолжают в течение 48 часов.
Концентрацию молочной кислоты определяют согласно методу ВЭЖХ [Acta Biotechnol. 1990. v. 10(5) p. 459-468]. Концентрацию этанола определяют согласно методу ГХ [Chromatogr. Sci. 2009. v. 47(4). p. 272-278].
По результатам ферментации отбирают трансформант №1, который при культивировании в пробирках позволяет получить молочную кислоту в количестве 39 г/л культуральной жидкости, продукция побочного продукта этанола составляет 25 г/л культуральной жидкости.
1.4 Последовательное многократное введение фрагментов ДНК в состав хромосомы дрожжей S. pombe.
Для повторного введения фрагмента ДНК, кодирующего аминокислотную последовательность гена ldh Lactobacillus plantarum, в состав хромосомы дрожжей S. pombe используют трансформант №1. Клетки трансформанта №1 готовят для трансформации и трансформируют интегративной экспрессионной кассетой, полученной из плазмиды pCMV-pla-Tf1, как описано в п.п. 1.1 и 1.3. Отбирают наиболее продуктивные трансформанты, как описано в п. 1.3. Далее проводят выщепление маркерного гена kanMX, как описано в п. 1.2.
В результате повторного введения фрагмента ДНК (ген ldh Lactobacillus plantarum) в состав хромосомы дрожжей S. pombe отбирают трансформант №2, способный продуцировать молочную кислоту в количестве 53 г/л, продукция побочного продукта этанола составляет 19 г/л за 48 ч культивирования. Условия культивирования описаны в п. 1.3.
Для последующего введения в хромосому гена ldh Lactobacillus plantarum используют трансформант №2 и вышеописанную последовательность действий. В результате получают трансформанты, в которых инактивирован ген алкогольдегидрогеназы adh1, а в хромосому интегрировано несколько копий гена лактатдегидрогеназы из Lactobacillus plantarum. Отбирают трансформант №3, способный продуцировать молочную кислоту.
Пример 2. Получение трансформанта дрожжей S. pombe с инактивированным геном adh1, в хромосому которого интегрирован ген ldh Lactobacillus plantarum и ген ldh Lactobacillus acidophilus.
Получают интегративную экспрессионную плазмиду pCMV-aci-Tf1, представленную на фиг. 3. Плазмиду pCMV-aci-Tf1 получают методом клонирования генетических элементов в коммерческий вектор pUC19. В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus acidophilus ВКПМ В-4625. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-aci-1 и pr-aci-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1, соответственно:
pr-aci-1 5'-aaagctagcatggcaagagttgaaaaa-3',
pr-aci-2 5'-aaagtttaaacttattgacgaaccttaacgc-3'.
Экспрессионная интегративная плазмида pCMV-aci-Tf1 (фиг. 3) содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер kanMX, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Фрагмент ДНК (ген ldh Lactobacillus acidophilus) под контролем CMV промотора
3. Область для интеграции - нуклеотидная последовательность ретротранспозона Tf1.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-aci-Tf1 обрабатывают эндонуклеазами рестрикции BamH1, Nae1. Полученные фрагменты разделяют в агарозном геле, выделяют и очищают фрагмент, размером 5326 п.о. Полученный фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе ген ldh Lactobacillus acidophilus под контролем CMV промотора; маркерный ген kanMX, фланкированный сайтами lox 66 и lox 71 и обуславливающий у дрожжей S. pombe устойчивость к антибиотику G418; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность ретротранспозона Tf1.
Для введения гена ldh Lactobacillus acidophilus в состав хромосомы дрожжей S. pombe используют клетки трансформанта №3 (см. пример 1). Клетки готовят для трансформации, трансформируют интегративной экспрессионной кассетой, полученной из плазмиды pCMV-aci-Tf1, и отбирают трансформанты, как описано в п. 1.1. Выщепление маркерного гена по loxP-сайтам осуществляют, как описано в п. 1.2. Получают трансформанты, в которых инактивирован ген алкогольдегидрогеназы adh1, а в хромосому интегрирован ген ldh Lactobacillus plantarum и ген ldh Lactobacillus acidophilus.
Продукцию молочной кислоты трансформантами оценивают по п. 1.3.
По результатам ферментации (условия культивирования описаны в п. 1.3) отобраны трансформанты №4 и №5, которые при культивировании в пробирках позволяют получить молочную кислоту в количестве 93 г/л и 91 г/л культуральной жидкости за 48 ч, соответственно, причем содержание побочного продукта - этанола - не превышает 10 г/л культуральной жидкости.
Трансформант №4 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как штамм Schizosaccharomyces pombe A4Km-plac1 - продуцент молочной кислоты - под регистрационным номером ВКПМ Y-4249.
Трансформант №5 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как штамм Schizosaccharomyces pombe A4Km-plac2 - продуцент молочной кислоты - под регистрационным номером ВКПМ Y-4250.
Штаммы Schizosaccharomyces pombe ВКПМ Y-4249 и ВКПМ Y-4250 характеризуются следующими признаками.
Культурально-морфологические признаки
Для описания культурально-морфологических признаков использовали среды "Malt extract", "Malt agar" и картофельно-кукурузный агар [Amsterdam, Elsevier Sci. Publ. B.V., 1984, p. 421].
После трех дней культивирования на среде "Malt extract" культура образует клетки округлые, элипсоидальные и цилиндрические (3,0-5,0)×(5,0-15,0-24,0) мкм. Осадок формируется.
На среде "Malt agar" на 5 сутки образует некрупные колонии белого или слегка кремоватого оттенка. Поверхность колоний гладкая, край ровный. Вегетативное размножение - деление клетки пополам.
Физиолого-биохимические признаки
Культура способна сбраживать глюкозу, сахарозу, мальтозу и раффинозу. Не способна к брожению галактозы, лактозы и мелибиозы. Ассимилирует в качестве единственного источника углерода сахарозу, мальтозу, раффинозу. Не ассимилирует галактозу, целлобиозу, трегалозу, лактозу, ксилозу, арабинозу, рибозу, рамнозу, эритрит, рибитол, маннит, крахмал, янтарную, лимонную кислоты, инозит культура не ассимилирует нитраты, не способна расти на среде без витаминов.
Оптимальные условия для размножения штамма.
Температура 30°С, рН 6, полная дрожжевая среда [Захаров А. и др. Сборник методик по генетике дрожжей сахаромицетов. - Л., Наука, 1984, стр. 144].
Штамм хранится в лиофилизированном виде или в парах жидкого азота.
Полученные штаммы Schizosaccharomyces pombe ВКПМ Y-4249 и ВКПМ Y-4250 сохраняют способность к образованию молочной кислоты после 18 последовательных пересевов на полноценной среде.
Заявляемые штаммы при выращивании в пробирках способны продуцировать молочную кислоту в количестве 93 г/л и 91 г/л культуральной жидкости, причем содержание побочного продукта - этанола - не превышает 10 г/л культуральной жидкости.
Пример 3. Получение трансформанта дрожжей S. pombe с инактивированным геном adh1, в хромосому которого интегрирован ген ldh Lactobacillus plantarum и ген ldh Lactobacillus amylovorus.
Получают интегративную экспрессионную плазмиду pCMV-amy-Tf1, представленную на фиг. 4. Плазмиду pCMV-amy-Tf1 получают методом клонирования генетических элементов в коммерческий вектор pUC19. В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus amylovorus, DSM 20531. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-amy-1 и pr-amy-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1, соответственно:
pr-amy-1
pr-amy-2
Экспрессионная интегративная плазмида pCMV-amy-Tf1 (фиг. 4) содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер kanMX, фланкированный сайтами lох 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Ген ldh Lactobacillus amylovorus под контролем CMV промотора.
3. Область для интеграции - нуклеотидная последовательность ретротранспозона Tf1.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-amy-Tf1 обрабатывают эндонуклеазами рестрикции BamH1, Nae1. Полученные фрагменты разделяют в агарозном геле, выделяют и очищают фрагмент, размером 5319 п.о. Полученный ДНК фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе ген ldh Lactobacillus amylovorus под контролем CMV промотора; маркерный ген kanMX, фланкированный сайтами lox 66 и lox 71, и обуславливающий у дрожжей S. pombe устойчивость к антибиотику G418; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность ретротранспозона Tf1.
Для введения гена ldh Lactobacillus amylovorus в состав хромосомы дрожжей S. pombe используют клетки трансформанта №3. Клетки готовят для трансформации, трансформируют интегративной экспрессионной кассетой, полученной из плазмиды pCMV-amy-Tf1, и отбирают трансформанты, как описано в п. 1.1. Выщепление маркерного гена по loxP-сайтам осуществляют, как описано в п. 1.2. Получают трансформанты, в которых инактивирован ген алкогольдегидрогеназы adh1, а в хромосому интегрировано несколько копий гена ldh Lactobacillus plantarum и одна или несколько копий гена ldh Lactobacillus amylovorus.
Продукцию молочной кислоты трансформантами оценивают по п. 1.3.
По результатам ферментации (условия культивирования описаны в п. 1.3) отобран трансформант №6, который при культивировании в пробирках позволяет получить молочную кислоту в количестве 89 г/л культуральной жидкости за 48 ч, причем содержание побочного продукта - этанола - не превышает 10 г/л культуральной жидкости.
Трансформант №6 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как штамм Schizosaccharomyces pombe A4Km-plam - продуцент молочной кислоты, регистрационный номер ВКПМ Y-4248.
Штамм Schizosaccharomyces pombe ВКПМ Y-4248 характеризуется следующими признаками.
Культурально-морфологические признаки
Для описания культурально-морфологических признаков использовали среды "Malt extract", "Malt agar" и картофельно-кукурузный агар [Amsterdam, Elsevier Sci. Publ. B.V., 1984, p.421].
После трех дней культивирования на среде "Malt extract" культура образует клетки округлые, элипсоидальные и цилиндрические (3,0-5,0)×(5,0-15,0-24,0) мкм. Осадок формируется.
На среде "Malt agar" на 5 сутки образует некрупные колонии белого или слегка кремоватого оттенка. Поверхность колоний гладкая, край ровный. Вегетативное размножение - деление клетки пополам.
Физиолого-биохимические признаки
Культура способна сбраживать глюкозу, сахарозу, мальтозу и раффинозу. Не способна к брожению галактозы, лактозы и мелибиозы. Ассимилирует в качестве единственного источника углерода сахарозу, мальтозу, раффинозу. Не ассимилирует галактозу, целлобиозу, трегалозу, лактозу, ксилозу, арабинозу, рибозу, рамнозу, эритрит, рибитол, маннит, крахмал, янтарную, лимонную кислоты, инозит культура не ассимилирует нитраты, не способна расти на среде без витаминов.
Оптимальные условия для размножения штамма.
Температура 30°С, рН 6, полная дрожжевая среда [Захаров А. и др. Сборник методик по генетике дрожжей сахаромицетов. - Л., Наука, 1984, стр. 144].
Штамм хранится в лиофилизированном виде или в парах жидкого азота.
Полученный штамм Schizosaccharomyces pombe ВКПМ Y-4248 сохраняет способность к образованию молочной кислоты после 18 последовательных пересевов на полноценной среде.
Заявляемый штамм при выращивании в пробирках способен продуцировать молочную кислоту в количестве 89 г/л культуральной жидкости за 48 ч культивирования, причем содержание побочного продукта - этанола - не превышает 10 г/л культуральной жидкости.
Важно отметить, что общей характеристикой для всех трансформантов, полученных по примерам 1-3, является следующее. Если для любого из полученных в примерах трансформантов при проведении ПЦР использовать его хромосому и проверочные селективные праймеры Pr-1 и Pr-2
Pr-1 5'-gacccaagctggctagccacc-3',
Pr-2 5'-tggctggcaactagaaggcacag-3',
то образующийся в ходе полимеразной цепной реакции ДНК фрагмент характеризуется размером, попадающим в интервал 1031-1050 п.н., что дает возможность осуществлять их идентификацию.
На фиг. 5 приведена электрофореграмма ПЦР-анализа полученных трансформантов (примеры 1-3, К-контроль). Для контроля величины фрагментов ДНК при электрофорезе используют молекулярный маркер O'GeneRuler 1000 bp DNA Ladder, размер фрагментов (сверху вниз) 250, 500, 750, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 5000, 6000, 8000, 10000 п.н.
Пример 4. Способ микробиологического синтеза молочной кислоты с использованием трансформанта с инактивированным геном adh1, в хромосому которого интегрирован ген ldh Lactobacillus plantarum.
В качестве посевной культуры используют клетки трансформанта №3 по примеру 1.
Посевную культуру выращивают при 30°С в течение 2 суток на чашках Петри на агаризованной среде YPD с добавлением глюкозы (2 мас. %).
Для получения инокулята пробирки (50 мл) с 10 мл жидкой питательной среды YPD с добавлением глюкозы (2 мас. %) засевают посевной культурой. Пробирки инкубируют на качалке (250 об/мин) при 30°С в течение 24 ч.
Колбу, объемом 750 мл, содержащую 95 мл жидкой среды состава (мас. %): дрожжевой экстракт - 0,5, пептон - 1, вода - остальное с добавлением глюкозы (18 мас. %), засевают 5 мл инокулята.
Культивирование осуществляют на качалке со скоростью 250 об/мин при температуре 30°С в течение 96 часов. Пробы отбирают каждые 12 часов стерильно по 1 мл для определения концентрации биомассы и молочной кислоты в культуральной жидкости, а также контроля стерильности. Трансформант секретирует молочную кислоту в количестве 100 г/л культуральной жидкости культивирования, продукция побочного продукта этанола составляет 8 г/л.
Таким образом, заявляемый способ модификации дрожжей Schizosaccharomyces pombe
- позволяет упростить последовательное введение различных фрагментов ДНК (в том числе и экспрессируемых) в состав хромосомы дрожжей, используя один и тот же маркерный ген, что существенно облегчает работу с прототрофными штаммами и не требует использования штаммов с ауксотрофными мутациями в ходе конструирования;
- не включает стадию выщепления плазмид помощников, содержащих ген Cre рекомбиназы, что существенно ускоряет и упрощает конструирование штаммов и позволяет получать штаммы-продуценты, не содержащие ген устойчивости к антибиотикам;
- в отличие от известного способа, позволяет в ходе конструирования использовать сильные природные индуцибельные промоторы, что избавляет от необходимости осуществлять синтез искусственных последовательностей.
1. Способ модификации дрожжей S. pombe, включающий трансформацию в клетку гена, кодирующего Cre-рекомбиназу, под контролем подходящего для работы в S. pombe индуцибельного промотора совместно с маркерным геном, интеграцию экспрессионной кассеты, содержащей фрагмент ДНК и маркерный ген, фланкированный loxP сайтами, выщепление маркерного гена по loxP-сайтам за счет индукции синтеза Cre-рекомбиназы, отличающийся тем, что при трансформации ген, кодирующий Cre-рекомбиназу, совместно с маркерным геном интегрируют в состав хромосомы, при этом маркерный ген фланкирован lохР сайтами, а после трансформации до интеграции кассеты дополнительно осуществляют выщепление маркерного гена по loxP-сайтам.
2. Способ по п.1, отличающийся тем, что в качестве индуцибельного промотора используют природный nmt1 промотор.
3. Способ по п.1, отличающийся тем, что для интеграции гена, кодирующего Cre-рекомбиназу, и интеграции фрагмента ДНК используют один и тот же маркерный ген.
4. Способ по п.1, отличающийся тем, что интегрируемый фрагмент ДНК экспрессируют в S. pombe.
5. Способ по п.1, отличающийся тем, что интеграцию кассеты и выщепление маркерного гена по loxP-сайтам проводят многократно.
6. Трансформант дрожжей S. pombe, для получения молочной кислоты, полученный способом по п.1, в котором инактивирован или делетирован один или несколько генов алкогольдегидрогеназ, а в хромосому интегрированы один или несколько генов лактатдегидрогеназ рода Lactobacillus.
7. Трансформант по п.6, в котором инактивирован ген алкогольдегидрогеназы adh1, а в хромосому интегрирована одна или несколько копий гена лактатдегидрогеназы ldh Lactobacillus plantarum.
8. Трансформант по п.6, в котором инактивирован ген алкогольдегидрогеназы adh1, а в хромосому интегрирована одна или несколько копий гена лактатдегидрогеназы ldh Lactobacillus plantarum и одна или несколько копий гена лактатдегидрогеназы ldh Lactobacillus acidophilus.
9. Трансформант по п.6, в котором инактивирован ген алкогольдегидрогеназы adh1, а в хромосому интегрирована одна или несколько копий гена лактатдегидрогеназы ldh Lactobacillus plantarum и одна или несколько копий гена лактатдегидрогеназы ldh Lactobacillus amylovorus.
10. Штамм - трансформант Schizosaccharomyces pombe ВКПМ Y-4248 по пп.6 и 9, в котором инактивирован ген алкогольдегидрогеназы adh1, а в хромосому интегрированы три копии гена лактатдегидрогеназы ldh Lactobacillus plantarum и одна копия гена лактатдегидрогеназы ldh Lactobacillus amylovorus - продуцент молочной кислоты.
11. Штамм - трансформант Schizosaccharomyces pombe ВКПМ Y-4249 по пп.6 и 8, в котором инактивирован ген алкогольдегидрогеназы adh1, а в хромосому интегрированы три копии гена лактатдегидрогеназы ldh Lactobacillus plantarum и одна копия гена лактатдегидрогеназы ldh Lactobacillus acidophilus - продуцент молочной кислоты.
12. Штамм - трансформант Schizosaccharomyces pombe ВКПМ Y-4250 по пп.6 и 9, в котором инактивирован ген алкогольдегидрогеназы adh1, а в хромосому интегрированы три копии гена лактатдегидрогеназы ldh Lactobacillus plantarum и одна копия гена лактатдегидрогеназы ldh Lactobacillus amylovorus - продуцент молочной кислоты.
13. Способ микробиологического синтеза молочной кислоты, включающий культивирование дрожжей Schizosaccharomyces pombe в питательной среде, отличающийся тем, что для культивирования используют трансформант по п.6.